尖锐湿疣是最常见的性传播疾病(STD)之一[1],90%以上的尖锐湿疣由HPV-6和HPV-11感染引起[2],典型皮损为性接触部位表面乳头瘤状的赘生物[3]。鬼臼毒素(POD)作为世界卫生组织推荐用于治疗尖锐湿疣的外用药物,主要通过抑制感染HPV的宿主细胞增殖分化来减少HPV的复制,同时诱导感染细胞凋亡来达到治疗效果[4-6]。目前临床广泛应用的POD制剂为鬼臼毒素酊剂(POD-T),仅适用于皮肤部位的尖锐湿疣。阴道等黏膜上皮与皮肤相比没有角质层,所以POD-T的酊剂载体易对黏膜产生明显刺激,常导致黏膜糜烂,甚至溃疡形成。目前阴道黏膜尖锐湿疣的治疗主要以冷冻、微波和光动力等物理疗法为主,患者不仅术后出现明显的疼痛,且创面暴露有继发感染风险,治疗费用相对高昂。因此寻求适用于黏膜部位尖锐湿疣的治疗POD新型载体迫在眉睫。纳米脂质载体(NLC)是近年新兴的药物载体,由类细胞生物膜的微囊体组成[7]。不仅生物相容性好,免疫原性低,且体积较小,药物有效接触面更大,可提高药效[8]。综上所述,为了使POD适用于黏膜部位尖锐湿疣,本团队创新性地把药物POD与载体NLC相结合,形成POD-NLC。本团队前期通过正交实验优化POD-NLC的合成处方得到稳定的PODNLC [9]。其次,通过Annexin V/PI检测发现POD-NLC诱导凋亡的效果明显优于POD-T [10]。通过动物实验证明POD-NLC的缓释性、黏膜靶向性优于POD-T [11-12]。最后,本研究将通过毒理学实验考察POD-NLC在阴道黏膜应用的安全性。
尽管国内外亦有把POD与其他新型载体相结合的研究,如羧基化碳纳米管负载鬼臼毒素、鬼臼毒素—固体脂质纳米粒等[13-14],这些研究虽证明新载体药物在动物皮肤上的应用毒性有所下降,但均未进行动物体内黏膜用药的毒理学实验,且实验时间短,未进行长期毒性试验,对于临床用药的指导性有限。本研究不仅创新性地研究了POD-NLC在动物阴道黏膜用药的安全性,填补目前POD治疗阴道黏膜尖锐湿疣的空白,还将重点评估该剂型POD的长期毒性,为临床POD-NLC黏膜应用提供安全用药资料。
1 材料和方法 1.1 实验动物新西兰兔12只,雌性,健康无孕,体质量2.0~2.5 kg,年龄约4~6月,普通级;SD大鼠100只,雌性,健康无孕,体质量180~220 g,约6~8周龄,SPF级。动物均由南方医科大学南方医院动物实验中心提供。实验前动物驯养观察1周,进行外观体征、行为活动、摄食量、体质量、粪便性状评估。
1.2 实验药物0.5% POD-NLC及赋形剂(空白-NLC)的制备及理化性质参考本课题组前期工作[9];将0.5 g POD溶于100 mL的75%乙醇制得0.5% POD-T。
1.3 实验方法 1.3.1 刺激性试验将12只新西兰兔平均分为3组:生理盐水对照组(NS)、0.5%鬼臼毒素酊剂组(POD-T)和0.5%鬼臼毒素纳米脂质载体组(POD-NLC)。给药前用速眠新Ⅱ肌肉注射以麻醉新西兰兔,用石蜡油涂抹阴道口以保护和润滑。连续10 d往新西兰兔阴道注入2 mL NS或POD-T或POD-NLC。给药结束后处死实验动物,解剖取出阴道,选取阴道上、中、下3个部位的组织,制备HE染色的组织病理切片,采用Eckstein评分系统对镜下改变进行评估[15-19]。
根据阴道黏膜的上皮组织、固有层白细胞浸润、固有层血管充血、固有层水肿四项进行Eckstein评分,每一项得分为0~4分,具体评分标准如下,上皮组织:0=完好无损、1=细胞变性或变扁平、2=组织变形、3=局部糜烂、4=广泛糜烂;固有层白细胞浸润(每个高倍镜视野):0=无、1=极少(< 25个)、2=轻度(26~50个)、3=中度(51~ 100个)、4=重度(>100个);固有层血管充血(毛细血管增殖):0=无、1=极少、2=轻度、3=中度、4=重度伴血管破裂;固有层水肿:0=无、1=极少、2=轻度、3=中度、4=重度。四项评分相加即为刺激性反应的总积分。刺激性指数为每组积分减去NS对照组积分,刺激性指数与刺激性反应强度分级的具体对应如下:< 1=无,1~ < 5=极轻,5~ < 9=轻度,9~ < 12=中度,≥12=重度。
1.3.2 急性毒性试验20只SD雌性大鼠平均分为2组:赋形剂组和POD-NLC组,将300倍临床剂量的赋形剂或POD-NLC,在24 h内分3次通过阴道给药,给药后观察动物的一般情况及行为活动,一般情况评估包括:大鼠是否出现困倦、呼吸困难、尾口足紫绀或苍白、眼鼻口异常分泌物、皮毛色泽及分布改变、大小便性状等情况。行为活动评估包括:大鼠是否出现俯卧、僵住、震颤、抽搐及痉挛等异常活动,探究活动、自发活动或者打理毛发等运动减少或增多,正常反射消失和异常反射出现等。连续观察14 d后麻醉解剖大鼠,观察各组大鼠的肾上腺、肾脏、脾脏、肝脏、卵巢、子宫、胸腺、肺脏、心脏、脑等主要器官的肉眼变化,然后分别称质量,并按公式计算脏器系数:器官的脏器系数=器官质量(g)/体质量(100 g)[20-22]。
1.3.3 长期毒性试验80只SD雌性大鼠平均分为4组:对照组(赋形剂)、POD-NLC低剂量组(15倍临床剂量)、POD-NLC中剂量组(30倍临床剂量)和POD-NLC高剂量组(60倍临床剂量)。连续13周每天阴道上药1次,记录每周体质量,观察给药期间大鼠的一般情况及行为活动,给药结束后对每组2/3的大鼠进行抽血检查、解剖并计算脏器系数。对照组与高剂量组进行肝脏病理形态学检查,若发现病理改变,其他剂量组大鼠亦需进行病理学检查。为观察药物的延迟毒性,每组剩余的1/3大鼠停药观察2周后做同前处理[23-27]。
1.3.4 统计学分析资料均采用均数±标准差表示,采用SPSS19.0统计软件进行统计分析。两组间比较使用t检验,多组间比较使用方差分析,当P < 0.05时认为差异有统计学意义。
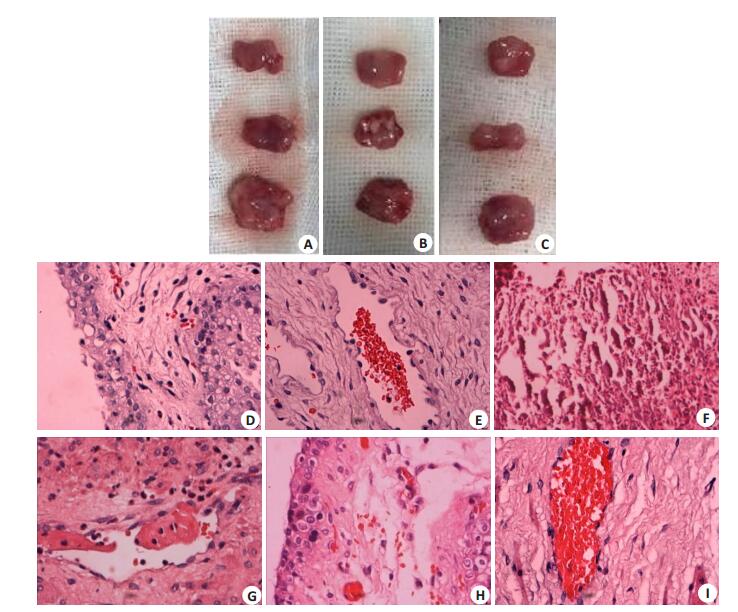
2 结果 2.1 刺激性试验结果 2.1.1 新西兰兔上药后阴道黏膜肉眼变化及高倍镜下的HE染色结果对比给药10 d后各组阴道组织的肉眼变化:NS组和POD-NLC组阴道黏膜光滑完整;POD-T组可见点状糜烂、溃疡面,伴白色疤痕样的纤维结缔组织增生。对比各组阴道组织HE染色后在高倍镜下的特征:NS组的黏膜结构清晰完整;POD-T组的黏膜呈大片坏死,难以观察到正常上皮结构,部分切片可见固有层水肿明显、大量淋巴细胞或者中性粒细胞浸润、血管破裂;POD-NLC组黏膜结构清晰,部分黏膜表皮较NS组变薄。
|
图 1 新西兰兔给药后阴道黏膜肉眼变化及高倍镜下的HE染色结果 Fig.1 Gross observation of the vaginal mucosa of the New Zealand rabbits in normal saline (A), POD-T (B), and POD-NLC (C) groups and pathological examination of the mucosa in normal saline (D, E), POD-T (F, G), and POD-NLC (H, I) groups (HE staining, original magnification: ×400). |
根据表 1各组阴道黏膜刺激性反应评分,NS组总平均分为1.333分;POD-T组总平均分为12.250分;POD-NLC组总平均分为3.750分。按照上述刺激性强度分级标准,POD-T组总平均分减去NS组总平均分为10.917 < 12分,是中度刺激性;POD-NLC组总平均分减去NS组总平均分为2.417分 < 5分,是极轻刺激性。
| 表 1 各组阴道黏膜刺激性反应评分 Tab.1 Mean scores of vaginal mucosa irritation of the rabbits based on the Eckstein scoring system (Mean±SD) |
POD-T组在给药第2天,1只动物出现血尿,症状持续至本实验结束;且POD-T组在给药第4天,另1只动物出现死亡;NS组及POD-NLC组无类似现象。
2.2 急性毒性试验 2.2.1 大鼠一般情况及行为活动赋形剂组和PODNLC组的实验大鼠在观察期间内,一般情况及行为活动均未见明显异常,无动物出现死亡等不良反应。
2.2.2 大鼠器官解剖及脏器系数解剖两组实验大鼠,肉眼观察发现两组大鼠的肾上腺、肾脏、脾脏、肝脏、卵巢、子宫、胸腺、肺脏、心脏、脑等器官的外观、体积、颜色等无明显差异,器官亦无出血、充血或者水肿等异常变化。称质量并计算各器官的脏器系数,发现两组大鼠各器官的脏器系数差异无统计学意义(P>0.05)。
2.3 长期毒性试验 2.3.1 大鼠一般情况及行为表现赋形剂组、POD-NLC低剂量组、POD-NLC中剂量组及POD-NLC高剂量组的实验大鼠各项观察指标均未见明显异常。大鼠食欲良好、饮水正常;毛发浓密而洁净、光滑有色泽;口、足垫、尾巴皮肤呈健康粉色,未见紫绀症状;阴道、肛门、眼、耳、口、鼻未见分泌物增多或异样的血性分泌物;呼吸平稳顺畅,未见呼吸急促、呼吸困难、喘息、咳嗽等现象;翻正反射、惊跳反射正常;四肢活动、步态正常、运动协调,未见异常运动,无俯卧、震颤、抽搐、强直、僵住等现象;粪便颗粒成形,呈棕褐色,未见稀粪现象和血尿。
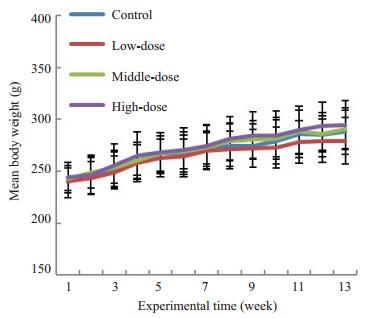
2.3.2 大鼠体质量变化图 2为第1~13周各组实验大鼠每周的体质量折线图,提示在观察期间,各组大鼠的体质量均呈稳步增长趋势,且增长速率相近。通过统计学分析,各组实验大鼠每周体质量的差异无统计学意义(P>0.05)。
|
图 2 长期毒性试验各分组全部大鼠在第1~13周体质量 Fig.2 Comparison of body weight of the rats in longterm toxicity test at weeks 1-13 (Mean±SD). |
表 2、表 3分别为各组大鼠血常规、血生化的结果,通过统计学分析,各组2/3大鼠在13周上药结束后,血常规、血生化的差异均无统计学意义(P>0.05)。为观察药物的延迟毒性,各组剩余1/3大鼠在上药13周后,停药2周,即在第15周做相同处理,结果提示各组剩余1/3大鼠在第15周的血常规、血生化的差异亦无统计学意义(P>0.05)。随后,我们把各组第13周与第15周的血常规、血生化进行对比,发现各组前后血常规、血生化的差异仍然无统计学意义(P> >0.05)。
| 表 2 长期毒性试验第13周与第15周各组大鼠的血常规结果 Tab.2 Blood routine of the rats in the long-term toxicity test at 13 and 15 weeks (Mean±SD) |
| 表 3 长期毒性试验第13周与第15周各组大鼠的血生化结果 Tab.3 Blood biochemistry of the rats in the long-term toxicity test at 13 and 15 weeks (Mean±SD) |
通过解剖发现,赋形剂组、POD-NLC低剂量组、POD-NLC中剂量组及POD-NLC高剂量组在第13周2/3大鼠和第15周1/3大鼠的肾上腺、肾脏、脾脏、肝脏、卵巢、子宫、胸腺、肺脏、心脏、脑等器官的外观、体积、颜色等无明显差异,器官亦无出血、充血或者水肿等异常变化。
表 4为各组大鼠重要脏器的脏器系数。通过统计学分析,各组2/3大鼠在13周上药结束后,各器官脏器系数的差异无统计学意义(P>0.05)。各组剩余1/3大鼠在第15周的各器官脏器系数差异亦无统计学意义(P>0.05)。随后,我们把各组第13周与第15周的脏器系数进行对比,各组前后脏器系数的差异无统计学意义(P>0.05)。
| 表 4 长期毒性试验第13周与第15周大鼠的脏器系数 Tab.4 Organ weights of the rats in the long-term toxicity at 13 and 15 weeks (Mean±SD) |
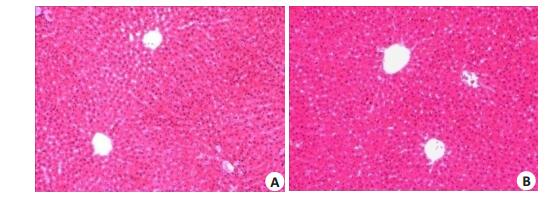
对照组与POD-NLC高剂量组大鼠的肝脏病理切片在高倍镜下均表现为:肝小叶结构明晰,肝索有序,肝窦未见扩张或狭窄。肝细胞大小一致,未见肿大或异型,无气球样变、脂肪空泡等。未见炎性细胞浸润。
3 讨论既往已有多项研究证明POD与新型载体相结合,较经典用药POD-T在皮肤的毒副作用下降。鬼臼毒素—固体脂质纳米粒(POD-SLN)对豚鼠皮肤无刺激性及致敏性[13]。羧基化碳纳米管负载鬼臼毒素(PPT-CNTsCOOH)在家兔皮肤刺激性试验中,24 h内为轻度刺激性,72 h后刺激性消失[14]。
然而,国内外尚无把POD与新载体相结合应用在阴道黏膜上的研究。与皮肤组织相比,阴道黏膜呈弱酸性,没有角质层,表面有分泌物。有学者发现,直径小于100 nm的颗粒与200 nm相比更容易受到宫颈黏液的阻碍,不容易到达黏膜上皮[28]。在我们前期的研究中,发现POD-NLC的pH为6.20±0.04,粒径小为(180±20)nm,包封率高,稳定性强。POD-NLC能抑制H8细胞的增殖,诱导凋亡的效果明显优于POD-T。在猪宫颈黏膜上药后药物分布的情况,发现POD-NLC具有黏膜靶向性、缓释性,与POD-T相比血药浓度低,有统计学上有意义(P < 0.05)。因此,POD-NLC的弱酸性质、适宜粒径、黏膜靶向性、缓释性及有效性,是支持其在阴道黏膜应用的研究基础。
本实验在既往研究的基础上,通过刺激性试验、急性毒性试验及长期毒性试验证明,POD-NLC在阴道黏膜应用的安全性较大。刺激性是指非口服的化学药物经阴道、直肠等给药后,对用药局部产生的可逆性炎症反应[29]。本研究发现,根据刺激性强度分级,0.5% POD-NLC在阴道黏膜用药为极轻刺激性,与经典用药0.5% POD-T对比黏膜刺激性明显减轻,用药局部未出现类似POD-T组的糜烂、溃疡,亦无血尿、死亡等系统的不良反应。该研究结果与PPT-CNTs-COOH、PODSLN等在皮肤刺激性试验结果相类似,POD与纳米载体结合可减轻其毒副作用。参考POD-T在临床应用的间断给药法,每周用药3 d后停药4 d,推测POD-NLC在阴道黏膜实际应用的刺激性可能更小,适用于黏膜部位的应用。
|
图 3 大鼠肝脏HE染色病理切片在高倍镜下的结果 Fig.3 Pathological section of the liver of the rats in the control (A) and high-dose (B) groups (×400). |
急性毒性是指动物在短时间大剂量接触药物后,在观察时间内所产生的局限及系统毒性反应[30],可以为药物超常规大剂量用药提供动物实验资料。国外曾有病例报道,一名尖锐湿疣患者在皮肤上外用大剂量的POD制剂后,出现脑组织、肝脏、肾脏的病理改变,最后出现死亡[31]。然而,本研究在大鼠阴道黏膜上,24h内应用300倍临床剂量的POD-NLC,大鼠的一般表现、行为活动及各重要器官未见明显异常,与对照组的脏器系数差异无统计学意义(P>0.05)。根据本研究结果初步推断,短时间内在阴道黏膜上应用较大剂量的POD-NLC,安全性较高。
长期毒性是指动物在连续多日给予等级剂量药后产生的毒副作用[32]。一项纳入60名确诊尖锐湿疣患者的临床试验发现,每周1次外用20% POD制剂,持续6周,可导致用药局部的红斑(53.3%)、水肿(56.6%)、溃疡或水泡(66.6%)、瘙痒(50%),而系统症状包括头痛(13.3%)、腹泻(10%)等[33]。本研究在阴道黏膜应用15倍、30倍、60倍临床剂量的POD-NLC,持续13周,未出现上述现象,且各组实验动物的一般表现、行为活动、体质量改变、血常规、血生化、重要器官的脏器系数及肝脏病理均未见明显异常,各组间差异无统计学意义(P>0.05)。长期毒性试验是最重要的临床前安全用药评估,可预测人体用药后的副作用和推测人体用药剂量的安全范围。根据本研究结果,在阴道黏膜较长时间应用60倍临床剂量以下的POD-NLC制剂相对安全。
综上所述,POD-NLC对给药局部及系统无明显毒副作用。与经典制剂POD-T对比,POD-NLC的安全性明显增高;与PPT-CNTs-COOH等其他新型载体的POD研究相比,本研究证明POD-NLC在阴道黏膜应用的安全性较大,填补目前POD治疗黏膜尖锐湿疣患者的研究空白;与目前治疗阴道黏膜尖锐湿疣的物理方法相比,POD-NLC制备工艺简单,治疗简单无创。
本研究仍有一定的不足之处,因实验条件限制,研究均使用啮齿类动物(如大小鼠、兔子等),未在非啮齿类动物身上重复(如狗、猪、猴子等)。两类动物对药物的耐受性可能不一致,具体表现为毒性剂量和毒副作用表现的不同。
| [1] |
Zhang Y, Jiang S, Lin H, et al. Application of dermoscopy image analysis technique in diagnosing urethral condylomata acuminata[J].
An Bras Dermatol, 2018, 93(1): 67-71.
|
| [2] |
Bechtel MA, Trout W. Sexually transmitted diseases[J].
Clin Obstet Gynecol, 2015, 58(1): 172-84.
DOI: 10.1097/GRF.0000000000000078. |
| [3] |
Nelson E L, Bogliatto F, Stockdale C K. Vulvar intraepithelial neoplasia (VIN) and vondylomata[J].
Clin Obstet Gynecol, 2015, 58(3): 512-25.
DOI: 10.1097/GRF.0000000000000132. |
| [4] |
Thurgar E, Barton S, Karner C, et al. Clinical effectiveness and costeffectiveness of interventions for the treatment of anogenital warts: systematic review and economic evaluation[J].
Health Technol Assess, 2016, 20(24): 1-486.
DOI: 10.3310/hta20240. |
| [5] |
Hu L, Zhou X, Zhang H, et al. Exposure to podophyllotoxin inhibits oocyte meiosis by disturbing meiotic spindle formation[J].
Sci Rep, 2018, 8(1): 10145.
DOI: 10.1038/s41598-018-28544-1. |
| [6] |
Karuppaiya P, Tsay HS. Therapeutic values, chemical constituents and toxicity of taiwanese fysosma pleiantha--a review[J].
Toxicol Lett, 2015, 236(2): 90-7.
|
| [7] |
Khan S, Baboota S, Ali J, et al. Nanostructured lipid carriers:An emerging platform for improving oral bioavailability of lipophilic drugs[J].
Int J Pharm Investig, 2015, 5(4): 182-91.
DOI: 10.4103/2230-973X.167661. |
| [8] |
Ghasemiyeh P, Mohammadi-Samani S. Solid lipid nanoparticles and nanostructured lipid carriers as novel drug delivery systems: applications, advantages and disadvantages[J].
Res Pharm Sci, 2018, 13(4): 288-303.
DOI: 10.4103/1735-5362.235156. |
| [9] |
韩凯, 王春慧, 种树彬, 等. 0.5%鬼臼毒素纳米脂质载体的制备及理化性质考察[J].
皮肤性病诊疗学杂志, 2012, 19(1): 10-3.
DOI: 10.3969/j.issn.1674-8468.2012.01.005. |
| [10] |
种树彬, 曾抗, 李国锋, 等. 鬼臼毒素纳米脂质载体的制备及体外对HPV感染的永生化人宫颈上皮细胞的作用[J].
南方医科大学学报, 2011, 31(6): 1023-8.
|
| [11] |
Gao Y, Han K, Wang Q, et al. Development of podophyllotoxinloaded nanostructured lipid carriers for the treatment of condyloma acuminatum[J].
Mol Med Rep, 2018, 17(5): 6506-14.
|
| [12] |
张静, 韩凯, 王春慧, 等. 鬼臼毒素纳米脂质载体的靶向分布[J].
南方医科大学学报, 2016, 37(9): 1237-41.
|
| [13] |
张敏, 曾抗, 李国锋, 等. 鬼臼毒素-固体脂质纳米粒的皮肤毒理学实验[J].
中国组织工程研究与临床康复, 2007(13): 2420-4.
DOI: 10.3321/j.issn:1673-8225.2007.13.006. |
| [14] |
邓亚利, 蔡鑫剑, 姚淑娴. 羧基化碳纳米管负载鬼臼毒素的制备及透皮性能研究[J].
中国药学杂志, 2017, 68(12): 1049-55.
|
| [15] |
Ardolino LI, Meloni M, Brugali G, et al. Preclinical evaluation of tolerability of a selective, bacteriostatic, locally active vaginal formulation[J].
Curr Ther Res Clin Exp, 2016, 83: 13-21.
DOI: 10.1016/j.curtheres.2016.07.002. |
| [16] |
Campaña-Seoane M, Peleteiro A, Laguna R, et al. Bioadhesive emulsions for control release of progesterone resistant to vaginal fluids clearance[J].
Int J Pharm, 2014, 477(2): 495-505.
|
| [17] |
Fields S, Song B, Rasoul B, et al. New candidate biomarkers in the female genital tract to evaluate microbicide toxicity[J].
PLoS One, 2014, 9(10): e110980.
DOI: 10.1371/journal.pone.0110980. |
| [18] |
Podaralla S, Alt C, Shankar GN. Formulation development and evaluation of innovative two-polymer (SR-2P) bioadhesive vaginal gel[J].
AAPS PharmSciTech, 2014, 15(4): 928-38.
DOI: 10.1208/s12249-014-0124-9. |
| [19] |
中华人民共和国卫生部.
消毒技术规范[M]. 北京: 中华人民共和国卫生部, 2002: 132-4.
|
| [20] |
Almomen A, Cho S, Yang CH, et al. Thermosensitive progesterone hydrogel:A safe and effective new formulation for vaginal application[J].
Pharm Res, 2015, 32: 2266-79.
DOI: 10.1007/s11095-014-1616-8. |
| [21] |
Ensign LM, Cone R, Hanes J. Nanoparticle-based drug delivery to the vagina:a review[J].
J Control Release, 2014, 190: 500-14.
DOI: 10.1016/j.jconrel.2014.04.033. |
| [22] |
Yun JW, Kwon E, Kim Y S, et al. Assessment of acute, 14-day, and 13-week repeated oral dose toxicity of Tiglium seed extract in rats[J].
BMC Complement Altern Med, 2018, 18: 251.
DOI: 10.1186/s12906-018-2315-5. |
| [23] |
Ryu HJ, Seong N, So BJ, et al. Evaluation of silica nanoparticle toxicity after topical exposure for 90 days[J].
Int J Nanomedicine, 2014, 9(2): 127-36.
|
| [24] |
Bregman CL, Adler RR, Morton DG, et al. Recommended tissue list for histopathologic examination in repeat-dose toxicity and carcinogenicity studies:a proposal of the Society of Toxicologic Pathology (STP)[J].
Toxicol Pathol, 2003, 31: 251-3.
|
| [25] |
Boudreau MD, Imam MS, Paredes AM, et al. Differential effects of silver nanoparticles and silver ions on tissue accumulation, distribution, and toxicity in the sprague dawley rat following daily oral gavage administration for 13 Weeks[J].
Toxicol Sci, 2016, 150(1): 131-60.
DOI: 10.1093/toxsci/kfv318. |
| [26] |
D'Cruz OJ, Waurzyniakt B, Uckun FM. A 13-week subchronic intravaginal toxicity study of pokeweed antiviral protein in mice[J].
Phytomedicine, 2004, 11(4): 342-51.
DOI: 10.1078/0944711041495209. |
| [27] |
Ryu HJ, Seo MY, Jung SK, et al. Zinc oxide nanoparticles:a 90- day repeated-dose dermal toxicity study in rats[J].
Int J Nanomedicine, 2014, 9(2): 137-44.
|
| [28] |
Das NJ, Araujo F, Andrade F, et al. Biodistribution and pharmacokinetics of dapivirine-loaded nanoparticles after vaginal delivery in mice[J].
Pharm Res, 2014, 31(7): 1834-45.
DOI: 10.1007/s11095-013-1287-x. |
| [29] |
《化学药物刺激性、过敏性、溶血性药物试验指导原则》课题研究组.
化学药物刺激性、过敏性、溶血性药物试验指导原则[M]. 北京: 国家食品药品监督管理局, 2005: 2-5.
|
| [30] |
《化学药物急性毒性试验指导原则》课题研究组.
化学药物急性毒性试验指导原则[M]. 北京: 国家食品药品监督管理局, 2005: 1-16.
|
| [31] |
Ward JW, Clifford WS, Monaco AR, et al. Fatal systemic poisoning following podophyllin treatment of condyloma acuminatum[J].
South Med J, 1954, 47(12): 1204-6.
DOI: 10.1097/00007611-195412000-00021. |
| [32] |
《化学药物长期毒性试验指导原则》课题研究组.
化学药物长期毒性试验指导原则[M]. 北京: 国家食品药品监督管理局, 2005: 1-14.
|
| [33] |
Padhiar BB, Karia UK, Aggarwal R, et al. A comparative study of efficacy of imiquimod 5% versus podophyllin 20% in treatment of external ano genital warts (60 patients)[J].
Indian J Sexually Trans Dis, 2006, 27(2): 67-9.
|
 2018, Vol. 38
2018, Vol. 38

