2. 重庆医科大学附属第二医院麻醉科,重庆 400010
2. Department of Anesthesiology, Second Affiliated Hospital of Chongqing Medical University, Chongqing 400010, China
内毒素或脂多糖(LPS)是多数革兰氏阴性细菌细胞壁的组成成分[1-2]。约有三分之一的败血症休克患者来源于革兰阴性菌感染,并有较高死亡率[3]。通常认为,LPS只能通过与细胞膜TOLL样受体4(LR4)结合后才能将刺激信号传导至细胞内进而导致炎症发生[4-6]。然而,有文献表明TLR4并不是导致细胞炎性死亡的唯一途径[7-8]。
组织蛋白酶B是溶酶体内一类半胱氨酸蛋白水解酶,生理情况下约10%酶原被分泌至胞浆,激活后参与激素原激活、抗原呈递等生理现象[9]。然而,在由病原微生物、促炎因子及氧化应激所致的细胞损伤状态下,细胞溶酶体膜稳定性下降,通透性升高甚至破裂,大量组织蛋白酶B释放入胞浆被激活,从而介导细胞的炎性坏死及凋亡[10]。肿瘤坏死因子(TNF)-α是炎症发生发展过程中的一种重要的促炎因子,人类单克隆抗体-抗TNF-α已被批准用于治疗炎症性疾病,如风湿性关节炎和炎症性肠道疾病等[11]。有文献证实,组织蛋白酶B活化后可引起下游TNF-α、IL-1β及IL-18等促炎因子的水平增加,而组织蛋白酶B的抑制剂可降低这些促炎因子的水平[12-14]。
脓毒血症的发病机制复杂,涉及感染、炎症、免疫、凝血及组织损害等一系列病理过程且死亡率极高,阻断LPS可显著降低脓毒血症发病率和死亡率[15]。更好地理解革兰氏阴性细菌感染识别中非依赖TLR4受体通路的活化机制可能成为治疗脓毒血症的新途径。然而,目前尚无确切研究证实LPS是否能通过组织蛋白酶B途径激活下游炎症反应进而引起脓毒血症。因此本实验提出假设:进入细胞质的LPS可以促进组织蛋白酶B的活化,并随后促进炎症因子水平的增加;组织蛋白酶B可成为治疗脓毒血症的新靶点。
1 材料和方法 1.1 试剂脂多糖(Sigma),组织蛋白酶B抑制剂(CA-074,Cayman),白细胞介素(IL)-1α、白细胞介素(IL)-1β、TNF-α和白细胞介素(IL)-18 ELISA试剂盒(中杉金桥)。
1.2 动物生存实验:致死剂量脂多糖刺激的动物建模分组从重庆医科大学动物实验中心领取6~8周,体质量20 g左右的雄性C57BL/6 WT小鼠18只随机分为3组(每组6只),TLR4-/-小鼠18只随机分为3组(每组6只),两种小鼠的各组均分别按照以下方式给予致死剂量LPS打击后,12 h观察1次,连续6 d,统计小鼠存活率。
(1)生理盐水对照组:腹腔注射与LPS组等体积的无菌生理盐水。
(2)致死剂量LPS组(LPS组):按照Kayagaki等(Kayagaki,et al.Science.2013)[8]的方法,腹腔注射LPS每千克体质量54 mg (致死剂量LPS)。
(3) CA-074预处理组(CA-074+LPS组):腹腔注射组织蛋白酶B抑制剂CA-074 10 mg/kg,30 min后腹腔注射致死剂量LPS。
1.3 脓毒血症动物建模及分组:大剂量脂多糖建立脓毒血症模型从重庆医科大学动物实验中心领取6~8周,体质量20 g左右的雄性C57BL/6 WT小鼠36只,随机分为3组(每组12只),雄性TLR4-/-小鼠36只,随机分为3组(每组12只),两种小鼠的各组均按照1.2中方法分组,分别给予:Ⅰ、无菌生理盐水,Ⅱ、大剂量LPS (20 mg/kg),Ⅲ、CA-074(10 mg/kg)+大剂量LPS (20 mg/kg)方式处理,12 h后收集外周血及肝组织进行检测。
1.4 Kupffer细胞的分离提取 1.4.1 材料显微外科器械、无菌培养皿(10 cm)、无菌移液管离心(15 mL)、无菌PBS、Ⅳ型胶原酶0.5%(每只1.5 mL)、无菌注射器(5 mL、1 mL)、无菌六孔板、碘伏、棉签、乙醚、DMEM (高糖)培养基。37℃水浴预热Ⅳ型胶原酶,按照0.5%Ⅳ型胶原酶/PBS=1/4比例配置Ⅳ型胶原酶工作液(即每只10 mL)。
1.4.2 细胞提取步骤无菌操作下,采用原位灌注法去除肝脏内血液并分离肝脏,去除肝脏周围结缔组织及胆囊,无菌PBS冲洗后,至于预热的胶原酶工作液中。用显微外科镊快速将肝脏划碎至尽可能小的组织块,反复水浴消化并吹打数次,总消化时长不超过40 min。消化液经金属滤网过滤后,悬液采用差速离心法离心,最终的细胞沉淀用培养基重悬后接种于六孔板中,选择性贴壁法纯化Kupffer细胞。
1.5 检测指标与方法 1.5.1 致死剂量LPS组小鼠生存率及生存时间观察(n=6)给予致死计量LPS打击后,每12 h观测1次,连续观察至处理组小鼠全部死亡,统计小鼠存活率及每组小鼠生存时间。
1.5.2 肝组织HE染色(n=4)取各脓毒血症组小鼠肝脏样本进行HE染色,观察肝脏病理变化情况。
1.5.3 组织蛋白酶B、NLRP3、caspase-1蛋白水平(n=4)提取剩余各脓毒血症组小鼠的肝脏Kupffer细胞,分别进行组织蛋白酶B、NLRP3、caspase-1蛋白水平检测。
1.5.4 组织蛋白酶B活性检测(n=4)采用洋地黄皂苷提取方法,即不破坏溶酶对细胞质内的组织蛋白酶B活性进行检测。
1.5.5 血清中IL-1α、IL-1β、TNF-α以及IL-18测定(n=8)从-80℃冰箱将小鼠血清标本取出,融化后每个样本取至少200 μL,按照ELISA试剂盒操作说明分别检测IL-1α、IL-1β、TNF-α以及IL-18水平。
1.6 统计学处理各组计量资料以均数±标准差表示,两组间采用t检验进行均值的比较;多组间采用单因素方差分析进行比较,数据分析使用SPSS统计分析软件,P<0.05为差异有统计学意义。
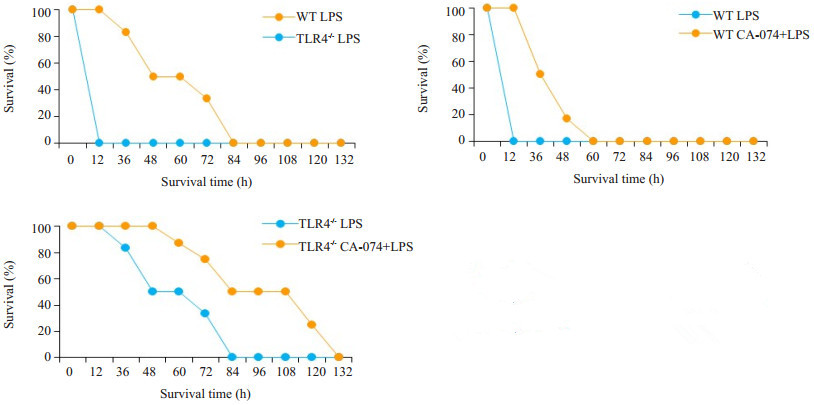
2 结果 2.1 小鼠生存率统计生存曲线结果显示:WT LPS组小鼠于给药12 h内全部死亡,TLR4-/- LPS组小鼠36 h开始死亡,84 h内全部死亡(图1),即与WT小鼠相比较,TLR4-/-小鼠对致死剂量LPS打击具有一定的抵抗力,但仍无法完全抵抗其伤害,表明LPS可以通过TLR4非依赖途经导致小鼠死亡。
|
图 1 致死性LPS (54 mg/kg)打击WT和TLR4-/-小鼠生存曲线 Fig.1 Survival curves of WT and TLR4-/- mice after injection with a lethal dose of LPS (54 mg/kg) |
经CA-074预处理后再使用LPS打击,相比于单纯LPS打击,WT及TLR4-/-CA-074+LPS组小鼠的生存时间显著延长,WT CA074+LPS组最长生存至60 h,TLR4-/-CA074+LPS组最长可生存至132 h (图1),即抑制组织蛋白酶B活性可以进一步缓解致死剂量LPS的作用,表明组织蛋白酶B在LPS导致脓毒血症过程中也具有重要作用。
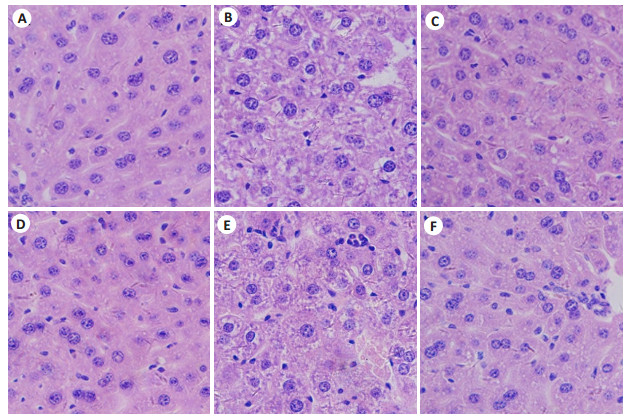
2.2 脓毒血症小鼠肝脏HE染色采用大剂量LPS刺激,建立小鼠脓毒血症模型(图2),相比于CON组小鼠的正常肝脏,WT及TLR4-/-LPS组小鼠的肝组织均发生明显组织膨胀,肝细胞水肿疏松,并有部分肝细胞脱落,炎症细胞浸润增加;相比于WTLPS组,TLR4-/-LPS组小鼠肝脏肿胀有所减轻,肝细胞水肿有所缓解。
|
图 2 各组小鼠脓毒血症建模肝脏HE染色 Fig.2 HE staining of the liver tissues (Original magnification:×400) A: WT N; B: WT LPS; C: WT LPS+ CA074; D: TLR4-/-N; E: TLR4-/-LPS; F: TLR4-/-LPS+CA074 |
经CA-074预处理后再加LPS刺激,相比于单纯使用LPS刺激,CA-074+LPS组小鼠的肝组织变性坏死显著减轻,肝组织膨胀明显缓解,仅有少量空泡存在。
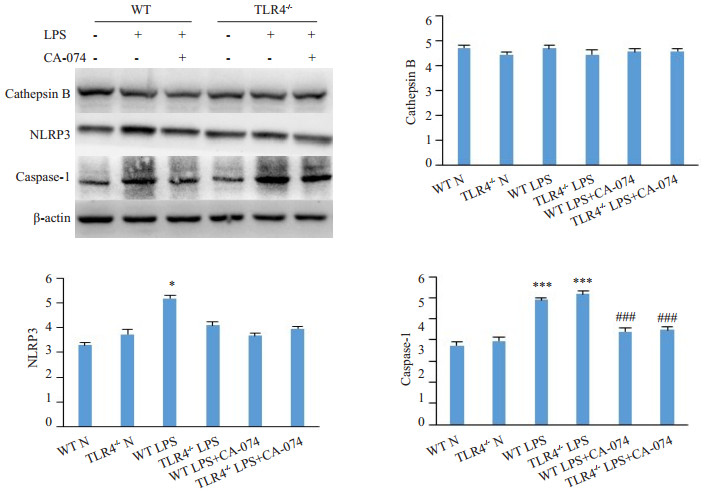
2.3 小鼠肝脏Kupffer细胞胞质中组织蛋白酶B、NLRP3、caspase-1蛋白质水平变化给与大剂量LPS刺激后,WB结果显示,与NS组相比,WTLPS组小鼠Kupffer细胞的组织蛋白酶B蛋白表达水平均无明显变化,而NLRP3蛋白表达水平则明显增加(P<0.05),caspase-1蛋白表达水平明显增加(P<0.05,图3)。表明大剂量LPS刺激导致WT小鼠的NLRP3炎症小体明显激活。与TLR4-/- NS组相比,TLR4-/-LPS组小鼠肝脏组织蛋白酶B蛋白水平无明显变化,caspase-1蛋白激活水平增加(P<0.05),NLRP3蛋白表达稍增加但无明显统计学意义(图3)。表明TLR4缺失后NLRP3炎症小体的激活不明显。
|
图 3 WT或TLR4-/-小鼠肝脏Kupffer细胞胞质中组织蛋白酶B、NLRP3、caspase-1蛋白质水平变化 Fig.3 Western blotting of cathepsin B, NLRP3, and caspase-1 in Kupffer cells of WT and TLR4-/- mice (*P<0.05, WT LPS vs WTN, ***P<0.001 vs WT N or TLR4-/- N; ###P<0.001 vs WT LPS) |
加入CA-074后WTLPS组及TLR4-/-LPS组的组织蛋白酶B水平变化无统计学差异,caspase-1及NLRP3蛋白水平稍降低。表明CA-074对组织蛋白酶B的蛋白水平无显著影响,但可以降低LPS引起的NLRP3炎症水平增高。
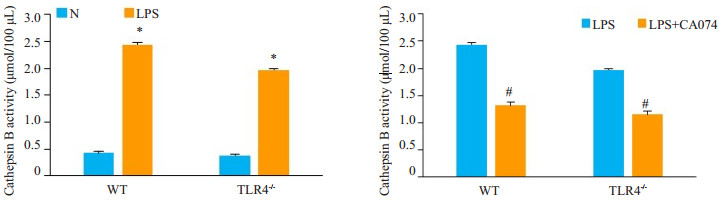
2.4 小鼠肝脏Kupffer细胞胞质中组织蛋白酶B活性改变给予大剂量LPS刺激后,Kupffer细胞胞质组织蛋白酶B活性检测结果显示:分别与各自对照组(NS组)比较,WT LPS组与TLR4-/- LPS组Kupffer细胞胞质中组织蛋白酶B活性显著增加(P<0.05,图4);WT LPS组与TLR4-/- LPS组相比,Kupffer细胞胞质中组织蛋白酶B活性增加程度无明显差异(图4)。表明TLR4缺失并不影响大剂量LPS刺激下胞质中组织蛋白酶B活性的增加。
|
图 4 Kupffer细胞胞质组织蛋白酶B活性变化 Fig.4 Activity of cathepsin B in Kupffer cells from WT and TLR4-/- mice *P < 0.05 vs WT N or TLR4-/- N; #P < 0.05 vs WT LPS or TLR4-/- LPS |
经CA-074预处理后再予以大剂量LPS刺激,与LPS组相比,CA-074+LPS组WT与TLR4-/-的组织蛋白酶B活性明显降低(P<0.05,图4)。表明组织蛋白酶B抑制剂预处理引起了组织蛋白酶B活性的明显下降。
2.5 小鼠血清炎症因子水平变化给予WT与TLR4-/-小鼠大剂量LPS刺激后,血清相关炎症因子水平ELISA检测结果显示:分别与各自对照组(NS组)比较,WT LPS组与TLR4-/-LPS组小鼠血清中IL-1α、IL-1β、TNF-α以及IL-18均明显增加(P<0.05)。与WT LPS组相比,TLR4-/- LPS组小鼠血清中IL-1α水平无明显差异,但IL-1β、TNF-α和IL-18水平明显低于WT LPS组(P<0.05,图5)。表明TLR4-/-主要影响IL-1β、TNF-α及IL-18的水平,对IL-1α水平影响较小。
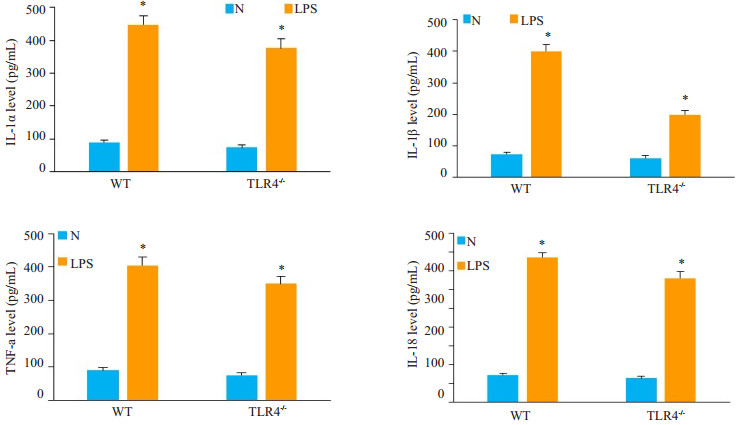
|
图 5 WT与TLR4-/-小鼠血清炎症因子水平变化 Fig.5 Levels of serum inflammatory cytokines in WT and TLR4-/-mice *P<0.05 vs WT N or TLR4-/- N |
经CA-074处理后再加LPS刺激,与LPS处理组相比,LPS+CA-074处理的WT及TLR4-/-血清中IL-1α、IL-1β、TNF-α以及IL-18均减少(P<0.05),其中IL-1α降低更为显著(P<0.05,图5)。表明抑制组织蛋白酶B活性可减少大剂量LPS刺激引起的WT与TLR4-/-血清炎症因子分泌,尤其可以减少IL-1α的分泌。
3 讨论本实验利用TLR4-/-小鼠,通过阻断TLR4研究非经典NLRP3炎症小体激活途径的可能分子机制,阐明组织蛋白酶B在脓毒血症的促炎作用,完善了LPS信号转导的分子机制,同时为临床相关感染性疾病的治疗提供了理论及实验依据。研究主要发现:(1)阻断TLR4信号通路不能完全消除对LPS的识别及信号传导,即LPS可能通过TLR4非依赖途经进入宿主细胞胞质并产生效应。(2)内毒素血症时,胞质内的组织蛋白酶B活性异常增加,从而促进炎症水平增加,尤其是IL-1α的分泌。(3)抑制组织蛋白酶B酶活性,能够降低大剂量LPS对Kupffer细胞的毒性作用,并且显著延长内毒素血症小鼠的生存时间及生存率,对内毒素血症小鼠能够产生有效的保护作用。
LPS是革兰阴性杆菌细胞壁的组成成分,是介导炎症反应的重要成分之一[2]。大约1/3的脓毒症休克患者是由革兰氏阴性杆菌感染导致,其发病机制复杂,涉及感染、炎症、免疫、凝血及组织损害等一系列病理过程且死亡率极高[16]。通常认为,LPS仅能通过作用于TLR4受体依赖的经典途径引发炎症反应[4-6]。NOD样受体(NLRs)是一类经典的胞质感受器,可以感受细菌、病毒或真菌等经TLR4传导的信号,其中NLRP3最为重要[17]。活化的NLRP3可以使pro-caspase-1裂解为成熟的caspase-1并招募ASC形成经典的NLRP3炎症小体,最终导致IL-1β、IL-18等炎症因子的成熟和分泌[18]。然而,许多特异性抑制TLR4信号通路的药物并不能降低脓毒症的死亡率,随着对炎症小体激活机制的研究逐步深入,非经典炎症小体途径的发现为临床相关感染性疾病治疗带来了新思路[19]。本实验结果显示:在致死剂量LPS建立的脓毒血症模型中,WT小鼠12 h内全部死亡,与其相比较,TLR4-/-小鼠对致死剂量LPS打击具有一定的抵抗力,36 h开始出现死亡,但仍无法完全抵抗其伤害,84 h全部死亡,表明LPS可以通过TLR4非依赖途经导致小鼠死亡。使用组织蛋白酶B抑制剂预处理后,WT与TLR4-/-小鼠各生存延长至60 h及132 h,表明组织蛋白酶B在LPS刺激产生脓毒血症过程中起重要作用。
溶酶体是一种膜性细胞器,存在于所有原生动物和多细胞动物细胞中,多种因素如活性氧、鞘氨醇以及组织蛋白酶类等可影响溶酶体膜的通透性[20]。当溶酶体膜通透性增加时,可释放一定量的溶酶体水解酶,导致细胞应激及凋亡[20-22]。当发生炎症反应与氧化应激时,细胞内活性氧生成增多,溶酶体内处于自由状态的铁离子通过对过氧化氢的催化作用,促进羟基自由基形成,同时在线粒体生成活性氧的正反馈环路作用下,引发溶酶体膜损伤[23-24];TNF-α等早期炎症介质可促进细胞内鞘氨醇生成,其经历溶酶体内部的质子化过程后,引发溶酶体膜发生通透反应[25],在LPS诱导的脓毒血症的发生发展过程中发挥重要作用;溶酶体内组织蛋白酶类的释放可以对溶酶体产生直接的破坏作用,进一步诱导溶酶体通透化[26-27]。本研究通过检测大剂量LPS处理的WT和TLR4-/-小鼠Kupffer细胞的组织蛋白酶B的蛋白表达水平及胞质内活性证实,LPS可显著增强组织蛋白酶B的活性,而不影响其蛋白水平,同时与TLR4是否缺陷无明确关系,表明组织蛋白酶B的活化不依赖TLR4受体。TLR4-/-LPS组小鼠的NLRP3、caspase-1蛋白水平虽显著低于WTLPS组小鼠,但较TLR4-/-组仍稍有增加,抑制组织蛋白酶B活性后,WTLPS+CA-074及TLR4-/-LPS+CA-074组小鼠的NLRP3、caspase-1蛋白水平均比WTLPS组显著降低,说明仅阻断TLR4后仅部分降低LPS的致炎作用,同时阻断TLR4及组织蛋白酶B可显著降低LPS的致炎作用。经过大剂量LPS刺激后,WT和TLR4-/-小鼠血清中炎症因子水平显著增加,然而相比于WT小鼠,TLR4-/-小鼠的IL-1β、TNF-α和IL-18水平明显降低,而IL-1α水平无明显差异,表明TLR基因缺陷主要影响IL-1β、TNF-α和IL-18的水平,而对IL-1α水平无明显干扰;用组织蛋白酶B抑制剂CA-074预处理后,IL-1α和TNF-α水平显著降低,表明组织蛋白酶B通路主要降低IL-1α及TNF-α的表达及分泌,进而缓解脓毒血症的发生。
本实验以组织蛋白酶B为主要切入点,证实了其在LPS引起的非经典炎症信号通路中的重要作用,为今后的研究方向奠定基础,同时为临床治疗相关疾病指引了新的方向。
| [1] |
Korneev KV, Kondakova AN, Sviriaeva EN, et al. Hypoacylated Lps from foodborne pathogen campylobacter jejuni induces moderate Tlr4-Mediated inflammatory response in murine macrophages[J].
Frontiers Cell Infect Microbiol, 2018, 8: 58.
DOI: 10.3389/fcimb.2018.00058. |
| [2] |
Xiang P, Chen T, Mou Y, et al. Nz Suppresses Tlr4/Nf-Kappab signalings and Nlrp3 inflammasome activation in Lps-Induced raw264.7 macrophages[J].
Inflam Res:Official J European Histamine Res Soc[et al], 2015, 64(10): 799-808.
|
| [3] |
Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock(Sepsis-3)[J].
JAMA, 2016, 315(8): 801-10.
DOI: 10.1001/jama.2016.0287. |
| [4] |
Poltorak A, He X, Smirnova I, et al. Defective Lps signaling in C3h/Hej and C57bl/10sccr mice:mutations in Tlr4 gene[J].
Science, 1998, 282(5396): 2085-8.
DOI: 10.1126/science.282.5396.2085. |
| [5] |
Meng J, Gong M, Bjorkbacka H, et al. Genome-wide expression profiling and mutagenesis studies reveal that lipopolysaccharide responsiveness appears to be absolutely dependent on Tlr4 and Md-2 expression and is dependent upon intermolecular ionic interactions[J].
J Immunol, 2011, 187(7): 3683-93.
DOI: 10.4049/jimmunol.1101397. |
| [6] |
Rathinam VA, Fitzgerald KA. Immunology:Lipopolysaccharide sensing on the inside[J].
Nature, 2013, 501(7466): 173-5.
DOI: 10.1038/nature12556. |
| [7] |
Joannes-Boyau O, Honore PM, Perez P, et al. High-volume versus standard-volume haemofiltration for septic shock patients with acute kidney injury(Ivoire Study):A multicentre randomized controlled trial[J].
Intens Care Med, 2013, 39(9): 1535-46.
DOI: 10.1007/s00134-013-2967-z. |
| [8] |
Kayagaki N, Wong MT, Stowe IB, et al. Noncanonical inflammasome activation by intracellular Lps independent of Tlr4[J].
Science, 2013, 341(6151): 1246-9.
DOI: 10.1126/science.1240248. |
| [9] |
Li YY, Fang J, Ao GZ. Cathepsin B and L Inhibitors:A Patent Review(2010-Present)[J].
Expert Opin Therap Patents, 2017, 27(6): 643-56.
DOI: 10.1080/13543776.2017.1272572. |
| [10] |
Kubisch R, Frohlich T, Arnold GJ, et al. V-atpase inhibition by archazolid leads to lysosomal dysfunction resulting in impaired cathepsin B Activation in Vivo[J].
Inter J Cancer, 2014, 134(10): 2478-88.
DOI: 10.1002/ijc.v134.10. |
| [11] |
Oberoi R, Vlacil AK, Schuett J, et al. Anti-tumor necrosis factoralpha therapy increases plaque burden in a mouse model of experimental atherosclerosis[J].
Atherosclerosis, 2018, 277: 80-9.
DOI: 10.1016/j.atherosclerosis.2018.08.030. |
| [12] |
Vancompernolle K, Van Herreweghe F, Pynaert G, et al. Atractyloside-induced release of cathepsin B, a protease with caspase-processing activity[J].
FEBS Letters, 1998, 438(3): 150-8.
DOI: 10.1016/S0014-5793(98)01275-7. |
| [13] |
Schotte P, Van Criekinge W, Van de Craen M, et al. Cathepsin Bmediated activation of the proinflammatory caspase-11[J].
Biochemi Biophy Rres Commun, 1998, 251(1): 379-87.
DOI: 10.1006/bbrc.1998.9425. |
| [14] |
Wenzel TJ, Klegeris A. Novel multi-target directed ligand-based strategies for reducing neuroinflammation in alzheimer's disease[J].
Life sciences, 2018, 207: 314-22.
DOI: 10.1016/j.lfs.2018.06.025. |
| [15] |
Mao K, Chen S, Chen M, et al. Nitric oxide suppresses Nlrp3 inflammasome activation and protects against Lps-induced septic shock[J].
Cell Res, 2013, 23(2): 201-12.
DOI: 10.1038/cr.2013.6. |
| [16] |
Angus DC, van der Poll T. Severe sepsis and septic shock[J].
New England J Med, 2013, 369(9): 840-51.
DOI: 10.1056/NEJMra1208623. |
| [17] |
Alonso-Perez A, Franco-Trepat E, Guillan-Fresco M, et al. Role of toll-like receptor 4 on osteoblast metabolism and function[J].
Frontiers Physiol, 2018, 9: 504.
DOI: 10.3389/fphys.2018.00504. |
| [18] |
Li H, Zhang X, Chen M, et al. Dexmedetomidine inhibits inflammation in microglia cells under stimulation of Lps and Atp by C-Fos/Nlrp3/Caspase-1 cascades[J].
EXCLI J, 2018, 17: 302-11.
|
| [19] |
Lu XJ, Chen J, Yu CH, et al. Lect2 Protects Mice against bacterial sepsis by activating macrophages via the Cd209a receptor[J].
J EXP Med, 2013, 210(1): 5-13.
DOI: 10.1084/jem.20121466. |
| [20] |
Guicciardi ME, Leist M, Gores GJ. Lysosomes in cell death[J].
Oncogene, 2004, 23(16): 2881-90.
DOI: 10.1038/sj.onc.1207512. |
| [21] |
Kagedal K, Zhao M, Svensson I, et al. Sphingosine-induced apoptosis is dependent on lysosomal proteases[J].
Biochem J, 2001, 359(Pt 2): 335-43.
|
| [22] |
Leist M, Jaattela M. Triggering of apoptosis by cathepsins[J].
Cell Death Differ, 2001, 8(4): 324-6.
DOI: 10.1038/sj.cdd.4400859. |
| [23] |
Kurz T, Gustafsson B, Brunk UT. Intralysosomal iron Chelation protects against oxidative stress-induced cellular damage[J].
FEBS J, 2006, 273(13): 3106-17.
DOI: 10.1111/ejb.2006.273.issue-13. |
| [24] |
Terman A, Kurz T, Gustafsson B, et al. Lysosomal labilization[J].
IUBMB life, 2006, 58(9): 531-9.
DOI: 10.1080/15216540600904885. |
| [25] |
Werneburg N, Guicciardi ME, Yin XM, et al. Tnf-Alpha-mediated lysosomal permeabilization is fan and caspase 8/Bid dependent[J].
Am J Physiol Gastroint Liver Physiol, 2004, 287(2): G436-43.
DOI: 10.1152/ajpgi.00019.2004. |
| [26] |
de Castro MA, Bunt G, Wouters FS. Cathepsin B launches an apoptotic exit effort upon cell death-associated disruption of lysosomes[J].
Cell Death Discovery, 2016, 2: 16012.
|
| [27] |
Yin L, Stearns R, Gonzalez-Flecha B. Lysosomal and mitochondrial pathways in H2o2-Induced apoptosis of alveolar type Ii cells[J].
J Cellular Biochem, 2005, 94(3): 433-45.
DOI: 10.1002/jcb.20277. |
 2018, Vol. 38
2018, Vol. 38

