2. 广东省人民医院//广东省医学科学院,广东 广州 510282
2. Department of Radiology, Guangdong Academy of Medical Sciences/Guangdong General Hospital, Guangzhou 510282, China
鼻咽癌(NPC)是一种典型地域分布的头颈部恶性肿瘤,主要分布在中国南方、东南亚以及非洲地区,与EB病毒感染密切相关[1-3]。每年约有87 000例病人确诊为鼻咽癌,而其中超过一半以上的TNM分期已是进展期[4-5]。同期进展期鼻咽癌病人采取的治疗方式相似,而其中约有30%以上的患者治疗失败[6]。以往治疗失败的原因归咎于局部复发以及远处转移,但随着调强放疗以及同步化疗技术提高,目前治疗失败的主要归咎于远处转移[7-8]。尽管目前关于鼻咽癌的预后预测做了大量的实验[7,9-14],但进展期鼻咽癌远处转移风险全面的临床参数模型至今尚未建立。此次回顾性实验的目的是基于140例进展期鼻咽癌患者的多方面临床参数建立的远处转移风险评估模型。
1 资料和方法 1.1 临床资料2007年9月~2015年6月期间,随访至2017年12月,纳入经活检证实为鼻咽癌的第七版AJCC分期为Ⅲ ~Ⅳ期(M0)的140例患者[15]。纳入标准:(1)均经活检证实为鼻咽癌患者;(2)所有纳入的转移的鼻咽癌患者病人均进行了PET/CT,头颈部MR,胸部X片,全腹B超,以及骨扫描等检查;(3)治疗前的临床检查资料完善:如血常规,全套生化检测,EBV DNA定量检测,EB病毒抗体滴度检测等;(4)规律的定期随访:前3年每1~3月1次;4~5年时每半年复查1次。随访方式包括电话随访、短信随访、门诊随访;(5)无其他恶性肿瘤病史。排除标准:(1)鼻咽癌患者一开始已发生远处转移;(2)远处转移诊断依据不充分,如无完善的影像学检查或活检;(3)临床资料不完善。判断远处转移的标准:以上任何一种影像学检查中提示转移病灶,则需要在可疑部位进一步附加检查证实,如CT,MRI或者活检等,并排除原发于其它脏器的远处转移。如若病灶在附加检查中未能确诊,则需每3月对该可疑病灶进行随访,随访至少1年。在随访1年以后,病灶未发生改变,则考虑为局灶性病变,排除该病例;若在随访期间进一步发展则考虑为远处转移[16-17]。
纳入的18个临床参数分别为:年龄,性别,T分期,N分期,分级,组织学类型,治疗前血清EBV DNA,VCA-IgA,EA-IgA,C反应蛋白(CRP),乳酸脱氢酶(LDH),血红蛋白(HGB),血小板计数(PLT),中性粒细胞计数/白细胞计数(NWR),中性粒细胞计数/淋巴细胞计数(NLR),白蛋白/碱性磷酸酶比率(ALB/ALP),同步放化疗,诱导化疗。
1.2 初诊时治疗方案同步放化疗的126例,非同步放化疗的14例;诱导化疗的40例。其中放疗采用常规分割外照射(1.8~2.0 Gy/次,5次/周),鼻咽原发灶部位剂量范围66~74 Gy,上颈部放疗50~60 Gy,下颈部放疗50 Gy;和调强放疗IMRT,原发灶部位剂量范围66~70 Gy,预防照射区域54~56 Gy,分割次数均为30~33次。化疗方案采用的是以铂类为主的单独或者联合化疗,包括68例紫杉醇+顺铂方案,60例5-氟尿嘧啶+顺铂方案,12例吉西他滨+顺铂方案。
1.3 统计方法统计分析运用了R语言3.5.0版本(https://www.rproject.org/)及SPSS 23.0软件。单因素分析用于检验单一变量或指标在不同分类及不同集合之间差异是否有统计学意义,对连续变量使用Mann-Whitney U检验或t检验,对标签变量使用χ2检验或Fisher精确检验。LASSO算法"glmnet "工具包进行选择最有鉴别意义的特征[
其中男性患者106例,女性患者34例;中位年龄为41岁;同步放化疗的126例,非同步放化疗的14例;诱导化疗的40例。病理分型WHO分为5例Ⅱ型(非角化分化型鳞状细胞癌),135例Ⅲ型(未角化未分化型鳞状细胞癌)。随访时间自确诊鼻咽癌并开始治疗起,至2017年截止。随访时间12~77月,失访3例,失访率为97.9%。开始治疗至发生转移的中位时间为12月(5~34月)。纳入的18个临床特征包括:年龄(41岁),性别,T分期,N分期,分级,组织学类型,治疗前血清EBV DNA (4000 copies/mL),VCA-IgA (1:160),EA-IgA (1:20),CRP (2.0 mg/L),LDH (184 U/L),HGB (140 × 109/L),PLT (232.7×109/L),NWR (0.65),NLR (2.8),ALB/ALP (0.58),同步放化疗(有或没有),诱导化疗(有或没有)(表1)。
| 表 1 训练集与验证集临床特征对比 Tab.1 Clinical characteristics of the training cohort and validation cohort |
共140例患者用于建模,其中按1:1的比例随机分为训练集和验证集。训练集与验证集的临床参数差异均无统计学意义。在总的18个临床参数,经LASSO算法筛选后,在图1中交叉验证误差最小时的lambda处,得到5个与进展期鼻咽癌患者远处转移密切相关的参数,分别是血清EBV DNA,中性粒细胞计数/淋巴细胞计数(NLR),治疗前血清VCA-IgA抗体,同步放化疗,诱导化疗。
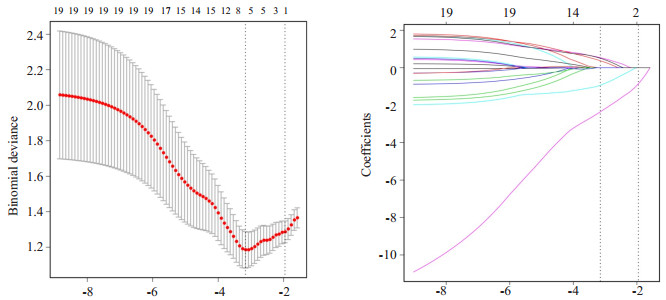
|
图 1 利用LASSO算法选择与进展期鼻咽癌远处转移最相关临床参数 Fig.1 Selection of the most significant clinical variables associated with distant metastasis of nasopharyngeal carcinoma using the least absolute shrinkage and selection operator (LASSO) method |
基于这5个临床参数,我们建立了一个风险评估模型为:风险值=1.73 × EBV DNA+0.54 ×NLR+0.38 × VCA-IgA-0.95×同步放化疗-2.37×诱导化疗+0.51。在训练集中该模型的AUC为0.83(95% CI,0.64-0.85),精确性为0.76,敏感性为0.82,特异性为0.72;验证集验证时该模型的AUC为0.74(95% CI,0.60-0.82),精确性为0.72,敏感性为0.65,特异性为0.77(图2)。根据模型输出的风险值,我们得到一个最佳节点值-0.62,将患者划分为高风险与低风险。当患者风险值低于-0.62时分为低风险,高于-0.62时分为高风险(P<0.001)。基于高低风险组的生存分析显示有明显的统计学意义(P<0.001,图3)。通过Cox分析得出选出的5个临床变量均为进展期鼻咽癌的远处转移独立风险因素(P<0.05)。
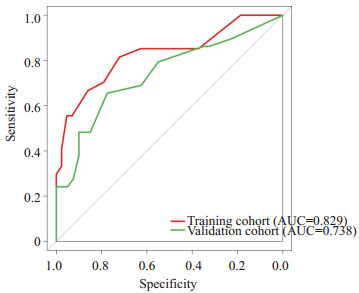
|
图 2 训练集与验证集模型预测表现 Fig.2 Receiver operating characteristic curve of the training cohort and validation cohort |
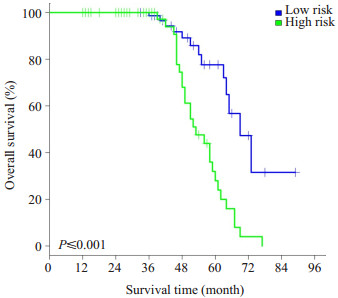
|
图 3 预测模型的高、低风险组的生存曲线 Fig.3 Survival curves in the low- and high-risk patient groups based on the model |
在此次回顾性实验中,我们纳入了前期文献中所提及与鼻咽癌相关的18个临床风险因素。将这18个临床参数运用机器算法进行筛选,最终建立以及验证了一个新型的用于预测评估进展期鼻咽癌患者的远处转移风险的预测模型。根据该模型将进展期鼻咽癌患者分为高转移风险组与低转移风险组,在高低风险组间总生存时间存在明显差异性(P<0.001)。
在此次实验中,我们发现EBVDNA,NLR,VCA-IgA,同步放化疗以及诱导化疗与进展期鼻咽癌患者远处转移密切相关。目前血清EBV DNA已广泛用于鼻咽癌的筛查、检测、治疗反应以及复发转移预测[19]。大量的研究[20-21]均指出,治疗前的血清EBV DNA滴度是鼻咽癌的一项重要的独立风险因素。值得注意的是也有文章[22-23]指出,尽管血清EBV DNA与鼻咽癌的总的生存情况密切相关,但其中对于远处转移的预测效果比局部复发的效果更好。而此次实验也证明了血清中EBV DNA可作为进展期鼻咽癌的远处转移一项独立风险因素(风险比,HR=1.87,95% CI:1.07-3.27;P=0.028)。血清EB病毒的VCA-IgA抗体与血清EBV DNA滴度一样,广泛运用的鼻咽癌早期检测以及监测治疗进展,也被作为独立风险因素保留下来[24-25]。本研究中血清EB病毒的VCA-IgA抗体中位数为1:160,并且其中只有6例病人低于1:10。也有学者[11,26]提出中性粒细胞-淋巴细胞比率(NLR)可作为鼻咽癌的风险因素,而在此次实验中我们证实了NLR可作为一项风险因素评估进展期的鼻咽癌的远处转移。
ESMO 2012年版鼻咽癌临床指南[27]建议:进展期鼻咽癌(Ⅲ~Ⅳ期)常规应用同步放化疗,并且进展期的病人常常在放疗前增加诱导化疗。而此次建立的基于的进展期的鼻咽癌患者建立的模型也同时证明了采用同步放化疗和诱导化疗可以降低风险值。此外多项临床随访治疗研究指出[28-29],诱导化疗加同步放化疗能明显提高进展期患者的远期控制。对于肿瘤病人的总的生存率以及远期控制确实能获益于应用诱导化疗加同步放化疗,但毒副反应也是潜在存在的,如口腔黏膜炎,白细胞减少,脊髓抑制等。因此运用我们的模型精确评估出区分出高转移风险和低转移风险的鼻咽癌患者,并针对不同风险患者进行精准的个体化治疗。这不仅仅是降低低风险鼻咽癌患者过度用药而导致的多种毒副反应,同时也降低高转移风险患者因用量不足而导致的的总体生存率以及远期控制不佳。
之前有研究[9,30]建立了基于血清C-反应蛋白(CPR)与N分期对于鼻咽癌远处转移的预测模型,并通过该模型将患者分为高中低风险,预测效果显著(P<0.001)。血清C-反应蛋白可以通过生化检查获得,而N分期可以从AJCC分期获得。而此次模型并未纳入这两项因素。基于算法自动筛选出与进展期鼻咽癌远处转移最相关的因素,因此CPR与N分期相对于纳入的因素而言,相关性并没有那么强。
在此次回顾研究中,我们还针对评估分类出的高低风险组患者进行了生存分析。结果表明高转移风险的患者总体生存明显低于低风险的患者。因此,治疗前精确评估是决定治疗成功与否的关键因素。在临床工作中,可依据此模型进行高低风险分类评估,以达到更加合理的选择治疗策略,更加精准的评估病人的病情。本研究的风险评估模型可应用于临床,并随着临床检验技术的发展,模型可得到进一步完善。
本研究也有一定的局限性:首先,本研究为回顾性研究,本身存在潜在的偏倚;其次,本研究为单中心、鼻咽癌好发地区收集的病例,这可能影响模型的广泛适用性,因此需要进一步多中心、多地区数据收集验证。
综上所述,本次基于EBV DNA,NLR,VCA-IgA,同步放化疗以及诱导化疗建立的鼻咽癌远处转移风险评估模型将鼻咽癌患者分为高低风险,实现个体化治疗。我们已经展示了模型强大的预测效果,这样在治疗方案制定时高风险的患者将获益于足量的治疗方案,而低风险的患者将承受更少因不适量而导致的毒副作用。
| [1] |
Peng H, Tang LL, Chen BB, et al. Optimizing the induction chemotherapy regimen for patients with locoregionally advanced nasopharyngeal Carcinoma: A big-data intelligence platform-based analysis[J].
Oral Oncol, 2018, 79(4): 40-6.
|
| [2] |
Lin JC, Wang WY, Chen KY, et al. Quantification of plasma EpsteinBarr virus DNA in patients with advanced nasopharyngeal carcinoma[J].
N Engl J Med, 2004, 350(24): 2461-70.
DOI: 10.1056/NEJMoa032260. |
| [3] |
Kamran SC, Riaz N, Lee N. Nasopharyngeal carcinoma[J].
Surg Oncol Clin N Am, 2015, 24(3): 547-61.
DOI: 10.1016/j.soc.2015.03.008. |
| [4] |
Tang XR, Li YQ, Liang SB, et al. Development and validation of a gene expression-based signature to predict distant metastasis in locoregionally advanced nasopharyngeal carcinoma: a retrospective, multicentre, cohort study[J].
Lancet Oncol, 2018, 19(3): 382-93.
DOI: 10.1016/S1470-2045(18)30080-9. |
| [5] |
Jin Y, Shi YX, Cai XY, et al. Comparison of five cisplatin-based regimens frequently used as the first-line protocols in metastatic nasopharyngeal carcinoma[J].
J Cancer Res Clin Oncol, 2012, 138(10): 1717-25.
DOI: 10.1007/s00432-012-1219-x. |
| [6] |
Ren XY, Yang XJ, Cheng B, et al. HOPX hypermethylation promotes metastasis via activating SNAIL transcription in nasopharyngeal carcinoma[J].
Nat Commun, 2017, 8(2): 14053.
|
| [7] |
Wang WY, Twu CW, Chen HH, et al. Plasma EBV DNA clearance rate as a novel prognostic marker for metastatic/recurrent nasopharyngeal carcinoma[J].
J Clin Oncol, 2010, 16(3): 1016-24.
|
| [8] |
易俊林. 416例鼻咽癌调强放疗远期生存与影响因素分析[J].
中华放射肿瘤学杂志, 2012, 21(3).
|
| [9] |
Xia WX, Zhang HB, Shi JL, et al. A prognostic model predicts the risk of distant metastasis and death for patients with nasopharyngeal carcinoma based on pre-treatment serum C-reactive protein and N-classification[J].
Eur J Cancer, 2013, 49(9): 2152-60.
DOI: 10.1016/j.ejca.2013.03.003. |
| [10] |
Shi Q, Shen CY, Kong L, et al. Involvement of both Cervical Lymph Nodes and Retropharyngeal Lymph Nodes has prognostic value for N1 patients with Nasopharyngeal Carcinoma[J].
Radiat Oncol, 2014, 9(1): 7.
DOI: 10.1186/1748-717X-9-7. |
| [11] |
Li XH, Chang H, Xu BQ, et al. An inflammatory biomarker-based nomogram to predict prognosis of patients with nasopharyngeal carcinoma: an analysis of a prospective study[J].
Cancer Med, 2017, 6(1): 310-9.
DOI: 10.1002/cam4.2017.6.issue-1. |
| [12] |
林灿峰, 李德锐, 陈志坚, 等. 无远处转移Ⅳ期鼻咽癌预后预测模型的建立与分析[J].
中国肿瘤临床, 2011, 38(23): 1443-6.
DOI: 10.3969/j.issn.1000-8179.2011.23.007. |
| [13] |
廖伟华, 杨力芳, 姜武忠, 等. Dce-mri定量参数评价放疗前后鼻咽癌肿瘤血管变化及其对预后评估的价值[J].
南方医科大学学报, 2015, 35(07): 954-9.
|
| [14] |
Chen C, Chen S, Le QT, et al. Prognostic model for distant metastasis in locally advanced nasopharyngeal carcinoma after concurrent chemoradiotherapy[J].
Head Neck, 2015, 37(2): 209-14.
DOI: 10.1002/hed.v37.2. |
| [15] |
Edge SB, Compton CC. The American joint committee on cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM[J].
Ann Surg Oncol, 2010, 17(6): 1471-4.
DOI: 10.1245/s10434-010-0985-4. |
| [16] |
Tang LQ, Chen QY, Fan W, et al. Prospective study of tailoring whole-body dual-modality [18F]fluorodeoxyglucose positron emission tomography/computed tomography with plasma epsteinbarr virus DNA for detecting distant metastasis in endemic nasopharyngeal carcinoma at initial staging[J].
J Clin Oncol, 2013, 31(23): 2861-9.
DOI: 10.1200/JCO.2012.46.0816. |
| [17] |
潘长穿. 1016例鼻咽癌远处转移患者的转移分层细化及其临床意义[J].
中华肿瘤杂志, 2013, 35(8).
|
| [18] |
Vasquez MM, Hu CC, Roe DJ, et al. Least absolute shrinkage and selection operator type methods for the identification of serum biomarkers of overweight and obesity: simulation and application[J].
BMC Med Res Methodol, 2016, 16(1): 154.
DOI: 10.1186/s12874-016-0254-8. |
| [19] |
Shao JY, Zhang Y, Li YH, et al. Comparison of Epstein-Barr virus DNA level in plasma, peripheral blood cell and tumor tissue in nasopharyngeal carcinoma[J].
Anticancer Res, 2004, 24(6): 4059-66.
|
| [20] |
Lo YM, Chan LY, Lo KW, et al. Quantitative analysis of cell-free Epstein-Barr virus DNA in plasma of patients with nasopharyngeal carcinoma[J].
Cancer Res, 1999, 59(6): 1188-91.
|
| [21] |
An X, Wang FH, Ding PR, et al. Plasma epstein-barr virus DNA level strongly predicts survival in metastatic/recurrent nasopharyngeal carcinoma treated with palliative chemotherapy[J].
Cancer, 2011, 117(16): 3750-7.
DOI: 10.1002/cncr.25932. |
| [22] |
Leung SF, Zee B, Ma BB, et al. Plasma Epstein-Barr viral deoxyribonucleic acid quantitation complements tumor-nodemetastasis staging prognostication in nasopharyngeal carcinoma[J].
J Clin Oncol, 2006, 24(34): 5414-8.
DOI: 10.1200/JCO.2006.07.7982. |
| [23] |
Leung SF, Lo YM, Chan AT, et al. Disparity of sensitivities in detection of radiation-naive and postirradiation recurrent nasopharyngeal carcinoma of the undifferentiated type by quantitative analysis of circulating Epstein-Barr virus DNA[J].
Clin Cancer Res, 2003, 9(9): 3431-4.
|
| [24] |
蔡永林, 郑裕明, 成积儒, 等. Eb病毒rta/igg, ebna1/iga, vca/iga及ea/iga抗体与鼻咽癌分期的关系[J].
南方医科大学学报, 2010, 30(03): 509-11.
|
| [25] |
孙剑光, 郑爱平. 鼻咽癌患者血浆EBV DNA水平和VCA-IgA检测的临床意义[J].
现代肿瘤医学, 2008, 16(12): 2086-7.
DOI: 10.3969/j.issn.1672-4992.2008.12.016. |
| [26] |
Wenhua, Liang, Guanzhu, et al. Development and validation of a nomogram for predicting the survival of patients with nonmetastatic nasopharyngeal carcinoma after curative treatment[J].
Chin J Cancer, 2016, 35(12): 658-65.
|
| [27] |
Chan A, Gregoire V, Lefebvre JL, et al. Nasopharyngeal cancer: EHNS-ESMO-ESTRO clinical practice guidelines for diagnosis, treatment and follow-up[J].
Annals of Oncology, 2012, 23(7): 83-5.
|
| [28] |
李卓玲, 金风, 吴伟莉, 等. 诱导化疗加同步放化疗治疗鼻咽癌的临床观察[J].
现代肿瘤医学, 2015, 23(6): 774-8.
DOI: 10.3969/j.issn.1672-4992.2015.06.14. |
| [29] |
Chen L, Hu CS, Chen XZ, et al. Concurrent chemoradiotherapy plus adjuvant chemotherapy versus concurrent chemoradiotherapy alone in patients with locoregionally advanced nasopharyngeal carcinoma: a phase 3 multicentre randomised controlled trial[J].
Lancet Oncol, 2012, 13(2): 163-71.
DOI: 10.1016/S1470-2045(11)70320-5. |
| [30] |
Yang L, Hong SD, Wang Y, et al. Development and external validation of nomograms for predicting survival in nasopharyngeal carcinoma patients after definitive radiotherapy[J].
Sci Rep, 2015, 5(10): 15638.
|
 2018, Vol. 38
2018, Vol. 38

