恶性肿瘤严重威胁人类健康,由于其常发生局部浸润和远处转移,我国恶性肿瘤死亡率持续上升。“肿瘤干细胞(CSC)理论”认为肿瘤是一种干细胞疾病,大量研究也表明恶性肿瘤中存在的CSCs可能与肿瘤的局部浸润和远处转移直接相关[1-3],但其中的发生机制尚不清楚。近年来,有研究发现肿瘤来源的外泌体与肿瘤的发生发展之间存在密切关系[4-7]。外泌体是由细胞分泌的直径在30~100 nm之间的脂质双分子层微小囊泡,携带多种生物活性物质[8-9],并广泛分布于多种体液中[10],不仅参与物质运输,而且在细胞间信息交流中发挥着媒介作用[11-12]。因此,我们推测肿瘤干细胞来源的外泌体可能在肿瘤转移中发挥着一定作用,即肿瘤干细胞产生的外泌体进入机体体液后,在远处转移灶通过改变正常的体细胞或干细胞的生物学行为,为肿瘤远处转移提供微环境,或者将正常细胞“肿瘤化”。然而目前CSCs来源的外泌体对正常分化细胞或干细胞的生物学行为的影响却鲜有报道。另一方面,间充质干细胞(MSC)作为肿瘤基质细胞,具有促进肿瘤发生发展的作用[13-15]。目前MSC可以从骨、脂肪等成人组织和脐带血等胎儿组织中分离[16],其中以骨髓间充质干细胞为代表的体内正常组织来源的干细胞由于受到供体年龄及健康状况、取材方式、道德伦理和传统观念等问题的影响,其科研和临床应用受到限制。而与之具有相似生理特征的人脐带间充质干细胞,来源广泛,便于取材,无伦理道德问题的限制,且细胞增殖、分化能力较强,适合体外大规模培养[17-18]。因此,脐带血来源的间充质干细胞已被广泛适用于各种实验模型[19-20],且最新研究的热点主要集中于脐带血间充质干细胞与肿瘤转移之间的关系[21]。
由于目前尚无从实体肿瘤中分离纯化出的CSCs的可靠方法,因此,本研究采用前期构建的细胞自我更新基因Piwil2重编程人成纤维细胞形成具有自我更新、多向分化、细胞异型性和高致瘤性的Piwil2诱导肿瘤干细胞(Piwil2-iCSCs)作为CSC细胞模型[22-23],研究其来源的外泌体对人脐带间充质干细胞(huMSCs)增殖、迁移、侵袭等生物学行为和细胞异质性的影响,为明确肿瘤转移发生机制及治疗奠定基础。
1 材料和方法 1.1 主要试剂与仪器hucMSCs由重庆医科大学附属儿童医院干细胞中心实验室分离并鉴定,Piwil2-iCSCs由重庆医科大学附属儿童医院儿童泌尿生殖发育与组织工程重点实验室转染并保存[22-23]。主要试剂和仪器为DMEM、DMEM/F-12培养基(Gibco)、胎牛血清(Gibco)、CCK-8试剂盒(日本株式会社同仁化学研究所)、BCA蛋白浓度测定试剂盒(碧云天)、CD9、CD63、Piwil2、MMP9抗体(Abcam)、MMP2抗体(Genetex)、PKH26红色荧光细胞连接试剂盒(Sigma)、超速离心机(Beckman)。
1.2 Piwil2-iCSCs培养及外泌体分离鉴定 1.2.1 Piwil2-iCSCs培养与外泌体的分离提取将胎牛血清在4℃条件下100 000 g离心过夜,0.22μm滤器过滤,得到无外泌体的胎牛血清(Exo-free FBS)。Piwil2-iCSCs用10% Exo-free FBS DMEM培养基在37℃、5% CO2培养箱中常规培养。用差速离心法从Piwil2-iCSCs条件培养基中分离出外泌体。即:10% Exo-free FBS DMEM培养Piwil2-iCSCs 72 h后收集细胞培养基。将培养基4℃下以500、2000 g分别离心10、20 min以去除死细胞、细胞碎片后,100 000 g离心70 min,弃上清,用灭菌PBS缓冲液重悬沉淀物后再次超速离心去除上清杂蛋白,沉淀即为外泌体。经0.22μm滤器过滤后冻存于-80℃备用。
1.2.2 Piwil2-iCSCs外泌体电镜鉴定外泌体经PBS稀释后,吸取适量滴到载样铜网上,滴于载样铜网上室温干燥,经1%戊二醛固定和醋酸双氧铀染色,室温风干后,采用透射电镜在120 kV下观察并拍照。
1.2.3 Piwil2-iCSCs外泌体粒径分析使用Nanosight LM10系统(Nanosight Ltd,Navato,CA)分析提取的外泌体。取适量外泌体稀释样品,待其布朗运动60 s后,使用Nanosight粒子追踪软件进行分析后计算出纳米粒子浓度和尺寸分布。
1.2.4 Piwil2-iCSCs外泌体蛋白提取及浓度测定取200μL外泌体悬液,加入100μL含1 mmol/L PMSF的RIPA细胞裂解液,震荡混匀,4℃超声裂解10 min后,12 000 r/min离心10 min,取上清。按照BCA蛋白浓度测定试剂盒说明书测定外泌体蛋白浓度。
1.2.5 Western blot取100μL外泌体裂解液加入25μL 5×Loadingbuffer,100℃煮沸10 min,冷却,经8% SDSPAGE 150 V恒压电泳2 h,15 V恒压转至PVDF膜,5%脱脂牛奶室温封闭1 h后,加入CD9、CD63、Piwil2抗体(均1∶1000稀释)4℃孵育过夜。二抗(1∶5000稀释)室温孵育1 h,ECL法显色并拍照。
1.3 Piwil2-iCSCs外泌体干预hucMSCs生物学行为的检测 1.3.1 hucMSCs培养及实验分组hucMSCs用10% FBS DMEM/F-12培养基在37℃、5% CO2培养箱中常规培养。将处于对数生长期的hucMSCs细胞接种于孔板后,为对照组(Control)、PBS干预组(PBS)和外泌体干预组(Exo)(加入200μg/mL外泌体),每组设置5个复孔。
1.3.2 外泌体摄入实验将hucMSCs细胞(3×104/孔)接种于预先放入细胞爬片的24孔板,贴壁后将PKH26预染的Piwil2-iCSCs外泌体(80μg/mL)加入孔板中共培养3、6、12、24 h后,4%多聚甲醛中固定细胞爬片20 min,PBS清洗3次,DAPI室温染色1 h,PBS清洗3次,抗荧光淬灭剂封片后置于荧光显微镜下拍照。
1.3.3 hucMSCs细胞增殖能力检测将接种于96孔板的hucMSCs (5×103/孔)常规培养24 h后,按实验分组干预,继续培养24、48、72 h,弃上清,每孔加入90μL的10% FBS DMEM/F-12培养基和10μL的CCK-8溶液,继续培养4 h,于450 nm波长下使用酶标仪测定各孔吸光度,记录并分析结果。
1.3.4 细胞迁移能力测定接种于6孔板的hucMSCs (1×105/孔)常规培养至近融合时,用200μL的枪头在6孔板内垂直均匀划直线,制造一个划伤伤口。按实验分组干预后,换1% FBS的DMEM/F-12培养基继续培养12 h和24 h后,置于倒置显微镜下观察并拍照。使用NIS-Elements (Nikon,日本)测量分析软件测量初始和最终伤口宽度,并使用以下公式确定3者之间的差异:(初始伤口宽度-最终伤口宽度)/2。
1.3.5 细胞侵袭能力测定接种hucMSCs后,按实验分组干预24 h。胰酶消化细胞后,用无血清培养基调整细胞密度为1×105/mL,取200μL细胞悬液加入40μL基质胶(Matrigel,1∶3稀释)包被的Transwell小室(8μm滤膜微孔)上层,下层加入600μL含10% FBS的DMEM/F-12培养基,常规培养24 h后取出Transwell小室,置于正置显微镜下随机选取5个视野拍照并计数。
1.4 Western blot检测hucMSCs MMP2及MMP9表达情况用含1% PMSF的RIPA裂解液提取细胞全蛋白,后其余方法同1.2.5。一抗MMP2、MMP9(均1∶1000稀释)4℃孵育过夜。二抗(1∶5000稀释)室温孵育1 h,ECL法显色并拍照。Image-J软件分析条带灰度值。
1.5 细胞染色体核型分析将接种于6孔板的hucMSCs分为Control组和200μg/mL外泌体干预的Exo组,常规培养30 d后,由重庆医科大学附属儿童医院分子诊断中心根据细胞核型分析标准步骤[24]进行细胞染色体核型分析。
1.6 统计学方法所得数据均以均数±标准差表示,采用SPSS 24.0软件进行统计学分析,组间比较采用单因素方差分析,两两比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果 2.1 Piwil2-iCSCs外泌体的物理特征透射电子显微镜观察Piwil2-iCSCs外泌体可见其大小较均匀,直径在50~100 nm,形态较规则,呈圆形或椭圆形囊泡状,中心淡染,边缘清晰(图1A)。NTA显示外泌体直径集中在100~200 nm (图1B)。
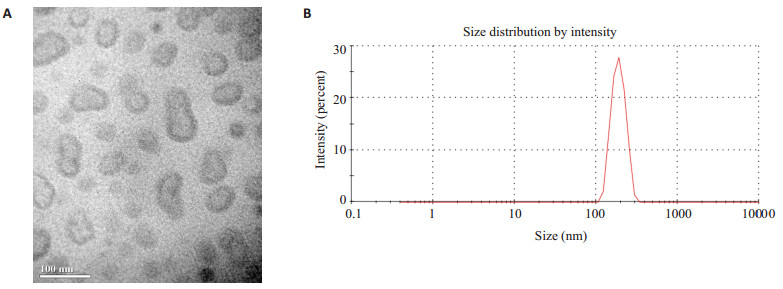
|
图 1 Piwil2-iCSCs来源的外泌体物理特性 Fig.1 Characteristics of Piwil2-iCSC-derived exosomes A: Morphology of Piwil2-iCSC exosomes under electron microscope; B: Nanoparticle tracing analysis of size distribution of Piwil2-iCSC exosomes. |
Western blot检测Piwil2-iCSCs外泌体蛋白标志物,结果显示Piwil2-iCSCs外泌体可稳定表达外泌体特异性标志蛋白CD9、CD63,并且和Piwil2-iCSCs一样,能够稳定表达Piwil2蛋白(图2)。
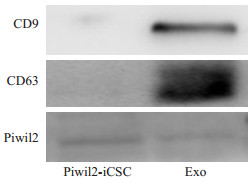
|
图 2 Piwil2-iCSCs外泌体标志物和Piwil2蛋白的表达 Fig.2 Expression of exosome markers and Piwil2 in Piwil2-iCSC exosomes |
荧光镜下观察检测到标记的Piwil2-iCSCs外泌体以时间依赖的方式进入细胞,共培养3 h及6 h后外泌体已进入细胞并在胞质中弥散分布,12 h时外泌体已大部分聚集于核膜,24 h时细胞核周围依然可见红色荧光聚集(图3)。
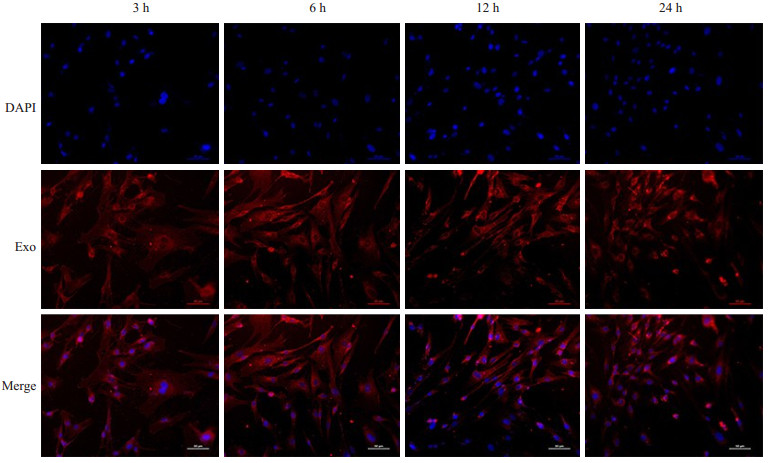
|
图 3 hucMSCs细胞与PKH26预染的Piwil2-iCSCs外泌体共培养3、6、12、24 h后的荧光结果 Fig.3 Fluorescence microscopy of hucMSCs after incubation with Piwil2-iCSCs exosomes for 3, 6, 12 and 24 h (Original magnification: ×200) |
CCK-8法检测经外泌体处理后hucMSCs的增殖能力,与Control组及PBS组相比较,72 h时Exo组hucMSCs增殖能力明显增强(P<0.05);24 h和48 h时,3组之间差异无统计学意义(P>0.05,图4)。
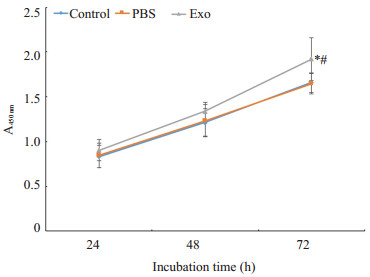
|
图 4 Piwil2-iCSCs外泌体对hucMSCs增殖能力的影响 Fig.4 Effect of Piwil2-iCSCs exosomes on the proliferation of hucMSCs *P<0.05 vs control group, #P< 0.05 vs PBS group |
划痕后12 h,Exo组迁移距离明显大于Control组和PBS组(P<0.05);划痕后24 h,Exo组划痕已经基本愈合,Control组和PBS组仍处于愈合期,差异具有统计学意义(P<0.01);Control组与PBS组细胞迁移距离(12,24 h)差异无统计学意义(P>0.05,图5)。
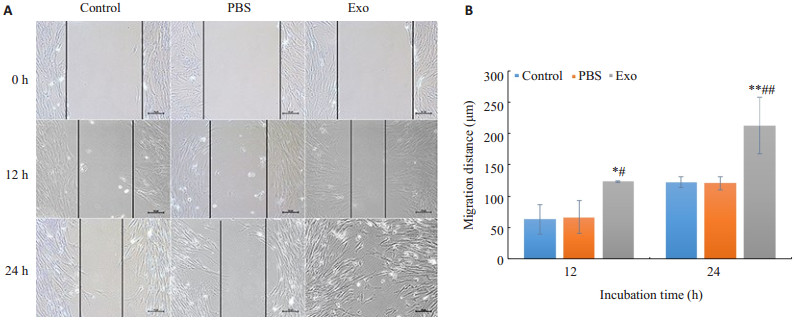
|
图 5 Piwil2-iCSCs外泌体对hucMSCs迁移能力的影响 Fig.5 Effect of Piwil2-iCSCs exosomes on migration of hucMSCs A: Wound-healing assay (×100); B: Statistical results of the migration distance (n=3, n±s). *P<0.05, **P<0.01 vs control group, #P<0.05, ##P<0.01 vs PBS group |
与Control组及PBS组相比,Exo组侵袭到下室的细胞数明显增多,差异具有统计学意义(P<0.01),Control与PBS组之间差异无统计学意义(P>0.05,图6)。
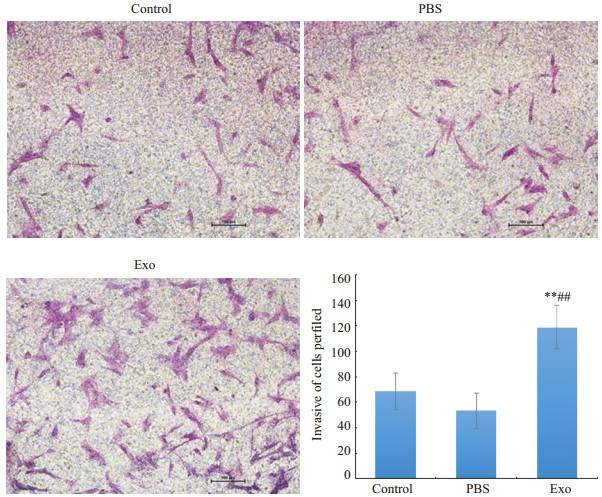
|
图 6 Piwil2-iCSCs外泌体对hucMSCs侵袭能力的影响 Fig.6 Effect of Piwil2-iCSC exosomes on invasion of hucMSCs (×100) **P<0.01 vs control group, ##P< 0.01 vs PBS group |
各组hucMSCs细胞培养72 h后,Western blot结果显示,与Control及PBS组相比,Piwil2-iCSC来源的外泌体干预组的hucMSCs细胞MMP2、MMP9蛋白表达量均明显升高,Control与PBS组之间差异无统计学意义(图7)。
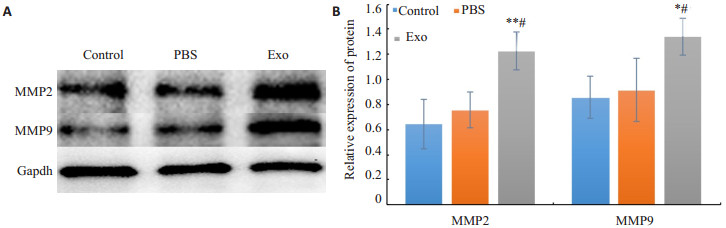
|
图 7 Piwil2-iCSC外泌体对hucMSCs细胞MMP2、MMP9蛋白表达量的影响 Fig.7 Effect of Piwil2-iCSC exosomes on the expression of MMP2 and MMP9 protein in hucMSCs A: Western blotting results; B: Statistical results of the protein expressions (n=3, n±s). *P<0.05, **P<0.01 vs control group, #P<0.05 vs PBS group. |
hucMSCs经过Piwil2-iCSCs外泌体长期干预后,染色体核型仍是46XY,其结构和数目与Control组相比无明显差异(图8)。
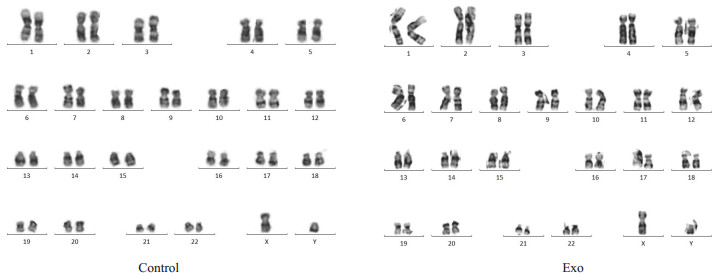
|
图 8 hucMSCs染色体核型 Fig.8 Karyotype analysis of hucMSCs |
外泌体是由多种细胞分泌的直径在30~100 nm的囊泡小体,可通过其内携带的蛋白质、核酸、脂类等来调节受体细胞的生物学活性[8-9]。本实验应用简单易行的差速离心法提取出Piwil2-iCSCs外泌体,并通过TEM、NTA及Western blot进行鉴定。我们提取的外泌体经TEM观察其具有典型盘状囊泡样结构,直径为50~100 nm,符合外泌体的一般形态特征。NTA显示外泌体直径分布集中在100~200 nm之间。TEM和NTA两者之间外泌体直径分布的差异可能是由于外泌体在NTA分析中的聚集行为[25]。CD9和CD63作为外泌体特征性表达的标志蛋白,在Western blot检测中呈阳性表达,提示我们成功提取了Piwil2-iCSCs外泌体。此外,我们用外泌体摄入实验进一步验证了Piwil2-iCSCs外泌体的作用途径。结果显示,PKH26标记的Piwil2-iCSCs外泌体与hucMSCs细胞共培养后,外泌体的入胞过程呈时间依赖性,提示Piwil2-iCSCs外泌体是通过进入细胞发挥作用。
随着CSCs研究的不断深入,大量研究表明恶性肿瘤中存在的CSCs与肿瘤的局部浸润和远处转移直接相关[1-3],Pang等[26]研究发现,CD26+肿瘤干细胞亚群与细胞侵袭性相关,能促进小鼠结直肠癌中肿瘤细胞远处转移。CD133+ CXCR4+肿瘤干细胞的亚群决定人类胰腺癌的肿瘤生长和转移活性[27],但具体的发生机制尚不清楚。本研究通过Piwil2-iCSCs外泌体干预hucMSCs后,观察其细胞生物学行为的改变,从而明确肿瘤干细胞是否可以通过其外泌体直接改变正常干细胞的生物学行为,进而为肿瘤远处转移提供微环境。CCK-8细胞增殖实验结果表明经过Piwil2-iCSCs外泌体干预72 h后,hucMSCs增殖活力明显增高;细胞划痕实验和Transwel实验结果显示Piwil2-iCSCs外泌体干预后的hucMSCs迁移及侵袭的细胞数目明显增多。同时,有研究发现MMP2和MMP9是细胞侵袭、转移过程中的两个关键酶,与肿瘤侵袭转移关系尤为密切[28-29],本研究Western blot显示,Piwil2-iCSCs外泌体干预后,hucMSCs中MMP2、MMP9蛋白表达水平均增高,提示hucMSCs经Piwil2-iCSCs外泌体干预后具有更强的迁移和侵袭能力。故本研究证实,Piwil2-iCSCs外泌体能够促使hucMSCs的细胞生物学行为发生改变。但Piwil2-iCSCs外泌体具体是通过何种具体的机制来改变hucMSCs的细胞生物学行为还需要进一步研究,相关研究报道显示,人前列腺CSCs来源的外泌体通过内含的miR-139和miR-183,可促进前列腺成纤维细胞的增殖和迁移[30]。还有研究指出甲状腺肿瘤干细胞样外泌体可通过介导非编码RNA (lncRNA)来促进肿瘤发生远处转移[31]。由此,我们推测Piwil2-iCSCs外泌体也是通过其内的生物活性物质改变hucMSCs的生物学行为。但同时我们注意到,目前肿瘤干细胞对正常体/干细胞的作用机制尚不十分明确,有研究表明肿瘤干细胞可通过分泌VEGF、IL-6等细胞因子调控相关通路或招募间充质干细胞来调节肿瘤的增殖、转移与复发[32-33]。而本研究发现,肿瘤干细胞外秘体对人体干细胞生物学行为的改变同样具有重要作用。因此,我们推测,干细胞生物学行为的改变并非仅受单一因子或者通路的影响,而可能是多种因素或机制共同作用的结果,值得进一步深入研究。另有文献报道,结直肠癌干细胞外泌体可以促进结肠间充质干细胞肿瘤化,导致细胞形态和功能发生改变,进而促进肿瘤的恶性发展[13]。为进一步证实Piwil2-iCSCs外泌体是否可以使正常的干细胞“肿瘤化”,我们对Piwil2-iCSCs外泌体长期干预后的hucMSCs进行染色体核型分析后发现,hucMSCs染色体无结构及数目变异,提示hucMSCs可能未发生恶性转化。由此我们推测,肿瘤干细胞来源外泌体可能通过改变正常细胞生物学活性,为肿瘤转移提供微环境,但并未将正常细胞转化为肿瘤细胞。此外,本实验采用的是细胞自我更新基因Piwil2重编程形成的肿瘤干细胞,尽管Piwil2特异性表达于不同的肿瘤组织,与肿瘤患者的预后不良紧密相关[34-35],但仍不能完全认为所有肿瘤干细胞外泌体均不改变正常细胞或干细胞的异质性或肿瘤细胞转化。
综上,本实验首次以Piwil2-iCSCs外泌体为对象,探讨了其在肿瘤转移过程中对hucMSCs的作用。由此推测,肿瘤干细胞外泌体可以通过促进MSC的增殖、迁移和侵袭等生物学行为来促进肿瘤远处转移,但并非直接将其转化为肿瘤细胞。本研究为深入了解肿瘤与肿瘤微环境的复杂联系提供了外泌体一个新的思路,并且为外泌体在癌症的靶向治疗中的潜在应用提供了理论基础。
| [1] |
Lawson DA, Bhakta NR, Kessenbrock K, et al. Single-cell analysis reveals a stem-cell program in human metastatic breast cancer cells[J].
Nature, 2015, 526(7571): 131-5.
DOI: 10.1038/nature15260. |
| [2] |
Yan X, Yu Y, Li L, et al. Friend leukemia virus integration 1 is a predictor of poor prognosis of breast cancer and promotes metastasis and cancer stem cell properties of breast cancer cells[J].
Cancer Med, 2018, 7(8): 3548-60.
DOI: 10.1002/cam4.2018.7.issue-8. |
| [3] |
Chiang K, Davies CC. Linking PRMT5 to breast cancer stem cells:New therapeutic opportunities[J].
Mol Cell Oncol, 2018, 5(3): e1441628.
|
| [4] |
Liu CM, Hsieh CL, Shen CN, et al. Exosomes from the tumor microenvironment as reciprocal regulators that enhance prostate cancer progression[J].
International Journal of Urology, 2016, 23(9): 734-44.
DOI: 10.1111/iju.2016.23.issue-9. |
| [5] |
刘小豪, 王方圆, 侯晋, 等. SACC-83来源的外泌体促进腺样囊性癌细胞的增殖[J].
南方医科大学学报, 2018, 38(8): 1008-13.
|
| [6] |
Abak A, Abhari A, Rahimzadeh S. Exosomes in cancer:small vesicular transporters for cancer progression and metastasis, biomarkers in cancer therapeutics[J].
PeerJ, 2018, 29(6): e4763.
|
| [7] |
Li L, Li C, Wang S, et al. Exosomes derived from hypoxic oral squamous cell carcinoma cells deliver miR-21 to normoxic cells to elicit a prometastatic phenotype[J].
Cancer Res, 2016, 76(7): 1770-80.
DOI: 10.1158/0008-5472.CAN-15-1625. |
| [8] |
Melo SA, Sugimoto H, O'connell JT, et al. Cancer exosomes perform cell-independent microRNA biogenesis and promote tumorigenesis[J].
Cancer Cell, 2014, 26(5): 707-21.
DOI: 10.1016/j.ccell.2014.09.005. |
| [9] |
Aga M, Bentz GL, Raffa S, et al. Exosomal HIF1α supports invasive potential of nasopharyngeal carcinoma-associated LMP1-positive exosomes[J].
Oncogene, 2014, 33(37): 4613-22.
DOI: 10.1038/onc.2014.66. |
| [10] |
Raposo G, Stoorvogel W. Extracellular vesicles:exosomes, microvesicles, and friends[J].
J Cell Biol, 2013, 200(4): 373-83.
DOI: 10.1083/jcb.201211138. |
| [11] |
Arslan F, Lai RC, Smeets MB, et al. Mesenchymal stem cellderived exosomes increase ATP levels, decrease oxidative stress and activate PI3K/Akt pathway to enhance myocardial viability and prevent adverse remodeling after myocardial ischemia/reperfusion injury[J].
Stem Cell Res, 2013, 10(3): 301-12.
DOI: 10.1016/j.scr.2013.01.002. |
| [12] |
Kosaka N, Yoshioka Y, Tominaga NA, et al. Dark side of the exosome:the role of the exosome in cancer metastasis and targeting the exosome as a strategy for cancer therapy[J].
Future Oncology, 2014, 10(4): 671-81.
DOI: 10.2217/fon.13.222. |
| [13] |
Lugini L, Valtieri M, Federici C, et al. Exosomes from human colorectal cancer induce a tumor-like behavior in colonic mesenchymal stromal cells[J].
Oncotarget, 2016, 7(31): 50086-98.
|
| [14] |
Mandel K, Yang Y, Schambach A, et al. Mesenchymal stem cells (MSC) directly interact with breast cancer cells and promote tumor cell growth in vitro and in vivo[J].
Stem Cells Dev, 2013, 22(23): 3114-27.
DOI: 10.1089/scd.2013.0249. |
| [15] |
Chang AI, Schwertschkow AH, Nolta JA, et al. Involvement of mesenchymal stem cells in cancer progression and metastases[J].
Curr Cancer Drug Targets, 2015, 15(2): 88-98.
DOI: 10.2174/1568009615666150126154151. |
| [16] |
Akimoto K, Kimura K, Nagano M, et al. Umbilical cord BloodDerived mesenchymal stem cells inhibit, but adipose TissueDerived mesenchymal stem cells promote, glioblastoma multiforme proliferation[J].
Stem Cells Dev, 2013, 22(9): 1370-86.
DOI: 10.1089/scd.2012.0486. |
| [17] |
Bieback K, Kern S, Klüter H, et al. Critical parameters for the isolation of mesenchymal stem cells from umbilical cord blood[J].
Stem Cells, 2004, 22(4): 625-34.
DOI: 10.1634/stemcells.22-4-625. |
| [18] |
Halfon S, Abramov N, Grinblat B, et al. Markers distinguishing mesenchymal stem cells from fibroblasts are downregulated with passaging[J].
Stem Cells Dev, 2011, 20(1): 53-66.
DOI: 10.1089/scd.2010.0040. |
| [19] |
Pullamsetti SS, Schermuly R, Ghofrani AA, et al. Novel and emerging therapies for pulmonary hypertension[J].
Am J Respir Crit Care Med, 2014, 189(4): 394-400.
DOI: 10.1164/rccm.201308-1543PP. |
| [20] |
Fu YS, Cheng YC, Lin MY, et al. Conversion of human umbilical cord mesenchymal stem cells in Wharton's jelly to dopaminergic neurons in vitro: potential therapeutic application for Parkinsonism[J].
Stem Cells, 2006, 24(1): 115-24.
DOI: 10.1634/stemcells.2005-0053. |
| [21] |
Jing W, Chen Y, Lu L, et al. Human umbilical cord blood-derived mesenchymal stem cells producing IL15 eradicate established pancreatic tumor in syngeneic mice[J].
Mol Cancer Ther, 2014, 13(8): 2127-37.
DOI: 10.1158/1535-7163.MCT-14-0175. |
| [22] |
吴鑫, 何大维, 张永波, 等. Piwil2重编程人成纤维细胞形成肿瘤干细胞的初步研究[J].
第三军医大学学报, 2013, 35(5): 394-9.
|
| [23] |
Zhang DY, Wu X, Liu X, et al. Piwil2-transfected human fibroblasts are cancer stem cell-like and genetically unstable[J].
Oncotarget, 2017, 8(7): 12259-71.
|
| [24] |
Amit M, Margulets V, Segev H, et al. Human feeder layers for human embryonic stem cells[J].
Biol Reprod, 2003, 68(6): 2150-6.
DOI: 10.1095/biolreprod.102.012583. |
| [25] |
Xue M, Chen W, Xiang A, et al. Hypoxic exosomes facilitate bladder tumor growth and development through transferring long non-coding RNA-UCA1[J].
Molecular Cancer, 2017, 16(1): 143.
DOI: 10.1186/s12943-017-0714-8. |
| [26] |
Pang R, Law WL, Chu AC, et al. A subpopulation of CD26+cancer stem cells with metastatic capacity in human colorectal cancer[J].
Cell Stem Cell, 2010, 6(6): 603-15.
DOI: 10.1016/j.stem.2010.04.001. |
| [27] |
Hermann PC, Huber SL, Herrler T, et al. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer[J].
Cell Stem Cell, 2007, 1(3): 313-23.
DOI: 10.1016/j.stem.2007.06.002. |
| [28] |
Li H, Zhang Y, Hai J, et al. Knockdown of TRIM31 suppresses proliferation and invasion of gallbladder cancer cells by downregulating MMP2/9 through the PI3K/Akt signaling pathway[J].
Biomed Pharmacother, 2018, 103(4): 1272-8.
|
| [29] |
Wu Z, Wang T, Fang M, et al. MFAP5 promotes tumor progression and bone metastasis by regulating ERK/MMP signaling pathways in breast cancer[J].
Biochem Biophys Res Commun, 2018, 498(3): 495-501.
DOI: 10.1016/j.bbrc.2018.03.007. |
| [30] |
Sánchez CA, Andahur EI, Valenzuela R, et al. Exosomes from bulk and stem cells from human prostate cancer have a differential microRNA content that contributes cooperatively over local and premetastatic niche[J].
Oncotarget, 2016, 7(4): 3993.
|
| [31] |
Hardin H, Helein H, Meyer K, et al. Thyroid cancer stem-like cell exosomes:regulation of EMT via transfer of lncRNAs[J].
Lab Invest, 2018, 98(9): 1133-42.
DOI: 10.1038/s41374-018-0065-0. |
| [32] |
Yi SY, Hao YB, Nan KJ, et al. Cancer stem cells niche:a target for novel cancer therapeutics[J].
Cancer Treat Rev, 2013, 39(3): 290-6.
DOI: 10.1016/j.ctrv.2012.10.004. |
| [33] |
Liu S, Ginestier C, Ou SJ, et al. Breast Cancer stem cells are regulated by mesenchymal stem cells through cytokine networks[J].
Cancer Res, 2011, 71(2): 614-24.
DOI: 10.1158/0008-5472.CAN-10-0538. |
| [34] |
Erdogdu IH, Yumrutas O, Ozgur CM, et al. Differential expression of PIWIL2 in papillary thyroid cancers[J].
Gene, 2018, 649.
|
| [35] |
Litwin M, Szczepańskabuda A, Michałowska D, et al. Aberrant Expression of PIWIL1 and PIWIL2 and Their clinical significance in ductal breast carcinoma[J].
Anticancer Res, 2018, 38(4): 2021-30.
|
 2018, Vol. 38
2018, Vol. 38

