糖尿病周围神经病变(DPN)是糖尿病常见的并发症,患病率高达50% [1]。以往DPN常被认为是仅累及外周神经系统的疾病,近年有研究[2-3]证实DPN患者存在中枢神经系统的结构性异常,包括:脊髓横截面积及体积减少、躯体感觉区域灰质体积减少等。静息态功能磁共振(rs-fMRI)相关研究[4-5]发现DPN患者可能存在中枢脑功能活动的异常,但其确切的中枢脑功能改变仍然未明。
rs-fMRI技术作为一种新的影像学技术,具有高安全性、高分辨率、无辐射损伤等优点[6-7]。国外有研究[4, 8]运用静息态功能连接(rsFC)分析方法、独立成分分析(ICA)方法及低频振荡振幅(ALFF)算法发现,与正常人相比,DPN患者前扣带皮质、默认网络及丘脑皮层连接性降低。此前的fMRI研究多关注脑区间功能连接的异常,而不能准确反映DPN患者特定脑区的异常变化。国内尚无DPN相关的fMRI研究报道。
局部一致性(ReHo)算法是一种处理rs-fMRI数据的分析方法[9],反映的是大脑局部神经元活动的功能协同性的特征,在多种神经性疾病的机制研究中具有重要价值[10-12]。与其他算法相比,ReHo可以作为评估局部脑区神经元活动及大脑功能活动改变的指标,且更适于观察从事高级功能活动,如认知、情感、学习等功能的脑区[9]。目前国内外尚无报道将ReHo算法应用于DPN的相关研究中。
基于以上,本研究首次将rs-fMRI及ReHo联合运用,评估DPN患者局部脑区神经元活动的改变,观察其脑功能变化情况,探索中枢神经系统在DPN发病机制中的作用。
1 资料和方法 1.1 研究对象本研究纳入2016年10月~2018年3月在南方医院内分泌科住院治疗的36例DPN患者,对照组为16例糖尿病无周围神经病变(Non-DPN)患者。根据多伦多共识声明[13],根据患者临床症状将受试者分为以下3组:(1)Non-DPN组:无神经病变症状且神经传导速度正常;(2)Painless DPN组:有神经病变症状但不伴神经性疼痛,神经传导速度至少有2项异常;(3)Painful DPN组:有疼痛性神经病变症状,疼痛至少持续6月,神经传导速度异常。所有受试者均在实验前被告知实验目的与注意事项,并签署知情同意书。
1.2 纳入及排除标准 1.2.1 纳入标准符合1999年WHO制定的2型糖尿病诊断标准[1];符合2015年美国ADA制定的DPN确诊诊断标准[1];右利手;受教育年限至少为6年;18岁≤年龄≤70岁。
1.2.2 排除标准1型糖尿病、妊娠糖尿病、特殊类型糖尿病患者;排除其他可能引起神经病变的病因,包括:神经毒性药物、重金属中毒、滥用酒精、血管炎、遗传性神经病、慢性炎症性脱髓鞘性神经病、肾脏疾病、维生素B12缺乏、椎管狭窄症;有磁共振禁忌症:体内有金属植入物、假牙、幽闭恐惧症;有心脑血管意外、周围血管疾病、甲状腺疾病、恶性肿瘤、精神性疾病等病史。
1.3 方法 1.3.1 临床数据采集对所有的受试者进行详细的病史采集和生化指标检测。一般资料包括:性别、年龄,糖尿病病程、受教育年限、体质量指数(BMI)、血压等。生化检查包括:糖化血红蛋白(HbA1c)、空腹血糖、C肽、甘油三酯、总胆固醇、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)等。
1.3.2 认知及情绪量表测评所有受试者均在环境安静的检查室内进行评估,由专人负责。蒙特利尔认知评估量表(MoCA)用来评估患者的总体认知功能。抑郁自评量表(SDS)及焦虑自评量表(SAS)用来评估患者的心理状况。睡眠自评量表(SRSS)用来评估患者的睡眠状况。
1.3.3 神经功能评估所有受试者均进行神经传导速度检查。采用Dantec Keypoint肌电图诱发电位仪,由同一个专业技师进行检查,测定受试者双下肢腓肠神经感觉神经传导速度、胫神经及腓总神经的运动神经传导速度。神经性疼痛症状由简式McGill疼痛问卷进行评估。
1.3.4 MRI数据采集采用飞利浦3.0T磁共振成像扫描仪(Philips Achiva 3.0T)进行检查。Painful DPN组受试者在fMRI扫描前停止使用止痛药物3 d。扫描过程中,要求受试者保持安静、头和身体保持静止不动,闭眼并保持清醒,尽量不要系统性思考。使用专用耳塞以减少机器噪声的影响。
磁共振扫描的主要序列及其参数如下:GRE-EPI序列参数:TR/TE=2000/35 ms,翻转角=90°,层厚=4.5 mm,层间距=0.7 mm,矩阵=64×64,视野=230×230×141,采集240个时相,轴位、扫描参考线平行于前后联合,扫描层数为33层,扫描时间为8 min。
1.3.5 图像处理数据处理在Matlab 2013a平台上(http://www.mathworks.com/products/matlab)进行。采用DPARSF(http://restfmri.net/forum/DPARSF )、SPM8(http://www.fil.ion.ucl.ac.uk/spm/software/SPM8)、REST(http://resting-fmri.sourseforge.net)分析软件。
1.3.5.1 预处理[9](1)将DICOM格式的原始数据转换为NIFTI格式;(2)去除前10个时相的数据;(3)时间校正(slice timing):以扫描中心层面为参考层,将受试者的脑功能图像进行时间差异校正;(4)头动校正(realignment):去除三维平移超过1 mm、三维旋转超过1o的受试者数据;(5)空间标准化(normalization):将头动校正后的数据标准化到MNI模版;(6)去线性漂移(removal of linear trends)和滤波:消除心跳、呼吸等噪声。
1.3.5.2 ReHo算法使用REST软件计算分析ReHo值,计算过程与以往报道一致[9]。fMRI检测的脑活动区域是空间上相邻的多个体素,计算每个既定体素的肯德尔和谐系数(KCC)值,最后可获得每个个体的KCC图[14]。将单个体素的KCC值除以全脑平均KCC值就生成了标准化的ReHo图。
1.3.6 统计分析应用SPSS 23.0统计软件进行数据处理,符合正态分布的计量资料用均数±标准差表示,不符合正态分布的数据经对数转换基本符合正态分布后分析,三组间比较采用单向方差分析。计数资料用率或构成比表示,三组间比较采用卡方检验。取P < 0.05为差异有统计学意义。
运用SPM8与REST软件对各个分组的ReHo统计图进行随机效应分析,包括单样本t检验与两独立样本t检验(以年龄、教育程度、头动、性别为协变量),FDR校正后取P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料三组比较,年龄、性别、受教育年限、糖尿病病程、BMI、空腹血糖、C肽、血脂差异均无统计学意义(P>0.05)。与Non-DPN组相比,Painful DPN组有更低的HbA1C(P < 0.05)。三组患者MoCA评分差异均无统计学意义(P>0.05)。与Non-DPN组相比,Painful DPN及Painless DPN组SDS、SAS、SRSS得分均显著增高(P < 0.05,表 1)。
| 表 1 患者一般资料 Tab.1 Demographic, clinical, and cognitive characteristics of the patients (Mean±SD) |
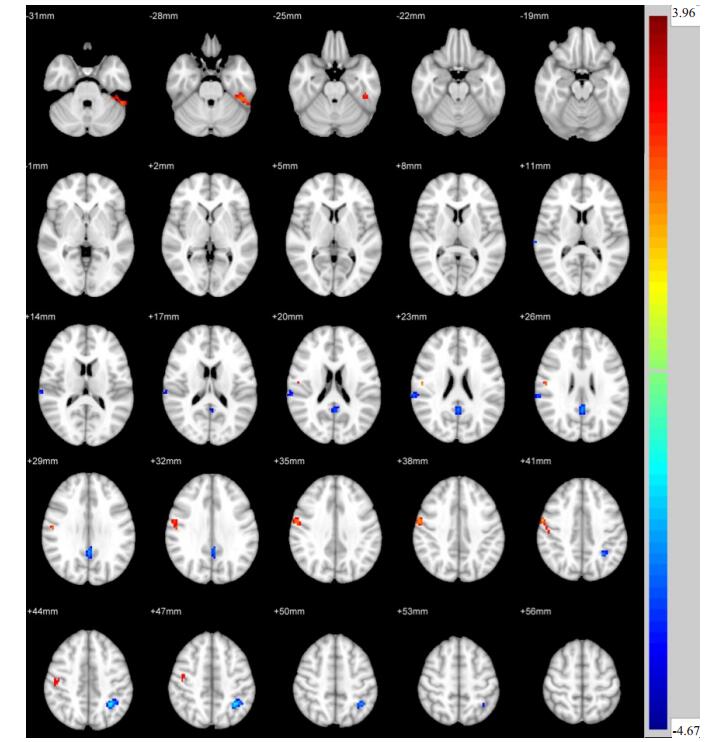
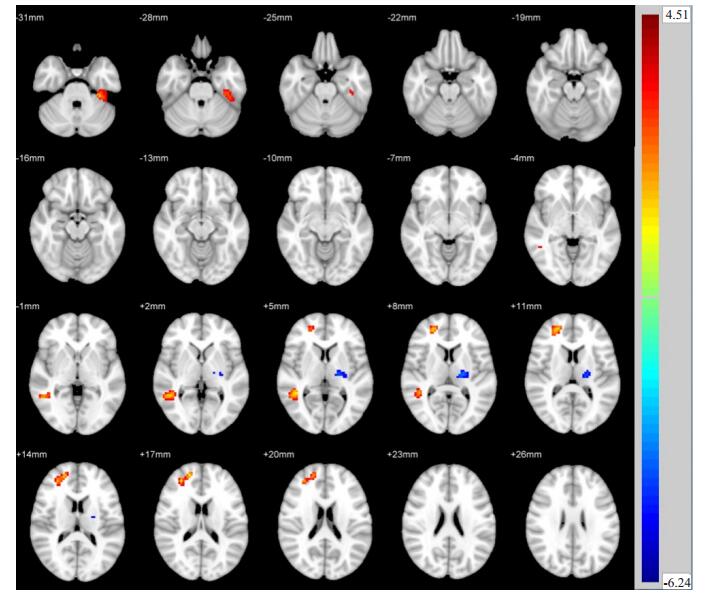
两独立样本t检验显示,与Non- DPN组相比,Painful DPN组左侧颞下回、右侧中央后回ReHo值升高,而后扣带回、右侧顶下回、左侧顶上回ReHo值降低(P < 0.05,图 1,表 2)。与Non- DPN组相比,Painless DPN组左侧颞下回、右侧颞中回、右侧额上回ReHo值升高,而左侧丘脑ReHo值降低(P < 0.05,图 2,表 3)。Painful DPN组与Painless DPN组间ReHo值无显著统计学差异(P>0.05)。
|
图 1 Painful DPN组与Non-DPN组比较ReHo差异区域 Fig.1 Regional differences in ReHo between painful DPN group and non-DPN group. |
| 表 2 Painful DPN组与Non-DPN组比较ReHo差异脑区 Tab.2 Brain regions with abnormal ReHo in painless DPN group and non-DPN group |
|
图 2 Painless DPN组与Non-DPN组比较ReHo差异区域 Fig.2 Regional differences in ReHo between painless DPN group and non-DPN group. |
| 表 3 Painless DPN组与Non-DPN组比较ReHo差异脑区 Tab.3 Brain regions with abnormal ReHo in painless DPN group and non-DPN group |
DPN的临床诊治近年来少有突破,因此,其发病机制一直是国内外研究的热点。对DPN患者大脑局部神经元活动的研究,有利于进一步探索特定脑区在DPN发病机制中的作用,为DPN的治疗提供新机遇。本研究运用rs-fMRI技术及ReHo算法发现DPN患者存在多个脑区神经元活动局部一致性(ReHo)的异常,证实DPN存在确切的脑功能活动改变。DPN患者存在默认网络区域神经元活动的改变,左侧颞下回可能是其功能代偿脑区。右侧中央后回神经元活动异常与Painful DPN患者的疼痛症状存在关联。
本研究发现,与Non-DPN组相比,Painful DPN组在后扣带回、右侧顶下回、左侧顶上回的局部一致性显著降低。上述脑区均为默认网络(DMN)的组成部分,而后扣带回是DMN的核心。DMN指受试者处于清醒、休息、不接受外在刺激的状态下,神经元活动所处的一种基线状态[15],其功能主要体现在产生自发性思维、创造力和情绪加工等方面,在维持正常的认知功能中具有重要作用[16]。DMN脑区神经元活动改变,提示DMN可能存在功能损害。Cauda等[4]研究发现,Painful DPN患者DMN功能连接较正常人显著降低。该研究反映DMN脑区间的功能连接,与之不同的是,本研究着眼于DMN局部脑区神经元活动的改变。此外,我们以NonDPN患者为对照,在一定程度上可以排除糖尿病作为混杂因素的影响。
临床上,大约50%的DPN患者具有神经性疼痛症状(Painful DPN),据报道[17],Painful DPN患者的慢性疼痛症状很少可以完全缓解,仅有三分之一的患者可以缓解50%的疼痛。进一步探索Painful DPN的中枢特异性改变,有利于寻找缓解疼痛的治疗新靶点。既往研究发现[18],在热刺激条件下,Painful DPN患者边缘系统神经元活动较正常人异常增强,推测边缘系统是慢性神经性疼痛的相关病变脑区。这种在刺激条件下进行的fMRI扫描称为任务态fMRI,反映受试者在伤害性疼痛刺激下的脑功能改变。与之相比,本研究采用静息态fMRI方法,反映受试者在清醒、安静及无任何外在刺激条件下的脑区自发性神经元活动的改变,即大脑生理基础状态下大脑功能活动的变化[19]。我们发现,Painful DPN患者在右侧中央后回显示出较Non-DPN组升高的局部一致性。作为躯体感觉的最高级中枢,中央后回参与接受深浅感觉信息,是痛觉的感觉中枢。有研究表明[20],Painful DPN患者神经性疼痛的基本机制包括外周神经的过度兴奋、中枢敏化以及中枢痛觉抑制通路的缺陷。右侧中央后回神经元活动的异常增强也许正是上述机制共同作用的结果。因此,我们推测右侧中央后回的神经元活动异常可能与Painful DPN患者的疼痛症状相关。但是,我们并未发现Painful DPN组与Painless DPN组间右侧中央后回的局部一致性差异,两者中枢病变的区别以及右侧中央后回在Painful DPN中的作用仍需要更深入的研究。
我们发现,Painless DPN组较Non-DPN组左侧丘脑局部一致性减低。丘脑是除嗅觉外所有感觉传至大脑皮层的集中部位,是皮质下感觉的最后中继站,起到重要的感觉加工和信号调制功能[21]。有研究表明[22],维持丘脑神经元功能可能是糖尿病患者感知神经性疼痛症状的先决条件。本研究中,Painless DPN组丘脑局部神经元活动降低,提示丘脑神经功能受损,这也许可以解释为何部分DPN患者不出现神经性疼痛症状。
Painful DPN组及Painless DPN组在左侧颞下回均显示出较Non-DPN组增高的局部一致性。左侧颞下回在语义认知功能中起重要作用[23]。这种静息状态下特定脑区神经元活动增强的机制可能是DPN患者出现的一种额外的功能活动代偿,以弥补其他脑区神经元活动的下降。既往研究[24-25]表明,大脑结构和功能可通过重组和代偿的机制来代替受损的神经功能。临床上,DPN患者目前能维持相对正常的认知功能或许是这种代偿的结果。然而,复杂的神经功能和各个脑区的交互作用均参与了脑功能活动[26],因此,这种代偿机制仍需更深入的研究。
本研究中,MoCA用来评估受试者的认知总体情况。MoCA是认知功能异常的初筛试验,主要用于筛查轻度认知功能障碍,如阿尔兹海默症[27-28]。在本研究中,MoCA的测试结果未见组间统计学差异,表明相比于Non-DPN组,DPN患者并无显著的认知功能下降,但已发现DPN患者存在多个脑区神经元活动的异常,表明通过rs-fMRI可以发现DPN患者早期隐匿性的脑功能改变。SDS、SAS用来初步评估受试者的心理状态,本研究中,DPN组患者评分较Non-DPN组更高,提示有症状的神经病变可能诱发抑郁及焦虑情绪。既往亦有研究显示[29-30],在出现异常躯体感觉的情况下,尤其是疼痛觉,更易引发患者产生心理及情绪障碍。因此,对于DPN患者,尤其是合并神经性疼痛者,在临床治疗中要注意积极筛查心理疾病,以及时干预。
综上所述,本研究运用fMRI及ReHo方法定位了DPN患者神经元活动异常脑区从而探索DPN的中枢神经系统改变,并进一步对Painful DPN特异性的中枢病变进行了探讨。ReHo方法为研究DPN中枢脑功能改变提供了新的途径。脑功能的异常特征或可能为DPN患者的治疗、疗效评估及预后提供新思路。本研究虽然发现DPN患者多个脑区均存在神经元活动异常,但目前尚不能明确这些异常是原发性病变还是继发于DPN的一种代偿改变,未来还需进一步的研究。
| [1] |
Tesfaye S, Boulton AJ, Dyck PJ, et al. Diabetic neuropathies:update on definitions, diagnostic criteria, estimation of severity, and treatments[J].
Diabetes Care, 2010, 33(10): 2285-93.
DOI: 10.2337/dc10-1303. |
| [2] |
Tesfaye S, Selvarajah D, Gandhi R, et al. Diabetic peripheral neuropathy May not be as its Name suggests:evidence from magnetic resonance imaging[J].
Pain, 2016, 157(Suppl 1): S72-80.
|
| [3] |
Selvarajah D, Wilkinson ID, Maxwell MA, et al. Magnetic resonance neuroimaging study of brain structural differences in diabetic peripheral neuropathy[J].
Diabetes Care, 2014, 37(6): 1681-8.
DOI: 10.2337/dc13-2610. |
| [4] |
Cauda F, Sacco K, Duca S, et al. Altered resting state in diabetic neuropathic pain[J].
PLoS One, 2009, 4(2): e4542.
DOI: 10.1371/journal.pone.0004542. |
| [5] |
Segerdahl AR, Themistocleous AC, Fido DA, et al. A brain-based pain facilitation mechanism contributes to painful diabetic polyneuropathy[J].
Brain, 2018, 141(2): 357-64.
DOI: 10.1093/brain/awx337. |
| [6] |
Xia WQ, Yang YE, Zhou Y, et al. Altered baseline brain activity in type 2 diabetes:a resting-state fMRI study[J].
Psychoneuroendocrinology, 2013, 38(11): 2493-501.
DOI: 10.1016/j.psyneuen.2013.05.012. |
| [7] |
Zhang Q, Wang D, Qin W, et al. Altered resting-state brain activity in obstructive sleep apnea[J].
Sleep, 2013, 36(5): 651-59B.
DOI: 10.5665/sleep.2620. |
| [8] |
Cauda F, Sacco K, D'agata F, et al. Low-frequency BOLD fluctuations demonstrate altered thalamocortical connectivity in diabetic neuropathic pain[J].
BMC Neurosci, 2009, 10(1): 138.
DOI: 10.1186/1471-2202-10-138. |
| [9] |
Zang Y, Jiang T, Lu Y, et al. Regional homogeneity approach to fMRI data analysis[J].
Neuroimage, 2004, 22(1): 394-400.
DOI: 10.1016/j.neuroimage.2003.12.030. |
| [10] |
Liu CH, Ma X, Wu X, et al. Regional homogeneity of resting-state brain abnormalities in bipolar and unipolar depression[J].
Prog Neuropsychopharmacol Biol Psychiatry, 2013, 41(4): 52-9.
|
| [11] |
Lv XF, Qiu YW, Tian JZ, et al. Abnormal regional homogeneity of resting-state brain activity in patients with HBV-related cirrhosis without overt hepatic encephalopathy[J].
Live Int, 2013, 33(3): 375-83.
DOI: 10.1111/liv.12096. |
| [12] |
Yu RJ, Zhao LY, Tian J, et al. Regional homogeneity changes in heavy male smokers:a resting-state functional magnetic resonance imaging study[J].
Addict Biol, 2013, 18(4): 729-31.
DOI: 10.1111/adb.2013.18.issue-4. |
| [13] |
Boulton AJ, Valensi P, Tesfaye S.The diabetic neuropathies: reports from the diabetic neuropathy expert panel meeting on neuropathy, toronto, october 2009: introduction[Z], 2011: 21.
|
| [14] |
Kendall MG. Rank correlation methods[J].
British Journal of Psychology, 1990, 25(1): 86-91.
|
| [15] |
Greicius MD, Srivastava G, Reiss AL, et al. Default-mode network activity distinguishes Alzheimer's disease from healthy aging: Evidence from functional MRI[J].
Proc Natl Acad Sci USA, 2004, 101(13): 4637-42.
DOI: 10.1073/pnas.0308627101. |
| [16] |
Spreng RN, Stevens WD, Chamberlain JP, et al. Default network activity, coupled with the frontoparietal control network, supports goal-directed cognition[J].
Neuroimage, 2010, 53(1): 303-17.
DOI: 10.1016/j.neuroimage.2010.06.016. |
| [17] |
Rosenberg CJ, Watson JC. Treatment of painful diabetic peripheral neuropathy[J].
Prosthet Orthot Int, 2015, 39(1): 17-28.
DOI: 10.1177/0309364614542266. |
| [18] |
Tseng MT, Chiang MC, Chao CC, et al. fMRI evidence of degeneration-induced neuropathic pain in diabetes:enhanced limbic and striatal activations[J].
Hum Brain Mapp, 2013, 34(10): 2733-46.
DOI: 10.1002/hbm.v34.10. |
| [19] |
Murphy K, Birn RM, Bandettini PA. Resting-state fMRI confounds and cleanup[J].
Neuroimage, 2013, 80(1): 349-59.
|
| [20] |
Rajiv. Insights into the pathogenesis of painful and painless diabetic neuropathy[J].
University of Sheffield, 2013, 15(31): 4768.
|
| [21] |
Dinesh S, Wilkinson ID, Rajiv G, et al. Microvascular perfusion abnormalities of the thalamus in painful but not painless diabetic polyneuropathy[J].
Diabetes Care, 2011, 34(3): 718-20.
DOI: 10.2337/dc10-1550. |
| [22] |
Selvarajah D, Wilkinson ID, Emery CJ, et al. Thalamic neuronal dysfunction and chronic sensorimotor distal symmetrical polyneuropathy in patients with type 1 diabetes mellitus[J].
Diabetologia, 2008, 51(11): 2088-92.
DOI: 10.1007/s00125-008-1139-0. |
| [23] |
Jefferies E. The neural basis of semantic cognition:Converging evidence from neuropsychology, neuroimaging and TMS[J].
Cortex, 2013, 49(3): 611-25.
DOI: 10.1016/j.cortex.2012.10.008. |
| [24] |
Zuo XN, Di Martino A, Kelly C, et al. The oscillating brain: Complex and reliable[J].
Neuroimage, 2010, 49(2): 1432-45.
DOI: 10.1016/j.neuroimage.2009.09.037. |
| [25] |
Cao H, Xu X, Zhao Y, et al. Altered brain activation and connectivity in early parkinson disease tactile perception[J].
AJNR, 2011, 32(10): 1969-74.
DOI: 10.3174/ajnr.A2672. |
| [26] |
Poldrack RA, Packard MG. Competition among multiple memory systems:converging evidence from animal and human brain studies[J].
Neuropsychologia, 2003, 41(3): 245-51.
DOI: 10.1016/S0028-3932(02)00157-4. |
| [27] |
Ciesielska N, Sokolowski R, Mazur EA, et al. Is the Montreal cognitive assessment (MoCA) test better suited than the MiniMental state examination (MMSE) in mild cognitive impairment (MCI) detection among People aged over 60?meta-analysis[J].
Psychiatr Pol, 2016, 50(5): 1039-52.
DOI: 10.12740/PP/45368. |
| [28] |
Wong A, Law LN, Liu W, et al. Montreal cognitive assessment[J].
Stroke, 2015, 642(4): 342-9.
|
| [29] |
Selvarajah D, Cash T, Sankar A, et al. The contributors of emotional distress in painful diabetic neuropathy[J].
Diabetes Vasc Dis Re, 2014, 11(4): 218.
DOI: 10.1177/1479164114522135. |
| [30] |
Selvarajah D, Cash T, Sankar A, et al. The contributors of emotional distress in painful diabetic neuropathy[J].
Diabetes Vasc Dis Re, 2014, 11(4): 218-25.
DOI: 10.1177/1479164114522135. |
 2018, Vol. 38
2018, Vol. 38

