2. 南京医科大学附属无锡第二医院消化科,江苏无锡 214002
2. Department of Gastroenterology, Wuxi Second People's Hospital Affiliated to Nanjing Medical University, Wuxi 214002, China
结肠癌是当今全球第3常见恶性肿瘤, 其死亡率居全部肿瘤中的第2位[1-3]。虽然既往已对结肠癌的发病机制进行了大量研究, 但是其确切发病机制尚未完全阐明[4-6]。MicroRNA主要在转录后水平发挥基因表达调控功能, 其主要通过与mRNA3'端非编码区(UTR)结合, 进而抑制mRNA的翻译[7]。已有研究表明, MicroRNAs参与细胞内多种生命过程, 包括肿瘤转移、抗炎、抗病毒等作用[8-10]。其中, miR-454-3p被证实介导了多种肿瘤增殖, 但miR-454-3p在结肠癌中的作用尚未见报道。本研究通过体内和体外实验, 旨在探索miR-454-3p过表达对结肠癌生物学行为的影响。
1 资料和方法 1.1 研究对象选取2016年3~9月在南京医科大学附属上海一院临床医学院外科行手术切除的结肠癌组织标本和癌旁组织, 共计20例。其中男性9例, 女性11例, 患者年龄47~74岁, 平均年龄61.5岁。患者在手术前均未接受过药物及放疗化疗处理。手术标本切下后, 迅速将组织分离, 无菌生理盐水冲洗2遍后, 用4%多聚甲醛固定, 另外取部分组织标本装于冻存管中置于液氮中速冻, 置入-80℃冰箱冷冻保存备用。本实验中标本的病理诊断由我院病理科高年资医生阅片诊断明确。本研究南京医科大学附属上海一院临床医学院伦理委员会批准, 所有样本采集均获得患者本人及其家属的同意并均签署了知情同意书。
1.2 实验方法 1.2.1 原位杂交检测miR-454-3p在组织中的表达水平miR-454-3p探针由上海吉玛制药技术有限公司构建。石蜡切片经干燥、二甲苯脱蜡、酒精复水, DEPC处理的PBS孵育后。再用DEPC处理的含100 mmol/L甘氨酸PBS、0.3% Triton X-100 PBS、PBS逐级漂洗。切片沥干后用杂交缓冲液漂洗, 并沿组织周边擦干, 每张切片滴加30 μL探针杂交液(内含5~10 ng非同位素标记cRNA探针)。置42℃湿盒内过夜。SSC振荡漂洗、NTE缓冲液漂洗。杂交后显色。显色后冲洗, 封片。阳性细胞数:阳性细胞≤ 10%、≤ 30%、≤ 70%和>70%分别计1、2、3和4分。
1.2.2 SW480结肠癌细胞株慢病毒过表达miR-454-3p将SW480结肠癌细胞株(中科院上海生物细胞研究所)接种于96孔细胞培养板中, 置于37℃培养箱中培养24 h, 当细胞密度达约50%~70%时进行转染操作, 参照Lipofectamine2000试剂(Invitrogen)说明书将miR- 454-3p mimics及阴性对照转染SW480结肠癌细胞株, 荧光显微镜下观察细胞状态及转染效率。以初步确定miR-454-3p的表达情况。
1.2.3 Real-time PCR检测SW480细胞miR-454-3p的表达情况取转染miR-454-3p mimics和阴性对照的SW480细胞, 分别加入1 mL的TRIzol裂解液(Invitrogen)提取细胞总mRNA, 紫外分光光度计测其浓度。然后运用TaKaRa反转录试剂盒进行反转录, 合成cDNA, 运用定量SYBR green PCR试剂盒将cDNA在实时PCR仪上进行定量, U6为内参, 反应模式为预变性95℃ 5 min; 变性95℃ 15 s; 退火60℃ 20 s; 延伸95℃ 5 s, 共40个循环。采用2-△△ct方法分析miR-454-3p在2种细胞中的相对表达水平。确定miR-454-3p转染成功后, 行后续实验。
1.2.4 CCK-8检测过表达miR-454-3p对SW480细胞增殖能力的影响将经过转染操作的两组SW480细胞接种于96孔板中, 置于37℃培养箱中培养1、2、3、4 d后, 向每孔加入10 μL CCK-8溶液(上海东仁化学科技公司), 注意避免产生气泡, 后置于37℃培养箱中孵育2 h后, 用酶标仪测定450 nm处的吸光度, 重复3次。分析两组细胞的活力。
1.2.5 克隆形成实验检测过表达miR-454-3p对SW480细胞增殖能力的影响取对数生长期的两组细胞, 用0.25%胰蛋白酶消化并吹打成单个细胞, 将细胞在6孔板中以每孔200个细胞的密度分别接种含10%胎牛血清的完全培养基中, 置于37℃ 5% CO2及饱和湿度的细胞培养箱中培养1周。当培养皿中出现肉眼可见的克隆时, 弃去细胞培养上清液, 用PBS小心浸洗2遍后, 加入4%多聚甲醛固定15 min。用PBS小心浸洗2遍后加适量结晶紫染色液(武汉谷歌生物有限公司)染10 min, 然后用流水缓慢洗去染色液。孔板干燥后, 用肉眼直接计数克隆数。
1.2.6 Transwell实验检测过表达miR-454-3p对SW480细胞侵袭能力的影响将以无血清细胞培养液稀释的Matrigel基质胶包被transwell小室基底膜的上室表面, 加入100 μL无血清培养基稀释的各组细胞悬液, 在小室下层孔板中加入含10%血清的完全培养液, 置于37℃孵箱培养培养24 h后取出培养小室的, 湿棉签轻轻拭去上层小室内的基质胶和细胞, 4%多聚甲醛固定后行结晶紫染色, 晾干后, 显微镜下选5个视野计数穿出细胞数目。
1.2.7 动物实验分析miR-454-3p对于结肠癌肝转移的影响取两组对数生长期细胞, 0.25%胰蛋白酶消化收集细胞, 用无血清培养基洗涤重悬制成单细胞悬液。6周龄的BALB/c小鼠麻醉(水合氯醛, 0.01 mL/g)后固定。于小鼠左上腹行横切口约6 mm, 逐层剥离进腹后于腹外侧找到脾脏, 小心显露, 用1 mL注射器5号针头从脾上极进针约3 mm, 注意进针与脾脏平行, 将两组肿瘤细胞分别注入至两组小鼠的脾被膜下, 结扎止血后切除脾脏, 逐层关腹。缝合后伤口用青霉素涂敷。术后4周脱颈处死荷瘤小鼠, 取出肝脏用4%多聚甲醛固定。观察两组小鼠肝脏表面转移灶数量和大小。
1.3 统计学方法数据分析采用SPSS 19.0统计软件, 计量资料以均数±标准差表示, 两组间均数的比较用独立样本t检验, P < 0.05为差异有统计学意义。
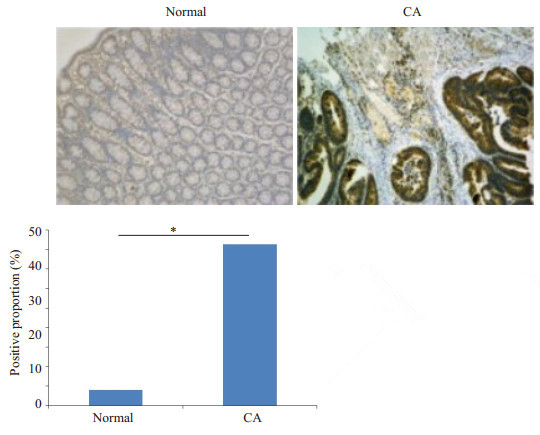
2 实验结果 2.1 miR-454-3p在结肠癌组织中高表达原位杂交结果显示, 在结肠癌组织中, miR-454-3p的表达水平显著高于正常结肠组织。我们对原位杂交结果进行统计分析, 分别取了5个高倍视野, 计算了miR-454-3p阳性细胞数占总细胞数的比例, 结果显示, 结肠癌组织中的miR-454-3p表达水平显著高于正常结肠组织中的表达水平组间差异显著(P<0.05, 图 1)。
|
图 1 结肠癌组织和正常结肠组织中miR-454-3p的表达 Fig.1 Expression of miR-454-3p in colon cancer tissues and normal colon tissues (Original magnification: × 100). *P < 0.05 vs normal group. |
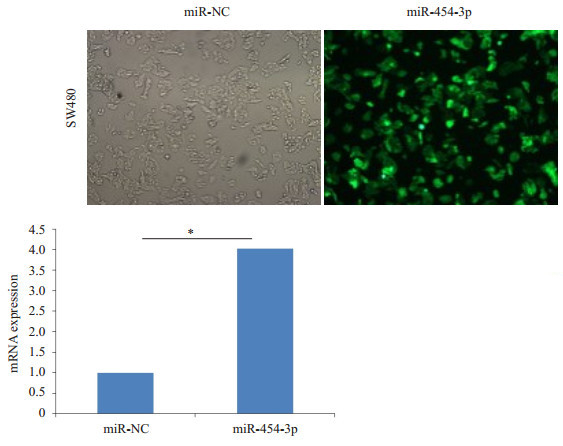
荧光显微镜观察结果显示, SW480细胞转染率约80%。Real-time PCR结果显示在miR-454-3p mimics转染组, 细胞的miR-454-3p的mRNA表达水平显著高于miR-454-3p阴性对照组(P < 0.05, 图 2)。
|
图 2 在SW480结肠癌细胞中成功过表达miR-454-3p Fig.2 Over-expression of miR-454- 3p in colon cancer SW480 cells. *P < 0.05 vs miR-NC. |
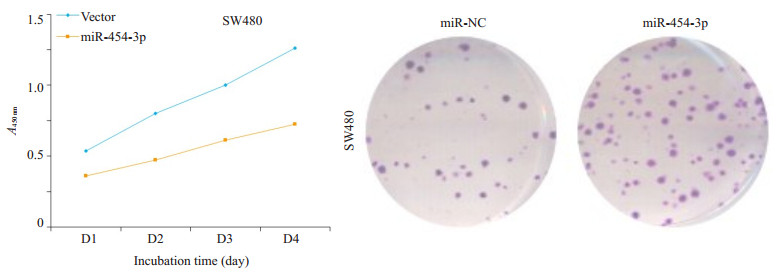
CCK-8检测结果显示, 在SW480细胞中过表达miR-454-3p后, 细胞的生长受到了明显的促进(图 3左), 组间差异显著(P<0.05)。同时, 细胞克隆形成实验结果显示, miR-454-3p mimics转染组较阴性对照组细胞在培养1周后出现较多细胞克隆(图 3右), 组间差异显著(P<0.05)
|
图 3 过表达miR-454-3p促进SW480结肠癌细胞增殖 Fig.3 Overexpression of miR-454-3p promotes the proliferation of colon cancer SW480 cells. *P < 0.05 vs vector. |
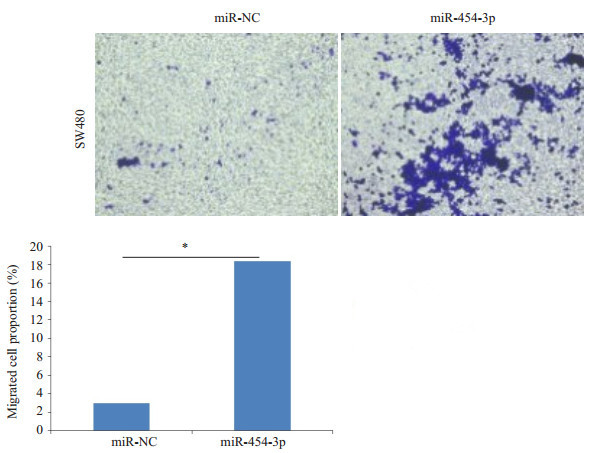
Transwell结果显示, 在SW480细胞中过表达miR- 454-3p后, 细胞的侵袭生长能力得到了明显的促进, 表现为在miR-454-3p mimics转染组中, 有更多的SW480细胞穿过Transwell膜, 在在阴性对照转染组, 穿透的细胞数较少(图 4), 组间差异显著(P<0.05)。
|
图 4 过表达miR-454-3p促进SW480结肠癌细胞侵袭 Fig.4 Overexpression of miR-454-3p promotes invasion of SW480 cells. *P < 0.05 vs miR-NC. |
建立小鼠肝转移模型[11], 动物实验结果显示, 在miR-454-3p mimics转染组中, 小鼠的肝转移灶数量显著高于阴性对照组。小鼠的肝转移灶为箭头所指示处, 统计发现组间差异显著, 具有统计学意义(P<0.05, 图 5)。
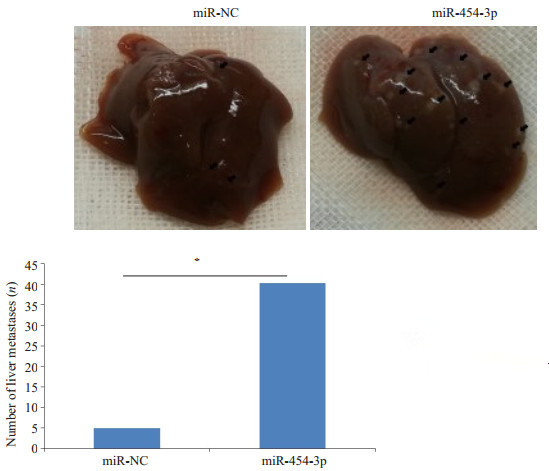
|
图 5 过表达miR-454-3p促进结肠癌肝转移 Fig.5 Overexpression of miR-454-3p promotes liver metastasis of colorectal cancer in mice. *P < 0.05 vs miR-NC. |
结直肠癌是全球癌症相关死亡的重要原因之一[12], 虽然近年来研究对结肠癌的基因改变有了更好的了解, 但由于癌症细胞侵袭和远处转移[13-14], 结肠癌患者的预后仍然很差[6], 这是由于结肠癌发生发展过程中, 肿瘤的固有异质性和内部复杂的基因相互作用所致[15-16]。因此, 发现新的介导肿瘤恶性转化的生物学机制和新的结肠癌恶性转化调控分子有望为控制结肠癌的发展提供一些潜在的更佳选择[17]。在侵袭和转移过程中, 致癌基因的激活和抑癌基因的失活起着重要的作用[18]。虽然这些过程的许多机制已经被阐明, 相应的诊疗已经得到改善, 但50%的结肠癌患者在手术后仍然会发生肿瘤转移[17, 19]。因此, 研究新的转移预测标志物, 探索参与结肠癌侵袭和转移的机制是当前亟待解决的问题之一。
MicroRNAs (miRNAs)是一种小的非编码RNA (一般由18~24个核苷酸组成), 可在血清中稳定存在, 并介导肿瘤的生物学过程, 如肿瘤细胞迁移、侵袭、增殖和凋亡[20-22]。越来越多的证据表明异常的miRNA的表达可以直接促进或抑制下游靶基因的转录表达, 进而影响结肠癌的病程进展。例如miR-34a-5p通过p53依赖途径抑制转移, 在Ⅰ/Ⅲ期结肠癌患者中发现miR-34a- 5p低表达, 同时, 该病理类型的结肠癌预后大多良好[18]。miR-1269a可以通过转化生长因子(TGF)家族成员直接靶向Smad7和HOXD10, 形成一个正反馈环, 增强结肠癌细胞的转移能力[23]。此外, miR-4775已被证实为一种新的致癌miRNA, 其对ERBB2/Her2基因有双重作用[24]。然而, 目前还没有关于miR-454-3p在结肠癌进展中的作用的报道。
miR-454-3p作为一种新发现的miRNA, 研究表明其在脑胶质瘤、肾癌及软骨肉瘤等疾病中具有重要的作用。作为众多致癌信号通路的趋同点, Stat3通过调控细胞增殖和凋亡, 通过Bcl-2、c-Myc和cyclin D1[25]等直接靶点参与细胞生长, 其中ATG12是自噬体形成的关键因素[26]。最近的研究表明, ATG12是一个涉及放化疗耐受的重要基因[27]。基于此, 有道称miR-454-3p通过靶向Stat3和Atg12, 从而作为软骨肉瘤的一种新的抗肿瘤基因[28]。另有研究表明BTG1基因是miR-454-3p的直接靶点。由于BTG1在细胞周期进程中的重要作用, 其表达水平的变化可以改变肿瘤细胞对与放疗的敏感性, 而miR-454-3p可以通过下调BTG1的表达, 进而可改变肿瘤细胞对放疗的敏感性[29]。还有研究表明血浆中的miR-454-3p表达水平可以作为神经胶质瘤诊断和预后的潜在非侵入性生物标志物[30]。
我们的研究发现miR-454-3p在结肠癌肿瘤组织中表达显著上调, 这表明miR-454-3p可能参与结肠癌肿瘤恶性转化的进程。细胞实验中, 我们运用基因转染技术过表达了miR-454-3p, 显示在miR-454-3p过表达组中, 结肠癌细胞SW480显示出了更加明显的增殖和侵袭表型; 动物实验中, miR-454-3p过表达细胞组小鼠肝脏可见更多的肿瘤转移病灶, 基于这些结果, 我们预测miR-454-3p可能作为结肠癌的一个新的标志基因促进结肠癌细胞的侵袭和转移进而参与其恶性转化。本文尚有一些不足, 如病例数尚不够多, 未对这些患者进行随访, 未来尚需更多的研究病例及随访来证实。我们的研究结果显示miR-454-3p在肿瘤发生和结肠癌发展中起重要作用, 为结肠癌的诊断和预后评估提供了一个新的潜在标志物, 具有一定的转化意义。
| [1] |
Zhao CJ, Li SL, Liu Q. Meta-analysis of molecular targeted agents in the treatment of elderly patients with metastatic colorectal Cancer:Does the age matter?[J].
J Cancer Res Ther, 2018, 14(1): S79-84.
|
| [2] |
鲍欣, 杨艳明, 刘念, 等. miR-21在结肠癌与癌旁组织中的表达及其临床意义[J].
吉林大学学报:医学版, 2013, 39(2): 318-21.
|
| [3] |
Ramon L, David C, Fontaine K, et al. Technical validation of a reverse-transcription quantitative polymerase chain reaction in vitro diagnostic test for the determination of MiR-31-3p expression levels in formalin-fixed paraffin-embedded metastatic colorectal cancer tumor specimens[J].
Biomark Insights, 2018, 13(3): 1177271918763357.
|
| [4] |
Pishvaian MJ, Slack RS, Jiang W, et al. A phase 2 study of the PARP inhibitor celiparib plus temozolomide in patients with heavily pretreated metastatic colorectal cancer[J].
Cancer, 2018, 124(11): 2337-46.
DOI: 10.1002/cncr.v124.11. |
| [5] |
de la fouchardiere C, Anadkat M, Jatoi A, et al. Regorafenib in the treatment of metastatic colorectal cancer[J].
Future Oncol, 2018, 14(22): 2239-46.
|
| [6] |
Lacouture ME, Anadkat M, Jatoi A, et al. Dermatologic toxicity occurring during Anti-EGFR monoclonal inhibitor therapy in patients with metastatic colorectal cancer:a systematic review[J].
Clin Colorectal Cancer, 2018, 17(2): 85-96.
DOI: 10.1016/j.clcc.2017.12.004. |
| [7] |
Sartori EM, Magro-Filho O, Silveira Mendonca DB, et al. Modulation of micro RNA expression and osteoblast differentiation by nanotopography[J].
Int J Oral Maxillofac Implants, 2018, 33(2): 269-80.
DOI: 10.11607/jomi.5372. |
| [8] |
Kit OI, Vodolazhsky DI, Rostorguev EE, et al. The role of microRNA in the regulation of signal pathways in gliomas[J].
Biomed khim, 2017, 63(6): 481-98.
DOI: 10.18097/pbmc20176306481. |
| [9] |
郑海伦, 赵睿, 李大鹏, 等. miR-625-3p在结肠癌组织和细胞中的表达[J].
中国病理生理杂志, 2016, 32(8): 1376-82.
DOI: 10.3969/j.issn.1000-4718.2016.08.006. |
| [10] |
曾长青, 黄良祥, 郑羽, 等. miR-146a在结肠癌中的表达及意义[J].
南方医科大学学报, 2014, 34(3): 396-400.
|
| [11] |
朴春梅, 刘旭霞, 王绿娅, 等. 小动物活体成像技术在结肠癌肝转移研究中的应用[J].
首都医科大学学报, 2014, 35(4): 468-72.
DOI: 10.3969/j.issn.1006-7795.2014.04.017. |
| [12] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J].
CA Cancer J Clin, 2015, 65(1): 5-29.
DOI: 10.3322/caac.21254. |
| [13] |
Sartore-Bianchi A, Loupakis F, Argiles G, et al. Challenging chemoresistant metastatic colorectal cancer:therapeutic strategies from the clinic and from the laboratory[J].
Annals of Oncology, 2016, 27(8): 1456-66.
DOI: 10.1093/annonc/mdw191. |
| [14] |
C.de Castro Sant'Anna. Molecular biology as a tool for the treatment of cancer[J].
Food Funct, 2018, 18(4): 457-64.
|
| [15] |
Li Y, Li W, Ying Z, et al. Metastatic heterogeneity of breast cancer cells is associated with expression of a heterogeneous TGF betaActivating miR424-503 gene cluster[J].
Cancer Res, 2014, 74(21): 6107-18.
DOI: 10.1158/0008-5472.CAN-14-0389. |
| [16] |
张言, 王争. 结肠癌转移相关基因1对结肠癌细胞肝转移的影响[J].
肿瘤, 2011, 31(6): 513-6.
|
| [17] |
Dekker E, Sanduleanu S. Colorectal cancer:strategies to minimize interval CRC in screening programmes[J].
Nat Rev Gastroenterol Hepatol, 2016, 13(12): 10-2.
|
| [18] |
Gao J, Li N, Dong Y, et al. miR-34a-5p suppresses colorectal cancer metastasis and predicts recurrence in patients with stage Ⅱ/Ⅲ colorectal cancer[J].
Oncogene, 2015, 34(31): 4142-52.
DOI: 10.1038/onc.2014.348. |
| [19] |
Junior AF, Soares P, Tuji F, et al. Molecular sequence of events and signaling pathways in cerebral metastases[J].
Clin Exp Med, 2018, 38(7): 1859-77.
|
| [20] |
Ohtsuka M, Ling H, Doki Y, et al. MicroRNA processing and human cancer[J].
J Clin Med, 2015, 4(8): 1651-67.
DOI: 10.3390/jcm4081651. |
| [21] |
李楠, 李夏雨, 黄铄, 等. miR-126靶向调控IRS1, SLC7A5及TOM1基因抑制结肠癌的增殖及侵袭转移[J].
中南大学学报:医学版, 2013, 38(8): 809-17.
|
| [22] |
吴瑾瑜, 门琼, 于观贞, 等. 转移抑制子KISS1和nm23在结肠癌中的表达以及与转移的关系[J].
中国医药指南, 2008, 6(5): 3-5.
DOI: 10.3969/j.issn.1671-8194.2008.05.002. |
| [23] |
Bu P, Wang L, Chen KY, et al. MiR-1269 promotes metastasis and forms a positive feedback loop with TGF-beta[J].
Nat Commun, 2015, 6(4): 6879.
|
| [24] |
Persson H, Kvist A, Rego N, et al. Identification of new MicroRNAs in paired normal and tumor breast tissue suggests a dual role for the ERBB2/her2 gene[J].
Cancer Res, 2011, 71(1): 78-86.
DOI: 10.1158/0008-5472.CAN-10-1869. |
| [25] |
Timme S, Ihde S, Fichter CD, et al. STAT3 expression, activity and functional Consequences of STAT3 inhibition in esophageal squamous cell carcinomas and Barrett's adenocarcinomas[J].
Oncogene, 2014, 33(25): 3256-66.
DOI: 10.1038/onc.2013.298. |
| [26] |
Otomo C, Metlagel Z, Takaesu G, et al. Structure of the human ATG12 similar to ATG5 conjugate required for LC3 lipidation in autophagy[J].
Nat Struct Mol Biol, 2013, 20(1): 59-U79.
DOI: 10.1038/nsmb.2431. |
| [27] |
An Y, Zhang Z, Shang Y, et al. miR-23b-3p regulates the chemoresistance of gastric cancer cells by targeting ATG12 and HMGB2[J].
Cell Death Dis, 2015, 6(2): e1766.
|
| [28] |
Bao X, Ren T, Huang Y, et al. Knockdown of long non-coding RNA HOTAIR increases miR-454-3p by targeting Stat3 and Atg12 to inhibit chondrosarcoma growth[J].
Cell Death Dis, 2017, 8(2): e2605.
DOI: 10.1038/cddis.2017.31. |
| [29] |
Wu X, Ding N, Hu WT, et al. Down-regulation of BTG1 by miR-454-3p enhances cellular radiosensitivity in renal carcinoma cells[J].
Radiat Oncol, 2014, 9(8): 179.
|
| [30] |
Shao NY, Wang L, Xue L, et al. Plasma miR-454-3p as a potential prognostic indicator in human glioma[J].
Neurol Sci, 2015, 36(2): 309-13.
DOI: 10.1007/s10072-014-1938-7. |
 2018, Vol. 38
2018, Vol. 38

