2. 重庆师范大学教育科学学院特殊教育系,重庆400047;
3. 陆军军医大学基础医学院生物化学与分子生物学教研室,重庆 400038
2. Facultiy of Educationfor Children with Special Needs, College of Education Science, Chongqing Normal University, Chongqing 400047, China;
3. Department ofBiochemistry and Molecular Biology, Army Medical University, Chongqing 400038, China
丙戊酸钠(VPA)是临床上常用的一种不含氮广谱抗癫痫药。对各型癫痫如局限性发作、肌阵挛性癫痫、各型小发作、大发作和混合型癫痫均有效[1]。同时VPA还常用于治疗双相性精神障碍、偏头痛、慢性头痛及辅助化疗。与其他同类抗癫痫药物相比, VPA的疗效和耐受性较好, 但VPA治疗的不良反应较重, 尤其对于儿童[2]。VPA可损害儿童认知, 尤其是学习记忆功能, 主要体现在学习成绩下降和智商降低, 停药后可逐渐改善[3]。同时, VPA可干扰脑发育过程, 导致胚胎期脑先天畸形[4]。一项大规模人群调查表明, VPA产前暴露显著增加了胎儿患自闭症的风险[5]。同时, 一次性注射VPA也是目前制备自闭症动物模型的标准方法。但VPA究竟是通过何种机制影响儿童的神经及认知系统目前尚不完全清楚。
自噬是细胞中降解长寿命蛋白与细胞器并回收利用相关降解产物的重要分解代谢机制, 在细胞的生长、发育与疾病的发生中发挥重要作用[6]。自噬水平的降低是多种神经退行性疾病如帕金森病、阿尔海默氏病、亨廷顿氏病等发病的重要原因[7-8]。同时, 自噬还与自闭症的发病密切相关, 在多种自闭症模型动物中均发现了自噬相关信号通路的改变[4, 9]。本课题组前期研究发现, VPA孕期暴露可抑制仔鼠神经组织中的自噬水平, 并引起自闭症相关病症[10-11], 但VPA在神经细胞中抑制自噬的相关机制尚未阐明, 亟待深入研究。
自噬相关蛋白4B (ATG4B)是C54肽酶家族的一个成员, 其在调控哺乳类细胞自噬过程中发挥着关键作用。在自噬发生过程中, ATG4B一方面可切割微管相关蛋白Ⅰ轻链3的前体proLC3而形成游离于胞质的LC3-Ⅰ, LC3-Ⅰ可被进一步加工成为自噬小体标志蛋白LC3-Ⅱ而参与自噬体形成; 另一方面ATG4B还可回收其他膜上的LC3-Ⅱ而为自噬体的形成做准备[12-13]。因此, ATG4B的表达与细胞自噬水平密切相关。本课题组在预实验中发现, VPA处理可导致神经细胞中ATG4B表达下降, 从而推测VPA可能通过下调ATG4B表达而抑制神经细胞的自噬水平, 进而影响神经细胞的功能。本研究以神经细胞为模型, 探讨VPA下调ATG4B的相关机制, 目的在于深入阐明VPA抑制自噬的分子机制, 在一定程度上解释VPA影响神经细胞功能乃至发生不良反应的可能机制。
1 材料和方法 1.1 细胞株及培养人神经母细胞瘤细胞SH-SY5Y从中国科学院上海生命科学研究院生物化学与细胞生物学研究所购买。细胞使用含10%胎牛血清, 100 U/mL青霉素, 100 μg/mL链霉素的DMEM培养基, 在37℃、5% CO2条件下静置培养。
1.2 药品及试剂丙戊酸钠(VPA, Sigma), 胎牛血清(HyClone), DMEM培养基、胰蛋白酶(Invitrogen), 定量PCR试剂盒(TAKARA), 蛋白定量试剂盒(碧云天), 双荧光素酶报告基因检测试剂盒(Promega), miRNA提取试剂盒(天根), miR-34c-5p模拟物与抑制剂(Thermo), 蛋白分子量标准(中衫), GAPDH、Beclin1、p62、ATG4B、LC3抗体(Cell Signaling), PVDF膜(Bio-Rad)。
1.3 细胞分组与处理将SH-SY5Y细胞接种在6孔板中, 2×105/孔, 待细胞长至约80%时, 将细胞用不同剂量的VPA进行处理, VPA的终浓度分别为0.1、0.2、0.3、0.6 mmol/L。对照组使用对照溶剂PBS处理。各组细胞处理24 h后进行检测。
1.4 定量PCR分析细胞处理结束后, 于2000 g/min离心收集细胞, 经PBS洗涤后使用TRIzol法提取总RNA, 经M-MLV反转录酶将mRNA反转录为cDNA, 然后采用SYBR法进行定量PCR检测。扩增条件为预变性94℃ 30 s; 循环反应94℃ 10 s, 60℃ 30 s, 35个循环; 冷却至4℃。PCR引物序列如下:ATG4B上游引物5'-GGTG TGGACAGATGATCTTTGC-3', 下游引物5'-CCAAC TCCCATTTGCGCTATC-3'。检测结果采用2-ΔΔCt法分析后作图。
1.5 Western blot分析细胞处理结束后, 于2000 r/min离心收集细胞, 经PBS洗涤后用RIPA裂解液于冰上裂解15 min, 12 000 r/min离心收集上清, BCA法测定上清中蛋白含量。对样品的蛋白含量标准化后进行SDS-PAGE电泳分析。分离胶浓度为12%, 上样量为每孔40 μg总蛋白, 恒压电泳。电泳结束后用半干转法将蛋白从凝胶中转移到PVDF膜上, 用3%牛血清白蛋白室温封闭2 h, 然后分别用兔多克隆抗体ATG4B (1:1000稀释)、LC3(1:1000稀释)、GAPDH (1:5000稀释)4℃孵育过夜, 用PBST 3次洗膜后, 分别用山羊抗兔二抗(1:10 000稀释)室温孵育1 h, 经PBST洗膜后采用ECL发光试剂盒发光、显影, 化学发光仪采集图像, Image J软件分析条带灰度值。
1.6 microRNA提取与检测根据microRNA提取试剂盒说明书提取细胞中microRNA。对提取的microRNA定量后行反转录反应, 条件为37℃ 60 min, 80℃ 5 min, 12℃保存。然后以U6基因作为内参照, 使用GeneCopoeia公司的qRT-PCR系统进行测定, 扩增条件为预变性95℃ 30 s; 循环反应95℃ 5 s, 60℃ 34 s, 40个循环。测定结果通过2-ΔΔCt方法进行分析作图。
1.7 双荧光素酶报告基因实验在48孔板中接种细胞, 待细胞生长至70%左右时, 采用脂质体法把pGL3-ATG4B报告质粒与pRL-TK内参照质粒共转染至细胞中, 以pGL3-Basic空载体和pRL-TK共转染作为对照组。转染后12 h加入VPA处理, 转染后36 h, 使用1×PLB裂解细胞, 将裂解产物冰浴20 min后于4℃, 12 000 r/min离心15 min。然后从每个样品中取20 µL上清, 加入50 µL虫荧光素酶底物并混匀, 在报告基因检测系统中测定虫荧光素酶活性后加入50 µL反应终止液, 再继续测定海肾荧光素酶活性。以虫荧光素酶活性对海肾荧光素酶活性的比值对各组进行量化后作图, 通过组间t检验进行统计学分析。
1.8 mRNA稳定性实验在48孔板中接种细胞, 待细胞生长至70%左右时, 分别加入终浓度为0.6 mmol/L的VPA、终浓度为5 µg/mL的放线菌素D (转录抑制剂)或两者联合加入, 每组3个复孔。分别在加药前(0 h)、加药后2、4、6、8 h收集细胞, 提取RNA, 行逆转录后按照前述方法通过定量PCR分析细胞中mRNA水平变化。
1.9 统计学分析所有数据通过SPSS 20.0统计软件进行单因素方差分析, 采用均数±标准差表示, P < 0.05表示差异具有统计学意义。
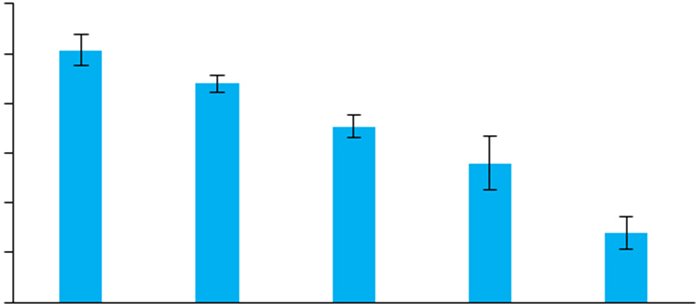
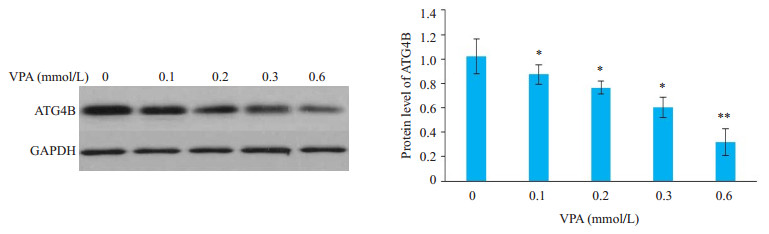
2 结果 2.1 VPA处理导致SH-SY5Y细胞中ATG4B的表达下调VPA可剂量依赖性下调SH-SY5Y细胞中ATG4B的mRNA水平(图 1), Western blot进一步检测发现, VPA同样剂量依赖性地下调了SH-SY5Y细胞中ATG4B的蛋白水平(图 2)。由于0.3 mmol/L和0.6 mmol/L的VPA能显著降低SH-SY5Y细胞中ATG4B的表达, 且该剂量属临床正常用药范围[14], 因此后续实验主要使用这两种剂量的VPA处理细胞。
|
图 1 VPA处理导致SH-SY5Y细胞中ATG4B的mRNA水平下调 Fig.1 VPA down-regulates ATG4B mRNA level in SHSY5Y cells (Mean±SD, n=3), *P < 0.05, **P < 0.01 vs control. |
|
图 2 VPA处理导致SH-SY5Y细胞中ATG4B的蛋白水平下调 Fig.2 VPA down-regulates ATG4B protein level in SH-SY5Y cells. *P < 0.05, **P < 0.01 vs control. |
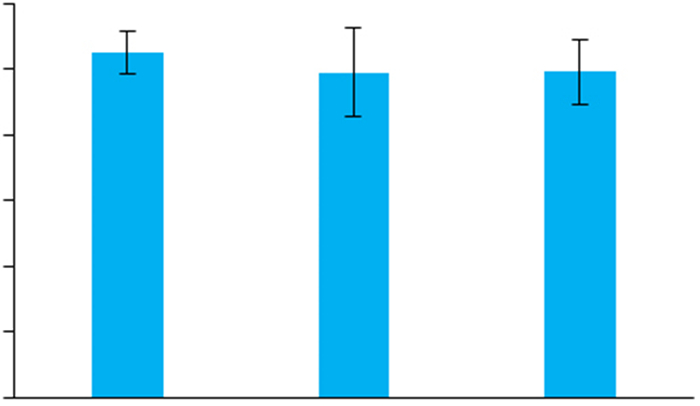
VPA处理并不能抑制SH-SY5Y细胞中ATG4B启动子的活性(图 3)。
|
图 3 VPA处理不影响SH-SY5Y细胞中ATG4B的启动子活性 Fig.3 VPA does not affect promoter activity of ATG4B in SH-SY5Y cells |
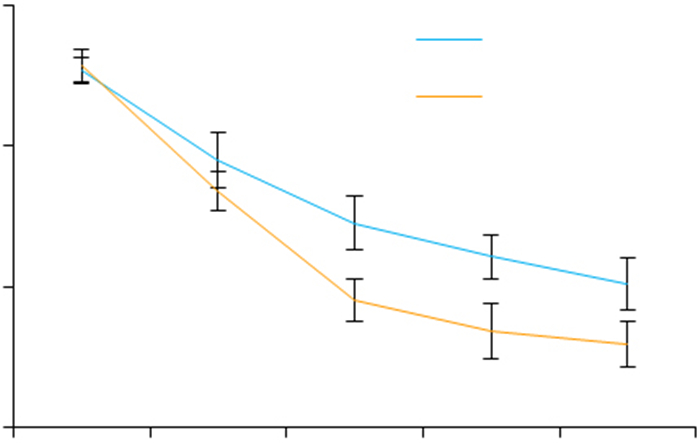
VPA处理可显著降低SH-SY5Y细胞中ATG4B mRNA的稳定性(图 4)。
|
图 4 VPA处理降低了SH-SY5Y细胞中ATG4B mRNA的稳定性 Fig.4 VPA lowers mRNA stability of ATG4B in SHSY5Y cells. Act D: Actinomycin D. **P < 0.01 vs Act D |
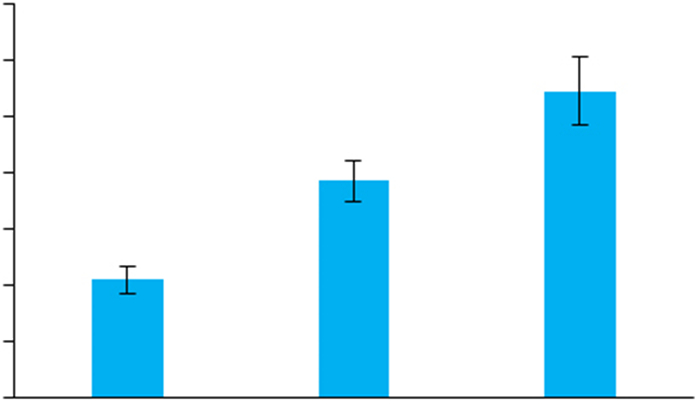
VPA处理可显著升高SH-SY5Y细胞中miR-34c- 5p的表达水平(图 5)
|
图 5 VPA处理导致SH-SY5Y细胞中miR-34c-5p水平上调 Fig.5 VPA up-regulates miR-34c-5p expression in SHSY5Y cells. *P < 0.01 vs control. |
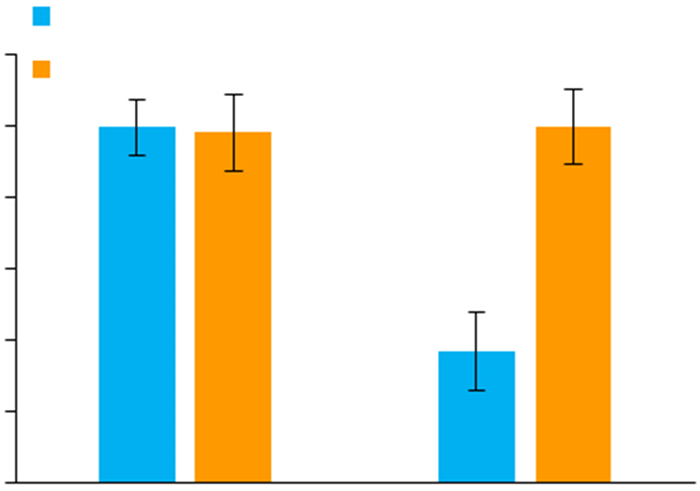
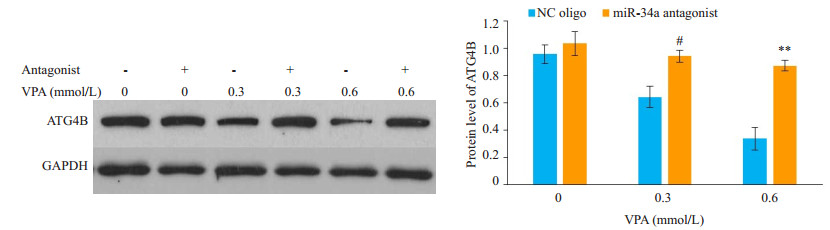
与VPA单独处理比较, 联合miR-34c-5p抑制剂处理显著逆转了VPA对ATG4B mRNA (图 6)与蛋白水平(图 7)的下调作用。
|
图 6 miR-34c-5p抑制剂逆转VPA对SH-SY5Y细胞中ATG4B mRNA的下调 Fig.6 miR-34c-5p antagonist reverses VPA-induced down-regulation of ATG4B mRNA in SH-SY5Y cells. **P < 0.01 vs control in 0.6 mmol/L VPA group. |
|
图 7 miR-34c-5p抑制剂逆转VPA对SH-SY5Y细胞中ATG4B蛋白水平的下调 Fig.7 miR-34c-5p antagonist reverses VPA-induced down-regulation of ATG4B protein in SH-SY5Y cells. #P < 0.05 vs control in 0.3 mmol/L VPA group; **P < 0.01 vs control in 0.6 mmol/L VPA group. |
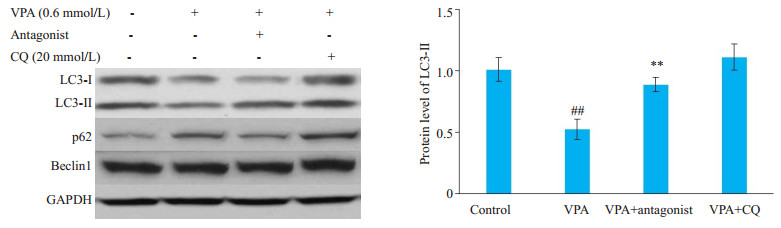
VPA处理可显著抑制SH-SY5Y细胞中自噬标志蛋白LC3-Ⅱ的水平(图 8), 同时还抑制p62的降解, 但不影响Beclin1的表达; 而使用miR-34c-5p抑制剂联合处理则可使LC3-Ⅱ与p62的水平得到恢复。联合使用自噬抑制剂氯喹(CQ)处理可引起LC3-Ⅱ与p62的堆积(图 8)。
|
图 8 miR-34c-5p抑制剂逆转VPA对SH-SY5Y细胞中自噬水平的下调 Fig.8 miR-34c-5p antagonist reverses VPA-induced suppression of autophagy in SH-SY5Y cells. ##P < 0.01 vs control, **P < 0.01 vs VPA. Antagonist: miR-34c-5p antagonist. |
尽管对VPA的不良反应有诸多报道, 但VPA对神经及认知系统的作用机制尚不完全清楚。研究表明, VPA可抑制γ-氨基丁酸(GABA)代谢酶活性, 导致脑组织中GABA浓度升高, 改变抑制性神经传递而干扰学习记忆过程[2]。VPA还具有抗谷氨酸作用, 它可阻断Na+通道而抑制谷氨酸释放进[15]。VPA暴露还可能影响小脑、前额叶、海马等脑组织的发育[16]。一方面, VPA可能影响成神经细胞的随意运动和定向迁移[17], 另一方面, VPA可致发育期神经细胞凋亡增加[9]。另外, VPA还可通过影响组蛋白的去乙酰化而影响大脑发育机制[18-19]。其中涉及到的分子信号机制包括AKT激酶信号通路[20]、mTOR信号通路[21]等。本课题组的前期研究发现, VPA暴露可导致大鼠脑组织中自噬水平下降, 且与自闭症的发生密切相关[10-11, 22], 而VPA抑制细胞自噬的机制可能与对mTOR信号的激活及对SIRT1活性的抑制相关, 使用mTOR的抑制剂雷帕霉素及SIRT1的激活剂白藜芦醇则可在一定程度上逆转VPA对自噬的抑制作用、改善自闭症病症[10-11]。与前期研究结果相符, 本研究进一步证实, VPA可在神经细胞中抑制自噬。由于0.6 mmol/L的VPA能显著降低SH-SY5Y细胞中ATG4B的表达, 且该剂量属临床正常用药范围[14], 因此在本实验中使用该剂量的VPA处理细胞。VPA在神经细胞中抑制自噬的机制则与其对miR-34c-5p/ATG4B信号通路的激活相关。由于多种信号途径可激活细胞自噬, 而ATG4B又是自噬发生过程中的关键分子, 因此, miR-34c-5p/ ATG4B信号通路可能是VPA抑制神经细胞中自噬活性的一条重要途径。
ATG4B是一种在脑组织中大量表达的自噬相关蛋白, ATG4B基因敲除小鼠的小脑和前庭组织会出现大量不规则球状体, 并对小鼠的运动神经功能造成损害[23]。帕金森患者外周血单核细胞中ATG4B的表达水平显著下降[24], 而高血糖则会引起ATG4B发生巯基亚硝基化, 抑制自噬从而导致中枢神经病变[25]。这些研究表明, ATG4B的表达变化可能与神经系统疾病的发生密切相关。本研究发现, VPA暴露会导致SH-SY5Y细胞中ATG4B在mRNA和蛋白水平均显著下降。调节mRNA水平的机制主要涉及转录控制和mRNA稳定性调控。双荧光素酶报告基因实验结果表明, VPA处理对ATG4B基因启动子的活性无明显影响, 说明VPA不能是转录水平抑制ATG4B表达。与此相反, mRNA稳定性实验发现, VPA处理导致ATG4B的mRNA稳定性显著降低, 从而证实VPA主要通过影响ATG4B的mRNA稳定性来抑制其表达。由于诸多因素可以影响mRNA的稳定性, 通过文献查阅发现, 在ATG4B mRNA的3'- UTR区存在miR-34c-5p的结合位点, 且miR-34c-5p结合后可促进ATG4B mRNA的降解[26], 进一步的实验结果也表明, VPA暴露确实可以导致SH-SY5Y细胞中miR-34c-5p水平升高, 并引起ATG4B的mRNA及蛋白水平下降低, 而联合使用miR-34c-5p的抑制剂则可以逆转上述现象。这些结果提示, VPA暴露在神经细胞中激活了miR-34c-5p/ATG4B信号通路而引起ATG4B表达下调。
VPA在神经细胞中上调miR-34c-5p的机制可能与它的组蛋白去乙酰化酶抑制剂功能相关[27]。抑制组蛋白去乙酰化酶的活性使得细胞中组蛋白乙酰化水平增加, 从而增强染色质结构的重塑并调节基因的表达。研究发现, VPA暴露可引起细胞中microRNA表达谱的改变[28-29]。如VPA暴露可导致细胞中miR-30d和miR- 181c的水平显著上调[22], VPA处理也可以使细胞中miR-155表达下调[30]。因此, VPA暴露可能通过上调神经细胞中miR-34c-5p水平抑制ATG4B的表达。
总之, 本研究在神经细胞中证实, VPA可通过激活miR-34c-5p/ATG4B信号通路而抑制自噬, 这可能是其影响神经细胞功能的一条重要通路, 而靶向这一通路可能有助于改善其不良反应。
| [1] |
陈湛愔, 陆兵勋, 刘中华, 等. 不同抗癫痫药物对癫痫患者认知功能障碍的影响[J].
南方医科大学学报, 2008, 28(8): 1394-7.
|
| [2] |
Li X, Risbrough VB, Cates-Gatto CA, et al. Comparison of the effects of the GABA (B) receptor positive modulator BHF177 and the GABA (B) receptor agonist baclofen on anxiety-like behavior, learning, and memory in mice[J].
Neuropharmacology, 2013, 70(70): 156-67.
|
| [3] |
Auvin S. Advancing pharmacologic treatment options for pharmacologic treatment options for children with epilepsy[J].
Expert Opin Pharmacother, 2016, 17(11): 1475-82.
DOI: 10.1080/14656566.2016.1195809. |
| [4] |
Chomiak T, Turner N, Hu B. What we have learned about autism spectrum disorder from valproic acid[J].
Patholog Res Int, 2013, 2013: 712758.
|
| [5] |
Roullet FI, Lai JK, Foster JA. In utero exposure to valproic acid and autism-A current review of clinical and animal studies[J].
Neurotoxicol Teratol, 2013, 36(SI): 47-56.
|
| [6] |
Chen W, Sun Y, Liu K, et al. Autophagy:a double-edged sword for neuronal survival after cerebral ischemia[J].
Neural Regen Res, 2014, 9(12): 1210-6.
DOI: 10.4103/1673-5374.135329. |
| [7] |
Evangelia, Kesidou, Ro za, et al. Autophagy and neurodegenerative disorders[J].
Neural Regen Res, 2013, 8(24): 2275-83.
|
| [8] |
Pircs K, Petri R, Jakobsson J. Crosstalk between microRNAs and autophagy in adult neurogenesis:implications for neurodegenerative disorders[J].
Brain Plast, 2018, 3(2): 195-203.
DOI: 10.3233/BPL-180066. |
| [9] |
Aluru N, Deak KL, Jenny MJ. Developmental exposure to valproic acid alters the expression of microRNAs involved in neurodevelopment in zebrafish[J].
Neurotoxicol Teratol, 2013, 40(40): 46-58.
|
| [10] |
戴旭芳, 秦利燕, 连继勤. 白藜芦醇对孤独症大鼠病症行为的改善作用[J].
第三军医大学学报, 2017, 39(13): 1360-5.
|
| [11] |
秦利燕, 戴旭芳. 雷帕霉素对自闭症大鼠病症行为的改善作用[J].
第三军医大学学报, 2015, 37(5): 420-4.
|
| [12] |
Green DR, Levine B. To be or not to be?How selective autophagy and cell death govern cell fate[J].
Cell, 2014, 157(1): 65-75.
DOI: 10.1016/j.cell.2014.02.049. |
| [13] |
Jiang P, Mizushima N. Autophagy and human diseases[J].
Cell Res, 2014, 24(1): 69-79.
|
| [14] |
彭敏, 邓楠. 丙戊酸钠的血药浓度及其影响因素分析[J].
中国药房, 2013, 26: 2422-4.
|
| [15] |
Maciejak P, Szyndler J, Kolosowska KA, et al. Valproate disturbs the balance between branched and aromatic amino acids in rats[J].
Neurotox Res, 2014, 25(4): 358-68.
DOI: 10.1007/s12640-013-9441-0. |
| [16] |
Gao JQ, Wang XE, Sun HL, et al. Neuroprotective effects of docosahexaenoic acid on hippocampal cell death and learning and memory impairments in a valproic acid-induced rat autism model[J].
Int J Dev Neurosci, 2016, 49(4): 67-78.
|
| [17] |
Harden CL. In utero valproate exposure and autism:long suspected, finally proven[J].
Epilepsy Curr, 2013, 13(6): 282.
DOI: 10.5698/1535-7597-13.6.282. |
| [18] |
Foti SB, Chou A, Moll AD, et al. HDAC inhibitors dysregulate neural stem cell activity in the postnatal mouse brain[J].
Int J Dev Neurosci, 2013, 31(6): 434-47.
DOI: 10.1016/j.ijdevneu.2013.03.008. |
| [19] |
Boudadi E, Stower H, Halsall JA, et al. The histone deacetylase inhibitor Sodium valproate causes limited transcriptional change in mouse embryonic stem cells but selectively overrides Polycombmediated Hoxb silencing[J].
Epigenetics Chromatin, 2013, 6(1): 11.
|
| [20] |
Yang EJ, Ahn S, Lee K, et al. Early behavioral abnormalities and perinatal alterations of PTEN/AKT pathway in valproic acid autism model mice[J].
PLoS One, 2016, 11(4): 0153298.
|
| [21] |
Hu GW, Mcquiston T, Bernard A, et al. A conserved mechanism of TOR-dependent RCK-mediated mRNA degradation regulates autophagy[J].
Nat Cell Biol, 2015, 17(7): 930-42.
DOI: 10.1038/ncb3189. |
| [22] |
Qin L, Dai X, Yin Y. Valproic acid exposure sequentially activates Wnt and mTOR pathways in rats[J].
Mol Cell Neurosci, 2016, 75: 27-35.
DOI: 10.1016/j.mcn.2016.06.004. |
| [23] |
Read R, Savelieva K, Baker K, et al. Histopathological and neurological features of Atg4b knockout mice[J].
Vet Pathol, 2011, 48(2): 486-94.
DOI: 10.1177/0300985810375810. |
| [24] |
Miki Y, Shimoyama S, Kon T, et al. Alteration of autophagy-related proteins in peripheral blood mononuclear cells of patients with Parkinson's disease[J].
Neurobiol Aging, 2018, 63: 33-43.
DOI: 10.1016/j.neurobiolaging.2017.11.006. |
| [25] |
Li YZ, Zhang YY, Wang L, et al. Autophagy impairment mediated by S-nitrosation of ATG4B leads to neurotoxicity in response to hyperglycemia[J].
Autophagy, 2017, 13(7): 1145-60.
DOI: 10.1080/15548627.2017.1320467. |
| [26] |
Wu YR, Ni ZH, Yan XJ, et al. Targeting the MIR34C-5p-ATG4Bautophagy axis enhances the sensitivity of cervical cancer cells to pirarubicin[J].
Autophagy, 2016, 12(7): 1105-17.
DOI: 10.1080/15548627.2016.1173798. |
| [27] |
Jonas S, Izaurralde E. NON-CODING RNA towards a molecular understanding of microRNA-mediated gene silencing[J].
Nat Rev Genet, 2015, 16(7): 421-33.
DOI: 10.1038/nrg3965. |
| [28] |
He H, Li W, Peng M, et al. MicroRNA expression profiles of neural stem cells following valproate inducement[J].
J Cell Biochem, 2018, 119(7): 6204-15.
DOI: 10.1002/jcb.v119.7. |
| [29] |
Hirsch MM, Declunann I, Fontes-Dutra M, et al. Behavioral alterations in autism model induced by valproic acid and translational analysis of circulating microRNA[J].
Food Chem Toxicol, 2018, 115: 336-43.
DOI: 10.1016/j.fct.2018.02.061. |
| [30] |
Zhang ZJ, Wang ZZ, Zhang B, et al. Downregulation of microRNA-155 by preoperative administration of valproic acid prevents postoperative seizures by upregulating SCN1A[J].
Mol Med Rep, 2018, 17(1): 1375-81.
|
 2018, Vol. 38
2018, Vol. 38

