宫颈癌是最常见的妇科恶性肿瘤,其高发病率和死宫颈癌是最常见的妇科恶性肿瘤,其高发病率和死亡率是影响女性健康的重要因素[1]。目前对于宫颈癌的治疗手段以手术、放疗为主,化疗为辅。近年来,随着广大医学工作者对宫颈癌分子发病机制的不断研究,基因靶向治疗肿瘤逐渐成为目前研究的热点[2]。相比于手术以及放疗化疗等手段,基因靶向治疗效果显著,副作用小,因此积极寻找安全有效的靶基因对宫颈癌的治疗具有重要意义。Fascin是一种在海胆卵母细胞中发现的聚束蛋白,在人体组织中存在3种Fascin,其中Fascin-1又称为Fascin,在脊椎动物体内广泛表达,Fascin在活细胞的胞质微丝束或突起中发挥调控作用,参与细胞内、外信号转导过程[3-5]。近期的研究发现,Fascin作为一种癌基因在多种肿瘤组织中高表达。在食管癌中,沉默Fascin具有抑制胆管癌、食管癌等肿瘤细胞生长作用[6-8]。在乳腺癌中,Fascin通过激活Notch通路以及胚胎转录因子,维持癌细胞的生长和增殖,靶向Fascin可能有助于乳腺癌的治疗[9-10]。有学者发现,宫颈上皮瘤变组织中检测到Fascin过表达,而正常组织中Fascin的表达水平则受到限制[11]。同时,有研究表明Fascin在正常宫颈组织不表达,但在宫颈上皮内瘤变、宫颈癌组织以及宫颈癌IA1期鳞状细胞中表达,参与了癌细胞的转移[11-12]。亦有研究表明Fascin的表达与子宫内膜肿瘤的发生发展密切相关,并在肿瘤侵袭过程中扮演了重要的角色[13]。但Fascin在宫颈癌中的具体作用和机制还不明确,本实验旨在探讨敲低Fascin表达对宫颈癌细胞生长及裸鼠成瘤能力以及细胞增殖和凋亡的影响,为靶向治疗宫颈癌提供新的方向。
1 材料和方法 1.1 材料雌性BLAB/c裸鼠(山东济南朋悦实验动物繁育有限公司提供,动物许可证号:SCXK(鲁)20160007),6周龄,体质量18~20 g。宫颈癌CaSki细胞购自上海沪震生物科技有限公司。qRT-PCR相关试剂(宝生物);Fascin抗体(Santa Cruz);增殖细胞核抗原(PCNA)抗体、Survivin抗体(PTGlab);细胞周期依赖性蛋白激酶4(CDK4)抗体、p21抗体(R & D Systems);HRP标记的二抗(羽朵生物);Fascin siRNA慢病毒和阴性对照慢病毒由深圳中洪博元生物技术有限公司构建。
1.2 方法 1.2.1 慢病毒感染CaSki细胞种植到24孔板内,倒置显微镜下观察细胞密度为40%,在细胞中添加慢病毒颗粒,MOI=20,继续孵育12 h以后,取出培养板,弃掉上清,添加细胞培养液(含有青链霉素的DMEM,同时添加10%胎牛血清),继续孵育培养3 d以后,观察荧光表达情况,感染效率高于90%,可用于后续实验。设置感染Fascin siRNA慢病毒和阴性对照慢病毒的CaSki细胞为干扰组和阴性组,设置没有感染慢病毒的CaSki细胞为对照组。
1.2.2 干扰效果检测用qRT-PCR和Western blot方法分别检测对照组、阴性组、干扰组细胞中Fascin表达变化。qRT-PCR:取对照组、阴性组、干扰组细胞按照每个25 mm的培养瓶中加入1 mL的Trizol提取细胞总RNA。逆转录合成cDNA第一链,反转录条件设置为:37 ℃ 15 min,85 ℃ 5 s,4 ℃保存,反转录的体系为:1.0 μL的PrimeScript RT Enzyme Mix,1.0 μL的4×RT Peimer Mix,4.0 μL的5×PrimeScript Buffer,4.0 μL的RNase Free dH2O,10 μL的RNA溶液。qRT- PCR程序为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,共40个循环,反应体系为:SYBR Primix Ex TaqⅡ 10 μL,0.8 μL的上下游引物,3.4 μL的dH2O,5 μL的cDNA。根据每个反应的Ct值,用2-△△Ct方法计算目的基因Fascin mRNA的表达水平,内参为GAPDH。
Western blot:取对照组、阴性组、干扰组细胞,添加含有PMSF的裂解液提取细胞总蛋白,按照BCA法分别检测各组蛋白浓度。将蛋白加入到1/4体积的5× Loading buffer中,放在100 ℃煮沸5 min。以10%下层胶和5%上层胶进行电泳,蛋白样品上样量为30 μg,电泳电压设置为90 V,电泳约30 min以后,将电压提高到120 V,肉眼观察溴酚蓝进入凝胶底部后,停止电泳。转膜电压设置为90 V,转膜置于冰上操作,转膜时长为90 min,把凝胶上的蛋白转移至大小相同的NC膜上。NC膜放在100 g/L的脱脂奶粉封闭液中,室温反应2 h。Fascin抗体用TBST稀释,稀释倍数为1:600稀释,NC膜置于抗体反应液中4 ℃过夜。再将HRP标记的二抗用TBST稀释,稀释倍数为1:3000,NC膜置于二抗反应液中孵育2 h。以ECL发光试剂盒显色以后,Image Quant Las 4000 mini拍照并分析目的条带Fascin和内参条带GAPDH灰度值,分析Fascin蛋白表达情况。
1.2.3 MTT测定敲减Fascin对细胞增殖影响取对照组、阴性组、干扰组细胞按照每孔中添加4000个细胞种植到96孔板中,设置不接种细胞的孔为空白调零孔,在CO2培养箱中孵育24、48、72、96 h后分别取出培养板,每孔中添加MTT溶液,放在37 ℃反应4 h,将孔内的液体分别吸除,添加150 μL的二甲基亚砜工作液,置于酶标仪上测定波长A490 nm。
1.2.4 裸鼠移植瘤模型构建取对照组、阴性组、干扰组CaSki细胞,用0.25%胰蛋白酶消化液将细胞消化,1000 g离心10 min,把上清溶液吸弃,添加PBS,将细胞配制成每毫升含有4×107细胞的单细胞悬浮液,吸取300 μL注射至裸鼠右侧后腿皮下,裸鼠均出现移植瘤。分别在接种CaSki细胞后7、12、17、22、27 d测量肿瘤体积,肿瘤体积=(长径×短径2)÷2。在最后1次测量肿瘤体积后,脱臼法将裸鼠处死,取肿瘤组织,称取肿瘤质量。
1.2.5 estern blot检测移植瘤组织中PCNA、survivin、CDK4、p21蛋白表达取1.2.4中收集的肿瘤组织,检测组织中PCNA、survivin、CDK4、p21蛋白表达水平,以Western blot方法检测,步骤同1.2.3。
1.3 统计分析实验数据采用SPSS21.0软件进行分析,计量资料用均数±标准差表示,多组差异比较用单因素方差分析,组间比较用SNK-q检验,P < 0.05为差异有统计学意义。
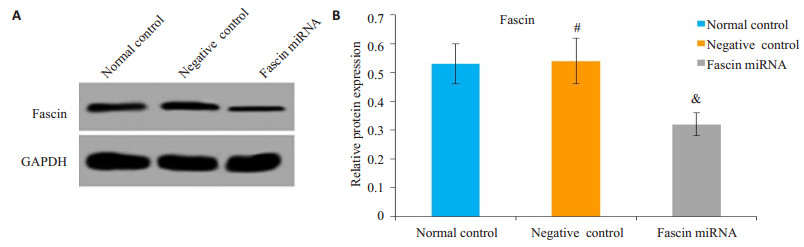
2 结果 2.1 Fascin siRNA干扰效果检测结果Fascin siRNA慢病毒感染后的CaSki细胞中对CaSki细胞中Fascin蛋白和mRNA水平明显降低,而阴性对照慢病毒对CaSki细胞中Fascin蛋白和mRNA水平没有影响(图 1、表 1)。Fascin siRNA可以明显敲减CaSki细胞中Fascin的表达和转录(P < 0.05)。
|
图 1 Western blot检测Fascin siRNA对CaSki细胞中Fascin蛋白表达影响 Fig.1 Fascin siRNA down-regulated the protein expression of fascin. A: Western blotting of fascin expression; B: Quantitative analysis of fascin expression. &P<0.05 vs normal control; #P>0.05 vs normal control. |
| 表 1 Fascin siRNA下调CaSki细胞中Fascin mRNA和蛋白水平 Tab.1 Fascin siRNA down-regulated the mRNA and protein expression of fascin in CaSki cells (Mean±SD) |
MTT法结果表明,敲减Fascin后的CaSki细胞在24、48、72、96 h在A490 nm的值均降低,而阴性对照慢病毒对CaSki细胞在A490 nm的值没有影响(表 2)。敲减Fascin可以明显降低CaSki细胞增殖能力(P < 0.05)。
| 表 2 敲减Fascin抑制CaSki细胞增殖 Tab.2 Fascin knockdown inhibited cell proliferation of CaSki in vitro (Mean±SD) |
敲减Fascin后的CaSki细胞裸鼠移植瘤在7、12、17、22、27 d肿瘤体积和肿瘤质量均明显降低,而阴性对照慢病毒对CaSki细胞裸鼠移植瘤肿瘤体积和肿瘤质量均没有影响(表 3)。敲减Fascin可以明显抑制CaSki细胞裸鼠移植瘤生长(P < 0.05)。
| 表 3 敲减Fascin抑制CaSki细胞裸鼠移植瘤生长 Tab.3 Fascin knockdown in CaSki cells inhibited xenograft tumor growth in nude mice (Mean±SD) |
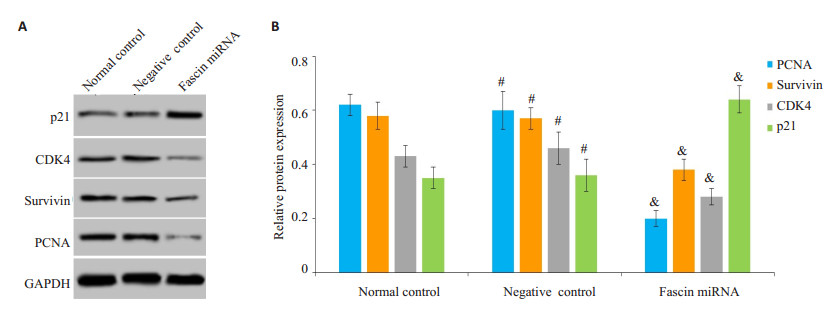
敲减Fascin后的CaSki细胞裸鼠移植瘤组织中PCNA、survivin、CDK4蛋白水平均降低,p21蛋白水平升高,而阴性对照慢病毒对CaSki细胞裸鼠移植瘤中PCNA、survivin、CDK4、p21蛋白水平均没有影响(图 2)。
|
图 2 Western blot检测敲减Fascin对CaSki细胞裸鼠移植瘤组织中PCNA、survivin、CDK4、p21蛋白表达影响 Fig.2 Effects of fascin knockdown on protein expressions of PCNA, survivin, CDK4 and p21 in CaSki cell xenograft in nude mice. A: Western blotting of PCNA, survivin, CDK4 and p21 expressions; B: Quantitative analysis of the expressions. & P < 0.05 vs normal control; #P>0.05 vs normal control (B). |
人类Fascin基因定位于7q22染色体上,其可以编码一个大小为55 ku的骨架蛋白,Fascin定位于细胞膜皱褶边缘、细胞质张力纤维中,Fascin蛋白单体含有2个可以与肌动蛋白结合的位点,2个单体可以形成一个二聚体,1个二聚体能够与肌动蛋白按照1:4的比例结合,形成肌动蛋白平行束结构,参与调控细胞的生物学特性发挥过程[14-16]。脊椎动物睾丸、卵巢、脑组织中存在较高水平的Fascin,在不同类型的细胞中的表达水平也不同[17-18]。Fascin在肿瘤组织中异常表达,在食管鳞癌、胃癌、乳腺癌、宫颈癌等肿瘤组织中发现Fascin高表达,并且其表达水平的高低与肿瘤患者临床分期、预后等具有相关性[19-22]。Fascin能够调控肿瘤细胞的增殖,RNA沉默胆管癌细胞中Fascin的表达后,细胞的增殖能力降低,沉默Fascin具有抑制胆管癌细胞生长的作用[23]。同时,还有大量文献表明,Fascin过表达通过调节MAPK以及β1 integrin/EGFR/VEGF-A等多种信号通路的转导从而促进了肿瘤的转移和侵袭[24-25]。此外亦有少量文献表明Fascin过表达参与了宫颈癌的发生发展过程[11-13]。但对于Fascin是否影响宫颈癌细胞的增殖尚不明确。
本次实验研究表明,RNA干扰Fascin表达后的宫颈癌细胞的体外增殖能力降低,说明Fascin在宫颈癌细胞生长中可能具有促进作用。为明确Fascin对整体动物肿瘤生长中的作用,我们进一步研究了敲低Fascin对宫颈癌细胞裸鼠成瘤能力的影响。结果发现,发现敲低Fascin后的宫颈癌细胞裸鼠移植瘤体积和重量均降低,说明敲低Fascin同样可以在体内抑制宫颈癌细胞的生长,抑制肿瘤的增殖。以上实验结果表明,敲低Fascin具有一定的抗宫颈癌细胞生长的作用,对治疗宫颈癌具有积极意义。
肿瘤细胞生物学特性的发挥受到细胞内多种调控因子的共同调控作用,survivin是在细胞有丝分裂间期高表达的调控基因,可以促进细胞有丝分裂正常进行,从而发挥促进细胞增殖的作用。CDK4也是一类细胞有丝分裂的促进因子,可以保证细胞周期正常进行,是细胞生长的基础[26-28]。而p21是一种细胞生长抑制因子,可以通过阻碍细胞周期正常有序的进展[29]。PCNA是目前公认的细胞增殖标志蛋白,在细胞增殖过程中高表达。研究显示,survivin、CDK4、PCNA表达下调是细胞增殖能力降低的标志[30-31]。癌症研究中,常以survivin、CDK4、PCNA、p21为观察指标,评估癌细胞增殖水平的强弱[32-35]。
本实验结果显示,敲低Fascin后的宫颈癌细胞移植瘤组织中的survivin、CDK4、PCNA蛋白表达下调,p21蛋白表达水平升高,提示敲低Fascin可能通过调控survivin、CDK4、PCNA、p21的表达水平影响宫颈癌细胞裸鼠移植瘤生长,同时表明Fascin可以促进癌细胞增殖,而敲低Fascin则会抑制癌细胞增殖,Fascin可能是宫颈癌治疗的一个靶点,对开发以Fascin为靶点的抗宫颈癌药物具有指导意义。
本实验从Fascin促进宫颈癌细胞增殖的角度进行研究,发现敲低Fascin具有在体内和体外抑制宫颈癌细胞生长的作用,敲低Fascin能够降低宫颈癌细胞裸鼠移植瘤体积和重量,下调survivin、CDK4、PCNA蛋白表达,促进p21蛋白表达。为研究Fascin在宫颈癌中的作用提供了基础,同时Fascin可能是宫颈癌治疗的靶基因和靶蛋白,为指导宫颈癌的靶向治疗药物的研发提供了依据,为治疗宫颈癌提供了新思路。同时文章也存在着不足之处,没有对Fascin促进宫颈癌细胞增殖作用的机制进行研究,下一步我们将通过体内外实验探讨Fascin促进宫颈癌细胞的增殖作用机制以及寻找以Fascin为靶点的靶向药物。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global Cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].
CA Cancer J Clin, 2018, 68(6): 394-424.
DOI: 10.3322/caac.v68.6. |
| [2] |
Zhang J, Liu SC, Luo XH, et al. Exosomal long noncoding RNAs are differentially expressed in the cervicovaginal lavage samples of cervical cancer patients[J].
J Clin Lab Anal, 2016, 30(6): 1116-21.
DOI: 10.1002/jcla.2016.30.issue-6. |
| [3] |
Liang ZG, Wang Y, Shen ZY, et al. Fascin 1 promoted the growth and migration of non-small cell lung cancer cells by activating YAP/TEAD signaling[J].
Tumour Biol, 2016, 37(8): 10909-15.
DOI: 10.1007/s13277-016-4934-0. |
| [4] |
Pelosi G, Pastorino U, Pasini F, et al. Independent prognostic value of fascin immunoreactivity in stage I nonsmall cell lung cancer[J].
Br J Cancer, 2003, 88(4): 537-47.
DOI: 10.1038/sj.bjc.6600731. |
| [5] |
Gonzalez-Reyes C, Marcial-Medina CA, Cortes-Reynosa P, et al. Migration and invasion induced by linoleic acid are mediated through fascin in MDA-MB-231 breast Cancer cells[J].
Mol Cell Biochem, 2018, 443(1/2): CP6-10.
|
| [6] |
Zhang H, Xu L, Xiao D, et al. Fascin is a potential biomarker for early-stage oesophageal squamous cell carcinoma[J].
J Clin Pathol, 2006, 59(9): 958-64.
DOI: 10.1136/jcp.2005.032730. |
| [7] |
Iguchi T, Aishima S, Taketomi AA, et al. Fascin overexpression is involved in carcinogenesis and prognosis of human intrahepatic cholangiocarcinoma:immunohistochemical and molecular analysis[J].
Hum Pathol, 2009, 40(2): 174-80.
DOI: 10.1016/j.humpath.2008.06.029. |
| [8] |
张金添, 黄汉兴, 吴永廉. Fascin蛋白在食管癌中的表达及临床意义[J].
南京医科大学学报:自然科学版, 2012, 32(7): 1000-3.
|
| [9] |
Barnawi R, Al-Khaldi S, Majed SG, et al. Fascin is critical for the maintenance of breast cancer stem cell pool predominantly via the activation of the notch Self-Renewal pathway[J].
Stem Cells, 2016, 34(12): 2799-813.
DOI: 10.1002/stem.v34.12. |
| [10] |
Kim DH, Min KW, Do SI, et al. Negative association between GATA3 and fascin could predict Relapse-Free and overall survival in patients with breast cancer[J].
Virchows Arch, 2016, 29(2): 51A.
|
| [11] |
Koay ME, Crook M, Stewart CR. Fascin expression in cervical normal squamous epithelium, cervical intraepithelial neoplasia, and superficially invasive (stage IA1) squamous carcinoma of the cervix[J].
Pathology, 2014, 46(5): 433-8.
DOI: 10.1097/PAT.0000000000000124. |
| [12] |
马艺珲. 宫颈癌组织中Fascin和Galectin-3的表达与其淋巴道转移的病理学研究[D]. 兰州: 兰州大学, 2012.
http://cdmd.cnki.com.cn/Article/CDMD-10730-1012373759.htm
|
| [13] |
Stewart CR. Crook maxine, Loi sarah.fascin expression in endocervical neoplasia:correlation with tumour morphology and growth pattern[J].
Pathol, 2012, 65(3): 213-7.
|
| [14] |
Jawhari AU, Buda A, Jenkins M, et al. Fascin, an actin-bundling protein, modulates colonic epithelial cell invasiveness and differentiation in vitro[J].
J Pathol, 2003, 162(1): 69-80.
|
| [15] |
Geyeregger R, Zeyda M, Bauer WA, et al. Liver X receptors regulate dendritic cell phenotype and function through blocked induction of the actin-bundling protein fascin[J].
Blood, 2007, 109(10): 4288-95.
DOI: 10.1182/blood-2006-08-043422. |
| [16] |
Tong GX, Yee H, Chiriboga L, et al. Fascin-1 expression in papillary and invasive urothelial carcinomas of the urinary bladder[J].
Hum Pathol, 2005, 36(7): 741-6.
DOI: 10.1016/j.humpath.2005.05.005. |
| [17] |
Bros M, Ross XL, Pautz A, et al. The human fascin gene promoter is highly active in mature dendritic cells due to a stage-specific enhancer[J].
J Immunol, 2003, 171(4): 1825-34.
DOI: 10.4049/jimmunol.171.4.1825. |
| [18] |
Brieger J, Duesterhoeft A, Brochhausen C, et al. Recurrence of pleomorphic adenoma of the parotid gland-predictive value of cadherin-11 and fascin[J].
APMIS, 2008, 116(12): 1050-7.
DOI: 10.1111/apm.2008.116.issue-12. |
| [19] |
石锋. 食管鳞癌组织中HIF-1α及Fascin蛋白的表达[J].
中国医学创新, 2016, 13(26): 13-6.
DOI: 10.3969/j.issn.1674-4985.2016.26.004. |
| [20] |
Kim SJ, Choi IJ, Cheong TC, et al. Galectin-3 increases gastric Cancer cell motility by up-regulating fascin-1 expression[J].
Gastroenterology, 2010, 138(3): U308-1035.
|
| [21] |
Heinz LS, Muhs S, Schiewek J, et al. Strong fascin expression promotes metastasis Independent of its F-actin bundling activity[J].
Oncotarget, 2017, 8(66): 110077-91.
|
| [22] |
黄必飞, 王超群, 赵永明, 等. Fascin-1蛋白在宫颈癌中的表达及其临床病理意义[J].
浙江医学, 2015, 37(18): 1515-7.
|
| [23] |
李健, 毛先海, 吴金术, 等. RNA干扰沉默Fascin基因对人胆管癌细胞QBC939侵袭力影响[J].
中国现代医学杂志, 2013, 23(9): 43-6.
DOI: 10.3969/j.issn.1005-8982.2013.09.010. |
| [24] |
Zhao D, Zhang T, Hou XM, et al. Knockdown of fascin-1 expression suppresses cell migration and invasion of non-small celllung cancer by regulating the MAPK pathway[J].
Biochem Biophys Res Commun, 2018, 497(2): 694-9.
DOI: 10.1016/j.bbrc.2018.02.134. |
| [25] |
Jeong BY, Hwa CK, Jeong KJ, et al. Rab25 augments cancer cell invasiveness through a β1 integrin/EGFR/VEGF-A/Snail signaling axis and expression of fascin[J].
Exp Mol Med, 2018, 50(1): e435.
DOI: 10.1038/emm.2017.248. |
| [26] |
Ji XL, Zhang ZH, Han Y, et al. Mesenchymal stem cells derived from normal gingival tissue inhibit the proliferation of oral cancer cells in vitro and in vivo[J].
Int J Oncol, 2016, 49(5): 2011-22.
DOI: 10.3892/ijo.2016.3715. |
| [27] |
Gupta N, Jagadish N, Surolia A, et al. Heat shock protein 70-2(HSP70-2) a novel cancer testis antigen that promotes growth of ovarian Cancer[J].
J Cancer Res, 2017, 7(6): 1252.
|
| [28] |
Hseu YC, Thiyagarajan V, Tsou HT, et al. In vitroandin vivoantitumor activity of CoQ0against melanoma cells:inhibition of metastasis and induction of cell-cycle arrest and apoptosis through modulation of Wnt/β-catenin signaling pathways[J].
Oncotarget, 2016, 7(16): 22409-26.
|
| [29] |
Chen WM, Huang MD, Sun DP, et al. Long intergenic non-coding RNA 00152 promotes tumor cell cycle progression by binding to EZH2 and repressing p15 and p21 in gastric cancer[J].
Oncotarget, 2016, 7(9): 9773-87.
|
| [30] |
Su Y, Sun B, Lin X, et al. Therapeutic strategy with artificially-designed i-lncRNA targeting multiple oncogenic microRNAs exhibits effective antitumor activity in diffuse large B-cell lymphoma[J].
Oncotarget, 2016, 7(31): 49143-55.
|
| [31] |
Singhal J, Nagaprashantha L, Chikara SA, et al. 2'-Hydroxyflavanone:A novel strategy for targeting breast cancer[J].
Oncotarget, 2017, 8(43): 75025-37.
|
| [32] |
Li D, Ni TY, Tao L, et al. Jinlong capsule (JLC) inhibits proliferation and induces apoptosis in human gastric cancer cells in vivo and in vitro[J].
Biomed Pharmacother, 2018, 107(2): 738-45.
|
| [33] |
Zhao XE, Guo XH, Shen JH, et al. Alpinetin inhibits proliferation and migration of ovarian cancer cells via suppression of STAT3 signaling[J].
Mol Med Rep, 2018, 18(4): 4030-6.
|
| [34] |
Zhu MM, Huang C, Ma X, et al. Phthalates promote prostate cancer cell proliferation through activation of ERK5 and p38[J].
Environ Toxicol Pharmacol, 2018, 63(8): 29-33.
|
| [35] |
Vilawan P, Chanaporn K, Wannarasmi K, et al. Mechanism of cepharanthine cytotoxicity in human ovarian cancer cells[J].
Planta Med, 2018, 24.
DOI: 10.1055/a-0706-7503. |
 2018, Vol. 38
2018, Vol. 38

