青光眼是致盲的主要原因[1],降低眼内压是预防青光眼患者视觉损伤的唯一有效途径[2-3],虽然在过去的10~15年间药物治疗在降低眼内压有很大的疗效,成为青光眼的一线治疗方法,但是仍有一些患者需要另外一种方式降低眼内压,如滤过性手术[4]。
青光眼滤过性手术采用创建结膜下滤过通道的方法被作为治疗青光眼最常选的术式,许多并发症的发生与滤过泡的存在息息相关[5],因此滤过性手术的成功率主要取决于能否形成功能良好的结膜下滤泡[6-7],但由于术后结膜下易形成过多的瘢痕,这成为滤过性手术失败的最主要原因[8]。近年来多种药物治疗应用于调控结膜下瘢痕形成,常见的有糖皮质激素、抗有丝分裂类如5-氟尿嘧啶和丝裂霉素C等,针刺注入5-氟尿嘧啶在中央、平面区域更易形成无功能的滤过泡[9],而且这些药物相对非特异性并且易导致眼内炎等并发症[10]。为了取得更好的预后,新的抗瘢痕化药物亟待发现。国内外实验证实哺乳动物雷帕霉素靶蛋白(mTOR)信号通路的关键分子可以作为多种纤维化疾病治疗靶点[11]。mTOR通路在眼科增殖性疾病中也有广泛应用,如后发性白内障、增生性玻璃体视网膜病变、横纹肌肉瘤等[12],mTOR结构中激酶结构域上游的FKBPl2复合物是雷帕霉素的结合位点[13],雷帕霉素正是通过此结合点发挥药理作用来抑制mTOR信号通路[14],我们猜测作为mTOR靶向抑制剂的雷帕霉素(RAPA)在解决纤维化相关的疾病中可能拥有广阔的临床应用前景。但我们仍不清楚其对滤过性手术后瘢痕形成是否有抑制作用。因此我们建立兔青光眼模型行小梁切除术后,观察RAPA疗效,以寻求一种降低青光眼术后瘢痕化发生率的新药。
1 材料和方法 1.1 实验材料 1.1.1 实验动物健康成年青紫兰兔96只,雌雄不限,体质量2.0~2.5 kg,由内蒙古医科大学实验动物中心提供,排除全身和眼部病变。
1.1.2 实验试剂蓖麻油(国药);雷帕霉素:(谱振生物),无菌条件下分别将1 g、3 g、5 g RAPA溶于灭菌蓖麻油,加蓖麻油至100 mL,制成1%、3%、5%RAPA滴眼剂,常温避光保存;增殖细胞核抗原PCNA(中杉金桥);SP-9002免疫组化染色试剂盒、DAB试剂盒(中杉金桥);DMEM培养基(Gibco);Hoechst染料(碧云天)。
1.1.3 实验仪器双目手术显微镜(六六);眼科显微手术器械(六六);Tono2Pen XL接触式眼压计(Medtronic),光学显微镜(Olympus);常规石蜡包埋切片所需器材;各种型号细胞培养板(赛默飞世尔);流式细胞仪(BD)。
1.2 方法 1.2.1 动物模型制作所有实验动物术前测量基础眼压后25%乌拉坦1 g/kg耳缘静脉注射麻醉,固定在手术台上进行常规消毒。在手术显微镜下行左眼小梁切除术:在兔眼的颞上方做以穹窿部为基底的结膜瓣,在兔眼约11点方位,做以角巩膜缘为基底的巩膜瓣,分离至透明角膜内至少1.0 mm处,。在巩膜瓣下面,切除1.5 mm× 1.0 mm的小梁组织,并行相应虹膜周边切除,恢复虹膜及前房,9/0线缝合巩膜瓣和结膜瓣。
1.2.2 分组及给药将成功建立动物模型96只青紫兰兔随机分为4组,每组24只,3组实验组和1组对照组,于造模后当天开始实验组左眼分别滴1%、3%、5%的雷帕霉素,对照组左眼滴药用蓖麻油,4次/d,连续给药7 d。眼局部不用抗生素、散瞳剂及糖皮质激素。
1.2.3 临床观察指标 1.2.3.1 术后眼压术后分别于第7、14、21、28天用Tono2Pen XL型接触式眼压计测眼压,测量3次取平均值。
1.2.3.2 术后眼部反应术后每日在裂隙灯下观察结膜充血、角膜透明度、前房反应及晶状体透明度,参照Rabowsky[14]标准分级.
1.2.4 病理组织学及免疫组化染色 1.2.4.1 HE染色术后分别于第7、14、21、28天随机每组各取6只灰兔处死后,分离眼周组织,完整取下眼球,放入中性甲醛中固定。取手术区全部组织经乙醇梯度脱水、透明、浸蜡、包埋,作连续切片,常规HE染色,待树胶干燥后,光镜观察。
1.2.4.2 PCNA同法捞片后严格按照免疫组化染色试剂盒说明进行PCNA:(1)脱蜡、水化;(2)用纯化水或PBS配制新鲜的3% H2O2,室温封闭5~10 min,以去除内源性过氧化物酶;(3)抗原修复;(4)滴加正常山羊血清封闭液,除去血清后滴加一抗(稀释为1:100的PCNA)、二抗、SABC(辣根酶标记链霉卵白素工作液);(5)DAB显色试剂显色(显微镜下掌握显色程度);(6)苏木素复染,盐酸酒精分化,脱水,透明,封片,镜检。
1.2.4.3 病理切片与数据分析病理切片由专人进行组织学观察:常规HE染色光镜观察;PCNA免疫组化切片见棕黄色颗粒位于细胞核,明显高于背景为染色成功;PCNA阳性成纤维细胞定量分析,使用计数器计算滤过区内单位面积(μm2)的阳性成纤维细胞总数。每张切片在显微镜下于手术区随机选择5个高倍镜视野,数出每个视野所含的PCNA阳性细胞的总数,取平均值。
1.2.5 RTFs的培养、鉴定以及细胞凋亡的检测将新鲜眼球旁紧贴巩膜的白色Tenons囊组织剪下,进行原代培养、传代、鉴定及检测。选取处于第四代对数期的RTFs,将细胞接入培养板中培养后加入不同浓度的雷帕霉素(0.06、0.25、1、4mg/L),使用Annexin V-Biotin试剂进行流式细胞术检测细胞凋亡。
1.2.6 统计学处理所有数据分析采用SPSS 13. 0软件处理,所有数据计数资料采用χ2分析,当n < 40或T < 1时采用Fisher确切概率法;计量资料采用均数±标准差表示,两组间均数比较采用t检验,多组间均数比较采用单因素方差分析,方差不齐是采用welch校正结果,方差分析显著进行多重比较,方差齐性时采用LSD法,方差不齐采用Dunnett's T3法,两因素分析采用析因分析,统计结果以P < 0.05为差异有统计学意义。
2 结果 2.1 雷帕霉素对术后眼压的影响滤过术前各组的基础眼压差异无统计学意义(P= 0.106)。滤过术后,实验组和对照组眼压均较术前降低,且术后各个时间点(第7、14、21、28天),3个实验组(1%雷帕霉素、3%雷帕霉素和5%雷帕霉素)眼压均比对照组要低(P < 0.05,表 1)。
| 表 1 实验组和对照组眼压比较 Table 1 Intraocular pressure in rapamycin-treated and control groups (Mean±SD, mmHg) |
术后各实验组与对照组均表现有轻微的结膜充血和前房闪辉,可见少量炎性细胞(0~1分),于术后5 d基本消失并无显著性差异,未见角膜水肿和晶状体混浊。
2.3 HE染色结果术后第2天几乎全部术眼有功能性滤过泡,可见大量炎性细胞和红细胞,巩膜滤过通道开放,未见成纤维细胞,各实验组和对照组基本相同;术后第7天,各实验组滤过通道开放,可见一些纤维蛋白基质,偶见成纤维细胞,对照组滤过通道有较多成纤维细胞出现,部分已被增生的成纤维细胞及增厚致密的胶原结缔组织填充;术后14 d,各实验组滤过通道大部分开放,出现少量成纤维细胞及纤维蛋白,周边纤维排列均匀,未见大量胶原结缔组织,对照组滤过通道大部分被大量增生的成纤维细胞及增厚、致密的胶原结缔组织阻塞,胶原纤维粗大,呈索条样扭曲,排列紊乱;术后第21天,各实验组仍有开放滤过通道,而对照组滤过通道全部被增生的成纤维细胞和异常致密的胶原所组成的瘢痕组织填充, 失去正常组织形态(图 1)。
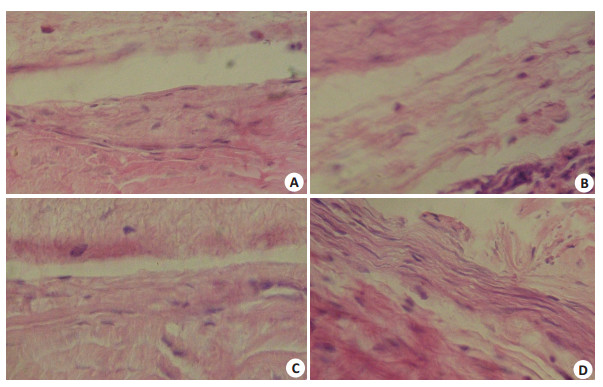
|
图 1 光镜下组织学改变 Figure 1 Histological changes in the filtering bleb of the rabbits under optical microscope (Original magnification: ×400). A: Rapamycin-treated group at 7 days; B: Control group at 7 days; C: Rapamycintreated group at 14 days; D: Control group at 14 days |
术后第7天、第14天、第21天,各实验组PCNA阳性细胞数均比对照组少,且具有显著性统计学差异(P < 0.05,表 2)。
| 表 2 实验组与对照组PCNA阳性细胞计数比较 Table 2 Comparison of PNCA-positive cells between rapamycin-treated group and control group (cell/μm2) |
A~E组依次为终浓度为0、0.06、0.25、1.0、4.0 mg/L的雷帕霉素对细胞凋亡的影响。图中左下部分为正常的活细胞;图中右下部分为凋亡早期的细胞;图中右上部分为坏死细胞和凋亡晚期的细胞;图中左上部分出现的是许可范围内的检测误差(图 2)。
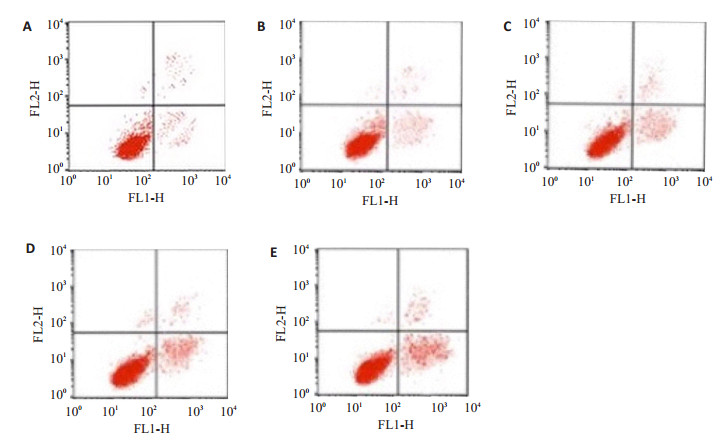
|
图 2 不同浓度雷帕霉素对细胞凋亡的影响 Figure 2 Effect of rapamycin at final concentrations of 0 (A), 0.06 (B), 0.25 (C), 1.0 (D), and 4.0 mg/L (E) on apoptosis of the fibroblasts. The lower left quadrant shows normal living cells; The lower right quadrant shows early apoptotic cells; The upper right quadrant shows the dead cells and late stage apoptotic cells; The upper left quadrant shows allowable metrical errors in the figure |
采用不同浓度的雷帕霉素处理后,caspase-3,caspase-9的mRNA表达量和蛋白的相对表达量随着雷帕霉素的浓度增加而增加,表现出浓度依赖性。但是caspase-8 mRNA表达量和蛋白的相对表达量与空白对照组中的水平却未出现显著的差别(表 3、4)。
| 表 3 不同浓度雷帕霉素处理后caspase-3,caspase-8,caspase-9 mRNA的相对表达变化 Table 3 Expressions of caspase-3, caspase-8, and caspase-9 mRNAin the fibroblasts after rapamycin treatment |
| 表 4 不同浓度雷帕霉素处理后caspase-3,caspase-8,caspase-9蛋白的相对表达变化 Table 4 Expressions of caspase-3, caspase-8, caspase-9 proteins in the fibroblasts after rapamycin treatment (n=6) |
本研究有两个主要的发现:(1)雷帕霉素发挥降低眼压的效应同时对眼部具有较低的毒副作用;(2)雷帕霉素可应用于青光眼滤过术后抗瘢痕化治疗。
当单纯药物和激光治疗不能有效降低眼压时,滤过性手术成为降低青光眼眼内压最有效的方式,但单纯手术常由于滤过泡瘢痕化而失败[15],国内外学者以丝裂霉素作为目前针对青光眼滤过性手术后瘢痕化的最常用药物,但其引起角膜水肿且持续应用对疾病控制疗效不佳[16-17]。另有研究表明[18-20],尽管滤过手术中糖皮质激素的局部应用可以抑制成纤维细胞的增生,但因这些药物可引起眼内毒性、滤过泡渗漏、术后浅前房以及结膜巩膜坏死等,故不能明显改善抗青光眼滤过手术的成功率,因此如何防止滤过通道瘢痕化已成为近年来眼科学界倍受关注的热点问题之一[21-23]。低毒副性且更有效的药物有待发现,雷帕霉素作为被选药物,于本次实验结果可见兔青光眼滤过术后使用雷帕霉素滴眼实验组眼压降低程度明显高于单纯滴用蓖麻油的对照组且雷帕霉素具有较低的毒副作用,结膜充血和前房闪辉于术后5 d内基本消失。但由于其的降眼压程度呈浓度依赖性,高浓度的雷帕霉素是否会诱发潜在并发症的出现仍是未知,因此找到临床应用的适宜浓度具有重要意义。
滤过性手术瘢痕化是青光眼手术失败的主要原因,瘢痕化主要是由于滤过泡上皮存在异常增生的纤维组织,术后成纤维细胞异常活跃,阻塞滤过通道导致房水引流不畅。雷帕霉素作为大环内酯类抗生素,能通过增殖细胞核抗原(PCNA)基因的转录而诱导cAMP反应元件调节因子抑制p70S6K的活性,能降低细胞周期依赖性激酶和细胞周期激酶复合物的活性,抑制DNA的合成,干扰细胞由G1期向S期发展[24],常用于免疫系统疾病的治疗,它还能抑制血管内皮细胞增殖,可用其组织手术区血管再生[25-26]。活化的caspase蛋白酶可以特异性地裂解底物,下调与DNA修复相关酶、mRNA剪切蛋白等[27],执行细胞凋亡功能。根据caspase蛋白酶对于底物的切割位点特异性,研究人员通过连接一些化学基团设计了一系列caspase蛋白酶抑制剂[28],其中caspase 8是外源性凋亡途径的执行者,caspase-9是内源性凋亡途径的执行者[29]。由于caspase-3、caspase-8、caspase-9是细胞凋亡过程中起关键作用的caspase蛋白酶,本实验结合不同浓度雷帕霉素对于caspase-3,caspase-8,caspase-9的表达影响。Huang JS[30]等证实caspase-3在口腔粘膜鳞状细胞癌的表达高于正常组织,邓海华[31]等证实其神经内分泌组织中的抗肿瘤作用,经雷帕霉素治疗后,caspase-9表达水平增加,因此推测雷帕霉素可通过caspase-3,caspase-9途径诱导细胞凋亡。
目前对于雷帕霉素的抑制纤维细胞增殖作用广布各个领域,但其在抑制滤过通道瘢痕化的治疗作用鲜有报道,在Daryan等[32]的实验证明,在给予高剂量雷帕霉素的情况下,喉气管狭窄患者的成纤维细胞明显减少,提示雷帕霉素存在弱化成纤维细胞增殖分化的功能。ZHENG Wen等的研究也表明雷帕霉素可以减轻腱鞘周围严重纤维化[33],以上结果为雷帕霉素抗瘢痕效能可否成功应用于青光眼术后滤过道瘢痕化的治疗提供了理论依据。本实验观察证实雷帕霉素具有抑制成纤维细胞增殖的作用。实验的成功进一步拓展了雷帕霉素的应用领域,相较于以往青光眼滤过性手术能获得更高的成功率。
综上所述,本研究结果表明雷帕霉素能够安全有效的在滤过性术后降低眼内压、减少炎症反应、抑制成纤维细胞的增生、保证滤过道通畅,显著的提高了手术的成功率;而且不同浓度雷帕霉素对细胞凋亡以及caspase-3,caspase-9 mRNA和蛋白的影响变大,可以推断雷帕霉素可以通过增加caspase-3,caspase-9的表达诱导凋亡发生;同时本研究还为滤过性术后瘢痕化治疗提出了新方案,为研发出抗瘢痕化适宜浓度的雷帕霉素制剂提供了新思路。
| [1] |
Taylor HR, Keeffe JE. World blindness: a 21st century perspective[J].
Br J Ophthalmol, 2001, 85(3): 261-6.
DOI: 10.1136/bjo.85.3.261. |
| [2] |
Heijl A, Leske MC, Bengtsson B, et al. Reduction of intraocular pressure and glaucoma progression: results from the early manifest glaucoma trial[J].
Arch Ophthalmol, 2002, 120(10): 1268-79.
DOI: 10.1001/archopht.120.10.1268. |
| [3] |
Collaborative Normal-Tension Glaucoma Study Group. The effectiveness of intraocular pressure reduction in the treatment of normal tension glaucoma[J].
Am J Ophthalmol, 1994, 126(4): 498-505.
|
| [4] |
Sung MS, Eom GH, Kim SJ, et al. Trichostatin a ameliorates conjunctival fibrosis in a rat trabeculectomy model[J].
Invest Ophthalmol Vis Sci, 2018, 59(7): 3115-23.
DOI: 10.1167/iovs.18-23826. |
| [5] |
周卫为. 青光眼非滤过泡依赖性手术的应用进展[J].
眼科新进展, 2017, 37(1): 94-7.
|
| [6] |
Patel S, Pasquale LR. Glaucoma drainage devices: a review of the past, present, and future[J].
Semin Ophthalmol, 2010, 25(5/6, SI): 265-70.
|
| [7] |
Sawchyn AK, Slabaugh MA. Innovations and adaptations in trabeculectomy[J].
Curr Opin Ophthalmol, 2016, 27(2): 158-63.
DOI: 10.1097/ICU.0000000000000236. |
| [8] |
Mehmet, Baykara, Basak, et al. A novel suturing technique for fi ltering glaucoma surgery: the accordion suture[J].
Int J Ophthalmol, 2017, 12(12): 1931-4.
|
| [9] |
Lee YS, Wu SC, Tseng HJ, et al. The relationship of bleb morphology and the outcome of needle revision with 5-fluorouracil in failing filtering bleb[J].
Medicine, 2016, 95(36): e4546.
DOI: 10.1097/MD.0000000000004546. |
| [10] |
Rodriguez-Agirretxe I, Garcia I, Soria J, et al. Custom RT- qPCRarray for glaucoma filtering surgery prognosis[J].
PLoS One, 2017, 12(3): e0174559.
DOI: 10.1371/journal.pone.0174559. |
| [11] |
高景, 焦虎, 曹蕊, 等. 雷帕霉素诱导瘢痕疙瘩成纤维细胞自噬的作用及机制[J].
中华整形外科杂志, 2016, 32(3): 208-14.
DOI: 10.3760/cma.j.issn.1009-4598.2016.03.012. |
| [12] |
王逸涵, 柳林. mTOR通路在眼科增殖相关性疾病中的研究进展[J].
国际眼科杂志, 2014, 14(8): 1417-9.
|
| [13] |
Cafferkey R, Young PR, Mclaughlin MM, et al. Dominant missense mutations in a novel yeast protein related to mammalian phosphatidylinositol 3-kinase and VPS34 abrogate rapamycin cytotoxicity[J].
Mol Cell Biol, 1993, 13(10): 6012-23.
DOI: 10.1128/MCB.13.10.6012. |
| [14] |
张桂铭. 哺乳动物雷帕霉素靶蛋白信号通路与眼科疾病相关性的研究进展[J].
中华实验眼科杂志, 2015, 33(11): 1048-51.
DOI: 10.3760/cma.j.issn.2095-0160.2015.11.018. |
| [15] |
Przekora A, Zarnowski T, Ginalska G. A simple and effective protocol for fast isolation of human Tenon's fibroblasts from a single trabeculectomy biopsy-a comparison of cell behaviour in different culture media[J].
Cell Mol Biol Lett, 2017, 22(1): 1-16.
DOI: 10.1186/s11658-016-0030-0. |
| [16] |
Zheng X, Ma WL, Ye CH. Influence of mitomycin C on corneal endothelial cell in phacoemulsification combined trabeculectomy[J].
Inter Eye Sci, 2018, 18(1): 96-9.
|
| [17] |
Bayoumi NH. Mitomycin C in filtering surgery for primary congenital glaucoma: a comparison of exposure durations[J].
J Pediatr Ophthalmol Strabismus, 2018, 55(3): 164-70.
DOI: 10.3928/01913913-20171129-02. |
| [18] |
Hirooka K, Mizote M, Baba T, et al. Risk factors for developing avascular filtering Bleb after fornix-based trabeculectomy with mitomycin C[J].
J Glaucoma, 2009, 18(4): 301-4.
DOI: 10.1097/IJG.0b013e3181815470. |
| [19] |
Hueber A, Esser JM, Kociok N, et al. Mitomycin C induces multidrug resistance in glaucoma surgery[J].
Graefes Arch Clin Exp Ophthalmol, 2008, 246(2): 297-304.
DOI: 10.1007/s00417-007-0695-1. |
| [20] |
Wu Z, Li S, Wang N, et al. A comparative study of the safety and efficacy effect of 5-fluorouracil or mitomycin C mounted biological delivery membranes in a rabbit model of glaucoma filtration surgery[J].
Clin Ophthalmol, 2013, 7: 655-62.
|
| [21] |
Nilforushan N, Yadgari M, Kish SK, et al. Subconjunctival bevacizumab versus mitomycin C adjunctive to trabeculectomy[J].
Am J Ophthalmol, 2012, 153(2): 352-7.
DOI: 10.1016/j.ajo.2011.08.005. |
| [22] |
Sengupta S, Venkatesh R, Ravindran RD. Safety and efficacy of using off-label bevacizumab versus mitomycin C to prevent Bleb failure in a single-site phacotrabeculectomy by a randomized controlled clinical trial[J].
J Glaucoma, 2012, 21(7): 450-9.
DOI: 10.1097/IJG.0b013e31821826b2. |
| [23] |
李中秋, 张孝生, 卢弘. 抗青光眼术后滤过泡瘢痕化组织人Tenon囊成纤维细胞的生长特性[J].
中华实验眼科杂志, 2014, 32(4): 308-12.
DOI: 10.3760/cma.j.issn.2095-0160.2014.04.005. |
| [24] |
Milani BY, Milani FY, Park D, et al. Rapamycin inhibits the production of myofibroblasts and reduces corneal scarring after photorefractive keratectomy[J].
Invest Ophthalmol Vis Sci, 2013, 54(12): 7424-30.
DOI: 10.1167/iovs.13-12674. |
| [25] |
Elsaid N, Somavarapu S, Jackson TL. Cholesterol- poly(ethylene) glycol nanocarriers for the transscleral delivery of sirolimus[J].
Exp Eye Res, 2014, 121: 121-9.
DOI: 10.1016/j.exer.2014.02.001. |
| [26] |
魏红领, 刘韶瑞, 陆宁. 雷帕霉素-壳聚糖-海藻酸钙缓释微球抑制青光眼滤过术区瘢痕增殖的实验研究[J].
眼科新进展, 2016, 36(2): 110-5.
|
| [27] |
周进, 赵朋. 白花蛇舌草对Renca肾癌细胞模型小鼠凋亡相关蛋白Fas、caspase3及caspase7表达影响[J].
中国生化药物杂志, 2016, 36(12): 37-40, 45.
|
| [28] |
张雁钦, 郑松志, 陶兰, 等. Caspase抑制剂的结构及合成[J].
化学进展, 2008, 20(1): 98-104.
|
| [29] |
周萍, 董晓先, 汤平. 桑根酮C通过激活caspase3及caspase9诱导前列腺癌PC3细胞凋亡[J].
南方医科大学学报, 2017, 37(9): 1206-10.
DOI: 10.3969/j.issn.1673-4254.2017.09.11. |
| [30] |
Huang JS, Yang CM, Wang JS, et al. Caspase- 3 expression in tumorigenesis and prognosis of buccal mucosa squamous cell carcinoma[J].
Oncotarget, 2017, 8(48): 84237-47.
|
| [31] |
邓海华, 马国祥, 丁西萍, 等. 雷帕霉素调剂对神经内分泌肿瘤组织中Caspase-9和Ki-67表达水平的影响[J].
中国实用神经疾病杂志, 2018, 12: 1303-8.
|
| [32] |
Nizeyimana H, Zhou DD, Liu XF, et al. Clinical efficacy of conjunctival flap surgery in the treatment of refractory fungal keratitis[J].
Exp Ther Med, 2017, 14(2): 1109-13.
DOI: 10.3892/etm.2017.4605. |
| [33] |
Zheng W, Qian Y, Chen S, et al. Rapamycin protects against peritendinous fibrosis through activation of autophagy[J].
Front Pharmacol, 2018, 9: 402.
DOI: 10.3389/fphar.2018.00402. |
 2018, Vol. 38
2018, Vol. 38

