结肠癌是目前世界上常见的消化道恶性肿瘤,发病率排行第3,死亡率排行第4。化疗是中晚期结肠癌主要的治疗手段。然而传统化疗手段预后不尽理想[1]。近年来分子靶向治疗成为治疗中晚期肿瘤治疗的研究热点。西妥昔单抗(C225,爱必妥TM)作为治疗中晚期结直肠癌的分子靶向药物获得了良好的疗效[2-4]。然而与传统化疗手段相似,西妥昔单抗药物在部分结直肠癌病人的治疗中存在严重的耐药[5]。研究证实,KRAS基因突变可能导致肿瘤对西妥昔单抗耐药。KRAS基因已作为西妥昔单抗靶向治疗预后的预测标志之一。研究证实,KRAS基因突变可能导致肿瘤对西妥昔单抗耐药。KRAS基因已作为西妥昔单抗靶向治疗预后的预测标志之一。然而,在临床诊疗中发现,仍然有众多KRAS基因野生型的患者对西妥昔单抗靶向治疗无效。可以推断,存在其他影响西妥昔单抗靶向药治疗效果的因素。探索研究结直肠癌患者对西妥昔单抗耐药的分子机制,对于临床诊疗活动中指导靶向药用药及预测患者预后具有积极意义。
去整合素-金属蛋白酶17(ADAM17)[6],已知它在许多恶性肿瘤如大肠癌中高度表达,在恶性肿瘤的发生发展中起着重要作用[7]。现有研究预测ADAM17的作用是通过水解剪切跨膜生长因子EGFR的膜外功能区。激活下游的信号通路从而发挥生物学作用[8-11]。而EGFR正是西妥昔单抗药物作用靶点。但目前ADAM17与结直肠癌对西妥昔单抗药物耐药的相关性尚不明确。本课题拟选用人结肠癌细胞株,干扰ADAM17表达,探索研究ADAM17的表达与结肠癌细胞对西妥昔单抗药物敏感性的影响,并进一步探讨其调控的分子机制。为临床指导西妥昔单抗靶向治疗结直肠癌提供新的思路及理论依据。
1 材料和方法 1.1 材料人结肠癌细胞株SW480、SW620、Lovo、HT116、HT29、174、RKO,人结肠上皮细胞株460,均保存于南方医科大学病理学系实验;lipofectamineTM3000,购自Invitrogen;胎牛血清和RPMI 1640细胞培养基,购自Gibco;细胞计数试剂盒8(cell counting kit-8, CCK-8)试剂盒购自中杉金桥生物技术有限公司;FITC/PI及7AAD/APC凋亡细胞染色试剂盒、BCA蛋白质定量试剂盒购自凯基生物技术有限公司;ADAM17、GAPDH抗体,购自Proteintech;GAPDH、EGFR、p-EGFR、Akt、p-Akt抗体,购自CST。
1.2 ADAM17-siRNA合成在NCBI数据库中获取人ADAM17 siRNA的序列,设计确定2对ADAM17siRNA序列,由吉凯基因有限公司合成(表 1)。
| 表 1 ADAM干扰片段siRNA序列 Table 1 SiRNA sequences for the target genes |
选取处于对数生长期的结肠癌细胞系,消化后接种于6孔板中。待细胞密度生长至80%时,加入1 mL PBS后轻刮下贴壁细胞,加入总蛋白裂解液冰上裂解30 min,离心收集上清液;总蛋白样品和5×loadingbuffer混匀,99 ℃煮沸5 min蛋白变性;制备10%分离胶和4%压缩胶,30 μg总蛋白加样器上样,压缩胶90 V电泳50 min,分离胶120 V电泳80 min;以0.45 μm的PVDF膜200 mA电流转膜60 min;用含5%脱脂奶粉的PBS-T封闭1 h;加入一抗,4 ℃孵育过夜;加入二抗,室温孵育60 min;ECL高敏显影液显影,成像分析系统拍照分析。
1.4 细胞培养及si-RNA干扰蛋白表达选取SW480细胞于含8%胎牛血清的RPMI 1640培养基,37 ℃、5% CO2培养箱内培养。SW480细胞转染ADAM17-siRNA,按LipofectamineTM 3000转染试剂盒说明书转染24 h。转染后收集提取总蛋白并行Western blot法检测结肠癌细胞系ADAM17蛋白表达。
1.5 西妥昔单抗诱导细胞凋亡并检测SW480细胞NC组以及转染了siRNA干扰片段的Si组接种于6孔板中,细胞贴壁后加入含有100 μg/mL西妥昔单抗的含8%胎牛血清RPMI 1640培养基,诱导24h。行FITC/PI染色后于流式细胞仪检测凋亡细胞比例。
1.6 Transwell检测结肠癌细胞迁移细胞技术板计数取SW480细胞NC组以及转染了siRNA-1干扰片段的Si组细胞各1×106个,含10%含牛血清的1640细胞培养基调整为100 μL后接种于Transwell小室上室。800 μL含20%牛血清的1640细胞培养基加入Transwell下室内。37 ℃、5% CO2细胞孵箱内培养24 h。24 h后取出小室,棉球擦去滤膜内侧细胞,甲醇固定,用Giemsa染料染色15 min。风干后显微镜下观察记录。
2 结果 2.1 结肠癌细胞系ADAM17表达情况利用Western blot法检测结肠癌细胞系,包括人结肠癌细胞HT29、HT116、174、SW480、SW620、Lovo、RKO细胞株,检测ADAM17蛋白表达结果可见,相较于其他结肠癌细胞株,SW480细胞株ADAM17高表达(图 1)。
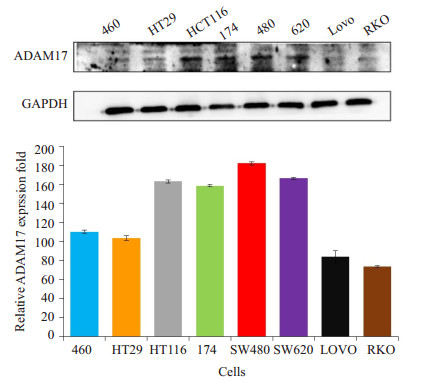
|
图 1 结肠癌细胞系中ADAM17的表达水平 Figure 1 Expression of ADAM17 in different colorectal cancer cell lines (n=7) |
通过以上实验,选择高表达ADAM17的SW480细胞株做siRNA干扰。SW480细胞株转染ADAM17- siRNA干扰片段1(Si-1)与干扰片段2(Si-2)后,Western blot法验证ADAM17蛋白表达,由图可见,siRNA干扰后,ADAM17表达显著降低(P < 0.005,图 2)。
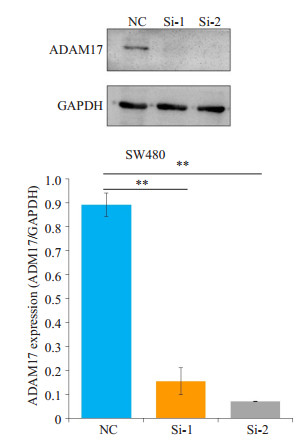
|
图 2 干扰ADAM17基因后ADAM17在480细胞株的表达 Figure 2 Relative expression of silencing ADAM17 in SW480 cells. **P < 0.005 |
SW480细胞株转染ADAM17-siRNA干扰片段24 h后,正常培养24 h,7-AAD/APC染色后行流式细胞仪检测,由图 3A可见,在未给予试剂诱导凋亡时,Si组与对照组细胞凋亡率无差异。
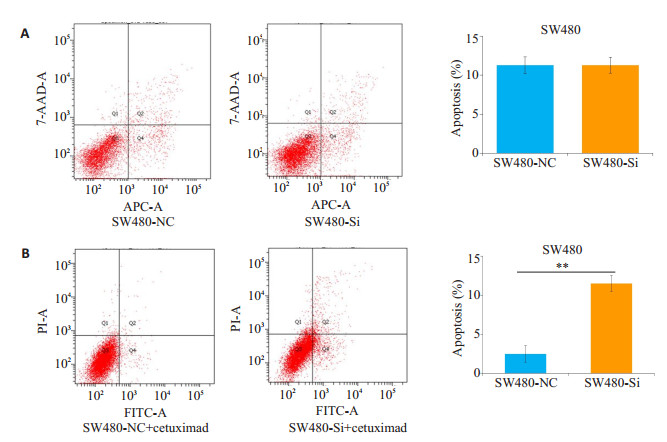
|
图 3 干扰ADAM17表达后SW480细胞凋亡情况 Figure 3 Apoptosis of SW480 cells with ADAM17 knockdown in response to cetuximad treatment. A: Cells without tocetuximad treatment; B: Cells with tocetuximad treatment. **P < 0.005 |
SW480细胞株转染ADAM17-siRNA干扰片段24 h后,予100 μg/mL含西妥昔单抗的完全细胞培养基诱导细胞凋亡。诱导24 h,FITC/PI染色后行流式细胞仪检测,由图 3B可见,西妥昔单抗药物诱导,干扰了ADAM17表达的Si组细胞凋亡率远高于对照组NC,差异具有统计学意义(P < 0.005)。
2.4 干扰ADAM17表达后SW480细胞迁移能力降低SW480细胞株转染ADAM17-siRNA干扰片段24 h,分别予正常细胞培养基和含有100 μg/mL含西妥昔单抗的细胞培养基处理细胞8 h后,计数后接种1×106个细胞于Transwell上室行细胞迁移实验。细胞孵箱内培养24 h后固定、染色,40倍光镜下选择视野内上下左右中5个不同视野的细胞数,求平均值。结果如图 4,在正常细胞培养基中,对照组SW480-NC与实验组SW480-Si穿过小室滤膜细胞数分别为67.5 ± 11.80和47.75 ± 11.61,组间比较无统计学差异(P > 0.05)。ADAM17干扰后,结肠癌SW480细胞细胞迁移能力无显著差异。在含有西妥昔单抗的细胞培养基处理后,对照组SW480-NC+cetuximad与实验组SW480-Si+cetuximad穿过小室滤膜细胞数分别为64.25±6.06和10.25±2.00,组间比较具有统计学差异(P < 0.005)。干扰ADAM17表达后,在西妥昔单抗作用下,结肠癌SW480细胞迁移显著降低(图 4)。
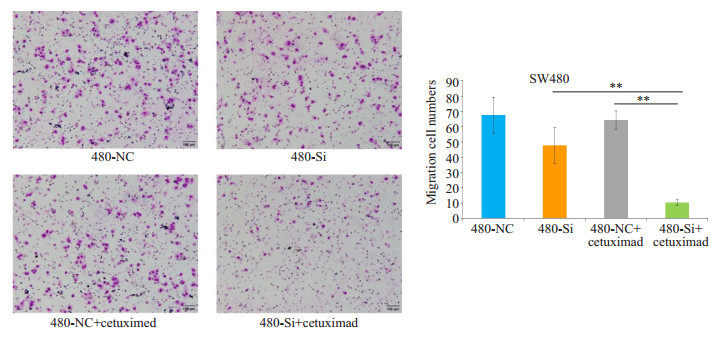
|
图 4 ADAM表达促进SW480细胞迁移增多 Figure 4 Migration of SW480 cells withADAM17 knockdown with or without cetuximad treatment. **P < 0.005 |
选择ADAM17-siRNA-1作为干扰片段。SW480细胞株瞬时转染ADAM17-siRNA-1干扰片段24 h后,分别予正常细胞培养基和含有100 μg/mL含西妥昔单抗的细胞培养基培养细胞24 h。提取细胞总蛋白,Western blot法验证ADAM17、EGFR、p-EGFR、AKT、p-AKT蛋白表达。如图 5,干扰了ADAM17表达后,无论是否给予西妥昔单抗药物作用,SW480-Si组的p-EGFR、p-AKT较对照组NC组显著下降,差异具有统计学意义(P < 0.001)。
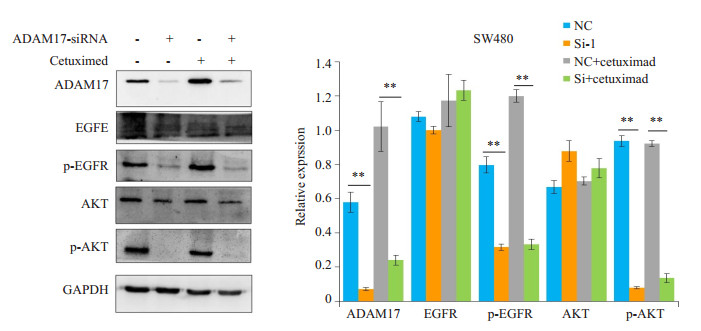
|
图 5 干扰ADAM17表达抑制了EGFR/AKT通路的激活 Figure 5 Knockdown of ADAM17 in SW480 cells enhances the inhibitory effect of cetuximab on EGFR/AKT signaling pathway. **P < 0.001 |
西妥昔单抗是治疗中晚期结直肠癌的一个重大突破,作为中晚期结直肠癌的分子靶向药物在临床诊疗中获得了良好的疗效。然而部分结直肠癌病人严重的药物耐药影响了西妥昔单抗靶向治疗效果。本课题通过构建干扰ADAM17表达的siRNA片段,成功下调ADMA17表达后,西妥昔单抗诱导细胞凋亡。通过流式细胞仪检测证实,下调ADAM17表达的实验组SW480-Si细胞经西妥昔单抗药物处理后,凋亡细胞比例较对照组显著上升。实验结果提示,在下调ADAM17表达的结肠癌SW480-Si细胞,对西妥昔单抗药物敏感性较空白对照组更高。同时,Transwell实验证实,在西妥昔单抗药物作用下,穿过Transwell小室滤膜的细胞较对照组细胞显著减少,细胞迁移能力随着ADAM17的下调而降低。以上结果提示,干扰结肠癌细胞ADAM17的表达,可提高结肠癌细胞对西妥昔单抗药物敏感性,降低耐药。ADAM17的表达可介导结肠癌细胞对西妥昔单抗耐药。目前已有的研究显示,Akt是EGFR下游信号传导通路中的重要分子[12-13],EGFR与配体结合,酪氨酸蛋白激酶激活引起的级联反应可通过Akt信号通路途径引起进一步的生物学反应[14],促进肿瘤的发生发展。西妥昔单抗与EGFR特异性结合后,抑制受体活化,阻断了下游AKT信号通路的激活[15-17]。为了进一步验证ADAM17是否异常激活EGFR及下游AKT信号通路从而调控结肠癌细胞对西妥昔单抗耐药,本课题利用Western blot检测干扰了ADAM17表达的结肠癌细胞SW480-Si组的EGFR、AKT蛋白表达以及激活情况。我们发现p-EGFR、p-AKT表达随着ADAM17被干扰而显著下降。EGFR的激活及下游AKT信号通路的活化与ADAM17的表达呈正相关,进一步验证ADAM17的表达与结肠癌SW480细胞对西妥昔单抗靶向药的耐药呈正相关。
西妥昔单抗于2004年被FDA批准用于治疗中晚期结直肠癌,其在临床治疗中,获得显著的疗效[18]。临床研究显示,伊立替康治疗无效的中晚期结肠癌患者,西妥昔单抗单独使用,患者疾病进展期从1.5月增加至4.1月[3];西妥昔单抗与伊立替康联合治疗,有效延长无进展生存期和总生存期[19]。然而早期的临床试验中,单用靶向EGFR抗体只对10%~20%中晚期结直肠癌患者有效,部分患者存在对西妥昔单抗耐药。提示存在先天性或后天性因素影响西妥昔单抗治疗效果。因此,探索西妥昔单抗的耐药机制并找到解决方案成为提高其疗效的重中之重。
Lièvre等[20]研究首先发现KRAS基因为突变型的患者对西妥昔单抗靶向药物治疗产生耐药,Di Fiore等[21]通过对西妥昔单抗耐药的结直肠癌患者研究,证实KRAS基因突变与西妥昔单抗靶向药的耐药密切相关。后续研究证实了这一点[22-23]。目前已经明确的是,KRAS基因突变是靶向EGFR的西妥昔单抗的原发耐药机制之一,以KRAS基因突变作为靶向EGFR单克隆抗体的疗效预测因子[24-25]。尽管通过KRAS基因突变检测,能更加合理指导用药[26]。然而在临床诊疗过程中发现,虽然KRAS基因已作为西妥昔单抗靶向治疗的预测标志因子,仍仅有40%有效率。提示仍有其他耐药机制存在。因此可以推断,存在其他影响西妥昔单抗靶向药治疗效果的因素。
目前大量关于靶向EGFR单克隆抗体耐药分子机制的研究均集中于EGFR下游信号通路关键转导因子的改变,如KRAS基因的第2外显子突变、PI3K的第20外显子突变等,针对EGFR上游影响因子的研究较少[27]。通过大量文献调研后我们发现,ADAM17蛋白在结肠癌组织中显著高表达,并与结肠癌的转移、预后等密切相关[28-29]。据报道,ADAM17蛋白通过Notch、PI3K/Akt等多条信号通路调控肿瘤细胞的生物学行为[15-16, 30]。ADAM17,通过水解、剪切、脱落细胞膜表面的TGF-α等配体并且与EGFR结合而激活EGFR[31],进一步激活下游细胞信号通路,进而影响肿瘤的发展[32-33]。而EGFR作为西妥昔单抗作用靶点,ADAM17的活化与结直肠癌细胞对西妥昔单抗靶向作用的相关性尚不清楚。因此,我们通过实验验证ADAM17与结肠癌细胞对西妥昔单抗耐药的关系。筛选高表达ADAM17的结肠癌细胞系,采用小片段siRNA干扰技术,干扰结肠癌SW480细胞ADAM17蛋白的表达,西妥昔单抗药物作用后验证细胞凋亡、迁移改变,从而证实干扰结肠癌细胞ADAM17的表达,可提高结肠癌细胞对西妥昔单抗药物敏感性,降低耐药。为验证ADAM17异常激活EGFR及下游AKT信号通路,本课题利用Western blot检测发现p-EGFR、p-AKT表达随着ADAM17被干扰而显著下降。EGFR的激活及下游AKT信号通路的活化与ADAM17的表达呈正相关,进一步验证ADAM17的表达与结肠癌SW480细胞对西妥昔单抗靶向药的耐药呈正相关。
综上所述,ADAM17的表达通过异常活激活结肠癌SW480细胞的EGFR进而活化AKT信号传导通路,促使结肠癌细胞对西妥昔单抗靶向药物耐药。随着研究的深入,我们相信ADAM17的功能及其作用机制将更加明了,这也将为临床指导及预测EGFR靶向治疗提供一个新的思路以及理论依据。
| [1] |
Meyerhardt JA, Mayer RJ. Systemic therapy for colorectal Cancer[J].
N Engl J Med, 2005, 352(5): 476-87.
DOI: 10.1056/NEJMra040958. |
| [2] |
Saltz LB, Meropol NJ, Loehrer PJ, et al. Phase Ⅱ trial of cetuximab in patients with refractory colorectal cancer that expresses the epidermal growth factor receptor[J].
J Clin Oncol, 2004, 22(7): 1201-8.
DOI: 10.1200/JCO.2004.10.182. |
| [3] |
Cunningham D, Humblet Y, Siena S, et al. Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer[J].
N Engl J Med, 2004, 351(4): 337-45.
DOI: 10.1056/NEJMoa033025. |
| [4] |
Sobrero AF, Maurel J, Fehrenbacher LA, et al. EPIC: phase Ⅲ trial of cetuximab plus irinotecan after fluoropyrimidine and oxaliplatin failure in patients with metastatic colorectal cancer[J].
J Clin Oncol, 2008, 26(14): 2311-9.
DOI: 10.1200/JCO.2007.13.1193. |
| [5] |
Katsila T, Juliachs M, Gregori J, et al. Circulating pEGFR is a candidate response biomarker of cetuximab therapy in colorectal cancer[J].
Clin Cancer Res, 2014, 20(24): 6346-56.
DOI: 10.1158/1078-0432.CCR-14-0361. |
| [6] |
Mullooly M, Mcgowan PM, Crown J, et al. The ADAMs family of proteases as targets for the treatment of cancer[J].
Cancer Biol Ther, 2016, 17(8): 870-80.
DOI: 10.1080/15384047.2016.1177684. |
| [7] |
Garton KJ, Gough PJ, Blobel CP, et al. Tumor necrosis factor-alphaconverting enzyme (Adam17) mediates the cleavage and shedding of fractalkine (CX3CL1)[J].
J Biol Chem, 2001, 276(41): 37993-8001.
|
| [8] |
Xu M, Zhou HL, Zhang CL, et al. Adam17 promotes epithelialmesenchymal transition via TGF-beta/Smad pathway in gastric carcinoma cells[J].
Int J Oncol, 2016, 49(6): 2520-8.
DOI: 10.3892/ijo.2016.3744. |
| [9] |
Oikawa H, Maesawa C, Tatemichi YA, et al. A disintegrin and metalloproteinase 17 (Adam17) mediates epidermal growth factor receptor transactivation by angiotensin Ⅱ on hepatic stellate cells[J].
Life Sci, 2014, 97(2): 137-44.
DOI: 10.1016/j.lfs.2013.12.028. |
| [10] |
Shen HY, Li LP, Zhou SY, et al. The role of Adam17 in tumorigenesis and progression of breast cancer[J].
Tumour Biol, 2016, 37(12): 15359-70.
DOI: 10.1007/s13277-016-5418-y. |
| [11] |
姜颖, 刘紫君, 林平, 等. ADAM17对前列腺癌细胞TGF-α、EGFR的表达影响[J].
山东医药, 2015, 55(26): 1-4.
DOI: 10.3969/j.issn.1002-266X.2015.26.001. |
| [12] |
Hawley SA, Ross FA, Gowans GJ, et al. Phosphorylation by Akt within the ST loop of AMPK-alpha 1 down-regulates its activation in tumour cells[J].
Biochem J, 2014, 459(2): 275-87.
|
| [13] |
Kanda S, Kanetake H, Miyata Y. Loss of PTEN function May account for reduced proliferation pathway sensitivity to LY294002 in human prostate and bladder cancer cells[J].
J Cancer Res Clin Oncol, 2009, 135(2): 303-11.
DOI: 10.1007/s00432-008-0465-4. |
| [14] |
Kenny PA, Lee GY, Bissell MJ. Targeting the tumor micro= environment[J].
Front Biosci, 2007, 12(7): 3468-74.
|
| [15] |
Groot AJ, Cobzaru C, Weber S, et al. Epidermal Adam17 is dispensable for notch activation[J].
J Invest Dermatol, 2013, 133(9): 2286-8.
DOI: 10.1038/jid.2013.162. |
| [16] |
Dosch J, Ziemke E, Wan SS, et al. Targeting Adam17 inhibits human colorectal adenocarcinoma progression and tumor-initiating cell frequency[J].
Oncotarget, 2017, 8(39): 65090-9.
|
| [17] |
Wang XJ, Feng CW, Li M. Adam17 mediates hypoxia-induced drug resistance in hepatocellular carcinoma cells through activation of EGFR/PI3K/Akt pathway[J].
Mol Cell Biochem, 2013, 380(1/2): 57-66.
|
| [18] |
Cheng CJ, Bahal R, Babar IA, et al. MicroRNA silencing for cancer therapy targeted to the tumour microenvironment[J].
Nature, 2015, 518(7537): 107-10.
DOI: 10.1038/nature13905. |
| [19] |
García-Alfonso P, Ferrer A, Gil S, et al. Neoadjuvant and conversion treatment of patients with colorectal liver metastasis: the potential role of bevacizumab and other antiangiogenic agents[J].
Target Oncol, 2015, 10(4): 453-65.
DOI: 10.1007/s11523-015-0362-0. |
| [20] |
Lièvre A, Bachet JB, Le Corre D, et al. KRAS mutation status is predictive of response to cetuximab therapy in colorectal cancer[J].
Cancer Res, 2006, 66(8): 3992-5.
DOI: 10.1158/0008-5472.CAN-06-0191. |
| [21] |
Di Fiore F, Blanchard F, Charbonnier F, et al. Clinical relevance of KRAS mutation detection in metastatic colorectal cancer treated by cetuximab plus chemotherapy[J].
Br J Cancer, 2007, 96(8): 1166-9.
DOI: 10.1038/sj.bjc.6603685. |
| [22] |
Morgan SR, Whiteley J, Donald E, et al. Comparison of KRAS mutation assessment in tumor DNA and circulating free DNA in plasma and serum samples[J].
Clin Med Insights Pathol, 2012, 5(3): 15-22.
|
| [23] |
Thierry AR, Mouliere F, El Messaoudi S, et al. Clinical validation of the detection of KRAS and BRAF mutations from circulating tumor DNA[J].
Nat Med, 2014, 20(4): 430-5.
DOI: 10.1038/nm.3511. |
| [24] |
Sato K, Watanabe R, Hanaoka H, et al. Photoimmunotherapy: comparative effectiveness of two monoclonal antibodies targeting the epidermal growth factor receptor[J].
Mol Oncol, 2014, 8(3): 620-32.
DOI: 10.1016/j.molonc.2014.01.006. |
| [25] |
Peeters M, Price T, Van Laethem JL. Anti-rpidermal growth factor receptor monotherapy in the treatment of metastatic colorectal vancer: where are we yoday?[J].
Oncologist, 2009, 14(1): 29-39.
DOI: 10.1634/theoncologist.2008-0167. |
| [26] |
Szpechcinski A, Chorostowska-Wynimko J, Struniawski R, et al. cell-free DNA levels in plasma of patients with non-small-cell lung cancer and inflammatory lung disease[J].
Br J Cancer, 2015, 113(3): 476-83.
DOI: 10.1038/bjc.2015.225. |
| [27] |
Musella V, Pietrantonio F, Di Buduo E, et al. Circulating tumor cells as a longitudinal biomarker in patients with advanced chemorefractory, RAS-BRAF wild-type colorectal cancer receiving cetuximab or panitumumab[J].
Int J Cancer, 2015, 137(6): 1467-74.
DOI: 10.1002/ijc.29493. |
| [28] |
Narita D, Seclaman E, Ursoniu S, et al. Increased expression of Adam12 and Adam17 genes in laser-capture microdissected breast cancers and correlations with clinical and pathological characteristics[J].
Acta Histochem, 2012, 114(2): 131-9.
DOI: 10.1016/j.acthis.2011.03.009. |
| [29] |
张琪, 杨光华, 刘少鹏. ADAM17-shRNA通过Akt/GSK3β信号通路促进HT29结肠癌细胞的凋亡[J].
中国普外基础与临床杂志, 2018, 25(5): 534-9.
|
| [30] |
Chiara F, Rasola A. GSK-3 and mitochondria in cancer cells[J].
Front Oncol, 2013, 35(5): 16.
|
| [31] |
Sokolosky M, Chappell WH, Stadelman KA, et al. Inhibition of GSK- 3 beta activity can result in drug and hormonal resistance and alter sensitivity to targeted therapy in MCF-7 breast cancer cells[J].
Cell Cycle, 2014, 13(5): 820-33.
DOI: 10.4161/cc.27728. |
| [32] |
Rios-Doria J, Sabol D, Chesebrough J, et al. A monoclonal antibody to adam17 inhibits tumor growth by inhibiting EGFR and nonEGFR-mediated pathways[J].
Mol Cancer Ther, 2015, 14(7): 1637-49.
DOI: 10.1158/1535-7163.MCT-14-1040. |
| [33] |
Meng XC, Hu BS, Hossain MM, et al. Adam17-siRNA inhibits MCF- 7 breast cancer through EGFR-PI3K-AKT activation[J].
Int J Oncol, 2016, 49(2): 682-90.
DOI: 10.3892/ijo.2016.3536. |
 2018, Vol. 38
2018, Vol. 38

