2. 广州市皮肤病防治所皮肤科,广东 广州 510095
2. Department of Dermatology, Guangzhou Institute of Dermatology, Guangzhou 510095, China
黑素瘤是一类起源于黑色素细胞的高度恶性皮肤肿瘤[1-3]。2011年的统计结果显示,我国黑素瘤的死亡率和发生率的比值为0.41[4]。另外,黑素瘤的发生率和死亡率正分别以每年5%和2%的速度增加[1]。虽然大部分早期黑素瘤患者可以外科手术的方式治愈,但晚期恶性黑素瘤患者的5年生存率仅为5%左右[3]。在因皮肤癌引起的死亡人数中,黑素瘤高达75%[5]。因此,阐明黑素瘤的发生、发展、侵袭等机制,将对有效控制黑素瘤发展、靶向治疗及改善预后有十分重要的意义。
越来越多的研究表明,miRNAs以癌基因或抑癌基因的角色参与多种恶性肿瘤的发生和发展过程[6-12]。最近研究发现[13],miR-122-5p在黑素瘤患者血清中显著高表达,提示miR-122-5p可能在黑素瘤的发生发展中发挥作用。另有报道表明,miR-122-5p在其他肿瘤的发生发展中发挥重要的作用[14-22]。如在胃癌、肝癌和肺癌细胞中,过表达miR-122-5p可抑制胃癌细胞的增殖、迁移和侵袭能力,同时可以诱导细胞凋亡的发生[15-16, 20-22]。另外,虽然已知miR-122-5p在调控肿瘤的发生发展中发挥重要作用,但其在黑素瘤中的作用及相关的调控机制尚不清楚。本文将首次研究确定miR-122-5p在人黑素瘤组织中的表达情况,分析miR-122-5p是否调节人黑素瘤细胞系SK-MEL-110和A375的增殖、凋亡和周期变化,并探讨相关的调控机制。
1 材料和方法 1.1 临床资料收集2015年1月~2017年12月在广州市第一人民医院皮肤科门诊、广州市皮肤病防治所皮肤科门诊就诊,病理确诊的黑素瘤患者的黑素瘤组织作为实验组,取正常者病理确诊的色素痣组织作为对照组,实验组和对照组各30例。
1.2 材料与试剂293T细胞株、人黑素瘤细胞株SK-MEL-110和A375细胞购自中国科学院典型培养物保藏委员会细胞库;RPMI 1640、胎牛血清、青霉素、链霉素、Trizol和RNA酶抑制剂(Invitrogen);茎环法逆转录试剂盒(生工);SYBR Green PCR Master Mix TAKARA;psiCHECH2双荧光素酶报告基因质粒普洛麦格;脂质体(LipofectamineTM 2000 Life technologies);NOP14抗体、GAPDH抗体及二抗(abcam);miR-122-5p(inhibitor)、内参U6逆转录及PCR引物(锐博)。荧光定量PCR仪7500 Seqtence Detection System(ABI PRISM®)。
1.3 方法 1.3.1 RNA提取及逆转录取20 mg左右组织标本,液氮充分研磨,用Trizol试剂盒提取总RNA。应用茎环法进行逆转录。配制逆转录体系:1 μg总RNA,10 mmol/L dNTP 2 μL,RNase inhibitor 0.5 μL,miR-122-5p逆转录引物0.5 μL,U6逆转录引物0.5 μL,5×buffer 4 μL,M-MLV 0.5 μL,加入适量ddH2O至20 μL。轻轻混匀离心3~5 s,16 ℃孵育30 min;37 ℃孵育30 min,85 ℃孵育10 min灭活逆转录酶,4 ℃保存待用。
Trizol试剂盒提取各组细胞的总RNA,并应用Oligo(dT)作为逆转录的引物进行逆转,将获得的cDNA用于检测NOP14的mRNA的表达水平。
1.3.2 Real time PCR检测配制PCR反应体系:加入cDNA 5.0 μL,上游引物0.5 μL,下游引物0.5 μL,2× SYBR Green PCR Master Mix 10 μL,加入适量的H2O至20 μL。反应条件为:95 ℃预变性5 min,然后95℃ 15 s,65℃ 15 s,72 ℃ 32 s反应40个循环。融解曲线分析温度为60~95 ℃。复孔为3。采用2-△△Ct法[23]计算miR-122-5p和NOP14的相对表达量。
1.3.3 细胞培养及转染在37 ℃、5% CO2的条件下用含10%胎牛血清的RPMI 1640培养基培养人黑素瘤细胞系SK-MEL-110和A375。当细胞密度约50%~60%时,进行转染,转染过程根据Lipofectamine 2000说明进行操作。
1.3.4 MTT检测细胞增殖培养人黑素瘤细胞株SKMEL-110和A375细胞,当细胞密度约50%~60%时分别转染miR-122-5p inhibitor及negative control inhibitor(NC),每组设置5个平行样,分别于0、24、48、72 h各时间点的细胞加入MTT,比例为1:10,即100 μL培养液加入10 μL检测液;在37 ℃、5% CO2培养箱中培养4 h;吸弃培养上清液,避免吸去紫色结晶;每孔加150 μL DMSO,振荡10 min,使结晶物充分溶解;选择490 nm波长,在酶联免疫监测仪上测定各孔光吸收值,记录结果,以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
1.3.5 流式细胞仪检测细胞凋亡及细胞周期培养人黑素瘤细胞株SK-MEL-110和A375细胞,当细胞密度约50%~60%时,分别转染miR-122-5p inhibitor及阴性对照组,然后用胰酶消化细胞,再用预冷的磷酸盐缓冲液(PBS)清洗细胞,离心弃上清。
细胞凋亡的检测:用1×PBS轻轻重悬细胞,使其密度约1×106/mL。加入1.25 μL Annexin V-FITC,室温避光反应15 min。1000×g离心5 min,弃上清。再用0.5 mL预冷的1×PBS轻轻重悬细胞,加入10 μL碘化丙锭(Propidium Iodide, PI),将样品置于冰上避光保存,并立即用流式细胞仪检测分析。
细胞周期检测:用0.5 mL PBS重悬细胞,迅速加入3.5 mL70%预冷的乙醇,吹打混匀。300×g离心10 min,弃上清,PBS洗涤细胞3次。用含有0.2 mg Rnase A的1 mL碘化丙锭/TritonX-100染色液重悬细胞,37 ℃染色10 min,立即用流式细胞仪分析。
1.3.6 荧光素酶报告基因检测采用Targetscan(www.targetscan.org/)和miRanda(www.microrna.org)在线预测软件预测miR-122-5p与NOP14(nucleolar protein 14)的结合位点。常规PCR方法扩增NOP14 3'UTR(NM_ 001291978)的全长序列,构建到荧光素酶报告基因载体psi-CHECK2上,并命名为:野生型psi-CHECK2-3'UTR。利用PCR点突变的方法构建miR-122-5p结合位点突变的荧光素酶报告基因载体,并命名为突变型psi-CHECK2-3'UTR。实验分组:miR-122-5p mimics联合野生型psi-CHECK2-3'UTR组、NC mimics联合野生型psi-CHECK2-3'UTR组、miR-122-5p mimics联合突变型psi-CHECK2-3'UTR组、NC mimics联合突变型psi-CHECK2-3'UTR组。按照以上分组转染293T细胞,转染试剂选用Lipofectamine 2000,根据操作说明书进行相应操作。转染细胞48 h后,用双荧光素酶报告系统试剂盒检测荧光素酶活性。
1.3.7 Western blot检测NOP14表达转染48 h后收集细胞样品,用RIPA裂解液裂解细胞,BCA法检测细胞中蛋白浓度,按照总蛋白一致的原则上样,10%分离胶进行SDS-PAGE电泳;300 mA湿转100 min,5%脱脂奶粉溶液37 ℃封闭1 h;TBST洗膜3次,10 min/次,NOP14一抗(1:5000)或者GAPDH(1:10 000)37 ℃孵育1 h;TBST洗膜3次,10 min/次,二抗羊抗兔(1:10 000)37 ℃孵育1 h;TBST洗膜3次,10 min/次,暗室曝光。
1.4 统计学处理应用SPSS 17.0软件对数据进行统计分析,计量资料以均数±标准差表示,两组之间比较采用独立t检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 miR-122-5p在黑素瘤与色素痣组织中表达荧光定量PCR检测黑素瘤与色素痣组织中miR- 122-5p的表达水平,结果显示在人色素痣和黑素瘤组织中miR-122-5p中的相对表达量为1.23±0.270和7.65± 1.37。与色素痣组织相比,黑素瘤组织中miR-122-5p的表达显著升高(P < 0.001)。
2.2 抑制miR-122-5p表达对SK-MEL-110和A375细胞增殖的影响为了明确miR-122-5p在黑素瘤中的作用,采用miR-122-5p inhibitor转染SK-MEL-110和A375细胞。荧光定量PCR结果显示,转染miR-122-5p inhibitor后,miR-122-5p在SK-MEL-110和A375细胞中的相对表达量分别为0.21±0.08和0.17±0.05。说明miR-122-5p inhibitor可以明显抑制SK-MEL-110和A375细胞中miR-122-5p的表达(P < 0.001,图 1A)。随后,利用MTT法检测,抑制miR-122-5p表达对SK-MEL-110和A375细胞的增殖的影响。结果表明,与NC相比,miR-122- 5p inhibitor可以明显抑制SK-MEL-110和A375细胞的生长(图 1B,C)。
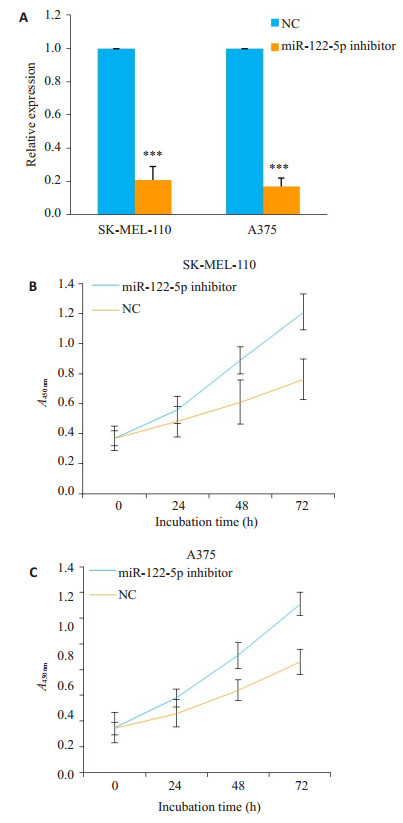
|
图 1 miR-122-5p inhibitor对SK-MEL-110和A375细胞的增殖的影响 Figure 1 Effect of miR-122-5p inhibitor on the proliferation of SK-MEL-110 and A375 cells. A: Relative miR-122-5p expression levels in the cells transfected with miR-122- 5p inhibitor or NC; B, C: Cell growth curve plotted according to OD value after transfection with miR-122- 5p inhibitor or NC. ***P < 0.01 vs NC group |
为了分析miR-122-5p inhibitor抑制SK-MEL-110和A375细胞生长的原因,流式细胞仪分析了miR-122- 5p inhibitor转染对SK-MEL-110和A375细胞周期和凋亡的影响。结果显示,与NC相比,转染miR-122-5p inhibitor明显增加SK-MEL-110和A375细胞G1期细胞的比例,出现明显的G1期阻滞现象(图 2)。另外,转染miR-122-5p inhibitor对SK-MEL-110和A375细胞的凋亡水平没有明显的影响(图 3)。
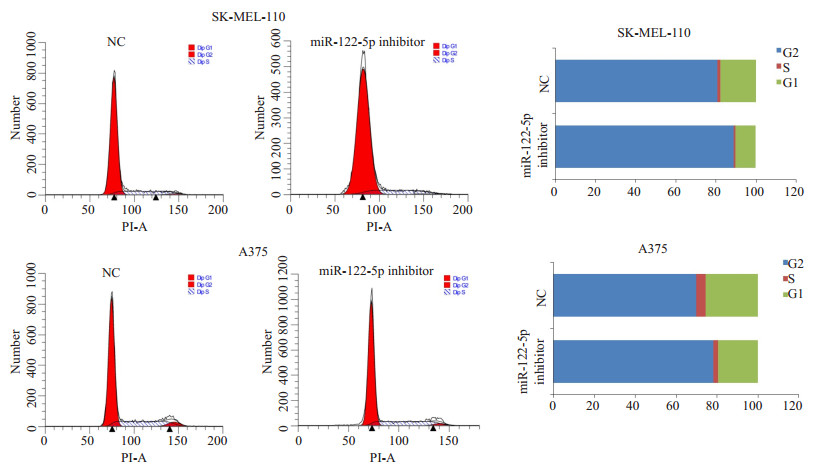
|
图 2 miR-122-5p inhibitor对SK-MEL-110和A375细胞周期的影响 Figure 2 Effect of miR-122-5p inhibitor on cell cycle of SK-MEL-110 andA375 cells |
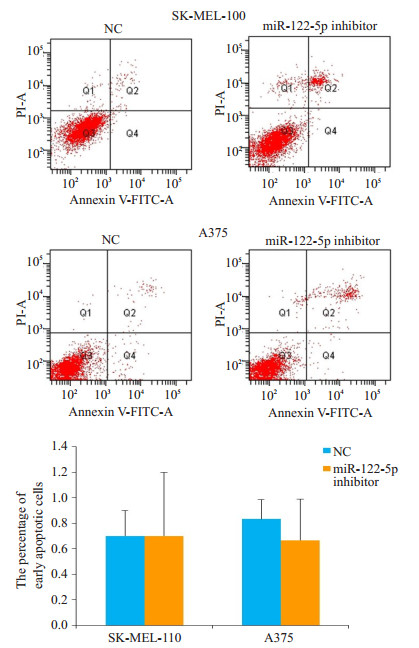
|
图 3 抑制miR-122-5p表达对SK-MEL-110和A375细胞凋亡的影响 Figure 3 Effect of miR-122-5p inhibitor on apoptosis of SKMEL-110 andA375 cells |
通过miRanda和Targetscan在线预测软件预测分析出miR-122-5p mimics和NOP14的3'UTR存在结合位点,结合信息见图 4A。双荧光报告基因结果显示,与NC mimics联合野生型3'UTR组相比,在293T细胞中共转染miR-122-5p mimics和野生型psi-CHECK2- 3'UTR质粒,其相对荧光素酶活性为0.21±0.14,较NC和野生型psi-CHECK2-3'UTR质粒转染组(0.56±0.1)明显下降,差异有统计学意义(P < 0.01)。而将NOP14 mRNA 3'UTR报告基因上miR-122-5p的结合位点进行突变后,转染miR-122-5p mimics对含突变型NOP14 mRNA 3'UTR报告基因的荧光素酶表达无明显的影响(P > 0.05,图 4B)。以上结果说明,miRNA靶基因预测软件预测的NOP14 mRNA 3'UTR上的miR-122-5p结合位点可以和miR-122-5p结合,从而影响荧光素酶的表达。
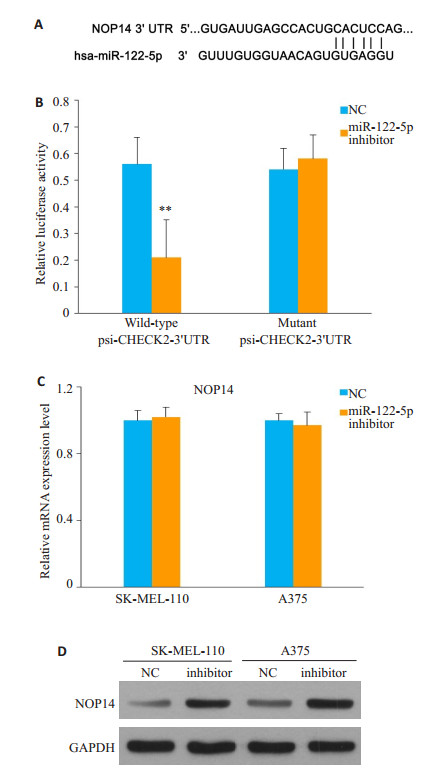
|
图 4 miR-122-5p靶向调控NOP14 Figure 4 NOP14 is a direct target of miR-122-5p. A: Diagram showing miR-122-5p binding site on the 3'UTR of NOP14; B: Effect of miR-122-5p transfection on relative luciferase activity of luciferase reporter vector that containing wildtype or mutant 3'UTR of NOP14; C, D: Effect of miR-122-5p inhibitor or NC transfection on NOP14 mRNA and protein expression |
采用荧光定量PCR和Western印迹法检测过表达miR-122-5p inhibitor对NOP14表达的影响。过表达miR-122-5p inhibitor后,NOP14的mRNA的表达水平未出现明显变化(P > 0.05,图 4C)。图 5D示,miR-122-5p inhibitor对NOP14的蛋白水平的表达有明显的促进。
3 讨论miRNA以癌基因或抑癌基因的角色参与多种恶性肿瘤的发生和发展过程[6-10]。本研究中发现miR-122-5p在黑素瘤组织样品中呈显著高表达,提示miR-122-5p可能参与黑素瘤的发生发展。为了进一步研究miR- 122-5p可能在黑素瘤中发挥的作用,本研究选择人黑素瘤细胞系SK-MEL-110和A375细胞作为研究对象。研究中发现转染miR-122-5p inhibitor后能显著性抑制人黑素瘤细胞系SK-MEL-110和A375细胞的生长,同时使G1期细胞比例明显增加,出现了G1期阻滞,但miR- 122-5p inhibitor对SK-MEL-110和A375细胞的凋亡没有明显的影响。因此本研究推测,miR-122-5p通过影响SK-MEL-110和A375细胞的周期变化促进人黑素瘤细胞的生长,miR-122-5p inhibitor可以改变这现象,可能成为潜在的人黑素瘤的治疗策略,但miR-122-5p在人其他肿瘤中的作用与本文的报道存在异同。本文的结果提示,miR-122-5p inhibitor抑制SK-MEL-110和A375细胞的生长,提示发挥癌基因在作用。在人胃癌和乳腺癌细胞中,miR-122-5p过表达抑制细胞的生长、迁移和侵袭,发挥抑癌基因的作用[15-16]。但在人透明细胞肾细胞癌中,miR-122-5p过表达却促进细胞的迁移和侵袭,发挥癌基因的作用[14]。因此,miR-122-5p在不同的癌细胞中可能发挥不同的作用,深入探讨miR- 122-5p的作用对于确定其的靶向治疗作用尤其重要。本研究将进一步通过增加细胞系的数量和加入体内实验的方法明确miR-122-5p在人黑素瘤发生发展中的作用。
microRNAs通过与靶基因3'UTR完全或不完全配对的方式,降解靶基因mRNA或抑制其翻译[6, 15, 25],进而发挥调控作用。因此,鉴定miRNAs的靶基因的对于阐明其的调控作用尤其重要。NOP14是一种含有857aa的核蛋白,其功能在真核生物中十分保守。NOP14是40 s核糖体成熟所必需的蛋白质[26]。在生物体内,热应激能够导致NOP14 mRNA表达量的急剧下降,从而降低40 s核糖体亚基的水平[27]。最近的研究发现NOP14在调控肿瘤的发生发展中发挥重要作用[28-32]。生物信息学预测发现NOP14的3'UTR位置存在miR-122-5p的结合位点,可能是miR-122-5p的潜在下游靶基因。因此,本文将着重研究miR-122-5p的NOP14的靶向调控关系。荧光素酶报告的结果显示,转染miR-122-5p mimics可以降低含NOP14野生型3'UTR质粒的相对荧光素酶值,提示NOP14 mRNA 3'UTR上的miR-122-5p结合位点可以和miR-122-5p结合。另外,荧光定量PCR和Western blot的结果显示,miR-122-5p inhibitor仅可以促进NOP14的蛋白水平,对mRNA表达水平没有影响。因此,本研究推测,miR-122-5p可能通过影响NOP14翻译的方式抑制NOP14蛋白的表达。但miR-122-5p是否通过NOP14调控黑素瘤细胞的发生仍需要进一步的探讨。
总之,本研究发现miR-122-5p在黑素瘤组织中高表达。另外,本研究发现miR-122-5p inhibitor抑制黑素瘤细胞系SK-MEL-110和A375细胞的增殖。NOP14是miR-122-5p的靶基因之一,miR-122-5p有可能通过抑制NOP14的蛋白水平的方式发挥癌基因的作用。虽然本文的结论需要更多的体内实验验证,但本文的结果为更好的理解黑素瘤的发生发展过程提供了更多的理论依据,并为黑素瘤的基因靶向治疗提供更好的参考靶点,为黑素瘤的治愈带来新的曙光。
| [1] |
Owens B. Melanoma[J].
Nature, 2014, 515(7527): S109.
DOI: 10.1038/515S109a. |
| [2] |
Situm M, Buljan M, Kolic M, et al. Melanoma-clinical, dermatoscopical, and histopathological morphological characteristics[J].
Acta Dermatovenerol Croat, 2014, 22(1): 1-12.
|
| [3] |
钱新宇, 潘月龙. 恶性黑色素瘤免疫治疗现状[J].
浙江医学, 2016, 38(12): 1043-8.
|
| [4] |
Chen W, Zheng R, Zeng H, et al. Annual report on status of cancer in China, 2011[J].
Chin J Cancer Res, 2015, 27(1): 2-12.
|
| [5] |
Corrie P, Hategan M, Fife K, et al. Management of melanoma[J].
Br Med Bull, 2014, 111(1): 149-62.
DOI: 10.1093/bmb/ldu019. |
| [6] |
Bartel DP. MicroRNAs: target recognition and regulatory functions[J].
Cell, 2009, 136(2): 215-33.
DOI: 10.1016/j.cell.2009.01.002. |
| [7] |
Mcguire A, Brown JA, Kerin MJ. Metastatic breast cancer: the potential of miRNA for diagnosis and treatment monitoring[J].
Cancer Metastasis Rev, 2015, 34(1): 145-55.
DOI: 10.1007/s10555-015-9551-7. |
| [8] |
Shin VY, Chu KM. MiRNA as potential biomarkers and therapeutic targets for gastric cancer[J].
World J Gastroenterol, 2014, 20(30): 10432-9.
DOI: 10.3748/wjg.v20.i30.10432. |
| [9] |
Hayes J, Peruzzi PP, Lawler S. MicroRNAs in cancer: biomarkers, functions and therapy[J].
Trends Mol Med, 2014, 20(8): 460-9.
DOI: 10.1016/j.molmed.2014.06.005. |
| [10] |
Garzon R, Calin G, Croce C M. MicroRNAs in cancer[J].
Annu Rev Pathol, 2009, 60: 167-79.
|
| [11] |
蒋源, 韩永智, 孙建. 靶向VEGF的miRNA对恶性黑色素细胞增殖和凋亡的影响[J].
南方医科大学学报, 2014, 34(3): 358-63.
DOI: 10.3969/j.issn.1673-4254.2014.03.14. |
| [12] |
金丹, 周烈, 刘启祥, 等. Mir-15b在恶性黑色素瘤a375细胞中的表达及其对细胞转移和侵袭的影响[J].
医学研究杂志, 2017, 46(7): 156-9.
|
| [13] |
Margue C, Reinsbach S, Philippidou DA, et al. Comparison of a healthy miRNome with melanoma patient miRNomes: are microRNAs suitable serum biomarkers for Cancer?[J].
Oncotarget, 2015, 6(14): 12110-27.
|
| [14] |
Fan Y, Ma X, Li H, et al. miR-122 promotes metastasis of clear-cell renal cell carcinoma by downregulating dicer[J].
Int J Cancer, 2018, 142(3): 547-60.
DOI: 10.1002/ijc.v142.3. |
| [15] |
Pei ZJ, Zhang ZG, Hu AX, et al. miR-122-5p inhibits tumor cell proliferation and induces apoptosis by targeting MYC in gastric cancer cells[J].
Pharmazie, 2017, 72(6): 344-7.
|
| [16] |
Xu X, Gao F, Wang J, et al. Mir-122-5p inhibits cell migration and invasion in gastric cancer by down-regulating dusp4[J].
Cancer Biol Ther, 2018, 19(5): 427-35.
DOI: 10.1080/15384047.2018.1423925. |
| [17] |
Zhang Y, Tang L. Inhibition of breast cancer cell proliferation and tumorigenesis by long non-coding rna rpph1 down-regulation of mir- 122 expression[J].
Cancer Cell Int, 2017, 17: 109.
DOI: 10.1186/s12935-017-0480-0. |
| [18] |
Heinemann FG, Tolkach Y, Deng MR, et al. Serum miR-122-5p and miR-206 expression: non-invasive prognostic biomarkers for renal cell carcinoma[J].
Clin Epigenetics, 2018, 10: 11.
DOI: 10.1186/s13148-018-0444-9. |
| [19] |
Chai FN, Ma WY, Zhang J, et al. Coptisine from Rhizoma coptidis exerts an anti-cancer effect on hepatocellular carcinoma by upregulating miR-122[J].
Biomed Pharmacother, 2018, 103: 1002-11.
DOI: 10.1016/j.biopha.2018.04.052. |
| [20] |
Barajas JM, Reyes R, Guerrero MJ, et al. The role of miR-122 in the dysregulation of glucose-6-phosphate dehydrogenase (G6PD) expression in hepatocellular cancer[J].
Sci Rep, 2018, 8(1): 9105.
DOI: 10.1038/s41598-018-27358-5. |
| [21] |
Ding CQ, Deng WS, Yin XF, et al. MiR-122 inhibits cell proliferation and induces apoptosis by targeting runt-related transcription factors 2 in human glioma[J].
Eur Rev Med Pharmacol Sci, 2018, 22(15): 4925-33.
|
| [22] |
Qin H, Sha J, Jiang C, et al. miR-122 inhibits metastasis and epithelialmesenchymal transition of non-small-cell lung cancer cells[J].
Onco Targets Ther, 2015, 8: 3175-84.
|
| [23] |
Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J].
Methods, 2001, 25(4): 402-8.
DOI: 10.1006/meth.2001.1262. |
| [24] |
李治, 张林梦, 斯越秀, 等. 恶性黑色素瘤的研究进展[J].
药物生物技术, 2018, 25(1): 70-4.
|
| [25] |
Chen Y, Huang T, Yang X, et al. Microrna106a regulates the proliferation and invasion of human osteosarcoma cells by targeting vnn2[J].
Oncol Rep, 2018, 40(4): 2251-9.
|
| [26] |
Liu PC, Thiele DJ. Novel stress-responsive genes EMG1 and NOP14 encode conserved, interacting proteins required for 40S ribosome biogenesis[J].
Mol Biol Cell, 2001, 12(11): 3644-57.
DOI: 10.1091/mbc.12.11.3644. |
| [27] |
Gasch AP, Spellman PT, Kao CM, et al. Genomic expression programs in the response of yeast cells to environmental changes[J].
Mol Biol Cell, 2000, 11(12): 4241-57.
DOI: 10.1091/mbc.11.12.4241. |
| [28] |
Zhou B, Wu Q, Chen G, et al. NOP14 promotes proliferation and metastasis of pancreatic cancer cells[J].
Cancer Lett, 2012, 322(2): 195-203.
DOI: 10.1016/j.canlet.2012.03.010. |
| [29] |
Du YX, Liu ZW, You L, et al. Pancreatic cancer progression relies upon mutant p53-induced oncogenic signaling mediated by NOP14[J].
Cancer Res, 2017, 77(10): 2661-73.
DOI: 10.1158/0008-5472.CAN-16-2339. |
| [30] |
Isaksson HS, Sorbe B, Nilsson TK. Whole genome expression profiling of blood cells in ovarian cancer patients-prognostic impact of the CYP1B1, MTSS1, NCALD, and NOP14 genes[J].
Oncotarget, 2014, 5(12): 4040-9.
|
| [31] |
Lei JJ, Peng RJ, Kuang BH, et al. NOP14 suppresses breast cancer progression by inhibiting NRIP1/Wnt/beta-catenin pathway[J].
Oncotarget, 2015, 6(28): 25701-14.
|
| [32] |
Du YX, Li ZZ, Liu CZ, et al. expression of nucleolar protein 14 and cd31 in pancreatic cancer mouse model and its correlation with tumor progression[J].
Chin J Surg, 2017, 55(6): 463-7.
|
 2018, Vol. 38
2018, Vol. 38

