慢加急性肝衰竭(ACLF)是在慢性肝病基础上发生的一种临床综合征,导致一个或多个器官衰竭,短期死亡率高达50%以上[1],目前由于该病在临床上多采用内科保守治疗,且人工肝治疗终末期肝病疗效欠佳,干细胞治疗技术仍在发展中[2]。终末期肝病患者大多并发多个器官衰竭,该类患者行肝移植手术时多存在局限性[3],因此,早期评估该类患者死亡风险,选择合适治疗手段具有重要意义。经典的终末期肝病评分(MELD评分)具有参数客观等优点,多用于重型肝炎的预后判断[4],但该评分为欧美国家建立,且未能考虑患者炎症因子等因素[5]。我国慢性肝病基础疾病多为乙型肝炎病毒(HBV)相关[6],因此该类评分对于乙肝相关慢加急性肝衰竭(HBV-ACLF)具有一定局限性[5],需要纳入较为稳定且独立于其他参数的指标建立评估模型。
红细胞分布宽度(RDW)可反映红细胞的异质性,是血常规中一项易于获得的参数。很多研究发现RDW与心血管疾病、肾脏疾病、脓毒血症等不良预后有关[7-8]。也有部分学者研究发现RDW在HBV相关性肝病中升高,是乙型肝炎患者90d死亡率的独立预测因子[9],并且与肝纤维化程度和肝脏疾病的损伤程度有关[10-12]。当RDW>17%时,HBV-ACLF患者生存率降低[13],但该研究使用的样本量较少,因此,本研究纳入更多样本探讨了RDW在HBV-ACLF患者中的短期转归中的预测价值,拟建立MELD-RDW预测模型,以提高HBV-ACLF患者的短期死亡的评估价值,为更好地指导临床治疗,早期判断患者死亡风险,选择合适治疗手段提供借鉴。
1 资料和方法 1.1 患者的纳入与排除标准回顾性收集2014年1月~2017年12月西南医科大学附属医院感染科收治的378例HBV-ACLF患者的一般临床资料及实验室检验指标,并以入院当天为随访起点,进行90随访。所有患者纳入标准均采用《肝衰竭诊治指南2012年版》 [14]。排除标准为:①排除合并有肝癌、重度营养不良以及严重心力衰竭、心肌梗死、中风、房颤等心血管疾病患者;②排除合并其他病毒(如甲型肝炎病毒,丙型肝炎病毒,丁型肝炎病毒,戊型肝炎病毒,艾滋病病毒,EB病毒,巨细胞病毒)感染,合并自身免疫性肝病,合并酒精性肝病患者;③排除失访患者。所有患者入院后均采用内科保守治疗。
1.2 资料分析本研究收集了我院378例HBV-ACLF患者,根据纳入与排除标准,有103例患者被排除,其中患者检验资料不全有29例;办理再入院患者有13例;合并肝癌有18例;合并肺结核有6例;合并自身免性肝病有1例;合并其他病毒感染有9例;重度贫血(< 60 g/L)有11例;合并脑梗塞有1例;合并心力衰竭有3例;合并哮喘有2例;合并下肢静脉曲张有1例;合并甲亢有3例;剖宫产术后患者1例;合并胰腺炎有2例;冠心病支架植入术后患者1例;合并房颤有1例;合并肾移植有1例。对纳入随访的275例HBV-ACLF患者进行电话随访,以入院当天为随访起点,追踪患者90 d内生存情况,有30例患者未随访到3个月内生存情况,故未纳入模型建立。最终本研究纳入245例研究对象,根据患者90 d生存情况,将HBV-ACLF患者分为生存组与死亡组,如果患者在90 d内死亡则纳入死亡组,反之则为生存组。
分析纳入患者的人口统计学和临床特征,以及入院时的静脉血样本,使用迈瑞6800自动血液分析仪测试全血细胞计数:白细胞数(WBC),中性粒细胞率(NEU-R),红细胞数(RBC),血红蛋白(HGB),血小板数(PLT);使用迈瑞BS200生化分析仪检测生化指标:丙氨酸氨基转移酶(ALT),天冬氨酸氨基转移酶(AST),白蛋白(ALB),总胆红素(TBIL),γ-谷氨酰转移酶(GGT),肌酐(Crea),血清钾(K),血清钠(Na);使用CS-5100全自动凝血分析仪检测凝血功能:凝血酶原时间(PT),国际标准化比率(INR),凝血酶原活动度(PTA);HBV-DNA通过ABI 7500FAST(荧光定量PCR仪)检测。所有检验结果均来自我院检验科检验结果,其检验结果可靠性高。并根据R=9.6×ln(Crea mg/dl)+3.8×ln(TBIL mg/ dl)+11.2×ln(INR)+6.4公式计算MELD评分。
1.3 统计方法统计软件SPSS20.0用于统计描述与推断,符合正态分布的定量资料采用均数±标准差表示,不符合正态分布的定量资料经lg转化后亦采用均数及标准差表示;定性资料采用频数及百分比表示;定量资料的组间比较采用独立样本t检验,定性资料采用U检验;ROC曲线下面积用于比较不同指标对于目标结局的预测价值,AUC的比较采用正态性的Z检验,当P < 0.05时认为差异具有统计学意义。
2 结果 2.1 HBV-ACLF患者生存组与死亡组的单因素分析比较本研究共纳入245例HBV-ACLF患者,其中男性212例,女性33例,非肝硬化患者53例,肝硬化患者192例,死亡率为50.6%;单因素分析结果显示,与生存组相比,Na,ALB,PTA,RBC,HGB在HBV-ACLF死亡组中较低,而WBC,NEU-R,RDW,TBIL,Crea,PT,INR和MELD评分在死亡组中增加(表 1),差异有统计学意义;其中RDW在HBV-ACLF生存组(14.97±1.38)明显低于死亡组(17.05±2.92,P < 0.001)。
| 表 1 HBV-ACLF患者的临床特征与实验指标的单因素分析比较 Table 1 Univariate analysis of the demographic, clinical and biochemical data of the patients with HBV-ACLF at admission with different short-term survival outcomes |
将单因素分析(表 1)中有意义的数据进行多因素回归分析,由于腹水分级和肝性脑病分级存在主观因素,故该指标不纳入回归分析。使用BOX-Tidwell方法检验自变量与因变量间无线性关系,运用容忍度、方差膨胀因子检验自变量之间的多重共线性,排除Crea,PT,INR等指标。将上述指标进行回归分析,结果显示RDW和MELD评分为HBV-ACLF患者死亡发生的危险因素,其OR值分别为1.840和1.154(P < 0.05),ALB和PTA为保护性因素,其OR值分别为0.921和0.943(P < 0.05);而WBC,NEU-R,RBC,HGB,Na等与HBVACLF死亡发生无关。提示高RDW和高MELD评分是HBV-ACLF患者90 d死亡的危险因素(表 2)。
| 表 2 HBV-ACLF患者90 d后相关独立预测因子的多变量logistic回归分析 Table 2 Multivariate logistic regression analysis of independent predictors associated with 90-day survival outcomes in patients with HBV-ACLF |
上述资料采用前进法共筛选出ALB、RDW、PTA、MELD评分4个变量与HBV-ACLF患者预后有关,根据回归系数(B值)作为危险因素的权重(表 3),建立如下模型:logisitMELD-RDW=- 9.375 + 0.582 × RDW- 0.091 × ALB-0.05×PTA+0.186×MELD,死亡概率P=elogisit (p)/1+ elogisit(p),该模型具有统计学意义。统计分析显示,在本组资料中,该模型预测的存活患者为98例,死亡患者为100例。因此,MELD-RDW预测模型能准确分类本研究现有的80.8%的个体,其灵敏度与特异度均较高,分别为80.6%、81%。
| 表 3 MELD-RDW模型的建立 Table 3 Establishment of the MELD-RDW model |
通过绘制RDW、MELD评分、MELD-RDW模型的ROC曲线(图 1),结果显示:MELD-RDW模型(0.878)高于RDW值(0.724)、MELD评分(0.780)的曲线下面积;MELD- RDW模型(0.878 ± 0.022)与MELD评分(0.780 ± 0.029)相比,Z值为2.665,P=0.004。说明MELD-RDW模型对HBV-ACLF患者90天死亡的预测能力具有更高的准确性(表 4)。MELD-RDW评分的约登指数最大值为0.633,该模型评分为9.757时,患者死亡风险大,对应的灵敏度为0.806,特异性为0.818。
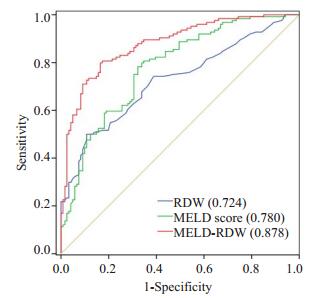
|
图 1 RDW、MELD评分和MELD-RDW模型的ROC曲线 Figure 1 ROC curve of the RDW, MELD score and the MELD-RDW model. |
| 表 4 RDW、MELD评分、MELD-RDW对HBV-ACLF患者90 d死亡率的预测效果 Table 4 Predictive sensitivity and specificity RDW, MELD score and the MELD- RDW model for 90-day mortality in patients with HBV-ACLF |
ACLF是由于促细胞因子激活、氧化应激、免疫功能障碍和感染风险增加所驱动的全身性炎症反应,还通过活性氧、氮质因素等危害器官功能的完整性[15-16]。该病短期死亡风险大,经典的MELD评分基于欧美人群建立,且未考虑炎性因子等因素[5],因此,有必要为HBVACLF患者制定简单而准确的预后评分。本研究根据2012版肝衰竭诊治指南[14]标准,收集了我院的378例HBV-ACLF患者的临床资料和实验室指标,排除了133例患者,最终符合本研究的对象有245例。在本组资料中,HBV-ACLF死亡发生率为50.6%,其中WBC、NEUR在HBV-ACLF死亡组中较高,但多因素回归分析后发现两者不能作为HBV-ACLF患者的90 d预后的独立危险因素,可能与其在炎症反应中的不稳定性有关,也可能与局部和系统水平对炎性细胞存在差异性调节有关[17]。单因素分析还发现RBC、HGB在死亡组中较低,这可能与严重肝损害产生大量胆红素引发快速钙内流、活化鞘磷脂酶等对红细胞毒性作用有关[18],导致RBC和HGB减低,季等[19]研究发现RBC可作为HBV-ACLF贫血的危险因素,但在本研究表明RBC、HGB与HBVACLF的90 d死亡无关。
本研究中RDW在HBV-ACLF死亡组中更高,其OR值为1.829,而且RDW的ROC曲线下AUC面积为大于0.7,本研究认为RDW可作为HBV-ACLF患者90 d死亡发生的独立危险因素,这与Jin等[13]研究一致。HBV-ACLF与RDW升高的具体机制还不清楚,可能与如下原因有关:第一,RDW显著变化与机体的一些异常表现有关,如炎症,氧化应激,红细胞碎片化,营养状况差以及促红细胞生成素功能异常等有关[20]。促炎因子不仅会损害红细胞的成熟,还会导致未成熟的红细胞进入血流,导致RDW升高[21]。第二,炎症性细胞因子如肿瘤坏死因子(TNF)-α,白细胞介素(IL)-1β和IL-6可能抑制铁代谢和促红细胞生成素的产生,导致合成障碍或促红细胞生成素异常活性[21-22]。第三,大量肝细胞坏死,使得肝储备维生素B12、叶酸、铁的功能下降[23],红细胞生成障碍,导致重型肝炎患者RDW升高。第四,机体在对HBV产生免疫应答时,病理性免疫反应可以释放炎性介质、内毒素等影响红细胞的生长发育[24],使得RDW升高。第五,低血清抗氧化剂浓度与RDW水平增加有关[25],氧化应激在肝病中很常见,具有氧化剂与抗氧化剂防御之间平衡受损的特征。因此,氧化应激可能是导致ACLF中RDW水平增加的另一种机制。
另外,本组资料中还显示,PTA和ALB可作为HBV-ACLF患者的保护性因素。PTA水平决定不同阶段ACLF患者的预后[26],肝衰竭指南已经表明,PTA被作为HBV-ACLF分期的重要指标[14]。Qin等[27]研究同样证实PTA较高时,患者死亡风险降低。白蛋白是肝脏产生的主要蛋白质,反映肝脏合成功能,故肝衰竭患者ALB降低。研究表明ALB可作为TIPS患者的保护性因素[28],与ACLF预后也有相关性[29-30]。这与本研究结果一致。
本研究发现RDW、MELD评分、PTA、ALB均与HBV-ACLF转归有关。因此,本研究通过对上述4个指标进行二元logistic回归分析建立MELD-RDW预测模型,RDW、MELD评分ROC曲线下AUC面积分别为0.724和0.780,而MELD-RDW模型的AUC值为0.878,其灵敏度与特异性均较高,说明MELD-RDW模型可提高HBV-ACLF患者90 d死亡预测的准确性。
综上所述,RDW可作为HBV-ACLF患者90 d死亡的独立预测因素;与MELD评分相比,MELD-RDW模型具有更高的死亡预测能力。HBV-ACLF病情变化快,而RDW是血常规中一项易于获得的指标,与MELD评分联合使用可较好的动态评估患者的病情变化,故在临床中能早期、及时对HBV-ACLF患者预后进行评价,选择合适治疗手段,提高HBV-ACLF患者生存率。但该研究为回顾性研究,还有待前瞻性研究观察RDW水平的纵向变化与HBV-ACLF患者转归之间的关联。
| [1] |
Sarin SK, Kedarisetty CK, Abbas Z, et al. Acute-on-chronic liver failure: consensusrecommendations of the asian pacific association for the Study of the Liver (APASL) 2014[J].
Hepatol Int, 2014, 8(4): 453-71.
DOI: 10.1007/s12072-014-9580-2. |
| [2] |
何宏亮, 李建国, 高志良. 人工肝和干细胞在肝衰竭治疗中的进展[J].
临床肝胆病杂志, 2013, 29(9): 670-3.
DOI: 10.3969/j.issn.1001-5256.2013.09.009. |
| [3] |
Durand F, Francoz C, Asrani SK, et al. Acute kidney injury after liver transplantation[J].
Transplantation, 2018, 102(10): 1636-49.
DOI: 10.1097/TP.0000000000002305. |
| [4] |
周林, 潘立超, 史宪杰, 等. MELD评价体系对肝移植受者选择的多中心临床研究进展[J].
器官移植, 2017, 8(2): 174-8.
DOI: 10.3969/j.issn.1674-7445.2017.02.016. |
| [5] |
Cheng XP, Zhao J, Chen Y, et al. Comparison of the ability of the PDD-ICG clearance test, CTP, MELD, and MELD- Na to predict short-term and medium-term mortality in patients with decompensated hepatitis B cirrhosis[J].
Eur J Gastroenterol Hepatol, 2016, 28(4): 444-8.
|
| [6] |
Song Y, Shen Y, Lu W, et al. Analysis of biochemical features of hepatitis B virus infected patients in southwest China[J].
Clin Lab, 2016, 62(9): 1803-7.
|
| [7] |
Salvagno GL, Sanchis-Gomar F, Picanza A, et al. Red blood cell distribution width: A simple parameter with multiple clinical applications[J].
Crit Rev Clin Lab Sci, 2015, 52(2): 86-105.
DOI: 10.3109/10408363.2014.992064. |
| [8] |
Orfanu AE, Popescu C, Leustean A, et al. The importance of haemogram parameters in the diagnosis and prognosis of septic patients[J].
J Critical Care Med, 2017, 3(3): 105-10.
DOI: 10.1515/jccm-2017-0019. |
| [9] |
Lou Y, Wang M, Mao W. Clinical usefulness of measuring red blood cell distribution width in patients with hepatitis B[J].
PloS one, 2012, 7(5): e37644.
DOI: 10.1371/journal.pone.0037644. |
| [10] |
Fan X, Deng H, Wang X, et al. Association of red blood cell distribution width with severity of hepatitis B virus-related liver diseases[J].
Clin Chim Acta, 2018, 482: 155-60.
DOI: 10.1016/j.cca.2018.04.002. |
| [11] |
Turcato G, Campagnaro T, Bonora A, et al. Red blood cell distribution width independently predicts 1-month mortality in acute decompensation of cirrhotic patients admitted to emergency department[J].
Eur J Gastroenterol Hepatol, 2018, 30(1): 33-8.
DOI: 10.1097/MEG.0000000000000993. |
| [12] |
Zhao RH, Shi Y, Zhao H, et al. Acute-on-chronic liver failure in chronic hepatitis B: an update[J].
Expert Rev Gastroenterol Hepatol, 2018, 12(4): 341-50.
DOI: 10.1080/17474124.2018.1426459. |
| [13] |
Jin L, Gao Y, Ye J, et al. Clinical usefulness of measuring red blood cell distribution width in patients with hepatitis B virus-related acuteon-chronic liver failure[J].
Clin Lab, 2017, 63(9): 1403-10.
|
| [14] |
中华医学会感染病学分会肝衰竭与人工肝学组, 中华医学会肝病学分会重型肝病与人工肝学组. 肝衰竭诊治指南(2012年版[J].
实用肝脏病杂志, 2013, 16(3): 210-6.
DOI: 10.3969/j.issn.1672-5069.2013.03.007. |
| [15] |
Bernardi M, Moreau R, Angeli P, et al. Mechanisms of decompensation and organ failure in cirrhosis: From peripheral arterial vasodilation to systemic inflammation hypothesis[J].
J Hepatol, 2015, 63(5): 1272-84.
DOI: 10.1016/j.jhep.2015.07.004. |
| [16] |
Moreau R. The Pathogenesis of ACLF: The inflammatory response and immune function[J].
Semin Liver Dis, 2016, 36(2): 133-40.
DOI: 10.1055/s-00000069. |
| [17] |
He Z, Chen Y, Chen P, et al. Local inflammation occurs before systemic inflammation in patients with COPD[J].
Respirology, 2010, 15(3): 478-84.
DOI: 10.1111/res.2010.15.issue-3. |
| [18] |
Lang E, Gatidis S, Freise NF, et al. Conjugated bilirubin triggers anemia by inducing erythrocyte death[J].
Hepatology, 2015, 61(1): 275-84.
DOI: 10.1002/hep.27338. |
| [19] |
季淑静, 王梦洁, 陈金军. 慢加急性乙型肝炎肝衰竭患者贫血特点分析[J].
实用肝脏病杂志, 2016, 19(1): 55-9.
DOI: 10.3969/j.issn.1672-5069.2016.01.014. |
| [20] |
Lippi G, Plebani M. Red blood cell distribution width (RDW) and human pathology. One size fits all[J].
Clin Chem Lab Med, 2014, 52(9): 1247-9.
|
| [21] |
Lippi G, Targher G, Montagnana M, et al. Relation between red blood cell distribution width and inflammatory biomarkers in a large cohort of unselected outpatients[J].
Arch Pathol Lab Med, 2009, 133(4): 628-32.
|
| [22] |
Semba RD, Patel KV, Ferrucci L, et al. Serum antioxidants and inflammation predict red cell distribution width in older women: The Women's Health and Aging Study I[J].
Clin Nutri, 2010, 29(5): 600-4.
DOI: 10.1016/j.clnu.2010.03.001. |
| [23] |
Ayalew Tefferi. Anemia in adults: A contemporary approach to diagnosis[J].
Mayo Clin Proc, 2003, 78(10): 1274-80.
DOI: 10.4065/78.10.1274. |
| [24] |
高鹏, 肖萍, 杨彦麟, 等. 病毒载量对不同病变阶段慢性乙型肝炎患者红细胞参数的影响及其临床意义[J].
北京大学学报:医学版, 2014, 46(6): 941-4.
|
| [25] |
Friedman JS, Lopez MF, Fleming MD, et al. SOD2- deficiency anemia: protein oxidation and altered protein expression reveal targets of damage, stress response, and antioxidant responsiveness[J].
Blood, 2004, 104(8): 2565-73.
DOI: 10.1182/blood-2003-11-3858. |
| [26] |
Xia Q, Dai X, Zhang Y, et al. A modified MELD model for Chinese pre-ACLF and ACLF patients and it reveals poor prognosis in preACLF patients[J].
PloS one, 2013, 8(6): e64379.
DOI: 10.1371/journal.pone.0064379. |
| [27] |
Qin G, Bian ZL, Shen Y, et al. Logistic regression model can reduce unnecessary artificial liver support in hepatitis B virus-associated acute-on-chronic liver failure: decision curve analysis[J].
BMC Med Inform Decis, 2016, 16: 59.
DOI: 10.1186/s12911-016-0302-7. |
| [28] |
Luca A, Angermayr B, Bertolini G, et al. An integrated MELD model including serum sodium and age improves the prediction of early mortality in patients with cirrhosis[J].
Digest Liver Dis, 2007, 13(8): 1174-80.
|
| [29] |
吴家箴, 杨兴祥, 江南. 乙肝慢加急性肝衰竭患者血清白蛋白水平和MELD评分关系分析[J].
航空航天医学杂志, 2017, 28(7): 811-2.
DOI: 10.3969/j.issn.2095-1434.2017.07.017. |
| [30] |
汤伟亮, 赵钢德, 董志霞, 等. 肝衰竭预后危险因素及预后模型建立的研究[J].
传染病信息, 2011, 24(3): 159-62.
DOI: 10.3969/j.issn.1007-8134.2011.03.009. |
 2018, Vol. 38
2018, Vol. 38

