肺癌是严重威胁人类健康和生命的疾病,目前肺腺癌已取代鳞癌成为最常见的肺癌病理类型[1]。2011年国际肺癌研究学会、美国胸科学会和欧洲呼吸学会提出了将肺腺癌分为原位腺癌、微浸润腺癌及浸润性腺癌的肺腺癌国际多学科分类[2]。该分类重新定义了肺腺癌的组织学发展谱系,经过数年的实践,被证实更有助于研究者判断肿瘤生物学行为、检测肿瘤分子表型特征及预测疗效[3]。2015年WHO肺腺癌组织学新分类也全盘采纳了该分类方法[4]。因此,以原位腺癌→微浸润腺癌→浸润性腺癌这一进程作为研究背景,分析促使肺腺癌进展的生物学因素更具有理论依据和研究价值。
目前研究表明淋巴管生成是恶性肿瘤进展的关键环节,且基质金属蛋白酶家族与血管内皮生长因子家族可能是淋巴管生成的调控因子[5-7],但淋巴管生成在原位腺癌、微浸润腺癌及浸润性腺癌的进展过程的作用尚未完全阐明[8-9]。膜型基质金属蛋白酶-1(MTl-MMP)是一直以来的研究热点,其通过对细胞外基质的有效降解及对其他可溶性MMPs(如proMMP-2)的激活等,在机体多种生理及病理进程中发挥重要作用[5]。此外,研究发现MTl-MMP还可以通过作用于内皮细胞等多种途径来调控肿瘤内淋巴管生成,促进肿瘤进展[6-7]。VEGF-C属于血管内皮生长因子家族,与淋巴内皮细胞表面的受体VEGFR3结合后,通过促进下游分子Shc、Grb2磷酸化,诱导淋巴管内皮增生、迁移和新的淋巴管形成[10]。有研究显示,MTl-MMP和VEGF-C共同参与了肿瘤淋巴管生成的过程,并且MT1-MMP对VEGF-C的表达具有调控作用[11-12]。
本研究旨在探讨肺原位腺癌、微浸润腺癌及浸润性腺癌中肿瘤淋巴管密度的变化差异及其与MT1-MMP、VEGF-C蛋白表达、临床病理因子(特征)的关系以及淋巴管生成在肺腺癌进展中的作用,目前国内外尚未见类似报道。
1 资料和方法 1.1 基本资料收集广州医科大学附属第一医院病理科2010年1月~2012年12月具有完整临床病理资料的肺腺癌病例301例。病例入选的标准包括:患者行肺肿物手术切除,术后石蜡切片病理诊断为肺腺癌;患者未行术前放、化疗;经免疫组化(CK7、TTF-1、NapsinA)证实为肺原发腺癌;排除腺鳞癌、腺样囊性癌、粘液表皮样癌等其它肺癌病理类型。根据2011年肺腺癌国际多学科分类标准及2015年WHO肺腺癌组织学分类,由两名高年资病理医生双盲法重新阅片,所有病例分为原位腺癌、微浸润腺癌及浸润性腺癌3组。
患者年龄为59.6 ± 10.8(23~84岁),包括147名(48.8%)男性及154名(51.2%)女性。219人(72.8%)为不吸烟者;82人(27.2%)为吸烟者。肺腺癌病理分型:肺原位腺癌28例(9.3%);肺微浸润腺癌86例(28.6%);肺浸润性腺癌187例(62.1%)。其中183例(60.8%)TNM分期为Ⅰ期+Ⅱ期;118例(39.2%)为Ⅲ期+Ⅳ期。
1.2 主要试剂和实验方法免疫组化MT1-MMP兔抗人单克隆抗体为NeoMarkers产品;VEGF-C兔抗人多克隆抗体及D2-40鼠抗人单克隆抗体为Abcam产品;Envision免疫组化二抗试剂盒及DAB显色试剂盒均为DAKO产品。应用免疫组化方法在各组肺腺癌中检测MT1-MMP及VEGF-C蛋白表达水平,免疫组化结果判读由两名高年资病理医师双盲法进行。应用D2-40免疫组化标记计数淋巴管密度,方法如下:先在低倍镜(100×)下观察肿瘤组织内染色典型区域,然后在高倍镜(400×)下计数,以阳性的内皮细胞簇或阳性的小脉管视作1个微淋巴管。每例计数5个高倍视野,取其平均值。
手工免疫组化染色步骤:10%中性福尔马林固定组织标本,经石蜡包埋后4 µm厚度切片。常规脱蜡、水化,3%过氧化氢阻断内源性过氧化物酶,枸橼酸缓冲液高温抗原修复。一抗37 ℃孵育1 h,冲洗后滴加二抗37 ℃孵育30 min,之后DAB显色、苏木素复染,冲洗后梯度酒精脱水、二甲苯透明,中性树胶封片。MT1-MMP、VEGF-C及D2-40一抗工作浓度分别为1:60、1:100、1:50。
1.3 统计学分析采用SPSS23.0统计软件进行统计学分析。计量资料以均数±标准差表示,使用Kruskal-Wallis H检验进行组间差异比较;使用Spearman相关系数分析VEGF-C、MT1-MMP蛋白表达水平与肿瘤淋巴管密度之间的相关性以及肿瘤淋巴管密度与临床病理因子(肿瘤大小、淋巴结及远处转移、临床分期等)之间的相关性。P < 0.05为差异有统计学意义。
2 结果 2.1 D2-40、VEGF-C及MT1-MMP在肺腺癌3种病理类型中的表达免疫组化染色显示:D2-40标记的淋巴管呈薄壁的管腔结构,分布在肿瘤中心及周边区域,管腔内很少有淋巴细胞,无红细胞,染色呈棕黄色;VEGF-C蛋白为胞浆着色,在肺腺癌及癌旁肺组织中均有表达,正常肺组织中的肺泡及支气管上皮均显示不同程度的阳性染色,而在肿瘤组织中,阳性染色仅表达于腺癌细胞,在肿瘤间质细胞不表达;MT1-MMP蛋白阳性染色定位于肺腺癌肿瘤细胞胞浆(图 1)。
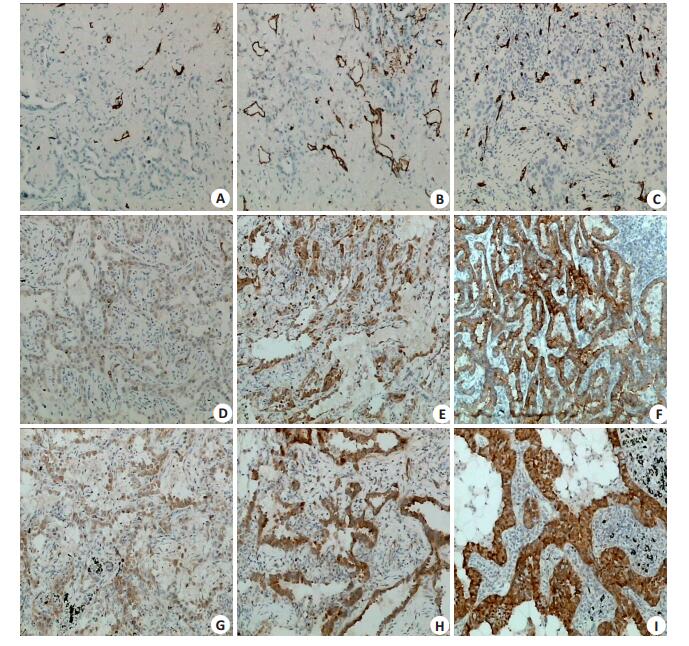
|
图 1 D2-40、VEGF-C及MT1-MMP在肺腺癌3种病理类型中的表达 Figure 1 LVD and expressions of D2-40, VEGF-C, and MT1-MMP in different lung adenocarcinomas (Immunohistochemistry, original magnification: × 200). A: D2-40 Immunohistochemistry showing lymphatic vessel density (LVD) in adenocarcinoma in situ (AIS); B: Immunohistochemistry showing LVD in minimally invasive adenocarcinoma (MIA); C: Immunohistochemistry showing LVD in invasive adenocarcinoma (IA); D: VEGF-C expression in AIS; E: VEGF-C expression in MIA; F: VEGF-C expression in IA; G: MT1-MMP expression in AIS; H: MT1-MMP expression in MIA; I: MT1-MMP expression in IA. |
由于3种病理类型的淋巴管密度不符合正态分布,所以使用多个样本非参数检验中Kruskal-Wallis H检验比较3组数据是否存在差异。分析结果显示肿瘤淋巴管密度均值在原位腺癌组为4.5±1.0;微浸润腺癌组为5.3±1.5;浸润性腺癌组为16.6±3.1,3组间差异具有统计学意义(P=0.000)。根据平均秩次推断:浸润性腺癌组淋巴管密度最高,微浸润腺癌组次之,原位腺癌组最低(表 1)。
| 表 1 3种病理类型肺腺癌的淋巴管密度变化差异 Table 1 Differences in tumor lymphatic vessel density among AIS, MIA, and IAgroups |
应用Spearman相关系数分析肿瘤淋巴管密度与MT1-MMP、VEGF蛋白表达的相关性。结果显示VEGF-C蛋白表达水平与淋巴管密度存在正相关关系(r=0.917, P=0.009),两者相关关系密切(r>0.5)。VEGF-C蛋白表达水平越高,淋巴管密度越高。MT1- MMP蛋白表达水平与淋巴管密度无显著相关性(r= 0.046, P=0.428),但与VEGF-C蛋白表达水平存在相关性(r=0.243, P=0.000)。
2.4 肿瘤淋巴管密度与临床病理因子的关系采用Spearman相关系数分析肿瘤淋巴管密度与临床病理因子的相关性。结果显示肿瘤淋巴管密度与T分期存在正相关关系(r=0.686, P=0.017),即T分期越高,淋巴管密度越高;肿瘤淋巴管密度与N分期存在正相关关系(r=0.739, P=0.000),即N分期越高,淋巴管密度越高;肿瘤淋巴管密度与M分期存在正相关关系(r= 0.420, P=0.036),即M分期越高,淋巴管密度越高,但相关关系较弱(r < 0.5);肿瘤淋巴管密度与TNM分期存在正相关关系(r=0.874, P=0.012),即TNM分期越高,淋巴管密度越高(表 2)。
| 表 2 肿瘤淋巴管密度与临床病理因子的关系 Table 2 Relationship between tumor lymphatic vessel density and clinicopathological factors |
目前研究认为淋巴管生成是恶性肿瘤进展的关键环节,基质金属蛋白酶家族与血管内皮生长因子家族可能是淋巴管生成的调控因子[10-12],但淋巴管生成在原位腺癌、微浸润腺癌及浸润性腺癌的进展过程的作用尚未完全阐明。本研究显示肿瘤淋巴管密度在肺原位腺癌、微浸润腺癌及浸润性腺癌中的差异具有显著性,肿瘤淋巴管密度均值在AIS组为4.5±1.0,MIA组为5.3±1.5,IA组为16.6±3.1,可见在肺浸润性腺癌组中淋巴管密度显著升高。新生淋巴管是在原有淋巴管基础上出芽、延伸,先在肿瘤周围形成新生淋巴内皮,然后延伸进入肿瘤内部。研究表明多数实体肿瘤内部都可以发现新生淋巴管,肺癌亦是如此[13],并且研究者用直观显像的方法可以在肿瘤内新生淋巴管中发现癌细胞[14]。新生淋巴管不仅管腔不规则、通透性高,而且淋巴管间及淋巴管血管间更容易形成交互连接,利于肿瘤细胞发生转移。我们的研究结果发现从原位腺癌进展至微浸润腺癌,肿瘤淋巴管密度逐渐递增,并且一旦肿瘤发生了广泛浸润,即在浸润性腺癌中淋巴管密度明显增加,也提示了淋巴管生成可能是促进肺腺癌进展发挥作用的重要生物因素。
MMPs是一组锌离子结合型蛋白水解酶,能够有效降解细胞外基质,在肿瘤侵袭转移及淋巴管生成过程中发挥重要作用[15]。膜型基质金属蛋白酶(MT-MMPs)是一组特殊类型的MMPs家族,MT-MMPs有6个成员,膜型基质金属蛋白酶-1(MTl-MMP)最早被发现,其以酶原形式产生,活化后可以激活MMP2,降解肿瘤周围间质的层粘连蛋白、玻璃粘连蛋白及Ⅰ、Ⅱ、Ⅲ型胶原等成分,促进肿瘤浸润、转移[16-18]。此外,研究发现MTl-MMP还可能通过对血管内皮生长因子的诱导作用,调控肿瘤内淋巴管生成[19-20]。本研究应用免疫组化方法并未发现MT1-MMP蛋白表达水平与肿瘤淋巴管密度之间存在显著相关性,究其原因可能为:MT1-MMP位于信号通路的上游,其通过调控VEGF-C等其它因子发挥促进淋巴管生成的作用;免疫组化抗体识别的蛋白肽段不同导致实验结果的差异。本研究结果提示,虽然MT1-MMP蛋白表达水平与肿瘤淋巴管密度并无显著相关性,但其与VEGF-C蛋白表达密切相关,提示MT1-MMP对VEGF-C的表达可能具有调控作用。
VEGF-C是血管内皮细胞生长因子家族成员之一,其通过旁分泌方式与相应受体结合,促使受体发生磷酸化、二聚化或寡聚化,启动胞内信息传导途径,促进淋巴管内皮细胞增殖及趋化[21-22]。研究发现将转染VEGF-C基因的MDA-MB-435/GFP肿瘤细胞注射于裸鼠脚垫,瘤内新生淋巴管明显增多,其他研究者也有类似发现[23-25]。另外,抑制肿瘤内VEGF-C的功能,淋巴管的新生也被抑制,肿瘤淋巴道的转移也同样被抑制[26]。近期研究显示VEGF-C还可能通过激活免疫细胞及基质重构,参与机体多种生理和病理过程[27]。在本研究中,VEGF-C蛋白表达水平与肿瘤淋巴管密度呈正相关,并且随着肿瘤从原位腺癌→微浸润腺癌→浸润性腺癌的进程,淋巴管密度与VEGF-C蛋白表达水平都相应升高,进一步表明VEGF-C可能是促进肿瘤淋巴管生成的调控因子,在肺腺癌进展过程中起着重要作用。
关于肿瘤淋巴管密度与非小细胞肺癌生物学行为关系的研究较多,但本研究根据新分类将肺腺癌分为原位腺癌、微浸润腺癌及浸润性腺癌,探讨在肺腺癌进展过程中淋巴管密度的变化,目前尚未见类似报道。我们的研究结果发现,肿瘤淋巴管密度在浸润性腺癌组远远高于原位腺癌及微浸润性腺癌,并且与肿瘤大小、淋巴结转移及临床分期显著相关,证实淋巴管生成是肿瘤进展的关键环节,一旦淋巴管生成的调控因子促发,肿瘤更易于发生浸润及转移。但本研究的不足之处是未能对浸润性腺癌的病理类型进行进一步细化分类。
| [1] |
Li S, Choi YL, Gong Z, et al. Comprehensive characterization of oncogenic drivers in Asian lung adenocarcinoma[J].
J Thorac Oncol, 2016, 11(12): 2129-40.
DOI: 10.1016/j.jtho.2016.08.142. |
| [2] |
Travis WD, Brambilla E, Noguchi M, et al. International association for the study of lung cancer/american thoracic society/european respiratory society international multidisciplinary classification of lung adenocarcinoma[J].
J Thorac Oncol, 2011, 6(2): 244-85.
DOI: 10.1097/JTO.0b013e318206a221. |
| [3] |
Yanagawa N, Shiono S, Abiko M, et al. The correlation of the international association for the study of lung cancer (IASLC)/ american thoracic society (ATS)/european respiratory society (ERS) classification with prognosis and EGFR mutation in lung adenocarcinoma[J].
Ann Thorac Surg, 2014, 98(2): 453-8.
DOI: 10.1016/j.athoracsur.2014.04.108. |
| [4] |
Travis WD, Brambilla E, Nicholson AG, et al. The 2015 world health organization classification of lung tumors: impact of genetic, clinical and radiologic advances since the 2004 classification[J].
J Thorac Oncol, 2015, 10(9): 1243-60.
DOI: 10.1097/JTO.0000000000000630. |
| [5] |
Che YL, Luo SJ, Li G, et al. The C3G/rap1 pathway promotes secretion of MMP-2 and MMP-9 and is involved in serous ovarian cancer metastasis[J].
Cancer Lett, 2015, 359(2): 241-9.
DOI: 10.1016/j.canlet.2015.01.019. |
| [6] |
Jiang W, Zhang Y, Kane KT, et al. CD44 regulates pancreatic cancer invasion through MT1-MMP[J].
Mol Cancer Res, 2015, 13(1): 9-15.
DOI: 10.1158/1541-7786.MCR-14-0076. |
| [7] |
Ingvarsen S, Porse A, Erpicum C, et al. Targeting a single function of the multifunctional matrix metalloprotease MT1-MMP: impact on lymphangiogenesis[J].
J Biol Chem, 2013, 288(15): 10195-204.
DOI: 10.1074/jbc.M112.447169. |
| [8] |
陈应凯, 蒋迎九. 肿瘤新生淋巴管生成的研究进展[J].
现代医药卫生, 2017, 33(15): 2300-3.
DOI: 10.3969/j.issn.1009-5519.2017.15.019. |
| [9] |
宋小刚, 赵洪文. 促淋巴管生长因子与NSCLC淋巴管新生及转移的研究进展[J].
国际呼吸杂志, 2017, 37(4): 285-90.
DOI: 10.3760/cma.j.issn.1673-436X.2017.04.010. |
| [10] |
Ji H, Cao R, Yang Y, et al. TNFR1 mediates TNF-α-induced tumour lymphangiogenesis and metastasis by modulating VEGF-CVEGFR3 signalling[J].
Nat Commun, 2014, 5(5): 4944.
|
| [11] |
Wong HL, Jin G, Cao R, et al. MT1-MMP sheds LYVE-1 on lymphatic endothelial cells and suppresses VEGF-C production to inhibit lymphangiogenesis[J].
Nat Commun, 2016, 7(7): 10824.
|
| [12] |
Yao G, He P, Chen L, et al. MT1-MMP in breast cancer: induction of VEGF-C correlates with metastasis and poor prognosis[J].
Cancer Cell Int, 2013, 13(1): 98.
|
| [13] |
Liu J, Liu C, Qiu L, et al. Overexpression of both platelet- derived growth factor-BB and vascular endothelial growth factor-C and its association with lymphangiogenesis in primary human non-small cell lung cancer[J].
Diagn Pathol, 2014, 9(9): 128.
|
| [14] |
Liersch R, Hirakawa S, Berdel WE, et al. Induced lymphatic sinus hyperplasia in sentinel lymph nodes by VEGF-C as the earliest premetastatic indicator[J].
Int J Oncol, 2012, 41(6): 2073-8.
DOI: 10.3892/ijo.2012.1665. |
| [15] |
姚广裕, 陈路嘉, 胡晓磊, 等. MT1-MMP在乳腺癌中的独特表达模式[J].
南方医科大学学报, 2016, 36(1): 94-7.
DOI: 10.3969/j.issn.1673-4254.2016.01.17. |
| [16] |
Kumar S, Das A, Barai A, et al. MMP secretion rate and interinvadopodia spacing collectively govern cancer invasiveness[J].
Biophys J, 2018, 114(3): 650-62.
DOI: 10.1016/j.bpj.2017.11.3777. |
| [17] |
叶慧瑾, 白建杰, 郭培培, 等. 丙泊酚下调水通道蛋白3和基质金属蛋白酶-9表达抑制人肺癌A549细胞的侵袭力[J].
南方医科大学学报, 2016, 36(9): 1286-90, 1294.
DOI: 10.3969/j.issn.1673-4254.2016.09.22. |
| [18] |
Kikuchi K, Kozuka- Hata H, Oyama M, et al. Identification of proteolytic cleavage sites of EphA2 by membrane type 1 matrix metalloproteinase on the surface of cancer cells[J].
Methods Mol Biol, 2018, 1731(1731): 29-37.
|
| [19] |
Vuong TT, Rønning SB, Ahmed TAE, et al. Processed eggshell membrane powder regulates cellular functions and increase MMPactivity important in early wound healing processes[J].
PLoS One, 2018, 13(8): e0201975.
DOI: 10.1371/journal.pone.0201975. |
| [20] |
Ma ST, Shibata E, Morimoto J, et al. Therapy with siRNA for Vegf-c but not for Vegf-d suppresses wide-spectrum organ metastasis in an immunocompetent xenograft model of metastatic mammary cancer[J].
Anticancer Res, 2013, 33(10): 4237-47.
|
| [21] |
Kowalczuk O, Laudanski J, Laudanski W, et al. Lymphaticsassociated genes are downregulated at transcription level in nonsmall cell lung cancer[J].
Oncol Lett, 2018, 15(5): 6752-62.
|
| [22] |
Chen FZ, Mo XM, Wang QP, et al. Effects of rosiglitazone on the growth and lymphangiogenesis of human gastric cancer transplanted in nude mice[J].
Oncol Rep, 2013, 30(6): 2705-12.
DOI: 10.3892/or.2013.2704. |
| [23] |
Song K, Herzog BH, Sheng MJ, et al. Lenalidomide inhibits lymphangiogenesis in preclinical models of mantle cell lymphoma[J].
Cancer Res, 2013, 73(24): 7254-64.
DOI: 10.1158/0008-5472.CAN-13-0750. |
| [24] |
Ekshyyan O, Moore-Medlin TN, Raley MC, et al. Anti-lymphangiogenic properties of mTOR inhibitors in head and neck squamous cell carcinoma experimental models[J].
BMC Cancer, 2013, 13(13): 320.
|
| [25] |
Yao J, Da M, Guo T, et al. RNAi-mediated gene silencing of vascular endothelial growth factor-C inhibits tumor lymphangiogenesis and growth of gastric cancer in vivo in mice[J].
Tumour Biol, 2013, 34(3): 1493-501.
DOI: 10.1007/s13277-013-0674-6. |
| [26] |
Choi JU, Chung SW, Al-Hilal TA, et al. A heparin conjugate, LHbisD4, inhibits lymphangiogenesis and attenuates lymph node metastasis by blocking VEGF-C signaling pathway[J].
Biomaterials, 2017, 139(9): 56-66.
|
| [27] |
Güç E, Briquez PS, Foretay D, et al. Local induction of lymphangiogenesis with engineered fibrin-binding VEGF-C promotes wound healing by increasing immune cell trafficking and matrix remodeling[J].
Biomaterials, 2017, 131(3): 160-75.
|
 2018, Vol. 38
2018, Vol. 38
