2. 中山大学肿瘤防治中心//华南肿瘤学国家实验室//肿瘤医学协同创新中心,广东 广州 510060
2. Department of Radiation Oncology, Sun Yat-Sen University Cancer Center, State Key Laboratory of Oncology in South China, Guangzhou 510060, China
近年来我国宫颈癌的发病率和死亡率逐年升高,宫颈癌已经成为我国最常见的妇科恶性生殖系统肿瘤[1-3]。各期宫颈癌都可以选择放射治疗[4-5],外照射放射治疗联合图像引导的后装自适应放射治疗(IGABT),已经成为宫颈癌放射治疗的标准模式[6-9],其中后装放疗又采用后装腔内放疗+宫旁组织间自由插植相结合的技术方式[10-16]。目前该技术所使用的施源器有不锈钢、钛合金、碳纤维及塑料等材质。此类施源器因其质地坚硬、价格便宜等特点在临床上得到普遍应用,但其周围会产生一定的金属伪影,降低图像质量。由于后装治疗各分次间患者体型、膀胱、直肠等器官充盈度等不同,以及肿瘤消退等因素影响导致各分次之间肿瘤靶区以及各危及器官发生形变[17]。为了避免肿瘤靶区欠量致肿瘤未控和危及器官过量照射导致不必要的并发症,应该考虑既往所受到的累积照射剂量,目前可通过图像形变配准技术,将既往的各分次剂量形变配准融合累加到新的后装治疗图像上,然后通过总的剂量体积直方图评估各部位所受到的总剂量[18]。各分次的剂量能否准确叠加的关键取决于图像配准的精度,影响配准精度的因素有很多,包括配准算法、配准范围大小、图像质量等[19-21]。余辉等[22]回顾分析了10例使用3根金属的Fletcher施源器(1根在宫体,2根在穹窿)实施后装放疗的患者的其中两次的CT图像,分别在去除和不除施源器信息的情况下进行图像配准,证实了去除施源器信息能够提高配准精度。目前,宫颈癌后装治疗所使用的施源器为宫腔管+宫旁组织间自由插植针,由于肿瘤退缩,组织肿胀,膀胱、直肠等充盈度的不同,所使用的施源器的数量和位置每次都可能不一样,而且这种新型标准治疗模式的施源器对图像配准精度的影响少有研究。睦建锋等[23]对腹部、头部和胸部各5位患者分别进行CBCT和CT之间的配准,证实了配准范围对配准精度具有一定的影响,但其只是对图像整体的配准精度进行了研究,没有对具体的器官进行评价研究。因此,本文利用Velocity软件,综合配准框的大小和配准图像是否存在金属施源器两个影响因素考虑,研究不同的配准条件对宫颈癌后装治疗CT图像的肿瘤靶区以及重要危及器官配准精度的影响。
1 材料和方法 1.1 一般临床资料随机选取我院2017年5~12月间15例已完成三维后装放疗+宫旁组织间插值的宫颈癌患者,年龄35~62岁,中位年龄49岁,其中后装治疗均采用1根金属的宫腔管,组织间自由插植采用4~10根数量不等的金属针。
1.2 CT图像的采集采用CT模拟定位系统(Sensation, Siemens AG)进行扫描。患者均取仰卧位并以真空袋固定,CT扫描条件为扫描电压140 kV,扫描电流280 mAs,扫描重建层厚均为3 mm,层距为3 mm,扫描范围从第五腰椎到坐骨结节下缘。将获得的患者CT图像传输至放疗计划设计系统(Monaco, V3.2, Elekta AB)。
1.3 器官勾画由同一名医师在医生工作站(Focal, Version4.7, Elekta AB)分别对病人计划CT图像按照临床要求进行靶区和OARs(Organs at risk, OARs)的手动勾画,勾画的靶区体积有HRCTV(高危CTV,治疗前认定的肿瘤扩展区)、IRCTV(中危CTV,由HRCTV外扩1 cm得到)。危及器官主要包括膀胱、直肠和脊髓等。勾画完成后,将每一例患者的最后一次治疗计划CT图像(CT1)和第一次治疗计划CT图像(CT2)导入Velocity软件(Version3.2, Varian)的进行图像配准,以CT1为参考图像、CT2为浮动图像。
1.4 图像处理(1)金属施源器的体积测量:经量程为2 mL、精度为0.02 mL的量筒测量金属施源器5次的平均体积为0.24 cc;(2)金属施源器基于CT阈值的体积自动分割:选择不同CT阈值,使用Velocity软件对金属施源器进行体积自动勾画,使得勾画体积与真实体积相近,重复实验5次,得到基于各CT阈值勾画的平均体积,从而得到施源器体积识别的最佳CT阈值;(3)金属施源器的结构模拟/屏蔽:使用Velocity软件的Structure masking的功能对图像中的金属施源器进行屏蔽(CT值置为0 HU, 等效于水),从而消除其对配准精度的影响。
1.5 图像配准在Velocity软件中以CT1为参考图像、CT2为浮动图像进行图像配准。选用以下3种不同的配准范围(图 1)进行图像配准。
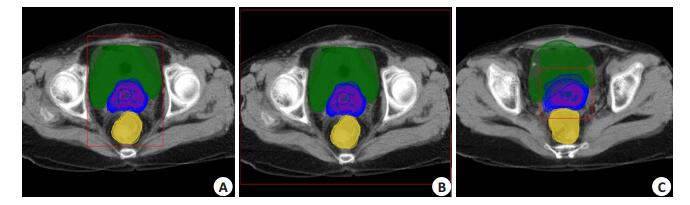
|
图 1 配准框范围大小横断面示意图 Figure 1 Transverse section of different registration regions. A: Region of registered target only (S Group); B: Region of registered interested organ structure (M Group); C: Region of registered body (L Group). |
(1)靶区附近小区域(简称配准靶区组,S组):配准范围只包括IRCTV;(2)配准器官结构区域(简称配准器官组,M组):配准范围包括HRCTV、IRCTV、Bladder和Rectum等;(3)配准全体廓范围(简称配准体廓组,L组):配准框包括CT扫描的整体图像范围。
配准的CT图像分别采用保留施源器和去除施源器两组,分析2种配准图像质量和3种配准范围共6种组合条件下的配准精度。
1.6 配准结果分析最后一次治疗计划CT图像(CT1)和各配准组第一次治疗计划CT图像(CT2)的相应结构的相似性指数(DSC)来评价不同配准方法的配准精度,其公式如下:
| $ \text{DSC=2}\left( {{\text{V}}_{\text{CT1}}}\cap {{\text{V}}_{\text{CT2}}} \right)\text{/}\left( {{\text{V}}_{\text{CT1}}}\text{+}{{\text{V}}_{\text{CT2}}} \right) $ |
其中VCT1、VCT2分别为最后一次治疗计划CT图像(CT1)和各配准组第一次治疗计划CT图像(CT2),VCT1∩VCT2为两者交集体积。该值越接近1,两者重合度越好。
1.7 统计方法用SPSS 17.0软件对各组实验数据行配对t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 不同的CT阈值自动分割的金属施源器的体积CTvalue=1700 HU时,施源器的平均体积大小为0.26 cm3;CTvalue=1800 H U时,施源器的平均大小为0.22 cm3,所以选择CTvalue值为1700~1800 HU进行施源器自动分割时,自动分割体积与真实体积(0.24 cm3)最接近。
2.2 施源器处理前配准框大小对各器官结构配准精度的影响对于靶区HRCTV和IRCTV,配准靶区组(S组)精度最高,明显好于其它两组,差别具有统计学意义(P < 0.05);对于危及器官膀胱和直肠,配准器官组(M组)精度最高,明显好于其他两组,差异具有统计学意义(P < 0.05);而配准体廓组(L组)在靶区和危及器官均没有配准精度上的优势(表 1)。
| 表 1 施源器处理前不同配准框大小对配准精度的影响 Table 1 Effect of different sizes of the registration region on registration precision without removing the applicators |
对于靶区HRCTV和IRCTV,配准靶区组(S组)精度最高,其配准精度优于或等效于配准器官组(M组),且两组配准精度均明显好于配准体廓组,差异具有统计学意义(P < 0.05);对于危及器官膀胱和直肠,配准器官组(M组)精度最高,明显好于其它两组,差异具有统计学意义(P < 0.05);而配准体廓组(L组)在靶区和危及器官均没有配准精度上的优势(表 2)。
| 表 2 施源器处理后不同配准框大小对配准精度的影响 Table 2 Effect of different sizes of the registration region on registration precision after removing the applicators |
去除施源器能明显提高配准直肠的配准精度,差别具有统计学意义(P < 0.05),且在配准器官组(M组)中其配准效果最好。而对于其他不同配准框大小的组别,去除施源器和保留施源器的图像配准,靶区IRCTV和膀胱配准精度无明显差别(表 3)。
| 表 3 施源器处理前后对配准精度的影响 Table 3 Registration precision before and after removing the applicators |
为实现后装自适应放疗,需将既往治疗扫描CT和新的治疗扫描CT进行融合配准,从而进行剂量叠加和追踪。图像配准技术精确与否直接关系到分次治疗剂量叠加的可靠性,从而影响临床治疗方案和成败,而图像配准的精度会受诸多因素的影响,主要包括所配准图像的质量[24]、不同配准算法[25]和不同配准范围大小[26]等。本研究通过对宫颈癌后装治疗各分次间的图像采取不同的配准条件(不同图像质量和不同配准范围)进行配准,找到了最合适的配准条件,为后续做剂量叠加提供了基础。在后装治疗中,金属施源器在CT成像时其周围会产生一定的金属伪影,从而降低图像质量[27],且施源器的准确定位关系到参考剂量的精确计算,同时也会影响图像的配准精度。文中首先通过量筒测量施源器的真实体积,然后利用Velocity软件的自动阈值分割功能自动勾画施源器的体积结构,从而得到施源器的最佳分割CT阈值为1700~1800 HU,这为施源器的精确定位提供了临床参考。精确定位施源器体积位置后,利用Velocity软件的Structure masking功能对图像中的金属施源器进行屏蔽,可提高图像质量,消除了金属伪影对图像配准的影响,从而提高了图像配准的精度。结果证实去除施源器后,直肠的配准精度明显变好,对于配准器官组,相对于施源器处理前其DSC值从0.664±0.152增加到0.679±0.156,差异具有统计学意义(P < 0.05)。
随着IGRT技术的深入应用已有研究者报道图像引导放疗的图像配准范围也会对配准结果产生明显的影响[28]。本实验结果也表明,不同配准范围,会有不同的配准精度。在两次CT图像配准中,仅对靶区附近范围进行图像配准,肿瘤靶区的配准精度均好于配准器官组和配准体廓组,但危及器官OAR的配准精度却明显差于配准器官组(表 2,3)。这是由于配准范围的选取决定了配准算法的搜索空间以及特征空间的大小,配准靶区时,配准算法考虑的范围仅为靶区区域,再者由于患者不同分次之间存在一定形变,靶区和危及器官的相对位置会发生变化,靶区配准精度高,周围危及器官的配准精度就会降低。
另外,配准范围越大,算法采集的配准信息越多,整体图像配准就越准确。本文得到相同结论,较大配准范围的配准器官组可以获得较好的靶区精度和最优的危及器官精度。在去除施源器组中,相对于配准靶区组,配准器官组膀胱和直肠的DSC值明显提高,差别具有统计学意义。但配准体廓组中并未获得配准精度上的优势,这是由于整体图像发生形变较大,形变配准会考虑整个图像范围内的形变大小,通过最优处理得到一个整体最佳配准,但这并不是相应器官结构的最佳配准结果。所以当配准范围包括整个图像范围时,会影响配准算法的计算结果以及配准耗时,从而影响临床效率。故不建议选用整个图像范围来进行图像配准。
综上所述,在宫颈癌后装自适应放疗中,使用Velocity软件对0.24 cc的金属施源器进行自动分割时应选择CTHU=1700~1800 HU。去除施源器可以提高图像质量,从而提高了图像配准精度,故建议在图像融合时使用去除施源器的图像并选用配准器官结构进行图像配准,这能够获得满足临床要求的较好配准精度和较高的配准效率。
| [1] |
Li H, Duan D, Xu J, et al. The incidence and mortality of cervical cancer in Ningbo during 2006-2014, China[J].
Iran J Public Health, 2017, 46(10): 1324-31.
|
| [2] |
胡尚英, 郑荣寿, 赵方辉, 等. 1989至2008年中国女性子宫颈癌发病和死亡趋势分析[J].
中国医学科学院学报, 2014, 36(2): 119-25.
DOI: 10.3881/j.issn.1000-503X.2014.02.001. |
| [3] |
赵方辉, 胡尚英, 张思维, 等. 2004~2005年中国居民子宫颈癌死亡情况及30年变化趋势[J].
中华预防医学杂志, 2010, 44(5): 408-12.
DOI: 10.3760/cma.j.issn.0253-9624.2010.05.009. |
| [4] |
Koh WJ, Greer BE, Abu-Rustum NR, et al. Cervical cancer, version 2.2015[J].
J Natl Compr Canc Netw, 2015, 13(4): 395-404; quiz 404.
DOI: 10.6004/jnccn.2015.0055. |
| [5] |
龚静, 张军. 《2016年NCCN宫颈癌临床实践指南》解读[J].
中国全科医学, 2016, 19(27): 3261-4.
DOI: 10.3969/j.issn.1007-9572.2016.27.001. |
| [6] |
Pötter R, Haie-Meder C, Van Limbergen E, et al. Recommendations from gynaecological (GYN) GEC ESTRO working group (Ⅱ): concepts and terms in 3D image-based treatment planning in cervix cancer brachytherapy-3D dose volume parameters and aspects of 3Dimage-based anatomy, radiation physics, radiobiology[J].
Radiother Oncol, 2006, 78(1): 67-77.
DOI: 10.1016/j.radonc.2005.11.014. |
| [7] |
Han K, Milosevic M, Fyles A, et al. Trends in the utilization of brachytherapy in cervical cancer in the United States[J].
Int J Radiat Oncol Biol Phys, 2013, 87(1): 111-9.
DOI: 10.1016/j.ijrobp.2013.05.033. |
| [8] |
Pötter R, Georg P, Dimopoulos JC, et al. Clinical outcome of protocol based image (MRI) guided adaptive brachytherapy combined with 3D conformal radiotherapy with or without chemotherapy in patients with locally advanced cervical cancer[J].
Radiother Oncol, 2011, 100(1): 116-23.
DOI: 10.1016/j.radonc.2011.07.012. |
| [9] |
Tanderup K, Patricia J, Catheryn M, et al. Curative radiation therapy for locally advanced cervical cancer: brachytherapy is not optional[J].
Int J Oncol Biophys, 2014(88): 537-9.
|
| [10] |
Sharma DN, Gandhi AK, Sharma S, et al. Interstitial brachytherapy vs. intensity-modulated radiation therapy for patients with cervical carcinoma not suitable for intracavitary radiation therapy[J].
Brachytherapy, 2013, 12(4): 311-6.
DOI: 10.1016/j.brachy.2012.10.003. |
| [11] |
Sharma DN, Rath GK, Thulkar S, et al. High-dose rate interstitial brachytherapy using two weekly sessions of 10 Gy each for patients with locally advanced cervical carcinoma[J].
Brachytherapy, 2011, 10(3): 242-8.
DOI: 10.1016/j.brachy.2010.09.001. |
| [12] |
Isohashi F, Yoshioka Y, Koizumi M, et al. High-dose-rate interstitial brachytherapy for previously untreated cervical carcinoma[J].
Brachytherapy, 2009, 8(2): 234-9.
DOI: 10.1016/j.brachy.2008.12.002. |
| [13] |
Mohamed S, Kallehauge J, Fokdal L, et al. Parametrial boosting in locally advanced cervical cancer: combined intracavitary/interstitial brachytherapy vs. intracavitary brachytherapy plus external beam radiotherapy[J].
Brachytherapy, 2015, 14(1): 23-8.
DOI: 10.1016/j.brachy.2014.09.010. |
| [14] |
Mesko S, Swamy U, Park SJ, et al. Early clinical outcomes of ultrasound-guided CT-planned high-dose-rate interstitial brachytherapy for primary locally advanced cervical cancer[J].
Brachytherapy, 2015, 14(5): 626-32.
DOI: 10.1016/j.brachy.2015.04.006. |
| [15] |
Yoshida K, Yamazaki H, Takenaka T, et al. Preliminary results of MRI-assisted high-dose-rate interstitial brachytherapy for uterine cervical cancer[J].
Brachytherapy, 2015, 14(1): 1-8.
DOI: 10.1016/j.brachy.2014.07.006. |
| [16] |
Nag S, Erickson B, Thomadsen B, et al. The American brachytherapy society recommendations for high-dose-rate brachytherapy for carcinoma of the cervix[J].
Int J Radiat Oncol Biol Phys, 2000, 48(1): 201-11.
DOI: 10.1016/S0360-3016(00)00497-1. |
| [17] |
李俨, 孔令玲. 宫颈癌调强放疗中膀胱状态对靶区及危及器官影响[J].
安徽医学, 2015, 36(6): 656-9.
DOI: 10.3969/j.issn.1000-0399.2015.06.005. |
| [18] |
邱大, 刘亚强.宫颈癌外照射结合后装腔内照射的剂量学评估[D].北京: 清华大学, 2012.
http://cdmd.cnki.com.cn/Article/CDMD-10003-1014021330.htm
|
| [19] |
黄伯天, 邓小武, 罗广文, 等. 图像引导放疗锥束CT与计划CT不同配准方法精度研究[J].
中华放射肿瘤学杂志, 2014, 23(2): 156-60.
DOI: 10.3760/cma.j.issn.1004-4221.2014.02.020. |
| [20] |
周露, 甄鑫, 卢文婷, 等. 基于改进Demons算法的非刚性配准及其在肿瘤放疗中的应用[J].
南方医科大学学报, 2012, 32(1): 40-5.
|
| [21] |
陈显毅, 周开利. 医学图像配准常用方法与分类[J].
信息技术, 2008, 32(7): 17-9, 24.
|
| [22] |
余辉, 张书旭. 金属施源器对盆腔部位图像配准的影响[J].
中国医学物理学杂志, 2016, 7(7): 683-6.
DOI: 10.3969/j.issn.1005-202X.2016.07.008. |
| [23] |
眭建锋, 孙鸿飞. CT和锥形束CT配准范围与精度关系研究[J].
中华放射医学与防护杂志, 2017, 37(4): 306-10.
DOI: 10.3760/cma.j.issn.0254-5098.2017.04.015. |
| [24] |
Oh S, Kim S, Sub IS, et a1. How image quality affects determination of target displacement when using kilo-voltage cone-beam computed tomography[J].
JAppl Clin Med Phys, 2007, 8: 101-7.
DOI: 10.1120/jacmp.v8i1.2440. |
| [25] |
王艳阳.影像引导肺癌立体定向放疗技术的建立与临床应用[D].上海: 复旦大学, 2009.
http://cdmd.cnki.com.cn/article/cdmd-10246-2009243167.htm
|
| [26] |
彭应林, 刘松然, 黄伯天, 等. 图像配准方法对肺癌放疗图像引导摆位精度的影响[J].
中华放射肿瘤学杂志, 2015, 24(2): 184-8.
DOI: 10.3760/cma.j.issn.1004-4221.2015.02.019. |
| [27] |
王先良, 康盛伟, 黎杰, 等. 施源器对192Ir源近距离治疗剂量的影响[J].
中华放射肿瘤学杂志, 2015, 24(5): 585-7.
DOI: 10.3760/cma.j.issn.1004-4221.2015.05.028. |
| [28] |
彭应林, 邓小武.图像配准方法对肺癌IGRT摆位精度的影响及综合配准评价策略的研究[D].武汉: 武汉大学, 2015.
|
 2018, Vol. 38
2018, Vol. 38

