2. 郑州大学第一附属医院肿瘤科,河南 郑州 450052
2. Department of Oncology, First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China
食管癌是我国最常见恶性肿瘤之一,由于早期淋巴结转移,病人预后较差。因此探讨食管癌侵袭转移早期发生、发展的机制对于提高患者预后至关重要[1-2]。上皮间质转化(EMT)是恶性肿瘤侵袭转移的第一步也是最重要的一步,因此探寻诱导EMT发生的机制,寻找针对EMT的治疗靶点对于恶性肿瘤包括食管癌的治疗具有重要意义[3-5]。
研究表明沉默信息调节因子1(SIRT1)可以通过催化蛋白质的去乙酰化调控机体多种基因的表达[6],从而在参与机体多种生物学行为的发生。国内外研究表明,SIRT1在多种肿瘤中表达上调,且与肿瘤的侵袭转移和预后密切相关[7]。有证据表明SIRT1参与肝癌、前列腺癌等EMT的发生[8]。但SIRT1在食管癌发生、发展中的作用研究甚少,SIRT1是否参与食管癌侵袭的发生、是否参与食管癌EMT的形成,是否可作为针对抑制EMT发生的治疗靶点尚无相关研究。
因此本研究拟在食管癌EC-9706和Eca-109细胞探讨SIRT1在EMT发生中的作用和机制及在食管癌EC-9706和Eca-109细胞侵袭转移中的作用,为探寻食管癌EMT发生的机制,寻找有效治疗靶点提供理论和实验依据。
1 材料和方法 1.1 细胞系食管癌EC-9706细胞系和Eca-109细胞系由本室保存。冻存EC-9706和Eca-109细胞放入37 ℃水箱中快速复苏,离心后弃上清于含10% FBS的RPMI 1640培养基中,37 ℃,5%CO2条件下培养,次日更换培养液。每2 d传代1次,实验所用细胞均处于对数生长期。
1.2 实验试剂RPMI 1640培养基及FBS胎牛血清(Gibco);ECL化学发光试剂盒、HRP标记羊抗兔或羊抗鼠二抗及BCA蛋白浓度测定试剂盒(碧云天);鼠抗人SIRT1抗体,鼠抗人E-cadherin抗体、鼠抗人twsit1抗体、兔抗人vimentin抗体、兔抗人Snail抗体和兔抗人ZEB抗体(abcam);transwell侵袭小室(BD)司;Trizol试剂及Lipofectamine 2000转染试剂(Invitrogen);cDNA第一链合成试剂盒及SYBR® Premix Ex TaqTM Ⅱ(宝生物);其他试剂均为分析纯试剂。
1.3 siRNA的设计及转染根据SIRT1在GenBank中的序列(NM_012238.4)设计3对siRNA,序列为:siRNA1:UGAACAAAA GUAUAUGGACCU;siRNA2:UUUGCAAACUUGA AGAAUGGU;siRNA3:ACUAGAACCAACAUUCU UCAA;同时设计阴性对照siRNA(GUGACAAGUU CAAGCUCAAGC)。所设计序列均进行同源性分析以确保其特异性。根据Lipofectamine 2000转染试剂说明书进行转染,转染前24 h,取对数生长期EC-9706细胞接种于六孔板(2×105/孔)。转染前4 h转为无抗生素无血清培养基培养。转染siRNA终浓度为100 nmol/L,以未转染细胞为空白对照。转染后6 h,更换为全培液培养至48 h后收集细胞进行后续实验。
1.4 总RNA提取、逆转录及real-time PCRTrizol提取EC-9706和Eca-109细胞总RNA,Nanodrop 2000核酸测定仪测定RNA浓度,同时测定RNA在260/280及260/230的比值用于判断提取RNA的质量。根据宝生物cDNA第一链合成试剂盒逆转录cDNA,4 ℃保存。Real-time PCR反应体系如下:SYBR® Premix Ex TaqTM Ⅱ 10 μL,上下游引物各1 μL,DNA模板2 μL,灭菌双蒸水6 μL,反应体系为20 μL。PCR反应前,95 ℃模板预变性30 s,随后进入PCR扩增阶段,共扩增35个循环。定量分析结果,并重复实验两次,统计分析结果。实验所用引物如下:SIRT1上游引物:5'-AAGGCCACGGATAGGTCCAT-3',下游引物: 5'-TCAGGTGGAGGTATTGTTTCCG-3',扩增片段大小为:108 bp;E-cadherin上游引物:5'-ATGCTGATGC CCCCAATACC-3',下游引物:5'-ATCTTGCCAGGTC CTTTGCT-3',扩增片段大小为:135 bp;vimentin上游引物:5'-GGTGCAATCGTGATCTGGGA-3',下游引物: 5'-GTCTTTGCTCGAATGTGCGG-3',扩增片段大小为:95 bp;Snail上游引物:5'-CGAGTGGTTCTTCT GCGCTA-3',下游引物:5'-GGGCTGCTGGAAGGTA AACT-3',扩增片段大小为:160 bp;twist1上游引物:5'- TACGCCTTCTCGGTCTGGAG-3',下游引物:5'-C GTCTGGGAATCACTGTCCA-3',扩增片段大小为:291 bp;ZEB上游引物:5'-GGATCAGGTCGTCGGTC TTG-3',下游引物:5'-CTGGTCTGTTGGCAGGTCAT- 3',扩增片段大小为:205 bp;β-actin上游引物:5'-CCG TTCCGAAAGTTGCCTTTT-3',下游引物:5'-ATCAT CCATGGTGAGCTGGC-3',扩增片段大小为:170 bp。
1.5 Western blotting取出培养细胞放置-80 ℃ 5 min,加入RIPA和PMSF混合细胞裂解液80 μL,充分裂解后吸出液体至EP管,震荡离心后吸取上清液,BCA检测试剂盒检测浓度后-80 ℃保存。上样蛋白100 ℃水浴锅变性10 min,50 μL上样针吸取样品加入制备好的SDS-PAGE胶孔,电泳结束后PVDF膜湿转,含5%脱脂奶粉的PBS封闭PVDF膜,4 ℃一抗孵育过夜,TBST洗涤3次后二抗室温孵育1 h,洗涤3次,ECL化学发光剂显影曝光,Image Lab分析软件分析结果。实验重复3次。
1.6 Transwell侵袭小室实验接种EC-9706和Eca-109细胞前,小室包被基质胶(300 mg/mL),37 ℃温箱内干燥2 h。之后,上室接种无血清培养基悬浮的EC-9706和Eca-109细胞2×105个,下室加含10%FBS的PRMI 1640培养基。48 h取出滤膜用棉签擦去上室细胞后固定,结晶紫染色1 h,显微镜下随机计数10个视野细胞。
1.7 划痕实验接种单层细胞于6孔板,200 μL枪头在贴壁细胞上划出一条平行裂口,PBS冲洗后拍照。48 h后继续拍照。Leica Application Suite软件分析划痕愈合的距离,从而反应细胞的迁移。实验重复3次。
1.8 统计学分析实验结果采用SPSS13.0软件分析。计量资料采用均数±标准差,两两均数比较采用t检验,多组间均数比较运用方差分析,P < 0.05为差异有统计学意义。
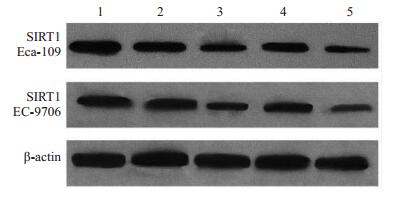
2 结果 2.1 靶向SIRT1的siRNA对SIRT1 mRNA和蛋白表达的影响Real-time PCR结果显示与空白对照(未转染EC- 9706和Eca-109细胞)和阴性对照(转染阴性对照siRNA)组相比,转染SIRT1 siRNA1和转染SIRT1 siRNA3组EC-9706和Eca-109细胞SIRT1 mRNA表达明显下降,差异有统计学意义(P < 0.01),而转染SIRT1 siRNA2组EC-9706和Eca-109细胞SIRT1 mRNA的表达与对照组相比差异无统计学意义(P>0.05,表 1,2)。Western blot结果显示转染SIRT1 siRNA1和转染SIRT1 siRNA3组EC-9706和Eca-109细胞SIRT1蛋白表达同样明显下降,与对照组相比差异有统计学意义(P < 0.01),而转染SIRT1 siRNA2组EC-9706和Eca-109细胞SIRT1蛋白的表达与对照组相比差异无统计学意义(P>0.05,图 1)。因此选择转染SIRT1 siRNA1和转染SIRT1 siRNA3组EC-9706和Eca-109细胞进行后续实验。
| 表 1 SIRT1 siRNA转染对食管癌EC-9706细胞中SIRT1 mRNA表达的影响 Table 1 mRNA expression of SIRT1 in EC-9706 cells transfected with SIRT1 siRNA |
| 表 2 SIRT1 siRNA转染对食管癌Eca-019细胞中SIRT1 mRNA表达的影响 Table 2 mRNA expression of SIRT1 in Eca-109 cells transfected with SIRT1 siRNA |
|
图 1 SIRT1 siRNA转染对食管癌EC-9706和Eca-109细胞中SIRT1蛋白表达的影响 Figure 1 Protein expression of SIRT1 in EC-9706 and Eca- 109 cells transfected with SIRT1 siRNA. 1: Blank control; 2: Negative control; 3: SIRT1 siRNA1; 4: SIRT1 siRNA2. 5: SIRT1 siRNA3. |
Transwell侵袭小室实验结果显示与空白对照组(86.5±16.3)和阴性对照组(83.2±7.9)相比,转染SIRT1 siRNA1组EC- 9706细胞(53.8 ± 11.4)和转染SIRT1 siRNA3组EC-9706细胞(44.2±15.3)穿膜能力明显下降,差异有统计学意义(P < 0.05)。转染SIRT1 siRNA1组Eca-109细胞(80.6±10.3)和转染SIRT1 siRNA3组Eca-109细胞(74.4±19.7)穿膜能力与对照组(空白组:100.9±20.1,阴性对照组:103.8±19.6)相比同样明显下降,差异有统计学意义(P < 0.05)。
2.3 干扰SIRT1的表达对EC-9706和Eca-109细胞转移能力的影响划痕实验结果显示与空白对照组(0.385±0.026)和阴性对照组(0.378±0.031)相比,转染SIRT1 siRNA1组EC-9706细胞(0.269±0.025)和转染SIRT1 siRNA3组EC-9706细胞(0.247±0.034)划痕愈合能力明显下降,差异有统计学意义(P < 0.05)。同样,转染SIRT1 siRNA1组Eca-109细胞(0.313±0.024)和转染SIRT1 siRNA3组Eca-109细胞(0.298±0.036),与对照组(空白组:0.412± 0.027 mm,阴性对照组:0.408±0.041 mm)相比差异有统计学意义(P < 0.05)。
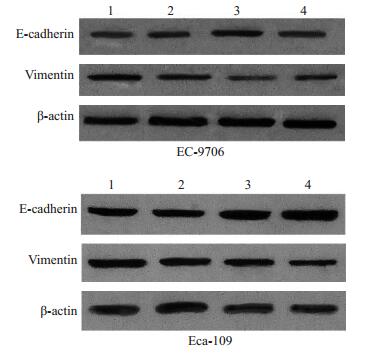
2.4 干扰SIRT1的表达对EC-9706和Eca-109 EMT发生的影响结果显示与空白组和阴性对照组相比,转染SIRT1 siRNA1组和转染SIRT1 siRNA3组EC-9706和和Eca-109细胞E-cadherin表达增高而vimentin表达则显著下降,差异有统计学意义(P < 0.05,表 3,4,图 2)。
| 表 3 SIRT1 siRNA转染对食管癌EC-9706细胞中E-cadherin和vimentin mRNA表达的影响 Table 3 mRNA expression of E-cadherin and vimentin in EC-9706 cells transfected with SIRT1 siRNA |
| 表 4 SIRT1 siRNA转染对食管癌Eca-109细胞中E-cadherin和vimentin mRNA表达的影响 Table 4 mRNA expression of E- cadherin and vimentin in Eca-109 cells transfected with SIRT1 siRNA |
|
图 2 SIRT1 siRNA转染对食管癌EC-9706和Eca-109细胞中E-cadherin和vimentin蛋白表达的影响 Figure 2 Protein expression of E-cadherin and vimentin in EC-9706 and Eca-109 cells transfected with SIRT1 siRNA(Red box for groups with significant difference). 1: Blank control; 2: Negative control; 3: SIRT1 siRNA1; 4: SIRT1 siRNA3. |
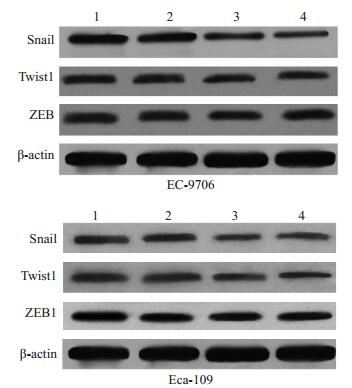
EC-9706细胞结果显示与空白组和阴性对照组相比,转染SIRT1 siRNA1组和转染SIRT1 siRNA3组EC- 9706细胞Snail mRNA和蛋白表达明显下降,与空白组和阴性对照组相比差异有统计学意义(P < 0.01,表 3,图 3)。转染SIRT1 siRNA1组和转染SIRT1 siRNA3组EC-9706细胞twist1和ZEB mRNA和蛋白的表达略有下降,与空白组和阴性对照组相比差异无统计学意义(P>0.05,表 5,图 3)。Eca-109结果显示与空白组和阴性对照组相比,转染SIRT1 siRNA1组和转染SIRT1 siRNA3组Eca-109细胞Snail和twist1 mRNA和蛋白表达明显下降,与空白组和阴性对照组相比差异有统计学意义(P < 0.01)。而转染SIRT1 siRNA1组和转染SIRT1 siRNA3组Eca-109细胞ZEB mRNA和蛋白的表达略有下降,与空白组和阴性对照组相比差异无统计学意义(P>0.05,表 6,图 3)。
|
图 3 SIRT1 siRNA转染对食管癌EC-9706和Eca-109细胞中Snail、twist1和ZEB蛋白表达的影响 Figure 3 Protein expression of Snail, twist1 and ZEB in EC- 9706 and Eca-109 cells transfected with SIRT1 siRNA (Red box for groups with significant difference). 1: Blank control; 2: Negative control; 3: SIRT1 siRNA1; 4: SIRT1 siRNA3. |
| 表 5 SIRT1 siRNA转染对食管癌EC-9706细胞中Snail、twist1和ZEB mRNA表达的影响 Table 5 mRNAexpression of Snail, Twist1 and ZEB in EC-9706 cells transfected with SIRT1 siRNA |
| 表 6 SIRT1 siRNA转染对食管癌Eca-109细胞中Snail、twist1和ZEB mRNA表达的影响 Table 6 mRNAexpression of Snail, Twist1 and ZEB in Eca-109cells transfected with SIRT1 siRNA |
食管癌是我国最常见的恶性肿瘤之一,其生物学特征是早期的侵袭转移和易复发,因此食管癌预后较差。虽然现在针对食管癌的手术治疗、放化疗等日趋完善,但仍难达到令人满意的疗效[1, 9]。因此探讨食管癌侵袭转移发生的机制并探寻相应的干预手段非常必要。
肿瘤侵袭转移的发生是一个多步骤的复杂的过程,涉及多种机制和信号通路。越来越多的国内外研究表明SIRT1可以通过调控多种机制或信号通路而在侵袭转移发生中起到重要作用[10-12]。但SIRT1在不同类型肿瘤中作用不同,有些是作为癌基因发挥作用,而在有些肿瘤中则作为抑癌基因起作用。为了研究SIRT1在食管癌发生、发展中的作用,我们设计3对靶向SIRT1的siRNA并转染入食管癌EC-9706和Eca-109细胞,realtime PCR和western blot结果显示转染SIRT1 siRNA1和转染SIRT1 siRNA3组EC-9706和Eca-109细胞SIRT1 mRNA和蛋白表达明显下降,和对照组相比差异有统计学意义。说明SIRT1在食管癌中作为癌基因在发挥作用。为了进一步探讨SIRT1在食管癌侵袭转移中的作用,我们采用Transwell侵袭小室和划痕实验检测EC-9706和Eca-109细胞的穿膜能力和划痕愈合能力。结果显示转染SIRT1 siRNA1和转染SIRT1 siRNA3组EC-9706和Eca-109细胞的穿膜能力和划痕愈合能力较对照组明显下降,差异有统计学意义。说明抑制食管癌EC-9706和Eca-109细胞SIRT1基因的表达可抑制EC-9706和Eca-109细胞的侵袭转移能力。
SIRT1在食管癌侵袭转移中的作用也有报道。孔德华等[13]报道指出SIRT1在食管癌中的表达明显高于癌旁组织,且其表达高低与肿瘤浸润深度和淋巴结转移密切相关。Ma等[14]的研究表明SIRT1在食管癌侵袭转移中发挥作用。但SIRT1如何在食管癌EC-9706和Eca-109细胞侵袭转移中发挥作用还知之甚少。
EMT是恶性肿瘤发生侵袭转移的第一步也是最重要的一步。有研究表明SIRT1在结肠癌[15-16],肺癌[17-18]、前列腺癌[19]等中通过诱导EMT从而在侵袭转移中发挥作用。那么SIRT1是否也可以通过诱导EMT发生在食管癌侵袭转移中发挥作用,为此,我们采用real-time PCR和western blot的方法检测转染SIRT1 siRNA1和SIRT1 siRNA3的EC-9706和Eca-109细胞中Ecadherin和vimentin的表达。E-cadherin是一种跨膜蛋白,是上皮表型的重要标志,在维持上皮组织稳定性中发挥关键作用[20]。E-cadherin的表达降低是评价EMT的主要标志[21]。在EMT发生过程中随着上皮表型表达下降,间质表型的表达会明显升高,vimentin是其中主要的代表[22-24]。实验结果显示,随着SIRT1表达下降,Ecadherin的表达升高而vimentin的表达下降,说明抑制SIRT1的表达可抑制食管癌EC-9706和Eca-109细胞EMT的发生。
如上所述,EMT发生过程中的标志性改变就是Ecadherin表达下调,它是EMT发生中的最重要的分子事件,研究表明,肿瘤组织中E-cadherin失活的机制主要包括该基因的转录抑制、启动子区的甲基化及突变失活,其中E-cadherin的转录抑制更受到人们的关注[25-27]。目前E-cadherin的转录抑制因子主要分为三大类——Snail [28]、ZEB [29]以及bHLH家族的twist [30]。因此我们采用real-time PCR和western blot的方法检测E-cadherin主要转录因子Snail、twist1和ZEB的表达,结果显示转染SIRT1 siRNA1和SIRT1 siRNA3的EC-9706细胞中Snail表达明显下降,而twist1和ZEB的表达改变不明显,与对照组相比无统计学差异,twsit1是否参与食管癌EMT发生还有待进一步研究。
综上所述,SIRT1可通过调控Snail的表达参与食管癌EC-9706和Eca-109细胞EMT发生从而在其侵袭转移中发挥作用,SIRT1有望成为食管癌早期诊断和治疗的靶点之一。
| [1] |
霍小东. ZEB2在食管癌侵袭转移中的作用及其机制研究[D].天津: 天津医科大学, 2017.
http://cdmd.cnki.com.cn/Article/CDMD-10062-1017873452.htm
|
| [2] |
魏娉, 路三军, 严金海, 等. Slug与食管癌侵袭转移间的关系及其调控机制研究[J].
东南大学学报:医学版, 2016, 35(4): 569-74.
|
| [3] |
Yuan H, Su L, Chen WY. The emerging and diverse roles of sirtuins in cancer: a clinical perspective[J].
Onco Targets Ther, 2013, 6: 1399-416.
|
| [4] |
李裕明. SIRT1通过增强PGC-1α介导的线粒体发生而促进肝癌转移的实验研究[D].重庆: 第三军医大学, 2016.
http://cdmd.cnki.com.cn/Article/CDMD-90031-1016277132.htm
|
| [5] |
Ferrer CM, Lu TY, Bacigalupa ZA, et al. O-GlcNAcylation regulates breast cancer metastasis via SIRT1 modulation of FOXM1 pathway[J].
Oncogene, 2017, 36(4): 559-69.
DOI: 10.1038/onc.2016.228. |
| [6] |
杨晓, 甘蓉, 杨英梅, 等. miRNA-221和miRNA-222对前列腺癌细胞PC-3的增殖、迁移及SIRT1表达的调控[J].
检验医学, 2014, 29(5): 446-51.
DOI: 10.3969/j.issn.1673-8640.2014.05.005. |
| [7] |
陈文楠, 杨柳, 宫惠琳, 等. 去乙酰化酶Sirt1对神经母细胞瘤SK-NSN细胞中Tau蛋白表达及磷酸化水平的影响[J].
西安交通大学学报:医学版, 2017, 38(3): 410-5.
|
| [8] |
王一涵, 赵斌, 李龙浩, 等. SIRT1表达水平与肿瘤患者预后关系的研究[J].
现代医药卫生, 2018, 34(10): 1464-8.
DOI: 10.3969/j.issn.1009-5519.2018.10.008. |
| [9] |
Sohda M, Kuwano H. Current status and future prospects for esophageal cancer treatment[J].
Ann Thorac Cardiovasc Surg, 2017, 23(1): 1-11.
DOI: 10.5761/atcs.ra.16-00162. |
| [10] |
Cao B, Shi Q, Wang W. Higher expression of SIRT1 induced resistance of esophageal squamous cell carcinoma cells to cisplatin[J].
J Thorac Dis, 2015, 7(4): 711-9.
|
| [11] |
石晓丽. SIRT1的抑制剂EX527对耐药细胞侵袭转移的影响及机制研究[D].郑州: 郑州大学, 2018.
|
| [12] |
Ren NSX, Ji M, Tokar EJ, et al. Haploinsufficiency of SIRT1 enhances glutamine metabolism and promotes cancer development[J].
Curr Biol, 2017, 27(4): 483-94.
DOI: 10.1016/j.cub.2016.12.047. |
| [13] |
孔德华, 曾薇, 朱金峰, 等. SIRT1的表达在食管鳞状细胞癌侵袭转移中的临床意义[J].
天津医药, 2018, 46(02): 166-70.
|
| [14] |
Ma MC, Chiu TJ, Lu HI, et al. SIRT1 overexpression is an Independent prognosticator for patients with esophageal squamous cell carcinoma[J].
J Cardiothorac Surg, 2018, 13(1): 25.
DOI: 10.1186/s13019-018-0718-5. |
| [15] |
Buhrmann C, Shayan P, Popper B, et al. Sirt1 is required for resveratrol-mediated chemopreventive effects in colorectal cancer cells[J].
Nutrients, 2016, 8(3): 145.
DOI: 10.3390/nu8030145. |
| [16] |
Chen X, Sun K, Jiao S, et al. High levels of SIRT1 expression enhance tumorigenesis and associate with a poor prognosis of colorectal carcinoma patients[J].
Sci Rep, 2014, 4: 7481.
|
| [17] |
Li X, Jiang Z, Li X, et al. SIRT1 overexpression protects non-small cell lung cancer cells against osteopontin-induced epithelialmesenchymal transition by suppressing NF-κB signaling[J].
Onco Targets Ther, 2018, 11: 1157-71.
DOI: 10.2147/OTT. |
| [18] |
Xie M, Liu M, He CS. SIRT1 regulates endothelial Notch signaling in lung cancer[J].
PLoS One, 2012, 7(9): e45331.
DOI: 10.1371/journal.pone.0045331. |
| [19] |
Zhang N, Xie T, Xian M, et al. SIRT1 promotes metastasis of human osteosarcoma cells[J].
Oncotarget, 2016, 7(48): 79654-69.
|
| [20] |
曾宪焕, 陈宁霞, 韩泽民, 等. E-cadherin在恶性肿瘤侵袭转移进程中的作用[J].
武警医学, 2016, 27(2): 193-7.
DOI: 10.3969/j.issn.1004-3594.2016.02.027. |
| [21] |
魏红, 李华, 赵丽花, 等. 上皮钙黏蛋白与肿瘤关系的研究进展[J].
临床合理用药杂志, 2016, 9(6): 179-80.
|
| [22] |
Palmirotta R, Cives M, Della-Morte D, et al. Sirtuins and cancer:role in the epithelial-mesenchymal transition[J].
Oxid Med Cell Longev, 2016, 2016: 3031459.
|
| [23] |
Santamaria PG, Moreno-bueno G, Portillo F, et al. EMT: Present and future in clinical oncology[J].
Molr Oncol, 2017, 11(7): 718-38.
DOI: 10.1002/mol2.2017.11.issue-7. |
| [24] |
Liu PF, Kang BH, Wu YM, et al. Vimentin is a potential prognostic factor for tongue squamous cell carcinoma among five epithelialmesenchymal transition-related proteins[J].
PLoS One, 2017, 12(6): e0178581.
DOI: 10.1371/journal.pone.0178581. |
| [25] |
杨森果, 毛大华, 杨海松, 等. E-cadherin与肿瘤侵袭, 转移相关性研究进展[J].
医学信息, 2018, 31(3): 3-6.
DOI: 10.3969/j.issn.1000-8039.2018.03.002. |
| [26] |
Smith BN, Bhowmick N. Role of EMT in metastasis and therapy resistance. brenner DA, kisseleva T, Fuxe J, eds[J].
J Clin Med, 2016, 5(2): 17.
DOI: 10.3390/jcm5020017. |
| [27] |
Heerboth S, Housman G, Leary M, et al. EMT and tumor metastasis[J].
Clin Transl Med, 2015, 4(1): 6.
DOI: 10.1186/s40169-015-0048-3. |
| [28] |
唐青, 侯建青. Snail介导的EMT在上皮性卵巢癌组织中的作用[J].
中国医药科学, 2014, 4(7): 9-13, 20.
|
| [29] |
甘泉, 苏瑾, 蒋壁谦, 等. STAT3通过ZEB1调节卵巢癌细胞SKOV- 3中E-cadherin表达的研究[J].
现代肿瘤医学, 2014, 22(11): 2548-52.
DOI: 10.3969/j.issn.1672-4992.2014.11.10. |
| [30] |
王文双, 杨兴升, 马先莹. Twist介导的上皮间质转化在卵巢癌组织中的作用[J].
中国医科大学学报, 2012, 41(2): 175-7.
DOI: 10.3969/j.issn.0258-4646.2012.02.023. |
 2018, Vol. 38
2018, Vol. 38

