外阴鳞状上皮内病变具有潜在的癌变倾向,有发展为浸润癌的可能,2%~4%进展为浸润癌[1]。WHO女性生殖器官肿瘤分类将外阴鳞状上皮内病变分为:低级别鳞状上皮内病变、高级别鳞状上皮内病变和分化型外阴上皮内瘤变[2]。近年来,研究发现外阴鳞状上皮内病变和外阴癌的发病率均逐步增加且外阴鳞状上皮内病变发病率相比2006年的5.7/10万,到2016年时发病率增长了1倍,且更趋于年轻女性[3]。然而目前,外阴鳞状上皮内病变的确切病因尚未完全明确,且尚无一种确切有效的治疗方式。现临床主要治疗方式包括药物治疗、手术治疗以及物理治疗等,但患者治疗后复发率仍高达25%~50% [4-5],且仍有进一步发展为外阴癌的可能,因此对患者生活及心理产生了严重影响。
由于临床标本难以获得,这为研究该疾病的发病机制及治疗机制带来困难,因此建立一种可靠的动物模型代替人外阴鳞状上皮内病变来探讨其发病机制、治疗机制、治疗疗效评估以及预后等显得尤为重要。近年,有研究报道用129/J型小鼠采取腹部皮下注射苯甲酸雌二醇可以建立VIN模型,其造模成功率分别报道为65.5%和40% [6-7]。但该造模方式外阴发生癌变机制尚不清楚且模型诱导成功率较低,再者129/J型小鼠目前市场价格昂贵且不易获得,对于需大批量动物模型的实验不再经济且可行性低。杨欢等[8]参考口腔鳞癌癌前病变动物模型用二甲基苯并蒽(DMBA)诱导出以鳞状上皮棘层细胞单纯性增生为特点的SD大鼠外阴慢性单纯性苔藓模型。DMBA作为一种致癌诱导剂,是否可以诱导出以外阴鳞状上皮细胞异型性增生为特点的外阴鳞状上皮内病变尚不清楚,因此本研究考虑应用DMBA涂抹法通过延长药物作用时间以期诱导出外阴鳞状上皮内病变大鼠模型。
1 材料和方法 1.1 实验动物与分组SPF级70只雌性SD大鼠,6~8周龄,体质量160~ 180 g,均购自于重庆医科大学动物实验中心(动物使用许可证号:SYXK(渝) 2017-0023)。将70只雌性SD大鼠分成4个组,即:空白对照组(10只),不给予任何处理;机械刺激组(10只),给予SD大鼠外阴皮肤单纯机械刺激;丙酮组(10只),给予外阴皮肤涂抹丙酮溶液;机械刺激+DMBA丙酮实验组(模型组,40只),给予外阴皮肤单纯机械刺激联合涂抹0.5% [8]DMBA丙酮溶液。
1.2 主要药品及试剂DMBA(Sigma);DMBA与分析纯丙酮溶液配制成0.5%的DMBA丙酮溶液,置于4 ℃冰箱内于棕色试剂瓶中保存备用;甲苯胺蓝(上海阿拉丁);p53单克隆抗体、血管内皮生长因子(VEGF)单克隆抗体(novus);ZB-2301山羊抗兔IgG(北京中杉公司);Trizol总RNA提取试剂(Servicebio);GAPDH(康成生物);逆转录试剂盒(Thermo);SYBR Green(Roche)。
1.3 动物模型的建立将SD大鼠用0.6%戊巴比妥钠溶液进行腹腔注射麻醉,待其麻醉后,用动物剃毛器进行剃毛备皮并清洁外阴皮肤。取模型组SD大鼠,充分暴露外阴,用硬毛牙刷刷外阴皮肤,刷至皮肤充血发红即可;再用勾线笔蘸取适量0.5%DMBA丙酮溶液涂抹于外阴皮肤1次,待其自然晾干后放回代养笼常规饲养。每周均于周一、三、五固定的时间给予处理,共处理14周,观察至18周。丙酮组丙酮溶液涂抹方法和机械刺激组机械刺激方法如前所述。
1.4 实验观察及病检在实验过程中密切观察SD大鼠的一般情况,包括:活动、食欲、精神状态等,观察大鼠外阴皮肤形态及变化情况,每周称体质量1次,触诊大鼠其他部位是否有肿块或淋巴结肿大等。分别于6、8、10、12、14、18周将各组SD大鼠麻醉后用1%甲苯胺蓝溶液涂抹于外阴皮肤,再用1%醋酸进行脱色,在不脱色处取材,用皮肤钻环钻取SD大鼠外阴皮肤组织,组织以4%多聚甲醛组织固定液固定,脱水,石蜡包埋,4 μm厚连续切片,HE染色后行光镜观察大鼠外阴皮肤变化情况。动物模型建立的病理诊断标准及分类参考2006年国际外阴阴道疾病学会外阴皮肤病理分类及2014年WHO女性生殖器官肿瘤分类[2, 9]。
1.5 免疫组织化学取空白对照组及模型组活检确定为外阴鳞状上皮内病变的皮肤组织石蜡块,切片后脱蜡清洗再抗原修复,室温避光环境中将玻片放入3%双氧水溶液中,孵育25 min,再PBS洗涤3次(pH:7.4),5 min/次;滴加3% BSA室温封闭30 min,滴加PBS按一定比例配好的一抗,PBS洗涤3次后,再滴加与一抗相应种属的二抗,室温孵育50 min;PBS洗涤3次后,用DAB显色液显色,最后脱水封片,用显微镜镜检,采用软件IPP 6.0进行光密度分析;每张切片在高倍镜下随机选取5个高倍视野,计算平均光密度值;平均光密度值代表蛋白相对表达的强度。
1.6 免疫印迹法取冻存于-80 ℃的空白对照组外阴皮肤组织及模型组大鼠活检确定为外阴鳞状上皮内病变的皮肤组织,用100 mg外阴皮肤组织块提取组织蛋白,测定蛋白质浓度;每个样本上蛋白样品量50 μg在聚丙烯凝胶(12%分离胶,4%浓缩胶)中进行电泳分离(电泳电压:浓缩胶80 V,分离胶120 V);电泳后将凝胶上的蛋白质转移至PVDF膜上(300 mA,90 min),用5%脱脂奶粉中室温下封闭4 h,先加入一抗(1: 1000,0.01 M PBT配制)和对应的二抗(1: 1000,0.01 M PBST配制),最后将PVDF置于化学发光试剂中增强反应1~3 min,暗室中爆光,常规方法显影,定影;图像采用凝胶成像系统进行分析,计算其光密度值;以目的蛋白/GAPDH值统计蛋白相对表达量进行半定量分析。
1.7 qRT-PCR取冻存于-80 ℃的空白对照组外阴皮肤组织及模型组大鼠活检确定为外阴鳞状上皮内病变的皮肤组织,用Trizol提取总RNA,使用Nanodrop 2000检测RNA浓度,提取2 μg总RNA逆转录合成cDNA,在FX9600荧光定量PCR仪器(Bio-Rad公司)上进行PCR反应。VEGF引物序列:5'ACCCTGGCTTTACTGCTGTA3'/ 5'CTCCAGG GCTTCATCATTGC3';突变型p53(mtp53)引物序列参考Minicucci等[10]p53基因顺序设计引物,由武汉赛维尔生物科技有限公司合成,5'CAGCGACAGGGTCACCTAATTC3'/5'GGCAGAA CAGCTTATTGAGGGA3';β-actin为内参,引物序列:5'TGCTATGTTGCCCTAGACTTCG3'/5'GTTGGCAT AG AGGTCTTTACGG3'。PCR反应循环条件:预变性(95 ℃ 10 min);PCR反应(95 ℃,15 s→60 ℃,60 s;共循环40次)。采用2-ΔΔCt法计算mtp53和VEGF mRNA的相对含量。
1.8 统计学方法所有数据均采用SPSS22.0统计软件进行处理。计量数据采用均数±标准差表示。组间mtp53、和VEGF相对表达量的比较采用独立样本t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况及大体形态观察空白对照组SD大鼠一般情况良好,食欲尚可,活动自如,精神状态良好等,体质量均匀增加,外阴皮肤正常且完整无破损,富有弹性,未触及异常肿块及肿大淋巴结(图 1A)。机械刺激组和丙酮组大鼠各个时期外阴皮肤情况(图 1B,C)与空白对照组无明显差异。模型组与同期对照组大鼠相比,体质量均较轻;药物涂抹第10周时,开始可见大小不等外生性生长的乳头状新生物,呈淡粉色,但直径均小于5 mm,与周围正常组织界限清晰(图 1D);第14周,乳头状新生物进一步增大,可见表面出血坏死点(图 1E);第18周,可见明显外阴肿瘤,表面明显出血坏死,触碰后坏死组织易脱落(图 1F)。
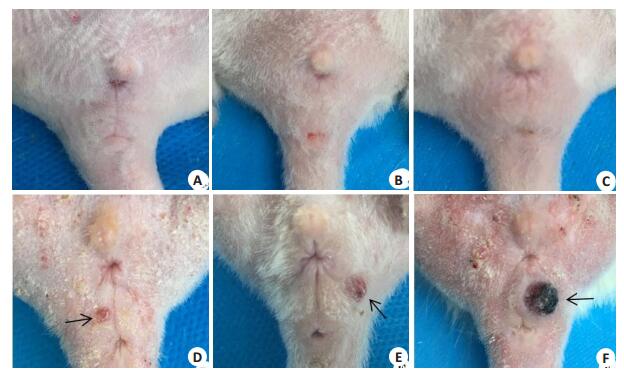
|
图 1 SD大鼠不同时期外阴皮肤形态学变化 Figure 1 Morphology of the vulvar skin of the rats at different time points. A: Vulvar skin of a normal SD rat (blank control group); B: Vulvar skin of a rat in mechanical irritation group at 18 weeks; C: Vulvar skin of a rat in acetone solution group at 18 weeks; D-F: Vulvar skin of a rat at 10 weeks (arrows indicate papillary hyperplasia), 14 weeks (arrows indicate bleeding and necrosis foci), and 18 weeks (arrows indicate vulvar skin tumor), respectively. |
空白对照组大鼠皮肤完整,表皮、真皮及皮下组织层次清晰;表皮组织薄,约2~4层细胞,基底层细胞排列规整(图 2A),各时期组织病理学变化无明显差异。机械刺激组及丙酮组大鼠各时期组织病理学情况(图 2B,C)与空白对照组基本相同,整个实验过程3组病理学变化无明显差异。模型组:在第8周可见(40/40)所有大鼠皮肤呈单纯鳞状上皮增生,无明显异型及核分裂象;第10周(9/40)22.5%大鼠皮肤可见类似低级别鳞状上皮内病变改变,具体为鳞状上皮增厚,上皮下半部细胞密度增加,细胞核极性轻度紊乱,大小不等,有轻度异形性,可见核分裂象位于上皮下1/3,上皮的上2/3分化成熟(图 2D);第14周(28/40)70.0%大鼠皮肤类似低级别鳞状上皮内病变改变,(11/40)27.5%大鼠出现类似高级别鳞状上皮内病变改变,即上皮增厚明显,全层2/3以上细胞中度异形,细胞极性紊乱,伴角化亢进及角化不全,增生的鳞状上皮可见异常角化珠及丰富嗜酸性胞浆细胞(图 2E);第18周(9/40)22.5%大鼠形成外阴鳞状细胞癌(VSCC),镜下可见鳞状上皮细胞全层排列紊乱,极性丧失,基底部可见反常角化,鳞状上皮呈蟹足样浸润性生长,可见促纤维间质反应,细胞核增大,核轮廓不规则,染色质边集,核仁明显,易见病理性核分裂像(图 2F)。模型组具体各个时期组织病理学变化情况如表 1所示。
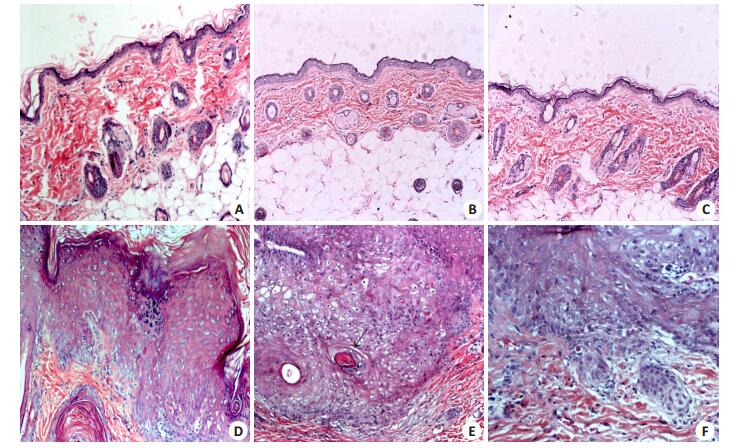
|
图 2 SD大鼠外阴皮肤组织病理学变化 Figure 2 Pathology of the vulvar skin of the SD rats (HE staining, original magnification: ×100 if not specified otherwise). A: Normal vulvar skin of a SD rat; B: Vulvar skin of a SD rat in mechanical irritation group; C: Vulvar skin of a SD rat in acetone solution group; D: Low-grade squamous intraepithelial lesion (LSIL) in a rat in the model group; E: High-grade squamous intraepithelial lesion (HSIL, arrows indicate keratin pearl) in a rat in the model group; F: Vulvar squamous cell carcinoma in a rat in the model group (×200). |
| 表 1 模型组SD大鼠外阴皮肤各时期组织病理学变化 Table 1 Pathological changes in the vulvar skin at different time points in the model group (n) |
空白对照组和模型组SD大鼠外阴皮肤mtp53和VEGF蛋白的表达(图 3A~D)显示,mtp53表达定位于细胞核,VEGF表达位于细胞膜和胞浆中,阳性染色均为棕黄色颗粒;与空白对照组相比,模型组大鼠外阴组织中mtp53和VEGF蛋白相对表达量均较明显。
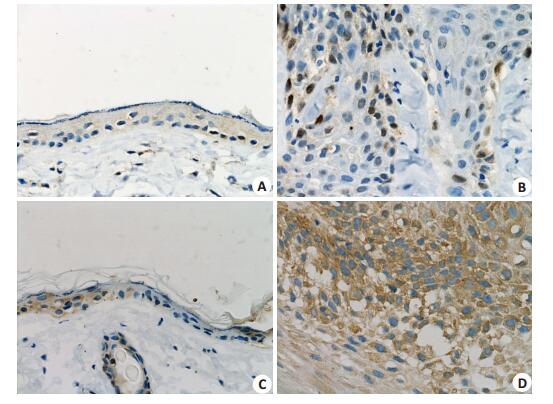
|
图 3 免疫组化检测大鼠外阴皮肤中mtp53、VEGF蛋白的表达 Figure 3 Expression of mtp53 and VEGF proteins in the vulvar skin of the rats detected by immunohistochemistry (×400). A: mtp53 protein expression in blank control group; B: mtp53 protein expression in model group; C: VEGF protein expression in blank control group; D: VEGF protein expression in model group. |
与空白对照组相比,模型组mtp53、VEGF的条带明显粗于空白对照组(图 4A,B),模型组皮肤组织中mtp53、VEGF蛋白相对表达量明显升高;两组差异具有统计学意义(P < 0.05,表 2)。
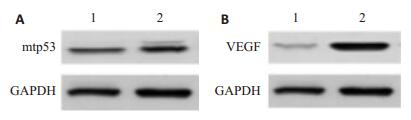
|
图 4 Western blotting检测大鼠外阴皮肤中mtp53、VEGF蛋白的表达(电泳图) Figure 4 Expression of mtp53 and VEGF proteins in the vulvar skin of the rats detected by Western blotting. 1: Blank control group; 2: Model group. |
| 表 2 两组大鼠外阴皮肤中mtp53、VEGF蛋白的相对表达量 Table 2 Relative expression of mtp53 and VEGF proteins in the vulvar skin of the rats (Mean±SD) |
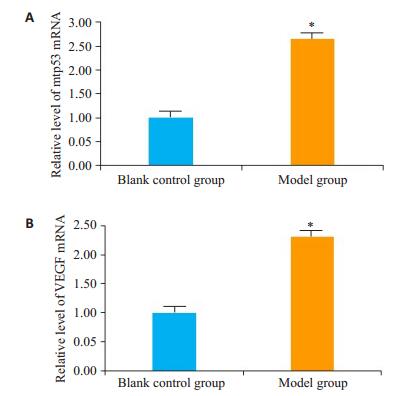
qRT-PCR检测结果采用2-△△Ct法计算后再比较空白对照组和模型组mRNA相对表达,以空白对照组mRNA水平为1,模型组SD大鼠外阴皮肤组织中mtp53 mRNA为空白对照组的2.763±0.828倍,差异具有统计学意义(图 5A,P < 0.05)。VEGF mRNA为空白对照组的2.309±0.171倍(图 5B,P < 0.05)。
|
图 5 qRT-PCR检测两组大鼠外阴皮肤中mtp53、VEGF mRNA的相对表达 Figure 5 Relative expression of mtp53 and VEGF mRNA in the vulvar skin of the rats detected by qRT-PCR. *P < 0.05 vs Blank control group. |
DMBA作为一种致癌诱导剂在动物模型的制备中运用广泛,常常运用于皮肤癌、口腔癌及其癌前病变、乳腺癌及卵巢癌等[11-14]动物模型的制备。它是一种多环芳烃类化合物,其致癌的可能机制是:DMBA进入细胞后,经微粒体羟化酶系作用,发生一系列代谢过程最终转化为能与正常组织细胞DNA结合的致癌化合物,从而引起DNA损伤,以致基因突变而使正常细胞发生异常增殖,最终导致肿瘤的发生[15-16]。实验研究证实DMBA在仓鼠口腔及小鼠皮肤中可作用于表皮角质形成细胞,引起表皮高度增生[16-17]。郑金华等[18]用1% DMBA丙酮液涂抹联合舌创伤诱导出SD大鼠口腔舌黏膜单纯增生、不同程度异常增生、原位癌、浸润癌各个连续的病理过程,各个阶段病变的转化较缓慢且病变的严重程度随DMBA作用时间延长而逐渐加重。有研究采用DMBA成功建立小鼠皮肤癌模型,其小鼠皮肤癌变过程与人类皮肤癌发生发展过程相似[19-20]。由于口腔黏膜与外阴皮肤的组织学结构相似[21],杨欢等[8]参照口腔粘膜白斑动物模型用0.5% DMBA丙酮溶液联合机械刺激顺利诱导出SD大鼠外阴慢性单纯性苔藓动物模型,在SD大鼠外阴慢性单纯性苔藓动物模型中肉眼表现出外阴皮肤颜色发红,皮肤明显增厚、粗糙且弹性降低甚至出现乳头状新生物,这与本实验研究的外阴鳞状上皮内病变的前期肉眼表现相似,病理学上外阴慢性单纯性苔藓动物模型表现出复层鳞状上皮增生,表皮过度角化且角化层增厚,无细胞异型性[8]。另外DMBA在大剂量或者高频率重复作用于小鼠皮肤时可以导致皮肤更易形成皮肤癌,这与紫外线长期作用于皮肤引起癌症的机制类似[22-23]。故本研究考虑采用相似的实验办法通过延长DMBA作用时间且联合机械刺激使SD大鼠外阴皮肤发生病变以期建立SD大鼠外阴鳞状上皮内病变动物模型。本研究结果显示,空白对照组、机械刺激组及丙酮组大鼠各个时期形态学及组织病理学变化无明显差异,提示可能单独地机械刺激或者丙酮溶液不会导致大鼠外阴皮肤增生;然而模型组SD大鼠在外阴机械刺激联合涂抹DMBA丙酮溶液8周后所有SD大鼠出现外阴鳞状上皮单纯性增生;第10周时开始出现大鼠外阴皮肤低级别鳞状上皮内病变,其与人外阴低级别鳞状上皮内病变形态学和组织病理学表现高度一致;第12周时开始出现大鼠外阴皮肤高级别鳞状上皮内病变;在第18周时可见数只SD大鼠形成外阴鳞状细胞癌。由此可以得出DMBA丙酮溶液联合机械刺激连续作用大鼠外阴皮肤后可以诱导大鼠外阴皮肤出现单纯性增生、低级别鳞状上皮内病变、高级别鳞状上皮内病变及皮肤鳞状细胞癌各个连续病变过程;DMBA丙酮溶液联合机械刺激作用大鼠外阴皮肤14周后外阴鳞状上皮内病变动物模型成功率达(39/40)97.5%,显著高于过去报道[6-7]造模方式的成功率。本研究在第10周后皮肤出现的乳头瘤样新生物,考虑可能是与DMBA引起表皮高度增生有关[24];随着DMBA作用时间的延长,乳头瘤样新生物病变程度进一步加重,可形成局部鳞状细胞癌;本研究也表明SD大鼠外阴鳞状上皮内病变大约出现在涂药后第14周左右,在停止涂药后所有大鼠皮肤病变仍在继续进展,在第18周有57.5%(23/40)出现皮肤高级别上皮内病变,22.5%(9/40)SD大鼠出现皮肤鳞状细胞癌,可能与DMBA长时间作用于外阴皮肤导致局部组织基因突变而致细胞增殖和凋亡平衡紊乱有关[17]。
p53基因作为最重要的抑癌基因之一,在肿瘤的发生发展及维持细胞稳态的过程中起着极其重要的作用。在正常状态下,p53蛋白活性低且在细胞内表达保持在较低的水平。但在细胞感应各种应激后,p53基因通过不同的信号通路发生一系列翻译后修饰,使蛋白表达水平及活性发生改变[25]。p53基因分为野生型和突变型;野生型p53基因作为“基因组卫士”,其表达的野生型p53蛋白参与维持细胞增殖与抑制动态平衡,具有抑制肿瘤细胞的作用,但性质极不稳定,在组织中难以检测;mtp53基因丧失了抑癌功能,还具有致癌活性,它通过对下游靶基因一系列的调控可促进细胞的增殖及肿瘤形成[26-29]。其中mtp53通过激活并延长下游靶基因NF-κB表达,上调促炎细胞因子的表达从而引起局部组织明显的慢性炎症反应及持续性损伤[30];通过产生活性氧类物质,促进表达VEGF从而活化成纤维细胞介导血管生成, 促进肿瘤的发生、生长和转移[31]。研究发现有超过50%的人类肿瘤存在p53突变或者功能丧失[32]。Kruse等[33]研究表示HPV阴性的年轻女性发生外阴癌其主要发病原因之一可能就是p53基因突变。研究显示p53基因的高表达在外阴癌及VIN中差异有统计学意义,其可能与DNA异倍体升高有关[34]。侯学涛等[35]研究结果表明,从正常外阴组织、VIN、外阴鳞状细胞癌发展过程中mtp53蛋白阳性表达率逐渐增高,检测mtp53的表达,有助于早期诊断外阴恶性病变。与上述研究结果一致,本研究显示:与正常SD大鼠相比,外阴鳞状上皮内病变模型大鼠外阴组织中mtp53蛋白及mRNA表达水平均有明显增加,差异有统计学意义。
研究发现mtp53对血管的生长具有影响,主要是通过激活蛋白激酶C上调VEGF的表达从而促进血管的生成[36]。VEGF是血管生成的关键调节因子之一,通过激活VEGF受体及其下游信号转导通路诱导血管内皮细胞增殖、迁移和存活从而促使新生血管形成,增加血管渗透性,抑制肿瘤细胞凋亡,促进肿瘤生长、侵袭与转移[37]。有研究报道VEGF在各类VIN组织中均有表达且均高于正常外阴组织[38]。Li等[39]研究表明VEGF在正常患者外阴表皮内仅25%区域呈弱阳性表达,而VIN及VSCC患者外阴表皮内大部分区域呈强阳性表达,其认为VEGF促进了VIN和VSCC新血管的形成,对VIN及VSCC病变的形成起着重要作用。本实验结果显示,SD模型大鼠外阴鳞状上皮内病变组织中VEGF蛋白及VEGF mRNA表达明显高于正常SD大鼠,与上述研究结论一致。
综上,采用DMBA丙酮溶液涂抹联合机械刺激可以成功建立SD大鼠外阴鳞状上皮内病变模型,也是国内外首次报道采用DMBA丙酮溶液联合机械刺激建立外阴鳞状上皮内病变动物模型;该模型相比以往报道的采取腹部皮下注射苯甲酸雌二醇建立外阴鳞状上皮内病变动物模型的方式,实验操作更加快捷简便且造模成功率更高,模型建立更经济稳定且具有较强的可行性和可重复性。本研究表明模型大鼠外阴皮肤形态学及病理学变化过程与人外阴鳞状上皮内病变变化过程相似,同时通过检测SD外阴鳞状上皮内病变模型大鼠外阴皮肤中mtp53和VEGF表达增加,进一步证实该动物模型符合外阴鳞状上皮内病变的变化。该模型的建立为研究该疾病的发病机制及治疗机制,探索新的治疗方式以及治疗疗效评估方面提供了可靠的动物模型和实验基础。但本实验动物模型制备仍有不足之处,动物模型数量有限,需进一步增加样本量,同时实验观察时间有限,需延长观察周期,进一步探讨模型变化情况与结局。
| [1] |
丰有吉, 沈铿, 马丁.
妇产科学[M]. 3版. 北京: 人民卫生出版社, 2015: 296-8.
|
| [2] |
Kurman RJ, Carcangiu ML, Herrington CS, et al.
WHO classification of tumours of female reproductive organs[M]. lyon: iarc press, 2014: 228-53.
|
| [3] |
Xiao X, Meng YB, Bai P, et al. Vulvar cancer in China: epidemiological features and risk analysis[J].
J Cancer, 2017, 8(15): 2950-8.
DOI: 10.7150/jca.20496. |
| [4] |
Nelson EL, Stockdale CK. Vulvar and vaginal HPV disease[J].
Obstet Gynecol Clin North Am, 2013, 40(2): 359-76.
DOI: 10.1016/j.ogc.2013.03.003. |
| [5] |
Østergård S, Vorbeck CS, Meinert M. Vulvar intraepithelial neoplasia[J].
Ugeskr Laeger, 2018, 180(20): 2012-23.
|
| [6] |
欧阳玲, 张淑兰, 付凌捷, 等. 外阴鳞癌动物模型的建立及MDM2表达的研究[J].
现代肿瘤医学, 2007, 15(8): 1062-5.
DOI: 10.3969/j.issn.1672-4992.2007.08.004. |
| [7] |
陈丽萍, 刘毅, 范秀芳, 等. 聚焦超声治疗129/J小鼠外阴上皮内瘤变模型的实验研究[J].
科技导报, 2009, 27(9): 34-8.
|
| [8] |
杨欢, 付贞花, 唐华均, 等. SD大鼠外阴慢性单纯性苔藓模型的构建及蛋白酶激活受体2的表达[J].
南方医科大学学报, 2017, 37(1): 30-5.
DOI: 10.3969/j.issn.1673-4254.2017.01.06. |
| [9] |
Lynch PJ, Moyal-Barracco M, Moyal-Barrocco M, et al. 2006 ISSVD classification of vulvar dermatoses: pathologic subsets and their clinical correlates[J].
J Reprod Med, 2007, 52(1): 3-9.
|
| [10] |
Minicucci EM, Ribeiro DA, da Silva GN, et al. The role of the TP53 gene during rat tongue carcinogenesis induced by 4-nitroquinoline 1- oxide[J].
Exp Toxicol Pathol, 2011, 63(5): 483-9.
DOI: 10.1016/j.etp.2010.03.009. |
| [11] |
Nassar D, Latil M, Boeckx B, et al. Genomic landscape of carcinogeninduced and genetically induced mouse skin squamous cell carcinoma[J].
Nat Med, 2015, 21(8): 946-54.
DOI: 10.1038/nm.3878. |
| [12] |
Annamalai G, Suresh K. Shogaol attenuates inflammation, cell prol iferation via modulate NF-κB and AP-1 oncogenic signaling in 7, 12- dimethylbenz[J].
Biomed Pharmacother, 2018, 98(4): 484-90.
|
| [13] |
Rajakumar T, Pugalendhi P, Jayaganesh R, et al. Effect of allylisothio cyanate on NF-κB signaling in 7, 12-dimethylbenz (a) anthracene and N-methyl-N-nitrosourea-induced mammary carcinogenesis[J].
Breast Cancer, 2018, 25(1): 50-9.
DOI: 10.1007/s12282-017-0783-y. |
| [14] |
Liu L, Hu Z, Zhang H, et al. Vitamin D postpones the progression of epithelial ovarian cancer induced by 7, 12-dimethylbenz[J].
Onco Targets Ther, 2016, 12(9): 2365-75.
|
| [15] |
Khalaileh A, Dreazen A, Khatib A, et al. Phosphorylation of ribosomal protein S6 attenuates DNA damage and tumor suppression during development of pancreatic cancer[J].
Cancer Res, 2013, 73(6): 1811-20.
DOI: 10.1158/0008-5472.CAN-12-2014. |
| [16] |
Nagini S. Of humans and hamsters: the hamster buccal pouch carcinogenesis model as a paradigm for oral oncogenesis and chemoprevention[J].
Anticancer Agents Med Chem, 2009, 9(8): 843-52.
DOI: 10.2174/187152009789124619. |
| [17] |
Thomas G, Tuk B, Song JY, et al. Studying skin tumourigenesis and progression in immunocompetent hairless SKH1-hr mice using chronic 7, 12-dimethy lbenz (a) anthracene topical applications to develop a useful experimental skin cancer model[J].
Lab Anim, 2017, 51(1): 24-35.
DOI: 10.1177/0023677216637305. |
| [18] |
郑金华, 王琪, 李会平, 等. 二甲基苯并蒽涂抹联合创伤诱发舌癌模型的比较研究[J].
解剖学研究, 2007, 29(6): 405-9, 416.
DOI: 10.3969/j.issn.1671-0770.2007.06.002. |
| [19] |
孙佳惠, 单慧, 潘萧羽, 等. 二甲基苯蒽/佛波酯两步化学法诱导小鼠皮肤癌的模型优化[J].
中国实验动物学报, 2017, 25(1): 31-5.
DOI: 10.3969/j.issn.1005-4847.2017.01.006. |
| [20] |
Ishikawa TO, Kumar IP, Machado HB, et al. Positron emission tomography imaging of DMBA/TPA mouse skin multi-step tumorigenesis[J].
Mol Oncol, 2010, 4(2): 119-25.
DOI: 10.1016/j.molonc.2010.01.005. |
| [21] |
李秉琦.
实用口腔黏膜病学[M]. 北京: 科学技术文献出版社, 2011.
|
| [22] |
Iversen OH. A comparison of the tumorigenic and carcinogenic effects of DMBA and TPA used as initiators and promoters in classical two-stage experimental protocols[J].
APMIS Suppl, 1994, 41(1): 1-38.
|
| [23] |
Li X, Eckard J, Shah R, et al. Interleukin-1alpha up-regulation in vivo by a potent carcinogen 7, 12-dimethylbenz(a)anthracene (DMBA) and control of DMBA- induced inflammatory responses[J].
Cancer Res, 2002, 62(2): 417-23.
|
| [24] |
王红丽, 陈苑, 胡银霞, 等. UVC因素对DMBA诱导的小鼠皮肤肿瘤建模的影响[J].
广东药学院学报, 2012, 28(6): 677-80.
|
| [25] |
Zhang J, Cao M, Dong J, et al. ABRO1 suppresses tumourigenesis and regulates the DNA damage response by stabilizing p53[J].
Nat Commun, 2014, 5(12): 5059-68.
|
| [26] |
Molchadsky A, Rotter V. p53 and its mutants on the slippery road from stemness to carcinogenesis[J].
Carcinogenesis, 2017, 38(4): 347-58.
DOI: 10.1093/carcin/bgw092. |
| [27] |
Simabuco FM, Morale MG, Pavan ICB, et al. p53 and metabolism: from mechanism to therapeutics[J].
Oncotarget, 2018, 9(34): 23780-823.
|
| [28] |
Li Q, Zhu Y, Hou L, et al. C23 promotes tumorigenesis via suppressing p53 activity[J].
Oncotarget, 2016, 7(36): 58274-85.
|
| [29] |
Wang W, Cheng B, Miao L, et al. Mutant p53-R273H gains new function in sustained activation of EGFR signaling via suppressing miR-27a expression[J].
Cell Death Dis, 2013, 4(6): e574-9.
|
| [30] |
Cooks T, Pateras IS, Tarcic O, et al. Mutant p53 prolongs NF-κB activation and promotes chronic inflammation and inflammationassociated colorectal cancer[J].
Cancer Cell, 2013, 23(5): 634-46.
DOI: 10.1016/j.ccr.2013.03.022. |
| [31] |
Hayashi Y, Tsujii M, Kodama T, et al. p53 functional deficiency in human colon cancer cells promotes fibroblast-mediated angiogenesis and tumor growth[J].
Carcinogenesis, 2016, 37(10): 972-84.
DOI: 10.1093/carcin/bgw085. |
| [32] |
胡汪来, 吴缅. p53在肿瘤发生过程中的功能研究及进展[J].
中国科学:生命科学, 2017, 47(1): 52-8.
|
| [33] |
Kruse AJ, Bottenberg MJ, Tosserams J, et al. The absence of highrisk HPV combined with specific p53 and p16INK4a expression patterns points to the HPV-independent pathway as the causative agent for vulvar squamous cell carcinoma and its precursor simplex VIN in a young patient[J].
Int J Gynecol Pathol, 2008, 27(4): 591-5.
DOI: 10.1097/PGP.0b013e318178e53b. |
| [34] |
van der Avoort IA, van de Nieuwenhof HP, Otte-Höller I, et al. High levels of p53 expression correlate with DNA aneuploidy in (pre) malignancies of the vulva[J].
Hum Pathol, 2010, 41(10): 1475-85.
DOI: 10.1016/j.humpath.2009.12.015. |
| [35] |
侯学涛, 王丽君, 李敏, 等. HPV、突变型p53和COX-2在外阴HPV感染相关疾病的表达及意义[J].
现代妇产科进展, 2013, 22(7): 575-7.
|
| [36] |
丁旭青, 韩玉培. 食管鳞癌p53、TSP-1、VEGF表达与肿瘤血管生成[J].
中国肿瘤外科杂志, 2009, 1(4): 209-11.
DOI: 10.3969/j.issn.1674-4136.2009.04.006. |
| [37] |
Karaman S, Leppänen VM, Alitalo K. Vascular endothelial growth factor signaling in development and disease[J].
Development, 2018, 145(14): 1507-13.
|
| [38] |
Lewy-Trenda I, Wierzchniewska-ławska A, Papierz W. Expression of vascular endothelial growth factor (VEGF) in vulvar squamous cancer and VIN[J].
Pol J Pathol, 2005, 56(1): 5-8.
|
| [39] |
Li YZ, Li SL, Li X, et al. Expression of endogenous hypoxia markers in vulvar squamous cell carcinoma[J].
Asian Pac J Cancer Prev, 2012, 13(8): 3675-80.
DOI: 10.7314/APJCP.2012.13.8.3675. |
 2018, Vol. 38
2018, Vol. 38

