2. 南方医科大学珠江医院肿瘤中心,广东 广州 510282
2. Center of Oncology, Zhujiang Hospital, Southern Medical University, Guangzhou 510282, China
数据显示,中国结直肠癌发病率在男性中排位第5位,女性中排位第4位[1],2018美国肿瘤数据显示结肠癌癌发病率男性、女性中的排位均为第3位[2]。据报道,遗传性非息肉病结肠癌、12%~15%散发性结肠癌均有微卫星不稳定。错配修复(MMR)基因突变使得MMR蛋白部分或全部表达缺失,使得DNA复制过程中出现重复序列或修复错误,是微卫星不稳定的主要原因。研究表明MMR缺陷的Ⅱ、Ⅲ期结肠癌患者疾病复发率低于、总生存优于MMR功能正常患者[3-8],提出可将MMR功能作为预后的一个预测因子。研究认为可能与MMR缺陷肠癌组织发生更多功能淋巴细胞浸润、肿瘤细胞凋亡增加,还有TP53、DCC、KRAS等基因突变减少有关[7]。临床上对于非高危的MSI-H的Ⅱ期肠癌术后的患者也不再推荐术后辅助化疗,而是密切随访、复查。DNA错配修复功能状态是决定Ⅱ期肠癌患者的治疗策略的重要因素,但其本质原因仍不明确。探究MMR功能对肠癌预后影响的分子机制将有利于选择真正辅助化疗受益人群,有利于实现肿瘤精准治疗,有利于节约医疗成本。本课题组前期利用基因芯片技术筛查不同MMR状态肠癌组织差异表达的mRNA,发现其中与细胞凋亡功能相关的差异表达基因中,分泌型卷曲相关蛋白4(SFRP4)差异性表达显著。SFRP4家族共5个成员SFRP1-5,其功能研究结果表明其可能为抑癌基因[9-10],SFRP4既往研究也表明SFRP家族蛋白与WNT通路相关[11-13],但尚未有SFRP4与MMR功能研究的报道,本研究进一步探究SFRP4在不同MMR型肠癌中的表达及意义。
1 材料和方法 1.1 组织来源收集的肠癌组织标本来源于中山大学附属中山医院普外三科住院患者。入组自2016年4月1日~5月1日经病理确诊结直肠癌(腺癌)且术前未经放疗或化疗的患者19例,肠癌术中取得新鲜癌组织,-20 ℃保存于RNA later液中。医院伦理委员会批准,符合伦理学规定,所有患者已签署患者知情同意书。患者需同时满足以下条件,纳入标准:ECOG评分 < 2分;我院电子肠镜、CT、MR明确为结直肠癌,病理结果明确为腺癌,依据2015 NCCN Guidelines (colon cancer、rectal cancer)临床分期为Ⅱ期;患者未行任何抗肿瘤治疗,包括手术、化疗、放疗、靶向治疗、免疫治疗、中医中药治疗等。排除标准:现或曾经患有第二肿瘤肿瘤;患者合并或潜在可能出现心肌损伤情况,如:心肌缺血、心肌炎、心肌梗死、心绞痛等;合并2型糖尿病、乙型肝炎等可能引起SFRP表达差异的疾病。
1.2 主要试剂人肠癌细胞株HCT116、SW480购自中科院上海细胞库。RPMI 1640细胞培养基、胎牛血清、PBS均来自Gibco。AnnexinV-FITC/PI细胞凋亡试剂盒购自南京凯基生物公司。荧光PCR试剂盒购自TaKaRa。SFRP4、HS-GAPDH上下游引物由上海欧易生物医学科技有限公司设计并合成。siRNA由广州市锐博生物科技有限公司设计并合成。兔抗人MSH2、MSH6、MLH1、PMS2、Ki-67抗体购自上海嘉禾。HS-GAPDH、兔抗人SFRP4单克隆抗体购自Affinity Biosciences。转染试剂盒LipofectamineTM2000购自Invitrogen。
1.3 方法 1.3.1 免疫组化及量化评估方法检测患者MMR、SFRP4、Ki-67的表达对入组结肠癌患者的石蜡标本进行免疫组织化学实验,检测其MMR各蛋白的表达情况。对切片常规脱蜡、水化处理后3% H2O2(80%甲醇)室温固定,高温加热抗原修复。正常山羊血清封闭液。孵Ⅰ抗,4 ℃过夜。孵Ⅱ抗,37 ℃ 1 h。苏木素复染、脱水、透明、封片、镜检。
同样方法在选择的组织样本中检测增殖相关蛋白Ki67、SFRP4表达。结果评判标准:SFRP4和Ki67蛋白主要表达于细胞质或细胞膜,以棕黄色颗粒染色为阳性,按显色程度评分:细胞无显色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。按阳性细胞百分率评分:< 10%为0分,10%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。总分值=阳性细胞染色强度得分×阳性细胞所占比例得分,总分值范围为0~12分,>6分为高表达,≤6分为低表达。
1.3.2 qRT-PCR检测不同MMR状态结肠癌组织、HCT116和SW480细胞株中mSFRP4的表达情况检测mSFRP4在pMMR、dMMR肠癌组织、pMMR细胞株SW480、dMMR细胞株HCT116的表达情况。以荧光定量PCR技术,进行扩增,qRT-PCR反应体系为10 µL。SFRP4的上游引物为:GCTGCAATGAGGTCACA AC,下游引物为:GGACACTGGCAAGAAGAAT。GAPDH的上游引物序列:TGTTGCCATCAATGACC CCTT,下游引物序列:CTCCACGACGTACTCAGCG预变性90 ℃ 10 min,然后进行共40个循环:变性95 ℃ 10 s、退火及延伸60 ℃ 30 s。最后从60 ℃到97℃缓慢增加温度,绘制溶解曲线。对检测结果的分析按表达量=2-△△Ct,其中△△Ct=(待测样品的目的基因的Ct平均值-待测样品的管家基因的Ct平均值)-(对照样品的目的基因的Ct平均值-对照样品的管家基因的Ct平均值)。
1.3.3 Western blot检测SFRP4在pMMR细胞株SW480,dMMR细胞株HCT116中的表达情况收集SW480及HCT116细胞株的细胞,利用含蛋白酶抑制剂的RIPA试剂于冰上裂解细胞、提取蛋白。按BCA蛋白检测试剂盒提供方法检测蛋白质浓度。95 ℃水煮蛋白-loading buffer混合物10 min后,SDS-PAGE电泳胶进行分离,电转移至PVDF膜上。用含5%脱脂牛奶的PBS液室温下封闭1 h。1:1000稀释的兔抗人SFRP4及GAPDH单克隆抗体4 ℃孵育过夜。PBS-Tween洗膜3次。辣根过氧化物酶标记的鼠抗兔二抗1: 10 000稀释,室温孵育1 h,PBS-Tween洗膜3次。暗室中曝光、显影、定影,室温晾干后扫描。利用Image J软件进行胶片的灰度分析。
1.3.4 细胞转染使用LipofectamineTM2000进行瞬时转染。siRNA序列为:GAAAGGAAACACCAATAAA。HCT116细胞浓度以1.5×106接种于六孔板,当细胞长到约50%时进行瞬时转染。用无血清无抗生素的RPMI 1640培养基作为稀释液,将siRNA稀释至20 pmmol/50 µL,轻轻混匀。LipofectamineTM2000稀释至2 µg/mL(稀释比例1: 50)室温下15 min。六孔板容积2 mL。取1 µL的LipofectamineTM2000稀释液加入50 µL无血清培养基-siRNA稀释液中。轻柔混匀250 µL的LipofectamineTM2000稀释液及250 µL的siRNA稀释液(总体积500 µL),室温下孵育15 min。六孔板内培养基换成无血清培养基1.5 mL。将摇匀的混合物加入六孔板,轻轻晃动,使均匀。在37 ℃,5%CO2培养箱中培养72 h后检测转染结果。
1.3.5 流式细胞术检测凋亡HCT116为dMMR型人肠癌细胞株,SFRP4高表达,转染siRNA干扰SFRP4的表达,验证干扰效果后,流式细胞术检测干扰前后细胞株的凋亡情况。
分别收集培养72 h的HCT116和HCT116-siSFRP4细胞,PBS洗3次,离心后重悬、计数,取5×105细胞加入流式管,按照说明书操作依次加入Binding buffer和AnnexinV-FITC/PI,室温下反应10 min,上机检测细胞凋亡率,重复3次。
1.3.6 统计学分析利用SPSS13.0软件分析。采用非参数检验Mann-Whitney U法、Spearman法分析,P < 0.05认为差异有统计学意义。
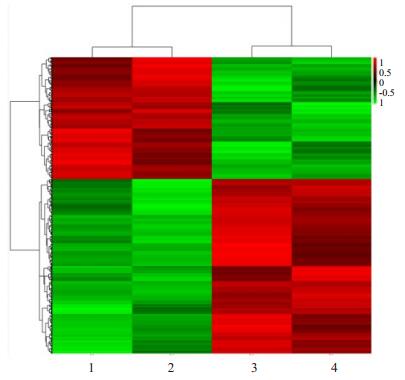
2 结果 2.1 SFRP4在MMR缺陷型结肠癌组织表达上调。通过初步筛选后差异mRNA较多(P≤0.05和FC≥2),初步聚类结果针对样本进行聚类。热图如下所示。色阶表示基因表达量从相对低(绿色)到相对高(红色)变化,各行代表不同基因探针,各列代表不同肠癌样本。
SPP1、COL10A1、SFRP4、SULF1、GREM1、MMP7等表达上调,CEACAM7、NXPE4、DUOX2、SLC26A2、A1CF等表达下调,差异均具有统计学意义(P < 0.005)。芯片检测发现在P < 0.001的差异表达mRNA中,mSFRP4在MMR缺陷型结肠癌组织中明显表达上调(P=3.48×10-4,FC=114.95)。
|
图 1 MEV软件分析不同肠癌标本聚类的热图 Figure 1 Clustering of the colon cancer samples using MEV software and the heatmap of gene expression. Samples No. 1 and 2 are dMMR colon cancer, No. 3 and No. 4 are pMMR cancer tissues. |
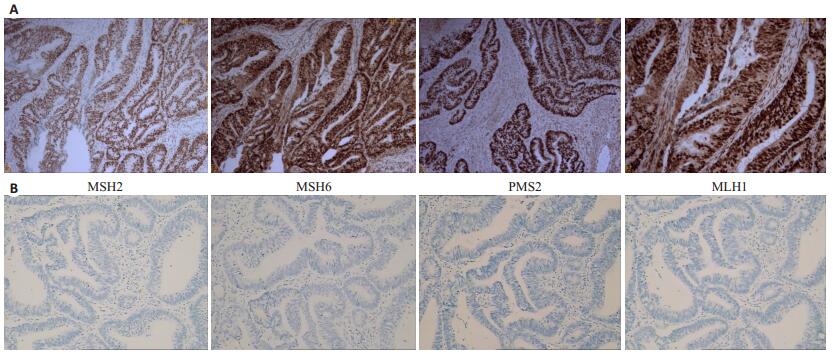
收集的19例患者中4例为pMMR,其余15例患者为dMMR,随机抽样法抽取5例dMMR标本。共入选9例标本。组织MMR状态(MSH2/MSH6/MLH1/PMS2)正常型及缺陷型的免疫组化表达情况(+/+/+/+、-/-/-/-)(图 2)。
|
图 2 错配修复蛋白(MMR)免疫组化结果 Figure 2 Mismatch repair proteins of colorectal cancer tissues detected by immunohistochemistry. A: Positive expression of MSH2, MSH6, PMS2 and MLH1; B: Negative expression of the proteins (Original magnification: ×200). |
免疫组化检测的SFRP4、Ki67在肠癌组织中表达存在负相关关系,γ=-0.687,P=0.041,差异有统计学意义。Mann-Whitney U检验结果显示免疫组化检测的SFRP4阳性率在dMMR肠癌组织表达高于pMMR肠癌组织差异有统计学意义(P=0.011)。Mann-Whitney U检验结果显示免疫组化检测的Ki67的阳性率在pMMR肠癌组织、dMMR肠癌组织间分布无明显差异(P=0.067,表 1)。
| 表 1 不同MMR状态结肠癌SFRP4与Ki-67表达情况 Table 1 Expression of SFRP4 and Ki-67 in dMMR and pMMR colorectal cancers |
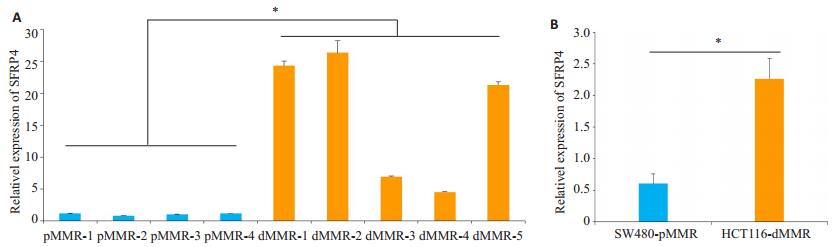
SFRP4在MMR缺陷型结肠癌组织及细胞株中表达较正常型增高。qRT-PCR检测不同MMR状态肠癌组织及不同MMR状态的两株人肠癌细胞株SW480、HCT116中SFRP4的表达,结果发现dMMR细胞株的相对表达量高于pMMR组的,Mann-Whitney U检验表明其差异有统计学意义(P < 0.05),dMMR状态的肠癌组织SFRP4的表达也比pMMR组的较高(P < 0.05,图 3)。
|
图 3 荧光PCR检测SFRP4在不同MMR状态肠癌组织(A)及细胞(B)的表达 Figure 3 SFRP4 mRNA expression detected by fluorescent real-time PCR in dMMR and pMMR colorectal cancer tissues (A) and cells (B). *P < 0.05. |
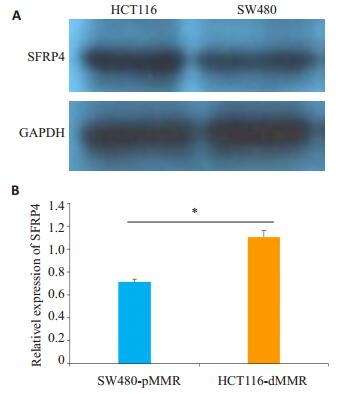
SFRP4的表达在dMMR细胞株HCT116中的表达较pMMR细胞株SW480增高,结果与qRT-PCR结果一致,差异有统计学意义(P < 0.05,图 4)。
|
图 4 蛋白印迹法检测SFRP4在不同MMR状态肠癌细胞株HCT116和SW480的表达 Figure 4 SFRP4 expression detected by Western blotting in dMMR and pMMR colorectal cancer cell lines HCT116 and SW480. A: Western blotting; B: Quantitative analysis. *P < 0.05. |
验证干扰效果后,流式细胞术检测干扰前后细胞株的凋亡情况发现,SFRP4被干扰后,HCT116细胞株凋亡率下降,两组细胞株晚期凋亡率差异性T检验结果提示差异有统计学意义(P < 0.05),两组早期凋亡率差异性T检验结果提示差异有统计学意义(P < 0.05,图 5)。
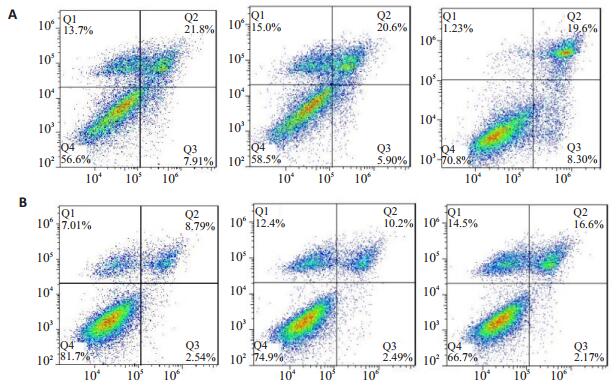
|
图 5 流式细胞术检测HCT116 (A)及HCT116-siSFRP4 (B)细胞株凋亡情况 Figure 5 Apoptosis of the cell lines detected by flow cytometry. A: HCT116; B: HCT116-siSFRP4. |
MMR缺陷时,无法及时识别微卫星不稳定情况,未能及时修正,将引起基因组的不稳定[14-15]。研究表明Ⅱ期dMMR结直肠癌患者似乎对5-FU化疗无明显获益,但是预后优于pMMR患者[16-18]。既往的研究结论已经改变了Ⅱ期肠癌患者辅助化疗的临床实践,但是不同状态MMR预后存在差异的具体机制尚不明确[19]。Li等[20]比较肠癌组织及正常大肠组织,挖掘差异性表达的mRNA和Lnc RNA,分析差异表达的mRNA和Lnc RNA与不同基因通路、肿瘤分期等的关系,研究优点是标本量较大,挖掘出大量差异表达的mRNA和Lnc RNA,但文中未对肠癌群体内MMR功能展开研究。与此不同的是,本研究立足于肠癌群体中,比较肠癌组织中dMMR和pMMR患者的mRNA表达差异,发现差异表达倍数在2倍以上,且P < 0.05的mRNA数量逾百,范围分布广泛,包括生物学行为、分子功能、细胞成分等。
差异表达的mRNA之SFRP4为分泌型卷曲相关蛋白,与WNT蛋白或者其配体结合,抑制WNT蛋白与转膜受体结合,抑制WNT/β-catenin信号通路[21-23]。WNT广泛参与生物基本发育过程及细胞增殖、分化、凋亡过程,与肿瘤形成有重要复杂的相关关系[24-27]。研究表明SFRP4是WNT信号通路的抑制剂。如Deshmukh A在耐药的乳腺癌及前列腺癌干细胞株中证实,SFRP4治疗在糖摄取中扮演重要角色,通过SFPR4改变代谢达到抑制肿瘤干细胞的目的,最后提出靶向基因SFRP4的抗肿瘤治疗[28]。SFRP4有可能成为新的抗肿瘤靶点,但SFRP4在不同癌种中表达情况不一,既有报道SFRP4在肠癌[29]、宫颈癌比健康组表达增高[30],也有研究显示子宫内膜癌中SFRP4比健康组织降低[31]。通过检测20名肠癌患者癌组织及周围健康组织SFRP4的表达,发现其在癌组织中表达增高,但是未对肠癌的MMR状态进行检测、未分析不同MMR状态SFRP4的表达差异[32]。本研究基因芯片结果显示不同MMR状态的Ⅱ期肠癌中SFRP4有明显表达差异,并在不同MMR状态肠癌中SFRP4是否差异表达行组织学和细胞学验证,发现SFRP4在MMR功能缺陷Ⅱ期肠癌中高表达。既往研究提示SFRP4在头颈部肿瘤中有促进肿瘤细胞凋亡、减弱肿瘤细胞耐药性作用[33],SFRP4上调时,肿瘤增殖相关基因cyclin D1、c-myc等是受抑制的,促进早期凋亡[34]。与该研究结果一致,本研究发现在dMMR的Ⅱ期肠癌细胞株中,干扰SFRP4表达,凋亡率也有明显下降,不同之处在于,不仅早期凋亡率下降,晚期凋亡率也有明显下降。
综上所述,本研究利用基因芯片筛查不同MMR状态下的肠癌组织差异表达的基因,找到SFRP4存在差异性表达,分析SFRP4与肿瘤增殖相关指标Ki67,发现二者存在负相关关系,即SFRP4高表达可能与Ki67低表达有相关关系。利用siRNA干扰dMMR型肠癌细胞株HCT116中SFRP4的表达,肠癌细胞凋亡率明显下降。因此,我们提出:SFRP4基因在Ⅱ期dMMR型肠癌中比pMMR型明显表达增高,SFRP4的高表达促进癌细胞凋亡、抑制增殖。或许不同MMR型肠癌预后差异与SFRP4改变肿瘤生长速度相关,SFRP4有望成为新型抗肿瘤靶点,后续有待进一步研究。
| [1] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J].
CACancerJClin, 2016, 66(2): 115-32.
|
| [2] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J].
CA CancerJClin, 2018, 68(1): 7-30.
DOI: 10.3322/caac.v68.1. |
| [3] |
Sargent DJ, Marsoni S, Monges G, et al. Defective mismatch repair as a predictive marker for lack of efficacy of fluorouracil-based adjuvant therapy in colon cancer[J].
JClinOncol, 2010, 28(20): 3219-26.
|
| [4] |
Zaanan A, Shi Q, Taieb J, et al. Role of deficient DNA mismatch repair status in patients with stage Ⅲ colon cancer treated with FOLFOX adjuvant chemotherapy: a pooled analysis from 2 randomized clinical trials[J].
JAMAOncol, 2018, 4(3): 379-83.
|
| [5] |
Hu J, Yan WY, Xie L, et al. Coexistence of MSI with KRAS mutation is associated with worse prognosis in colorectal cancer[J].
Medicine (Baltimore), 2016, 95(50): e5649.
DOI: 10.1097/MD.0000000000005649. |
| [6] |
Kawakami H, Zaanan A, Sinicrope F. Microsatellite instability testing and its role in the management of colorectal cancer[J].
Curr TreatOptionsOncol, 2015, 16(7): 30.
|
| [7] |
Yoon YS, Yu CS, Kim TW, et al. Mismatch repair status in sporadic colorectal cancer: immunohistochemistry and microsatellite instabilityanalyses[J].
J Gastroenterol Hepatol, 2011, 26(12): 1733-9.
DOI: 10.1111/jgh.2011.26.issue-12. |
| [8] |
Tougeron D, Sickersen G, Mouillet G, et al. Predictors of diseasefree survival in colorectal cancer with microsatellite instability: An AGEO multicentre study[J].
EurJCancer, 2015, 51(8): 925-34.
|
| [9] |
Zi X, Guo Y, Simoneau AR, et al. Expression of Frzb/secreted Frizzled-related protein 3, a secreted Wnt antagonist, in human androgen-independent prostate cancer PC-3 cells suppresses tumor growth and cellular invasiveness[J].
Cancer Res, 2005, 65(21): 9762-70.
DOI: 10.1158/0008-5472.CAN-05-0103. |
| [10] |
Mandal D, Srivastava A, Mahlum E, et al. Severe suppression of Frzb/sFRP3 transcription in osteogenic sarcoma[J].
Gene, 2007, 386(1/2): 131-8.
|
| [11] |
Shin H, Kim JH, Lee YS, et al. Change in gene expression profiles of secreted frizzled- related proteins (SFRPs) by Sodium butyrate in gastric cancers: induction of promoter demethylation and histone modification causing inhibition of Wnt signaling[J].
Int J Oncol, 2012, 40(5): 1533-42.
|
| [12] |
Cruciat CM, Niehrs C. Secreted and transmembrane Wnt inhibitors and activators[J].
Cold Spring Harb Perspect Biol, 2013, 5(3): a015081.
|
| [13] |
Kawai N, Kuraishi R, Kaneko H. Wnt, frizzled, and sFRP gene expression patterns during gastrulation in the starfish patiria (asterina)pectinifera[J].
GeneExprPatterns, 2016, 21(1): 19-27.
|
| [14] |
Koi M, Tseng-Rogenski SS, Carethers JM. Inflammation-associated microsatellite alterations: Mechanisms and significance in the prognosis of patients with colorectal cancer[J].
World J Gastrointest Oncol, 2018, 10(1): 1-14.
DOI: 10.4251/wjgo.v10.i1.1. |
| [15] |
Hu ZI, Shia J, Stadler ZK, et al. Evaluating mismatch repair deficiency in pancreatic adenocarcinoma: challenges and recommendations[J].
ClinCancerRes, 2018, 24(6): 1326-36.
|
| [16] |
Devaud N, Gallinger S. Chemotherapy of MMR-deficient colorectal Cancer[J].
FamCancer, 2013, 12(2): 301-6.
|
| [17] |
Kawakami H, Zaanan A, Sinicrope FA. Implications of mismatch repair-deficient status on management of early stage colorectal cancer[J].
JGastrointestOncol, 2015, 6(6): 676-84.
|
| [18] |
Copija A, Waniczek D, Witkoś A, et al. Clinical significance and prognostic relevance of microsatellite instability in sporadic colorectal cancer patients[J].
IntJMolSci, 2017, 18(1): e107.
|
| [19] |
Li SK, Martin A. Mismatch repair and colon cancer: mechanisms and therapiesexplored[J].
TrendsMolMed, 2016, 22(4): 274-89.
|
| [20] |
Li Q, Li N, Lao Y, et al. Variable levels of long noncoding RNA expression in DNA mismatch repair-proficient early-stage colon cancer[J].
DigDisSci, 2017, 62(5): 1235-45.
|
| [21] |
Kongkham PN, Northcott PA, Croul SE, et al. The SFRP family of WNT inhibitors function as novel tumor suppressor genes epigenetically silenced in medulloblastoma[J].
Oncogene, 2010, 29(20): 3017-24.
DOI: 10.1038/onc.2010.32. |
| [22] |
Constantinou T, Baumann F, Lacher MD, et al. SFRP-4 abrogates Wnt-3a-induced beta-catenin andAkt/PKB signalling and reverses a Wnt-3a-imposed inhibition of in vitro mammary differentiation[J].
J MolSignal, 2008, 3(2): 10.
|
| [23] |
Pawar NM, Rao P. Secreted frizzled related protein 4 (sFRP4) update:Abriefreview[J].
CellSignal, 2018, 45(45): 63-70.
|
| [24] |
Kim JH, Park SY, Jun Y, et al. Roles of Wnt target genes in the journey of cancer stem cells[J].
IntJMolSci, 2017, 18(8): e1604.
|
| [25] |
Yang G, Shen TY, Yi XM, et al. Crosstalk between long non-coding RNAs andWnt/beta-catenin signalling in cancer[J].
J Cell Mol Med, 2018, 22(4): 2062-70.
DOI: 10.1111/jcmm.2018.22.issue-4. |
| [26] |
Zhang LS, Lum L. Chemical modulation of WNT signaling in cancer[J].
Prog Mol Biol Transl Sci, 2018, 153(153): 245-69.
|
| [27] |
Kumar R, Kotapalli V, Naz AA, et al. XPNPEP3 is a novel transcriptional target of canonical Wnt/-catenin signaling[J].
Genes ChromosomesCancer, 2018, 57(6): 304-10.
DOI: 10.1002/gcc.v57.6. |
| [28] |
Deshmukh A, Arfuso F, Newsholme P, et al. Regulation of cancer stem cell metabolism by secreted Frizzled-related protein 4(sFRP4)[J].
Cancers(Basel), 2018, 10(2): pii:E40.
|
| [29] |
韩黔峰. SFRP4、β-catenin、Cox-2、ER-β、pS2、Keratin 19蛋白和MSI基因在结直肠癌细胞中的表达[D].四川大学, 2005.
http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y792930
|
| [30] |
Li X, Ho uA, Li Z, et al. Expression of SFRP4 and DKK1 in cervical squamous cell carcinoma and the clinicopathological implications[J].
Nan Fang Yi Ke Da Xue Xue Bao, 2015, 35(7): 1063-7.
|
| [31] |
韩翠香, 晋雅凌, 白治英. Wnt抑制分子Dkk3、SFRP1和SFRP4在子宫内膜癌中的表达分析[J].
实用肿瘤杂志, 2016(6): 541-5.
|
| [32] |
Huang D, Yu B, Deng Y, et al. SFRP4 was overexpressed in colorectalcarcinoma[J].
JCancerResClinOncol, 2010, 136(3): 395-401.
|
| [33] |
Warrier S, Bhuvanalakshmi G, Arfuso F, et al. Cancer stem-like cells from head and neck cancers are chemosensitized by the Wnt antagonist, sFRP4, by inducing apoptosis, decreasing stemness, drug resistance and epithelial to mesenchymal transition[J].
Cancer GeneTher, 2014, 21(9): 381-8.
|
| [34] |
Ghoshal A, Ghosh SS. Antagonizing canonical Wnt signaling pathway by recombinant human sFRP4 purified from E.coli and its implications in cancer therapy[J].
Mol Cell Biochem, 2016, 418(1/2): 119-35.
|
 2018, Vol. 38
2018, Vol. 38

