2. 儿童发育疾病研究教育部重点实验室,重庆 400014;
3. 儿童发育重大疾病国家国际科技合作基地,重庆 400014;
4. 儿科学重庆市重点实验室,重庆 400014
2. Ministry of Education Key Laboratory of Child Development and Critical Disorders, Chongqing 400014, China;
3. China International Science and Technology Cooperation Base of Child Development and Critical Disorders, Chongqing 400014, China;
4. Chongqing Key Laboratory of Pediatrics, Chongqing 400014, China
大脑在发育爆发期的易损性会显著增加[1]。诸多研究表明,婴幼儿多次经历全麻和手术后会导致学习能力缺陷[2-3]。丙泊酚目前被广泛用于麻醉的诱导、维持和ICU镇静[4],然而丙泊酚对大脑的影响目前尚无确切结论[5-7]。有研究认为,丙泊酚可引起遗忘,甚至导致记忆能力受损[8-9]。也有研究认为丙泊酚并不会影响实验动物的学习能力、记忆功能[10]。这些研究结论不一的原因可能与氧浓度、动物品种、年龄、研究方法等因素关系密切[11-13]。在氧浓度对认知的影响方面,有研究认为低氧暴露能够通过影响一些学习记忆相关蛋白,从而对大脑的学习记忆能力产生影响[14],也有研究认为适度低氧对脑损伤的保护作用[15]。临床实践中,麻醉、低血压、病理分流、胸科手术、单肺通气等情况都可能引起低氧[16-18]。有研究显示tau蛋白参与了丙泊酚导致的认知功能障碍[19]。丝裂原活化蛋白激酶(MAPKs)在哺乳动物细胞多种信号传导通路中起重要作用,p38MAPK传导途径在其中居于重要地位。缺氧时p38MAPK通路对神经系统来说既是损伤因子又是保护因子[20]。在未成熟脑组织中p38的活化情况与tau蛋白的表达情况以及两者的关系并不清楚。因此,本文将对丙泊酚合并低氧对发育期大鼠认知功能的影响及机制进行探讨,为今后临床有效预防、减少麻醉手术后并发症提供科学依据。
1 材料和方法 1.1 实验动物本实验共用180只SD大鼠幼鼠,由重庆医科大学提供,已通过重庆医科大学附属儿童医院伦理委员会审查。饲养环境温度20~25 ℃,湿度60%~70%。孕鼠生产后将幼鼠继续与母鼠共同饲养至7日龄。
1.2 主要药品、试剂与实验仪器丙泊酚注射液(Corden Pharma S.P.A.);脂肪乳(科伦药业);磷酸化蛋白提取试剂盒(凯基生物);BSA(索莱宝);磷酸化Tau蛋白抗体(GeneTex, Inc.);总tau蛋白抗体(GeneTex, Inc.);p-p38抗体(Cell Signaling Technology);p-p38阻滞剂(MedChem Express);二甲基亚砜(鼎国昌盛);β抗体(万类生物);兔抗鼠二抗(中杉金桥);BCA蛋白浓度检测试剂盒(碧云天);显影剂(Millipore);酶标仪(BioTek);高速低温离心机(Thermo);电泳仪(BIO-RAD)。
1.3 实验模型及分组将90只7日龄(P7)SD大鼠随机分为丙泊酚低氧组(PH组)、丙泊酚空气组(PA组)、丙泊酚氧气组(PO组)、脂肪乳低氧组(CH组)、脂肪乳空气组(CA组)、脂肪乳氧气组(CO组)。丙泊酚低氧组、丙泊酚空气组、丙泊酚氧气组幼鼠腹腔注释丙泊酚50 mg/kg,脂肪乳低氧组、脂肪乳空气组、脂肪乳氧气组幼鼠腹腔注射脂肪乳5.0 mL/kg。1次/d,连续7 d。每次注射完毕后分别放入氧浓度为18%、21%、50%的暖箱(38 ℃),待幼鼠翻正反射完全恢复后放回鼠笼。
另取90只P7大鼠分为阻滞剂加丙泊酚低氧组(SPH组)、阻滞剂加丙泊酚空气组(SPA组)、阻滞剂加丙泊酚氧气组(SPO组)、阻滞剂加脂肪乳低氧组(SCH组)、阻滞剂加脂肪乳空气组(SCA组)、阻滞剂加脂肪乳氧气组(SCO组),每组腹腔注射p-p38阻滞剂15 mg/kg,30 min后分别与丙泊酚低氧组、丙泊酚空气组、丙泊酚氧气组、脂肪乳低氧组、脂肪乳空气组、脂肪乳氧气组进行同样处理。
之后将每组分为两个部分,一部分于建模完成后立即处死取海马组织检测p-p38通路蛋白及Tau蛋白表达情况,另一部分继续饲养至1月龄做水迷宫检测。
1.4 呼吸频率和血氧饱和度监测每只幼鼠均在给药后,用婴儿血氧饱和度探头环绕于腹部,连续监测呼吸频率(RR)和血氧饱和度(SpO2)。
1.5 Western blot测tau、p-tau蛋白及p-p38的表达在最后一次药物注射苏醒后,每组随机取8只幼鼠用于取脑组织进行相关蛋白表达的测定。冰上迅速分离大鼠两侧海马,每100 mg海马组织加入磷酸化蛋白提取液700 μL后匀浆,4 ℃、10 000 r/min离心5 min,取上清液。用BCA法检测蛋白提取液浓度。经电泳,转膜,封闭后。加入兔抗tau蛋白及tau/p-tau蛋白/p-p38抗体(1: 1000),4 ℃孵育过夜,羊抗兔二抗(1: 7000)室温孵育1 h,ECL化学发光法显影。采用BIO-RAD凝胶图像分析系统进行扫描并清晰成像,显影结果经quantity-one软件进行定量分析。目的蛋白与内参β-actin灰度值的比值作为目的蛋白的含量。
1.6 Morris水迷宫实验每组取7只幼鼠继续饲养至30日龄时开始进行Morris水迷宫实验,评估其空间学习和记忆能力。开始测试前1 d,让每只大鼠在水池中游泳120 s以适应环境。第1~5天进行定位航行实验,将大鼠头朝池壁放入水中。记录120 s内寻找到平台的时间(逃避潜伏期),若大鼠在120 s内未找到平台,则将其引导至平台并停留20 s,逃避潜伏期记录为120 s。每只大鼠每天游4次,每次从不同的象限入水,两次之间间隔15 min。逃避潜伏期越长,表示学习能力越差;第6天进行空间探索实验,撤除平台,将大鼠从原平台对侧象限放入水中,记录120 s内穿越原平台次数及在目标象限(第Ⅲ象限)停留的时间。整个测试期间保持实验室内灯光、物品等室内环境一致。
1.7 统计学处理所有数据均使用SPSS 24.0软件进行分析,正态分布资料以均值±标准差展现。t检验法比较丙泊酚组与脂肪乳组之间的潜伏期、穿越平台次数、第三象限停留时间。灰度值差异采用LSD-t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠RR和SpO2监测结果与对应的脂肪乳剂组相比,丙泊酚空气组、丙泊酚低氧组,阻滞剂加丙泊酚空气组、阻滞剂加丙泊酚低氧组的RR和SpO2均明显下降,且差异有统计学意义(P < 0.05);丙泊酚空气组、丙泊酚低氧组与丙泊酚氧气组比较,阻滞剂加丙泊酚空气组、阻滞剂加丙泊酚低氧组与阻滞剂加丙泊酚氧气组比较,SpO2显著降低,差异有统计学意义(P < 0.05);注射阻滞剂前后各对应组之间的差异无统计学意义(P>0.05,表 1)。
| 表 1 各组大鼠呼吸频率和需氧饱和度值的比较 Table 1 Comparison of respiratory rate (RR) and blood oxygen saturation (SpO2) values of rats in each group (Mean±SD, n=15) |
p-p38、tau蛋白、p-tau蛋白在丙泊酚低氧组中的表达高于脂肪乳低氧组,丙泊酚空气组高于脂肪乳空气组,丙泊酚氧气组高于脂肪乳氧气组。脂肪乳低氧组、脂肪乳氧气组、脂肪乳空气组之间无显著差异(图 1A,图 2A)。注射p-p38通路阻滞剂后,p-p38在各组之间表达差异无统计意义,表明通路阻滞成功。tau蛋白、p-tau蛋白在丙泊酚组与相应脂肪乳组之间的差异无统计学意义(图 1B,图 2B)。
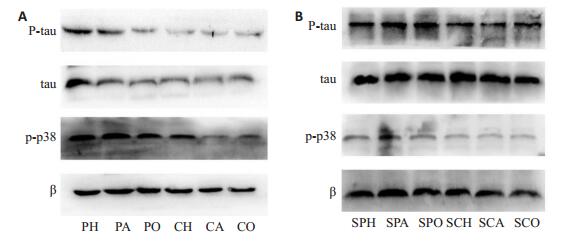
|
图 1 注射阻滞剂前后各组蛋白表达情况 Figure 1 Protein expression in each group before (A) and after (B) injection of blocker. CO: Fat emulsion oxygen group; CA: Fat emulsion air group; CH: fat emulsion hypoxia group; PO: Propofol oxygen group; PA: propofol air group; PH: Propofol hypoxia group; SCO: Blocker fat emulsion oxygen group; SCA: Blocker fat emulsion air group; SCH: Blocker fat emulsion hypoxia group; SPO: Blocker propofol oxygen group; SPA: Blocker propofol air group; SPH: Blocker propofol hypoxia group. |
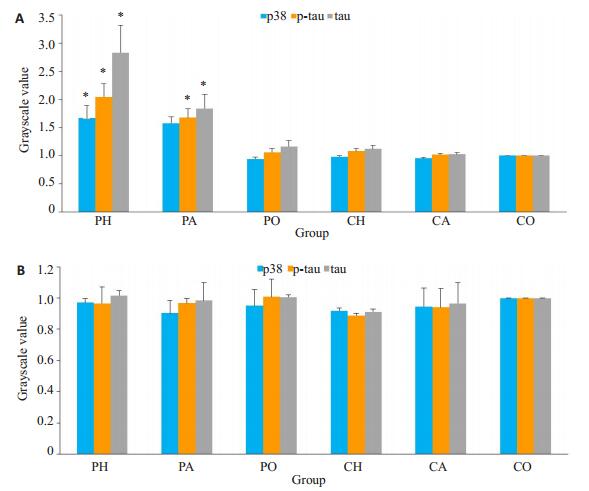
|
图 2 各组蛋白灰度值比较 Figure 2 Comparison of grayscale values of the proteins among the groups before (A) and after (B) blocker injection. Grayscale values of each protein is standardized by SCO group. *P < 0.05 vs corresponding lipid emulsion group. |
未注射阻滞剂时,定位航行实验结果:丙泊酚空气组、丙泊酚低氧组与相应脂肪乳组相比第1天潜伏期无差异,第2~4天潜伏期延长。脂肪乳氧气组与丙泊酚氧气组第1~5天均无差异。
空间探索实验结果:与脂肪乳氧气组相比,丙泊酚氧气组第三象限停留时间无差异,穿越平台次数减少。丙泊酚空气组、丙泊酚低氧组与相应脂肪乳组相比穿越平台次数、第三象限停留时间均减少(表 2,图 3A)。
| 表 2 注射阻滞剂前各组水迷宫实验结果 Table 2 Results of Morris water maze test before injection of blocker (Mean±SD, n=7) |
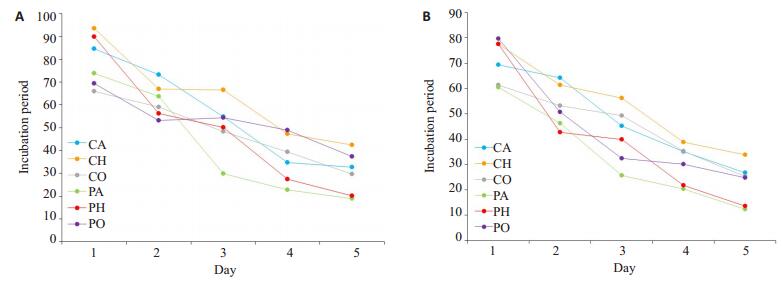
|
图 3 定位航行实验结果 Figure 3 Positioning navigation test results. A: Incubation period of each group before injection of blocker; B: Incubation period of each group after injection of blocker. |
注射阻滞剂后,定位航行实验结果:阻滞剂加脂肪乳氧气组与阻滞剂加丙泊酚氧气组第1~5天潜伏期均无差异;与阻滞剂加脂肪乳空气组相比,阻滞剂加丙泊酚空气组的潜伏期第1~2天无差异,第3~5天延长;与阻滞剂加脂肪乳低氧组相比,阻滞剂加丙泊酚低氧组第1~3天潜伏期无差异,第4~5天延长。空间探索实验结果:与阻滞剂加脂肪乳氧气组相比,阻滞剂加丙泊酚氧气组第三象限停留时间无差异,穿越平台次数减少;与阻滞剂加脂肪乳空气组相比,阻滞剂加丙泊酚空气组第三象限停留时间无差异,穿越平次数减少;与阻滞剂加脂肪乳低氧组相比,阻滞剂加丙泊酚低氧组第三象限停留时间缩短,穿越平台次数减少(表 3,图 3B,P < 0.05)。
| 表 3 注射阻滞剂后的水迷宫实验结果 Table 3 Results of Morris water maze test after injection of blocker (Mean±SD, n=7) |
脂肪乳氧气组与阻滞剂加脂肪乳氧气组,脂肪乳空气组与阻滞剂加脂肪乳空气组,脂肪乳低氧组与阻滞剂加脂肪乳低氧组之间的潜伏期、第三象限停留时间、穿越平台次数的差异均无统计学意义,表明两组之间具有可比性。定位航行实验:丙泊酚空气组与阻滞剂加丙泊酚空气组在第1~5天潜伏期的差异具有统计学意义;丙泊酚低氧组与阻滞剂加丙泊酚低氧组在第1~5天潜伏期的差异具有统计学意义。空间探索实验:丙泊酚氧气组与阻滞剂加丙泊酚氧气组组穿越平台次数有差异;丙泊酚空气组与阻滞剂加丙泊酚空气组、丙泊酚低氧组与阻滞剂加丙泊酚低氧组之间的穿越平台次数及第三象限停留时间均有差异。
3 讨论微管相关tau蛋白磷酸化是人类认知功能障碍最主要疾病阿尔茨海默病的特征性病变之一[21-23]。tau蛋白磷酸化后与微管蛋白的结合力会显著下降[24],同时失去促进微管装配形成、维持微管稳定的功能。最终引起突触丢失,脑神经元病变[25],最终导致认知障碍的发生。促分裂素原活化蛋白激酶(MAPK)链是真核生物信号传递网络中的重要途径之一,在基因表达调控和细胞质功能活动中发挥关键作用[2-27]。p38MAPK通路是MAPK通路的重要组成之一,可参与调节大鼠海马内tau蛋白的磷酸化[28]。本实验结果显示会在低氧合并丙泊酚条件下,p38会活化为p-p38,进而导致tau蛋白生成增加。
Yuan等[29]人的研究同样认为正常气压的高氧能够发挥神经保护作用,此外还有研究发现适当的高氧对心、小肠、肝、均有一定程度的保护能力[30-33]。这些实验结果表明本实验中氧气改善认知状况可能并非通过特异性阻滞相关通路实现,而是通过改善氧化应激等方式实现对神经的保护作用[34]。吕靖[35]的研究显示丙泊酚对发育期大鼠海马神经细胞具有损伤作用,缺氧预处理够减轻丙泊酚对发育期大鼠海马神经细胞的损伤。该实验结论与本研究结论不一致。推测可能与缺氧时间,是否间断缺氧等因素有关。
在本实验中,我们发现空气或低氧条件下,丙泊酚多次暴露会导致幼鼠认知功能障碍,氧气对丙泊酚导致的认知功能障碍有一定的保护作用。此外,当p38通路被阻断后,各组tau蛋白表达不再有明显差异且各组大鼠认知功能均有一定程度的改善。这说明tau蛋白是丙泊酚合并低氧时大鼠认知功能受损的直接原因之一,且p38通路在这一过程中介导了tau蛋白的生成。本实验及课题组之前的研究显示,由于丙泊酚对呼吸和心血管系统的抑制,空气组的幼鼠实际上处于低血氧状态[36],因此本研究中的丙泊酚空气组,阻滞剂加丙泊酚空气组幼鼠认知功低于正常水平。李旭泽等[37]的研究同样发现在空气条件下丙泊酚会使p-p38的表达量上升,该结论与本实验一致。注射p38通路阻滞剂后各丙泊酚组与注射阻滞剂前丙泊酚组相比潜伏期均值减小,说明p38通路参与了丙泊酚引起的认知障碍。而在注射阻滞剂后阻滞剂加丙泊酚空气组与阻滞剂加脂肪乳空气组、阻滞剂加丙泊酚低氧组与阻滞剂加脂肪乳低氧组之间仍存在差异,说明阻滞p38通路未能完全逆转丙泊酚对认知功能的损伤,可能还有其他因素参与了这一过程[38-39]。
| [1] |
Walters JL, Paule MG. Review of preclinical studies on pediatric general anesthesia-induced developmental neurotoxicity[J].
Neurotoxicol Teratol, 2017, 60(3): 2-23.
|
| [2] |
Shen FY, Song YC, Guo F, et al. Cognitive impairment and endoplasmic reticulum stress induced by repeated short-term sevoflurane exposure in early Life of rats[J].
Front Psychiatry, 2018, 9: 332.
|
| [3] |
Schneuer FJ, Bentley JP, Davidson AJ, et al. The impact of general anesthesia on child development and school performance: a population-based study[J].
Pediatr Anesth, 2018, 28(6): 528-36.
DOI: 10.1111/pan.2018.28.issue-6. |
| [4] |
王家强, 缪长虹, 陈家伟. 丙泊酚的脑保护作用及其机制研究进展[J].
中国新药与临床杂志, 2016, 35(8): 538-41.
|
| [5] |
徐振东, 林蓉, 刘志强, 等. 全身麻醉药对发育期大脑的影响:毒性作用还是保护作用[J].
中国临床医学, 2014, 21(3): 370-3.
|
| [6] |
梁小洁, 官瑞丽, 王涛, 等. 丙泊酚对认知的损伤及成瘾性研究进展[J].
现代生物医学进展, 2016, 16(20): 3974-6.
|
| [7] |
Zhang S, Liang Z, Sun W, et al. Repeated propofol anesthesia induced downregulation of hippocampal miR-132 and learning and memory impairment of rats[J].
Brain Res, 2017, 1670: 156-64.
DOI: 10.1016/j.brainres.2017.04.011. |
| [8] |
Wang YJ, Guo XY, Wang J. Influences of repeated propofol anesthesia on hippocampal apoptosis and long-term learning and memory abilities of neonatal rats[J].
Beijing Da Xue Xue Bao, 2017, 49(2): 310-4.
|
| [9] |
Logan S, Jiang C, Yan Y, et al. Propofol alters long non-coding RNA profiles in the neonatal mouse hippocampus: implication of novel mechanisms in anesthetic-induced developmental neurotoxicity[J].
Cell Physiol Biochem, 2018, 49(6): 2496-510.
DOI: 10.1159/000493875. |
| [10] |
Tian HT, Duan XH, Yang YF, et al. Effects of propofol or sevoflurane anesthesia on the perioperative inflammatory response, pulmonary function and cognitive function in patients receiving lung cancer resection[J].
Eur Rev Med Pharmacol Sci, 2017, 21: 5515-22.
|
| [11] |
Li M, Zhang X, Wu A, et al. Propofol-induced age-different hypocampal long-term potentiation is associated with F-actin polymerization in rats[J].
Cell Biochem Biophys, 2015, 71(2): 1059-66.
DOI: 10.1007/s12013-014-0309-6. |
| [12] |
Fontes MT, Mcdonagh DL, Phillips-Bute B, et al. Arterial hyperoxia during cardiopulmonary bypass and postoperative cognitive dysfunction[J].
J Cardiothorac Vasc Anesth, 2014, 28(3): 462-6.
DOI: 10.1053/j.jvca.2013.03.034. |
| [13] |
Ibrahim RM, Krammer CW, Hansen TG, et al. Systemic physiology and neuroapoptotic profiles in young and adult rats exposed to surgery: A randomized controlled study comprising four different anaesthetic techniques[J].
Int J Dev Neurosci, 2015, 45: 11-8.
DOI: 10.1016/j.ijdevneu.2015.04.351. |
| [14] |
李晓娜, 靳国恩, 李生花. 低氧对学习记忆相关蛋白的影响研究进展[J].
现代生物医学进展, 2017, 17(31): 6191-5.
|
| [15] |
丁伏生, 范明, 朱玲玲. 适度低氧对脑损伤的保护作用[J].
生理科学进展, 2018, 49(4): 241-6.
DOI: 10.3969/j.issn.0559-7765.2018.04.001. |
| [16] |
Campos JH, Feider A. Hypoxia during one-lung ventilation-a review and update[J].
J Cardiothorac Vasc Anesth, 2018, 32(5): 2330-8.
DOI: 10.1053/j.jvca.2017.12.026. |
| [17] |
赵湛元, 李建伟, 李斌飞, 等. 体外膜肺氧合在成人大面积肺血栓栓塞中的应用[J].
广东医学, 2017, 38(2): 229-30, 233.
DOI: 10.3969/j.issn.1001-9448.2017.02.019. |
| [18] |
东利宁.等比通气联合呼气末正压对妇科腹腔镜手术患者呼吸功能的影响[D].延安: 延安大学, 2017.
http://cdmd.cnki.com.cn/Article/CDMD-10719-1017721139.htm
|
| [19] |
孙清, 张亮, 陈伯成, 等. 丙泊酚对仔鼠海马磷酸化tau蛋白及β-淀粉样蛋白_(1-42)表达的影响[J].
医药导报, 2015, 34(4): 435-9.
DOI: 10.3870/yydb.2015.04.003. |
| [20] |
Li YW, Li QY, Wang JH, et al. Contribution of p38 MAPK to the ameliorating effect of enriched environment on the cognitive deficits induced by chronic cerebral hypoperfusion[J].
Cell Physiol Biochem, 2016, 40(3/4): 549-57.
|
| [21] |
Hammes J, Drzezga A, Van Eimeren T. The role of Tau imaging in parkinsonian disorders[J].
Curr Neurol Neurosci Rep, 2018, 18(12): 86.
DOI: 10.1007/s11910-018-0898-3. |
| [22] |
Wang JZ, Liu F. Microtubule-associated protein tau in development, degeneration and protection of neurons[J].
Prog Neurobiol, 2008, 85(2): 148-75.
DOI: 10.1016/j.pneurobio.2008.03.002. |
| [23] |
Jagust W. Imaging the evolution and pathophysiology of Alzheimer disease[J].
Nat Rev Neurosci, 2018, 19(11): 687-700.
DOI: 10.1038/s41583-018-0067-3. |
| [24] |
Pluta R, Ułamek-Kozioł M, Januszewski S, et al. Tau protein dysfunction after brain ischemia[J].
J Alzheimers Dis, 2018.
|
| [25] |
Passarella D, Goedert M. Beta-sheet assembly of Tau and neurodegeneration in Drosophila melanogaster[J].
Neurobiol Aging, 2018, 72: 98-105.
DOI: 10.1016/j.neurobiolaging.2018.07.022. |
| [26] |
Bohush A, Niewiadomska G, Filipek A. Role of mitogen activated protein kinase signaling in parkinson's disease[J].
Int J Mol Sci, 2018, 19(10): 2973.
DOI: 10.3390/ijms19102973. |
| [27] |
安秋霞, 蒙艳丽, 吕丹丹, 等. 丝裂原活化蛋白激酶信号通路的研究进展[J].
黑龙江中医药, 2016, 45(5): 65-6.
|
| [28] |
Kheiri G, Dolatshahi M, Rahmani F, et al. Role of p38/MAPKs in alzheimer's disease: implications for amyloid beta toxicity targeted therapy[J].
Rev Neurosci, 2018.
|
| [29] |
Yuan Z, Pan R, Liu W, et al. Extended normobaric hyperoxia therapy yields greater neuroprotection for focal transient ischemiareperfusion in rats[J].
Med Gas Res, 2014, 4(1): 14.
DOI: 10.1186/2045-9912-4-14. |
| [30] |
Caldeira DE, Silveira MR, Margarido MR, et al. Effect of hyperbaric hepatic hyperoxia on the liver of rats submitted to intermittent ischemia/reperfusion injury[J].
Acta Cir Bras, 2014, 29(suppl 1): 24-8.
DOI: 10.1590/S0102-86502014001300005. |
| [31] |
Tavafi M, Ahmadvand H, Tamjidipour A, et al. Effect of normobaric hyperoxia on gentamicin- induced nephrotoxicity in rats[J].
Iran J Basic Med Sci, 2014, 17(4): 287-93.
|
| [32] |
Kang N, Hai Y, Liang F, et al. Preconditioned hyperbaric oxygenation protects skin flap grafts in rats against ischemia/ reperfusion injury[J].
Mol Med Rep, 2014, 9(6): 2124-30.
DOI: 10.3892/mmr.2014.2064. |
| [33] |
Peng YW, Mohammed A, Deatrick KB, et al. Differential effects of normoxic and hyperoxic reperfusion on global myocardial ischemiareperfusion injury[J].
Semin Thorac Cardiovasc Surg, 2018.
|
| [34] |
Ferrando C, Soro M, Belda FJ. Protection strategies during cardiopulmonary bypass[J].
Curr Opin Anaesthesiol, 2015, 28(1): 73-80.
DOI: 10.1097/ACO.0000000000000143. |
| [35] |
吕靖. cAMP/PKA/CREB信号通路在缺氧预处理逆转丙泊酚致发育期大鼠海马神经元毒性中的作用[D].南宁: 广西医科大学, 2018.
|
| [36] |
涂生芬.低氧环境下丙泊酚对新生大鼠学习记忆功能的影响及其机制研究[D].重庆: 重庆医科大学, 2011.
http://cdmd.cnki.com.cn/Article/CDMD-10631-1011174325.htm
|
| [37] |
李旭泽.异丙酚对发育期海马神经元凋亡的影响及Rho GTP酶在其中的作用研究[D].石家庄: 河北医科大学, 2015.
http://med.wanfangdata.com.cn/Paper/Detail/DegreePaper_Y2786102
|
| [38] |
严艾.脑源性神经营养因子在丙泊酚致新生鼠认知功能障碍中的作用机制研究[D].重庆: 重庆医科大学, 2016.
http://cdmd.cnki.com.cn/Article/CDMD-10631-1016782970.htm
|
| [39] |
严艾, 高进, 陈萍. mBDNF/Akt/CREB和proBDNF/RhoA信号传导失衡在丙泊酚致新生鼠认知功能障碍的作用[J].
基础医学与临床, 2016, 36(5): 666-71.
|
 2018, Vol. 38
2018, Vol. 38

