糖尿病肾病(DN)是终末期肾脏疾病的主要原因之一,探索糖尿病肾病中肾小球损伤的机制,以期获得新的治疗策略,是目前医学研究的一个热点。既往研究表明,在1型和2型糖尿病中,足细胞的损伤和减少是DN发病机制中最早的机制之一[1-3],糖尿病肾病中肾小球损伤的发展涉及足细胞,内皮细胞和系膜细胞之间的相互作用。足细胞的丢失是糖尿病肾病发展的早期和关键步骤,并且通过对系膜内结构性病变的分析暗示足细胞的丧失是关键的介导事件[4]。高葡萄糖(HG)在体外或体内均可诱导足细胞凋亡[5-6],导致足细胞损伤和数目的减少, 高血糖或者氧化应激产物(ROS)的增加可能是糖尿病肾病中足细胞损伤和凋亡的触发因素[7-9]。然而,高血糖诱导足细胞凋亡的具体机制尚未被完全阐明。
活化T细胞核因子(NFAT)是一类Ca2+/钙调磷酸酶(CaN)依赖的转录因子,NFAT的活化高度依赖于Ca2+/ CaN,而环孢素A(CSA)可以有效地抑制CaN。高葡萄糖可激活血管平滑肌细胞、胰腺β细胞的NFAT;NFAT的过度活化参与了足细胞损伤和肾小球硬化[10-11],但是目前未见关于高血糖是否可激活肾小球足细胞的NFAT2并进而导致足细胞凋亡的报道。本研究旨在探讨高葡萄糖是否能活化体外培养足细胞的NFAT2和活化的NFAT 2在高葡萄糖诱导的足细胞凋亡中所发挥的作用;同时观察NFAT2活化是否对足细胞中的促凋亡因子Bax的表达产生影响并由此促进细胞的凋亡;从而初步探讨DN肾小球足细胞损伤的机制。
1 资料和方法 1.1 试剂和仪器 1.1.1 试剂抗体(Santa Cruz Biotechnology和Invitrogen);Bax polyclonal IgG(Cell Signaling);Rabbit antiGAPDH(Sofar);HRP conjugated Goat Anti-Mouse IgG(Jackson);HRP conjugated Goat Anti-Rabbit IgG(Jackson);钙离子荧光探针(Fluo3/AM):Sigma Aldrich;PrimeScript 1st Strand cDNA Synthesis Kit(TakaRa);Rnase-Free DNA酶试剂盒(QAIGEN);TRIzol(Invitrogen);葡萄糖(D-+- Glucose):Sigma Aldrich;甘露醇(DMannitol):Sigma Aldrich;环孢素A(CsA):Sigma Aldrich;Ionomycin:SigmaAldrich;11R-VIVIT:MERCK;DAPI荧光染料:(Roche, Shanghai,China);lip 2000 Invitrogen: Carlsbad,CA,USA;Annexin V-FITC/PI细胞凋亡检测试剂盒(北京嘉美)。
1.1.2 仪器FACSCALIBUR流式细胞分析仪(Beckman);激光共聚焦显微镜(LEICA),普通光学显微镜(OLYMPUS);HEPA Class100二氧化碳培养箱(Thermo Foma);实时定量PCR仪(option Tm2,BIORAD,USA);NANo DROP1000核酸检测仪(Thermo SCIENTIFIC);SynergyTM HT多通道酶标仪(BIO TEK);数字式超声细胞破碎仪(S-150D,Branson);Mini-ProteanÒ3电泳系统(Bio-Rad);电转移槽(Mini Trans-Blot Electrophoretic Transfer Cell,Bio-Rad);分光光度仪(Beckman)。
1.2 足细胞培养、鉴定及实验分组条件永生性小鼠足细胞由Baylor医学院Danesh教授惠赠。分化成熟后的足细胞在相差显微镜下直接拍片,观察其形态学差异;表达足细胞骨架蛋白synaptopodin的细胞为分化成熟的足细胞,未分化的足细胞不表达synaptopodin蛋白。
1.2.1 按以下不同目的进行分组干预处理足细胞不同糖浓度干预下和不同作用时间下足细胞核中NFAT 2的表达情况:正常糖组予葡萄糖5.3 mmol/L干预0.5、1、2和4 h;高糖组分别予10、30、40 mmol/L Glucose干预2 h和葡萄糖20 mmol/L分别作用0.5、1、2和4 h。
添加不同试剂后足细胞核中NFAT 2的表达情况:葡萄糖5.3 mmol/L+Mannitol1 4.7 mmol/L,葡萄糖20 mmol/L+11R-vivit 100 nmol/L,葡萄糖20 mmol/L+ CsA 500 nmol/L均作用2 h;不同干预下足细胞的凋亡:葡萄糖5.3 mmol/L不同作用时间12,24,48 h;葡萄糖20 mmol/L作用12 h,24 h不同时间;分别观察葡萄糖20 mmol/L,葡萄糖20 mmol/L+11R-vivit 100 nmol/L,葡萄糖5.3 mmol/L+Mannitol 14.7 mmol/L作用48 h的结果。
不同干预下足细胞的促凋亡因子Bax的表达情况:葡萄糖5.3,20 mmol/L,葡萄糖5.3 mmol/L+Mannitol 14.7 mmol/L均作用24 h;葡萄糖20 mmol/L+11R-vivit 100 nmol/L作用24 h;葡萄糖5.3 mmol/L,葡萄糖20 mmol/L,葡萄糖5.3 mmol/L+Mannitol14.7 mmol/L,葡萄糖20 mmol/L+11R-vivit 100 nmol/L均作用48 h。
1.2.2 NFAT2的活化、足细胞凋亡、Bax的表达的情况和Ca2+内流的情况分别用免疫荧光、Western blot检测不同刺激物不同时间(具体见1.2.1)下足细胞NFAT 2的活化(核浆分离后对核蛋白进行检测);流式细胞术检测足细胞的凋亡;实时定量PCR和Western blot检测Bax表达,PCR引物设计:鼠:①Bax:正向5'-TGGCAGCT GACATGGTTTCTGAC-3',反向5'- CGTCCCAACCA GGGTCT-3',反向195 bp PCR产物。②GAPDH:正向5'-CGAAGTCAACGGATTTGGTCGTAT-3',反向5'- AGCCTTCTCCATGGTGGTGAAGAC-3',306 bp PCR产物;采用荧光染料法,用激光共聚焦动态观察足细胞内Ca2+水平的变化。
1.3 统计学处理计量资料数据以均数±标准差表示,应用SPSS 23.0统计软件进行统计学分析,结果用单因素方差分析,如方差齐用LSD法进行组间多重比较,方差不齐则用Dunnett's T3法进行组间多重比较。P < 0.05被定为有统计学差异。
2 结果 2.1 葡萄糖呈浓度依赖活化NFAT2葡萄糖5.3、10、20、30及葡萄糖40 mmol/L各自作用足细胞2 h,Western blot检测结果显示足细胞核中NFAT2/Histone3的比值分别为0.999±0.001;1.652± 0.188;2.405±0.281;1.850±0.397及2.000±0.381。高糖系列组与葡萄糖5.3 mmol/L组比较,足细胞胞核中的NFAT2均有增加,其差异具有统计学意义(P5.3 mmol/L组,10 mmol/L组=0.020;P5.3 mmol/L组,20 mmol/L组 < 0.001;P5.3 mmol/L组,30 mmol/L组= 0.005;P5.3 mmol/L组,40 mmol/L组=0.002);在相同培养时间时,葡萄糖对足细胞NFAT 2表达的影响呈浓度依赖(图 1)。
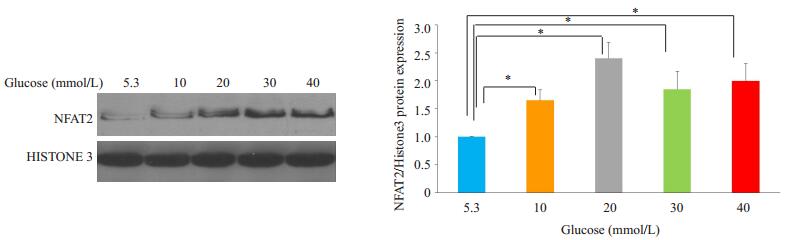
|
图 1 Western blot检测不同葡萄糖浓度作用下足细胞胞核中NFAT2的表达 Figure 1 Western blotting for detecting NFAT2 expression in the nuclei of podocytes exposed to different concentrations of glucose (n=3). *P < 0.05. |
葡萄糖5.3 mmol/L(NG)分别作用足细胞0.5、1、2和4 h,Western blot显示NFAT2/Histone3结果分别为:1.000±0.000;1.080±0.321、1.229±0.385及1.112±0.458;各组两两对比,其差异均无统计学意义(PNG 0.5 h组, NG 1 h组= 0.792;PNG0.5h组, NG2h组=0.455;PNG0.5h组, NG4h组=0.713;PNG1h组, NG2h组=0.626;PNG 1 h组, NG 4 h组=0.916;及PNG2 h组, NG4 h组=0.701);葡萄糖20 mmol/L(HG)分别作用足细胞0.5、1、2和4 h,Western blot显示NFAT 2/Histone 3结果分别为:1.253±0.332、1.656±0.464、2.080±0.319及1.601±0.431;其中HG 0.5 h组与HG 1 h组对比,其差异不具有统计学意义(PHG 0.5h组,HG 1h组=0.197),HG 0.5 h组与HG 2 h组对比,其差异具有统计学意义(PHG 0.5h组,HG 2h组=0.014),HG 2 h组与HG 4 h组对比,其差异不具有统计学意义(PHG 2h组,HG 4h组= 0.128)。由此推测:在高浓度葡萄糖的培养基中,足细胞NFAT 2表达的呈时间依赖;当应用葡萄糖浓度为20 mmol/L的培养基培养2 h时,NFAT 2的活化达到高峰(图 2)。
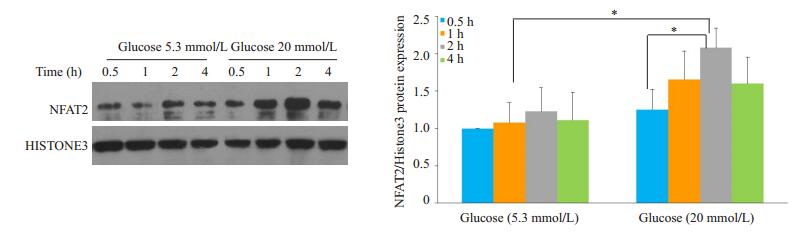
|
图 2 Western blot检测不同时间作用下足细胞胞核中NFAT2的表达 Figure 2 Western blotting for detecting NFAT2 expression in the nuclei of podocytes exposed to 20 mmol/L glucose for different durations (n=3). *P < 0.05. |
Western blot检测显示足细胞核中NFAT 2/Histone 3的比值:HG 2 h组为2.039±0.373;与葡萄糖5.3 mmol/L+ Ionomycin 500 nmol/L 2 h组(2.353±0.506)结果相近,两组差异不具有统计学意义(PHG组,Ionomycin组=0.220);葡萄糖20 mmol/L+11R-vivit 100 nmol/L 2 h组与葡萄糖20 mmol/L + CsA 500 nmol/L 2 h组分别为:1.223 ± 0.188、1.208±0.207,比葡萄糖20 mmol/L 2 h组明显减少,其差异具有统计学意义(P11R-vivit组,HG组=0.005;PCsA组,HG组 =0.004),与葡萄糖NG组(1.000±0.000)相近,其差异不具有统计学意义(P11R-vivit组,NG组=0.378;PCsA组,NG组=0.409);葡萄糖5.3 mmol/L+Mannitol 14.7 mmol/L(渗透压对照)组为:1.173±0.194,与葡萄糖5.3 mmol/L 2 h组相近,其差异不具有统计学意义(P渗透压对照组,NG组=0.491)。由此推测:高浓度葡萄糖通过不依赖增加渗透压的途径活化足细胞的NFAT 2,使用CsA抑制CaN或者11R-vivit均可明显减少高糖诱导的NFAT 2的活化(图 3)。
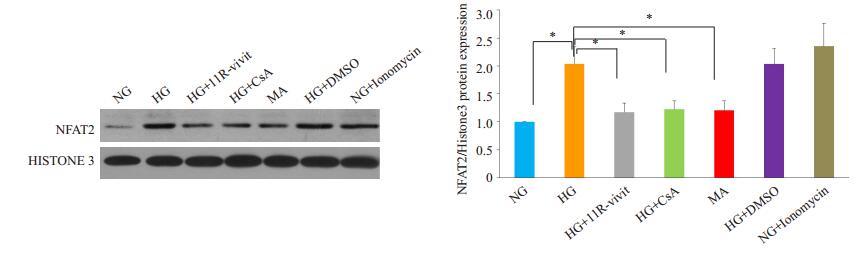
|
图 3 Western blot检测不同处理对足细胞胞核中NFAT2表达的影响 Figure 3 Western blotting for detecting NFAT2 expression in the nuclei of podocytes with different treatments (n=3). *P < 0.05. |
应用激光共聚焦观察不同干预下足细胞胞核的NFAT 2定性表达情况,NFAT 2着染为红色,细胞核着染为蓝色,两种颜色重叠为紫色。NG组、渗透压对照组、11R-vivit组及CsA组的NFAT 2均以表达于细胞质为主,胞核区仅有少量表达;而HG组、DMSO组及Ionomycin组的NFAT 2不仅在细胞质中表达,还高表达于细胞的胞核中。其变化与Western blot检测结果相似。
2.4 不同干预对足细胞凋亡的影响(见表 1)| 表 1 流式细胞术检测不同干预下组足细胞的凋亡率 Table 1 Apoptotic rate of the podocytes with different treatments by flow cytometry (Mean±SD, %) |
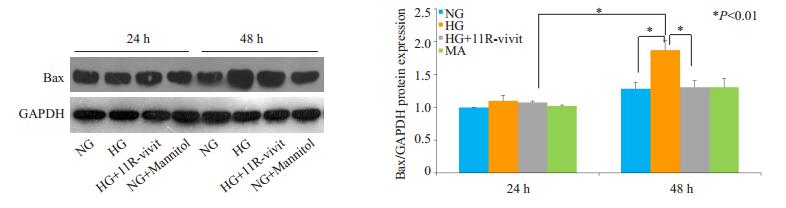
Bax因子是细胞中的促凋亡因子。实时定量PCR和Western blot分析结果表明:葡萄糖20 mmol/L 48 h组,足细胞中Bax因子的mRNA和蛋白表达对比葡萄糖5.3 mmol/L 48 h组均显着增加(PHG48h组,NG48h组 < 0.01,PHG48h组,NG48 h组 < 0.01);但是葡萄糖5.3 mmol/L+Mannitol 14.7 mmol/L 48 h组与葡萄糖5.3 mmol/L 48 h组结果相似;而葡萄糖20 mmol/L+11R-vivit 100 nmol/L 48 h组较葡萄糖20 mmol/L 48 h组明显减少(PHG48 h组,11R-vivit48 h组 < 0.01,PHG48 h组,11R- vivit48 h组 < 0.01)也与葡萄糖5.3 mmol/L 48 h组相似(图 4、5)。
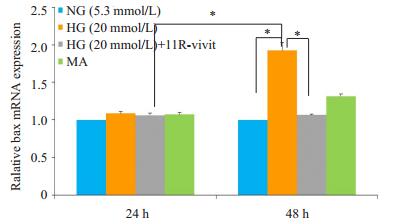
|
图 4 实时定量PCR检测不同处理时足细胞凋亡因子Bax mRNA的水平 Figure 4 Bax mRNA level of in the podocytes with different treatment time detected by real-time quantitative PCR. *P < 0.01. |
|
图 5 Western blot检测不同处理时足细胞凋亡因子Bax蛋白的表达水平 Figure 5 Protein expression of Bax in the podocytes with different treatment time detected by Western blotting. *P < 0.01. |
|
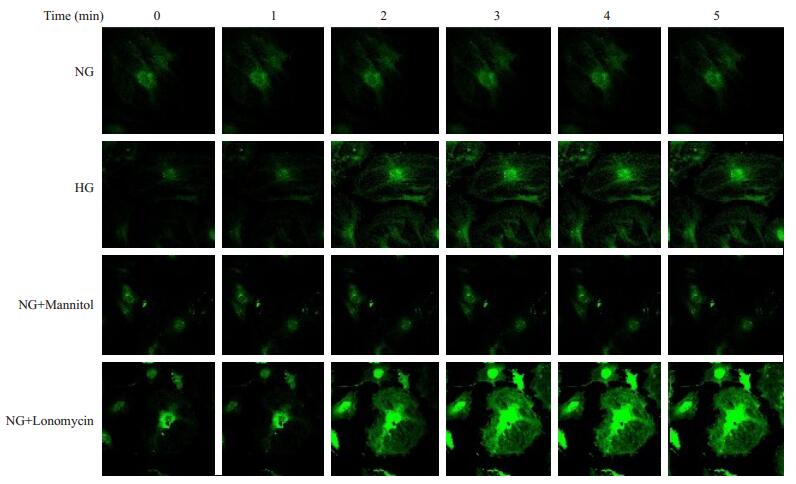
图 6 激光共聚焦观察不同处理时足细胞中钙离子浓度依赖性荧光强度 Figure 6 Intracellular Ca2 + concentrations in cultured podocytes with different treatment detected by confocal laser microscopy. |
应用Fluo-3/AM标记Ca2+,激光共焦显微镜扫描不同刺激下足细胞内Ca2+浓度的变化。结果表明:葡萄糖20 mmol/L组、葡萄糖5.3 mmol/L+Ionomycin 500 nmol/L组较葡萄糖5.3 mmol/L组钙离子内流随刺激时间延长均明显增加;但葡萄糖5.3 mmol/L+Mannitol 14.7 mmol/L组钙离子内流与葡萄糖5.3 mmol/L组相似。由此推测,浓度为20 mmol/L的葡萄糖可增加体外培养足细胞的钙离子内流,且该过程不依赖于渗透压的增加。
3 讨论在肾小球疾病的进展中,足细胞发挥关键的作用[12]。研究[13-14]结果表明:足细胞凋亡是早期肾脏损伤的一种表现,同时也在蛋白尿的发展中以及糖尿病肾病的进展中发挥举足轻重的作用。基础和临床的研究[14]结果均表明:在糖尿病肾病的发生发展过程中,肾小球足细胞由于凋亡及脱落导致数目的减少从而出现蛋白尿。因此,减少或阻断足细胞的凋亡可能将成为糖尿病肾病一项行之有效的新治疗策略。
我们的研究结果显示:高糖(葡萄糖20 mmol/L)可以诱导体外培养足细胞的凋亡,同时上调细胞中促凋亡因子Bax的mRNA及蛋白质的表达。重要的是,我们首次证实:高糖通过活化足细胞中钙调磷酸酶(CaN)的底物活化T细胞核因子2(NFAT 2)从而促进足细胞的凋亡。同时我们也进一步发现,NFAT 2的活化可能是由于高糖导致足细胞的钙离子内流增加,激活CaN进而活化NFAT 2入核发挥相关的效应。由此推测:阻断CaN/NFAT2/Bax信号途径可能是有效阻断高糖诱导足细胞凋亡这一过程的关键。
NFAT属于一类核转录因子家族,NFAT包括NFAT 1、NFAT 2、NFAT 3、NFAT 4及NFAT 5共5个成员,磷酸化的NFAT蛋白随着钙调磷酸酶活化而去磷酸化并从细胞的胞质中转移入胞核,从而发挥转录活性[15]。在本实验中,我们发现当给予体外培养的肾小球足细胞20 mmol/L的葡萄糖刺激2 h时,细胞的胞核中NFAT 2的表达明显增加,而这种现象可以被钙调磷酸酶的抑制剂CsA或NFAT的抑制剂11R-vivit所阻断。这一结果显示:当给予体外培养的肾小球足细胞高糖刺激时,细胞中的NFAT 2可以被活化并从细胞的胞质中转移进胞核中。
NFAT蛋白在免疫及非免疫等多种细胞中表达并发挥不同的功能[16-18]。人们也越来越关注它们在不同细胞中多种多样的生物学功能。近期,多个实验的结果表明:细胞中NFAT的活化与细胞的凋亡相关[19-23]。尤其是近期有关NFAT在肾小球足细胞中的信号途径中的相关研究更值得我们的关注[24-29]。高糖活化NFAT后是否导致足细胞的凋亡呢?高糖通过激活足细胞那种NFAT而导致足细胞的凋亡呢?基于近期文献报导的肾小球足细胞中NFAT 2的过度活化可导致蛋白尿及肾小球硬化[30]。因此我们通过实验验证是否肾小球足细胞中NFAT 2的活化介导了高糖导致的足细胞凋亡;应用annexin-V/PI标志足细胞检测高糖作用下足细胞的凋亡情况。我们在实验中发现,高糖可以促进体外培养肾小球足细胞的凋亡,而这一过程可以被NFAT 2的抑制剂11R-vivit所阻断。这一结果说明肾小球足细胞中NFAT 2的活化介导了高糖导致的足细胞凋亡。
为了更好地明确NFAT 2介导高糖导致足细胞凋亡的机制,我们同时观察了足细胞中的促凋亡因子Bax的表达。结果显示:当给予体外培养的足细胞高糖刺激时,促凋亡因子Bax的mRNA及蛋白的表达水平明显增加,但这种现象可以被NFAT 2的抑制剂11R-vivit所阻断,同时我们也发现甘露醇并不能增加足细胞中Bax的mRNA或者蛋白的表达。这些与高糖导致足细胞凋亡现象相吻合。
综上,我们首次探索了高糖是否活化体外培养的小鼠足细胞的NFAT 2以及NFAT 2的活化是否导致足细胞的凋亡。我们研究的结果显示:高糖诱导体外培养的足细胞凋亡呈时间依赖性,这一过程可以被NFAT2的抑制剂11R-vivit所阻断。高糖能有效的增加体外培养足细胞中NFAT 2活化入核,而这一过程可以被NFAT 2的抑制剂11R-vivit或钙调磷酸酶的抑制剂CsA所阻断,同时我们也揭示,高糖通过促进钙离子内流增加细胞内钙离子浓度从而活化钙调磷酸酶及其下游NFAT2。综合这些结果,我们推测,高糖可能通过CaN/ NFAT2/Bax信号通路介导足细胞的凋亡,阻断CaN/ NFAT2/Bax信号通路可以减少高糖诱导的足细胞凋亡。
| [1] |
Liu J, Li QX, Wang XJ, et al. β-Arrestins promote podocyte injury by inhibition of autophagy in diabetic nephropathy[J].
Cell Death Dis, 2016, 7(4): e2183.
DOI: 10.1038/cddis.2016.89. |
| [2] |
Tharaux PL, Huber TB. How is proteinuric diabetic nephropathy caused by disturbed proteostasis and autophagy in podocytes?[J].
Diabetes, : 539-41.
|
| [3] |
Wang Y, Li Y, Zhang T, et al. Genistein and Myd88 activate autophagy in high glucose-induced renal podocytes in vitro[J].
Med Sci Monit, 2018, 24(24): 4823-31.
|
| [4] |
Alpers CE, Hudkins KL. Pathology identifies glomerular treatment targets in diabetic nephropathy[J].
Kidney Res Clin Pract, 2018, 37(2): 106-11.
DOI: 10.23876/j.krcp.2018.37.2.106. |
| [5] |
Shi JX, Wang QJ, Li H, et al. Silencing of USP22 suppresses high glucose-induced apoptosis, ROS production and inflammation in podocytes[J].
Mol Biosyst, 2016, 12(5): 1445-56.
DOI: 10.1039/C5MB00722D. |
| [6] |
Yang H, Wang Q, Li S. MicroRNA-218 promotes high glucoseinduced apoptosis in podocytes by targeting heme oxygenase-1[J].
Biochem Biophys Res Commun, 2016, 471(4): 582-8.
DOI: 10.1016/j.bbrc.2016.02.028. |
| [7] |
Li J, Wang B, Zhou G, et al. Tetrahydroxy stilbene glucoside alleviates high glucose-induced MPC5 podocytes injury through suppression of NLRP3 inflammasome[J].
Am J Med Sci, 2018, 355(6): 588-96.
DOI: 10.1016/j.amjms.2018.03.005. |
| [8] |
Shi JX, Huang Q. Glucagon-like peptide-1 protects mouse podocytes against high glucose induced apoptosis, and suppresses reactive oxygen species production and proinflammatory cytokine secretion, through sirtuin 1 activation in vitro[J].
Mol Med Rep, 2018, 18(2): 1789-97.
|
| [9] |
Qian XX, Tan J, Liu L, et al. MicroRNA-134-5p promotes high glucose-induced podocyte apoptosis by targeting bcl-2[J].
Am J Transl Res, 2018, 10(3): 989.
|
| [10] |
Fu Y, Wang C, Zhang D, et al. Increased TRPC6 expression is associated with tubular epithelial cell proliferation and inflammation in diabetic nephropathy[J].
Mol Immunol, 2018, 94: 75-81.
DOI: 10.1016/j.molimm.2017.12.014. |
| [11] |
Pedigo CE, Ducasa GM, Leclercq F, et al. Local TNF causes NFATc1-dependent cholesterol-mediated podocyte injury[J].
J Clin Invest, 2016, 126(9): 3336-50.
DOI: 10.1172/JCI85939. |
| [12] |
Garg P, Holzman LB. Podocytes: gaining a foothold[J].
Exp Cell Res, 2012, 318(9): 955-63.
DOI: 10.1016/j.yexcr.2012.02.030. |
| [13] |
Eid AA, Gorin Y, Fagg BM, et al. Mechanisms of podocyte injury in diabetes: role of cytochrome P450 and NADPH oxidases[J].
Diabetes, 2009, 58(5): 1201-11.
DOI: 10.2337/db08-1536. |
| [14] |
Lee SC, Han SH, Li JJ, et al. Induction of heme oxygenase-1 protects against podocyte apoptosis under diabetic conditions[J].
Kidney Int, 2009, 76(8): 838-48.
DOI: 10.1038/ki.2009.286. |
| [15] |
Rao A, Luo C, Hogan PG. Transcription factors of the NFAT family: regulation and function[J].
Annu Rev Immunol, 1997, 15: 707-47.
DOI: 10.1146/annurev.immunol.15.1.707. |
| [16] |
Peng Q, Luo A, Zhou Z, et al. Interleukin 29 inhibits RANKLinduced osteoclastogenesis via activation of JNK and STAT, and inhibition of NF-κB and NFATc1[J].
Cytokine, 2018(18): 30282-5.
|
| [17] |
Zappe M, Feldner A, Arnold C, et al. NFAT5 isoform C controls biomechanical stress responses of vascular smooth muscle cells[J].
Front Physiol, 2018, 9: 1190.
DOI: 10.3389/fphys.2018.01190. |
| [18] |
He RL, Wu ZJ, Liu XR, et al. Calcineurin/NFAT signaling modulates pulmonary artery smooth muscle cell proliferation, migration and apoptosis in monocrotaline-induced pulmonary arterial hypertension rats[J].
Cell Physiol Biochem, 2018, 49(1): 172-89.
DOI: 10.1159/000492852. |
| [19] |
Papin J, Zummo FP, Pachera N, et al. Na +/Ca2 + exchanger a druggable target to promote β-Cell proliferation and function[J].
J Endocr Soc, 2018, 2(7): 631-45.
DOI: 10.1210/js.2017-00370. |
| [20] |
Chen Q, Mo L, Cai X, et al. ICOS signal facilitates Foxp3 transcription to favor suppressive function of regulatory T cells[J].
Int J Med Sci, 2018, 15(7): 666-73.
DOI: 10.7150/ijms.23940. |
| [21] |
Xu S, Shu P, Zou S, et al. NFATc1 is a tumor suppressor in hepatocellular carcinoma and induces tumor cell apoptosis by activating the FasL-mediated extrinsic signaling pathway[J].
Cancer Med, 2018, 7(9): 4701-17.
DOI: 10.1002/cam4.2018.7.issue-9. |
| [22] |
Lu WC, Xie H, Tie XX, et al. NFAT-1 hyper-activation by methionine enkephalin (MENK) significantly induces cell apoptosis of rats C6 glioma in vivo and in vitro[J].
Int Immunopharmacol, 2018, 56: 1-8.
DOI: 10.1016/j.intimp.2018.01.005. |
| [23] |
Qin JJ, Wang W, Zhang R. Experimental therapy of advanced breast cancer: targeting NFAT1-MDM2-p53 pathway[J].
Prog Mol Biol Transl Sci, 2017, 151: 195-216.
DOI: 10.1016/bs.pmbts.2017.07.005. |
| [24] |
Yao XM, Liu YJ, Wang YM, et al. Astragaloside IV prevents high glucose-induced podocyte apoptosis via downregulation of TRPC6[J].
Mol Med Rep, 2016, 13(6): 5149-56.
DOI: 10.3892/mmr.2016.5167. |
| [25] |
Abkhezr M, Kim EY, Roshanravan H, et al. Pleiotropic signaling evoked by tumor necrosis factor in podocytes[J].
Am J Physiol Renal Physiol, 2015, 309(2): F98-108.
DOI: 10.1152/ajprenal.00146.2015. |
| [26] |
Schlöndorff J, Del Camino D, Carrasquillo R, et al. TRPC6 mutations associated with focal segmental glomerulosclerosis cause constitutive activation of NFAT-dependent transcription[J].
Am J Physiol Cell Physiol, 2009, 296(3): C558-69.
DOI: 10.1152/ajpcell.00077.2008. |
| [27] |
Nijenhuis T, Sloan AJ, Hoenderop JG, et al. Angiotensin Ⅱ contributes to podocyte injury by increasing TRPC6 expression via an NFAT-mediated positive feedback signaling pathway[J].
Am J Pathol, 2011, 179(4): 1719-32.
DOI: 10.1016/j.ajpath.2011.06.033. |
| [28] |
Zhang H, Liang S, Du Y, et al. Inducible ATF3-NFAT axis aggravates podocyte injury[J].
J Mol Med (Berl), 2018, 96(1): 53-64.
DOI: 10.1007/s00109-017-1601-x. |
| [29] |
Zhang L, Li R, Shi W, et al. NFAT2 inhibitor ameliorates diabetic nephropathy and podocyte injury in db/db mice[J].
Br J Pharmacol, 2013, 170(2): 426-39.
DOI: 10.1111/bph.2013.170.issue-2. |
| [30] |
Wang Y, Jarad G, Tripathi P, et al. Activation of NFAT signaling in podocytes causes glomerulosclerosis[J].
J Am Soc Nephrol, 2010, 21(10): 1657-66.
DOI: 10.1681/ASN.2009121253. |
 2018, Vol. 38
2018, Vol. 38

