转录因子GATA4是GATA锌指转录因子家族的一员,是心脏前体细胞最早期标志之一,也是心脏细胞分化、发育过程中的重要转录因子[1]。研究报道GATA4基因突变与先天性心脏病的发生密切相关[2-7],我们前期研究发现GATA4基因错义突变(H436Y)与先天性心脏病房室间隔缺损有关[8]。为深入阐明GATA4基因p.H436Y突变在心脏房室间隔发育中的作用及机制,建立基因敲入小鼠模型是一种十分有效的手段。人类GATA4蛋白与小鼠Gata4蛋白序列比对结果显示两组有高度的同源性,人类GATA4蛋白所对应的氨基酸第436位HèY,与小鼠Gata4蛋白氨基酸第435位HèY相一致,组氨酸在生物进化过程中处于高度保守,而Gata4基因p. H435Y突变在小鼠心脏房室间隔发育中的作用未知。
本研究利用新兴的CRISPR/Cas9技术[9-11]成功建立了Gata4基因H435Y突变型小鼠并繁育,解决了以往基因敲除或敲入技术中效率低、耗时长、难度大等问题,目前该小鼠模型国内外尚未见报道。
1 材料和方法 1.1 实验材料SPF级3~4周龄C57BL/6J野生型小鼠(南方模式生物)、RT-PCR试剂盒(TaKaRa)、PCR引物、LB-琼脂平板、Cas9表达载体、oligo donar DNA、pUC57-T7-GDNA质粒、大肠杆菌、AgeⅠ酶(TaKaRa)、DraⅠ酶(TaKaRa)、T7 Ultra试剂盒(Invitrogen)、质粒提取试剂(Qiagen)、回收试剂、限制性核酸内切酶BasⅠ(TaKaRa)、T7 RNA聚合酶(TaKaRa)。
1.2 方法 1.2.1 sgRNA设计及寡核苷酸链合成根据美国国立生物技术信息中心(NCBI),小鼠Gata4基因定位于第14条染色体(chromosome14:63, 198, 922-63, 271, 692, ENSMUST00000118022.7),全长3374 bp,有7个外显子,6个编码外显子,起始于exon2,终止于exon7,表达蛋白全长441aa。确定转录起始密码子附近及下游GN20GG序列,将其作为靶点,设计合成引物。根据在线sgRNA软件(http://crispr.mit.edu/),设计并合成2对Gata4基因的寡核苷酸链:1.正向序列5'-AGACATCGCAGGCCAGCTCCAAGCAGGACT-3',反向序列5'-TACGGGGACATAATCACCGCGTAAT CAGCGC-3';2.正向序列5'-CTTGGAACAGCCTGG TCCTGGCTGACAGT-3',反向序列5'-CCCCCCTTC CCTCTTCAAATTCCTGCTCG-3'。获得的寡核苷酸进一步纯化,将设计Gata4的sgRNA寡核苷酸链通过下列步骤退火形成双链:94 ℃预变性5 min;90 ℃变性30 s,50 ℃退火30 s,70 ℃延伸30 s,循环30次;4 ℃下保持。获得的寡核苷酸立即使用或保存于-20 ℃环境下备用。
1.2.2 sgRNA表达载体的构建和PCR鉴定将2对sgRNA寡核苷酸双链稀释至0.5 μmol/L,利用BsaI酶切pUC57-T7-GDNA质粒,使其线性化,进一步稀释至50 mg/L,两者分别进行混合连接。连接的体系为:线性化的pUC57-T7-GDNA质粒载体2 μL,稀释后的寡核苷酸双链5 μL,T4缓冲液1 μL,T4DNA连接酶1 μL,50% PEG4000 1 μL,合计10 μL。反应条件为:22 ℃下30 min,37 ℃下15 min,16 ℃下6 h。将连接后产物转化大肠杆菌DH5α感受态细胞,涂布于氨苄抗性的LB-琼脂平板上培养,放置14~16 h后选取具有氨苄抗性的单克隆菌群,溶于LB液摇匀后,将部分菌液接种到具有氨苄抗性的LB液中摇菌培养,剩余菌液提取质粒DNA,进行PCR鉴定。阳性克隆鉴定产物大小为449 bp,阴性克隆产物无条带,完成sgRNA载体构建。
1.2.3 Cas9和sgRNA表达载体体外转录Cas9表达载体经AgeI酶切线性化,sgRNA的表达载体pUC57-T7- GDNA-sgRNA经DraI酶切线性化,纯化后作为模板,用于体外转录sgRNA的体外合成,利用MEGA shortscript Kit在体外通过T7 RNA聚合酶完成。Cas9 mRNA的合成利用T7 Ultra试剂盒在体外通过T7 RNA聚合酶完成。
1.2.4 oligo donor DNA序列信息根据选择的sgRNA模板序列,合成一对互补的oligo donor DNA [13]序列:AGACATCGCAGGCCAGCTCCAAGCAGGACTCT TGGAACAGCCTGGTCCTGGCTGACAGTTACGG GGACATAATCACCGCGTAATCAGCGCCCCCCCTTCCCTCTTCAAATTCCTGCTCG
1.2.5 Cas9 mRNA/sgRNA原核注射取3~4周龄C57BL/ 6J雌鼠超排后与性成熟的C57BL/6J雄鼠交配,挑选见栓鼠取受精卵,培养在M16培养液中,将Cas9 mRNA、gRNA和oligo DNA通过显微注射技术注射到受精卵中,注射后的受精卵移植到0.5天假孕鼠的输卵管,每只假孕鼠输卵管单侧移卵约25枚,培育后获得F0代小鼠。
1.2.6 小鼠Gata4基因PCR鉴定及测序新生F0代小鼠出生后1~2周,剪尾放入200 μL组织裂解液,55 ℃消化过夜。使用2倍体积的100%乙醇沉淀,室温13 000 r/min离心5 min。弃上清,500 μL 70%的乙醇溶液清洗一次,待沉淀DNA晾干后,置于500 μL TE(10 mM pH 8.0)中55 ℃溶解1 h以上,取1 μL作为模板进行PCR分析,上下游引物序列为5'-GTCCCCACAAGGCTATGC-3'和5'-GCTGGGGTGAAGGAGATTATGTGT-3'。在20 μL体系中加入:ddH2O 13.2 μL,rTaq PCR Buffer 2 μL,2.5 mmol/L dNTP 2 μL,Primer Ⅰ (10 pmol/μL)及Primer Ⅱ(10 pmol/μL)各0.5 μL,r Taq DNA Polymerase 0.8 μL,Tail genomic DNA 1 μL,94 ℃预变性3 min,循环参数为94 ℃ 20 s,61 ℃ 20 s,72 ℃ 1 min,34个循环后72 ℃扩展1 min,12 ℃保存。使用PCR纯化试剂纯化PCR产物,通过PCR产物的大小判断F0代小鼠中的阳性小鼠。若CRISPR/Cas9技术修饰Gata4基因相对应位点使其突变,那么该PCR产物将消失,变成缩短或者增长的异常表达片段。为了进一步验证突变情况,通过TA克隆及测序检测来确定突变。
1.2.7 繁育Gata4基因突变小鼠并分析其后代突变情况将F0代小鼠饲养于SPF环境,提供充足食物与饮水。根据PCR及TA克隆、测序结果,挑选出Gata4基因突变的F0代小鼠,分别与同龄性成熟的野生型C57BL6/129小鼠交配后,获得F1代小鼠,再将性成熟的F1代小鼠相互杂交,每只F1代孕鼠单独饲养、培育,得到F2代小鼠。
2 结果 2.1 设计Gata4的sgRNA序列及表达载体利用CRISPR/Cas9技术,在第7个编码外显子上选择sgRNA靶点(图 1),pUC57-T7-GDNA质粒经BsaⅠ酶切线性化,设计的sgRNA寡核苷酸双链的黏性末端与BsaⅠ酶的黏性末端相互匹配,sgRNA寡核苷酸双链可分别与上述载体连接,进而成功构建pUC57-T7- GDNA-sgRNA载体,经过体外转录Cas9、gRNA电泳(图 2)、测序验证序列正确无误。
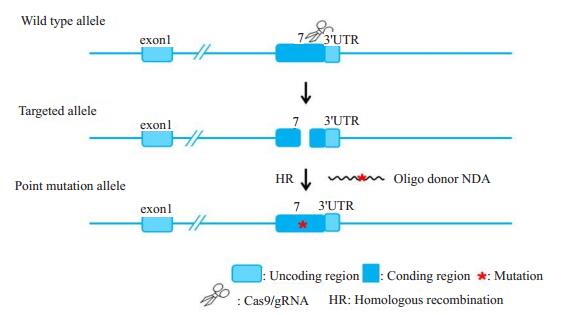
|
图 1 sgRNA识别基因外显子示意图 Figure 1 Schematic diagram of exon recognition by sgRNA. |
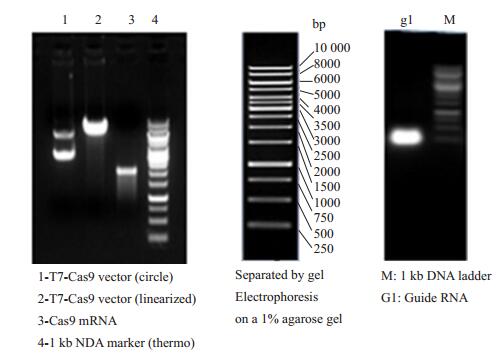
|
图 2 体外转录Cas9、gRNA电泳结果 Figure 2 Electrophoresis of the in vitro transcripts of Cas9 and gRNA. |
pUC57-T7-GDNA-sgRNA载体和Cas mRNA表达载体经体外转录,将sgRNA和Cas mRNA均匀混合,通过显微注射法将受精卵移植入假孕鼠,经过培育,共获得F0代小鼠36只,通过PCR检测和基因测序鉴定,对F0代小鼠的基因型进行鉴定,共获得4只目的基因点突变的阳性F0代小鼠,分别为2(雌性)、6(雄性)、7(雄性)、9(雌性)(图 3),经过PCR产物连接T-vector测序,确定这4只小鼠体内已经实现了Gata4基因突变。
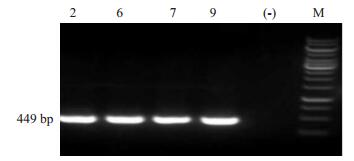
|
图 3 F0代基因敲入小鼠PCR电泳结果 Figure 3 Electrophoresis of the PCR product for F0 generation knockin mice. 2, 6, 7, 9: Positive mice; (-): Control, M: 1kb DNA Marker. |
将阳性F0小鼠2(雌性)、6(雄性)、7(雄性)、9(雌性)与野生型C57BL/6J小鼠会交获得F1代小鼠,这里我们选择活力较好的7(雄性)进行繁育,同样的方法进一步验证来自同一个7号的F1代杂合子为Gata4基因敲入小鼠,选取阳性F0代小鼠与野生型C57BL/6J小鼠交配,获得的F1代小鼠通过PCR检测和基因测序鉴定,共获得阳性小鼠6只,分别为1、4、14、18、23、26号(图 4)。
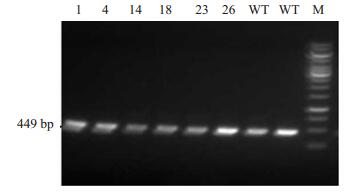
|
图 4 F1代基因敲入小鼠PCR电泳结果 Figure 4 Electrophoresis of the PCR product for F1 generation knockin mice. 1, 4, 14, 18, 23, 26: positive mice; WT: Wild type mice, M: 1 kb DNA Marker. |
对F1代小鼠进行测序验证,阳性小鼠点突变前后测序比对,结果以及点突变前后测序发现1号(由325- 327位,移位到315-317位)及26号(由325-327位,移位到314-317位)小鼠发生移码突变;4号、14号、18号、23号小鼠发生碱基突变(由ATG变为GTA)。
3 讨论近年来众多的国内外研究报道GATA4基因突变与先天性心脏病发生有关[12-13],随着对该基因的不断深入研究发现,人类GATA4基因通过其锌指结构与其他心脏特异性的转录因子相互作用,是心脏发生调控网络中重要的转录因子[14-15]。目前研究结果认为[16],人类GATA4基因病理性突变可引起基因产物的转录活性下降,影响其他心脏发育相关因子发挥作用,从而影响心脏正常发育,最终导致先天性心脏病的发生。在小鼠胚胎发育研究中发现[17],心脏发育的整个过程中都有Gata4基因的表达,敲除Gata4基因的小鼠研究证实其无法形成原始心管,若Gata4基因表达量减少70%,鼠胚胎表现为完全性房室间隔缺损、右室双流出道、心肌增殖减少所致的心室肌发育不全等[18]。
上述研究表明不论是小鼠还是人类,转录因子GATA4均与心脏的发育与心功能的改变密切相关。我们在前期研究的基础上,建立基因敲入小鼠模型, 探讨Gata4基因p.H435Y突变在小鼠心脏房室间隔发育中的作用及机制,是一种十分有效的手段。
基因敲入技术[19-21]是近几年来研究基因功能直接且有效的新技术,其中包括ZFNs、TALENs和CRISPR/ Cas [22-25]技术为代表的基因编辑技术在动植物基因改造方面展现出了巨大的潜力,得到了广泛的应用。CRISPR/Cas9技术与以往的技术不同,其系统的工作原理是crRNA通过碱基配对与tracrRNA结合形成tracrRNA/crRNA复合物,通过此复合物可引导核酸酶Cas9蛋白,使其在与crRNA配对的序列靶位点剪切双链DNA,而通过人工设计这两种RNA,可以改造形成具有引导作用的sgRNA,以引导Cas9对DNA的定点切割,进而使得DNA双链断裂,在sgRNA的介导下即可实现定向的基因打靶[26]。CRISPR/Cas9技术较传统的基因敲出技术相比,其特点是制作简单、成本低、作用高效,能实现定点突变[27-28]。CRISPR/Cas9技术已经作为一种工具,应用于执行高效、高特异性的人类细胞全基因组筛选和构建,为人类健康和疾病相关基因功能的研究开辟了无限的可能[29-30]。
本研究依据文献报道,设计sgRNA的作用靶点,依赖于oligo donor DNA、Cas9蛋白形成核糖核酸蛋白复合物来识别靶序列,最终对特定的位点进行修饰。将Cas9 mRNA、sgRNA和donor DNA混合物显微注射入小鼠受精卵后,移植入假孕鼠子宫内, 进行培育后,获得的小鼠进行PCR鉴定后获得4只阳性小鼠,为确保产生的突变可以成功整合进生殖系染色体并稳定遗传,进行杂交、繁育的野生型小鼠均来自相同背景。本研究所获得的F0及F1代小鼠,均通过PCR方法对基因片段的突变情况进行鉴定,然后通过PCR产物经连接T-vector测序,以确认该基因片段是否发生突变,对已经确认产生突变,并且来自同一亲代的F1代小鼠,分别进行相互交配,以获得Gata4基因突变的纯合子小鼠。对所获得的纯合子小鼠进行PCR鉴定,进而证明成功建立的鼠系为可以稳定遗传的基因突变小鼠。
本研究运用CRISPR/Cas9技术,以GATA4基因为靶点,通过对小鼠的受精卵中注入Cas9 mRNA、sgRNA和donor DNA混合物来实现对目的基因的定点切割与破坏。该小鼠模型建立成功以后,为研究GATA4基因在先天性心脏病发生过程中的作用机制提供了实验材料,也为其他重要基因体内功能的研究提供了重要的技术借鉴。
| [1] |
Holtzinger A, Rosenfeld GE, Evans T. Gata4 directs development of cardiac-inducing endoderm from ES cells[J].
Dev Biol, 2010, 337(1): 63-73.
DOI: 10.1016/j.ydbio.2009.10.003. |
| [2] |
杜佳, 易岂建. NKX2-5, TBX5, GATA4基因与先天性心脏病关系研究进展[J].
儿科药学杂志, 2018, 24(5): 58-61.
|
| [3] |
Han H, Chen Y, Liu G, et al. GATA4 transgenic mice as an in vivo model of congenital heart disease[J].
Int J Mol Med, 2015, 35(6): 1545-53.
DOI: 10.3892/ijmm.2015.2178. |
| [4] |
Manjegowda DS, Karunakar P, Ramachandra NB. Effect of structural changes in proteins derived fromGATA4nonsynonymous single nucleotide polymorphisms in congenital heart disease[J].
Indian J Pharm Sci, 2015, 77(6): 735.
DOI: 10.4103/0250-474X.174988. |
| [5] |
Ang YS, Rivas RN, Ribeiro AJ, et al. Disease model of GATA4 mutation reveals transcription factor cooperativity in human cardiogenesis[J].
Cell, 2016, 167(7): 1734.
DOI: 10.1016/j.cell.2016.11.033. |
| [6] |
韩燊, 蒋立虹, 王文举. GATA转录因子家族与先天性心脏病研究进展[J].
医学综述, 2016, 22(4): 628-32.
DOI: 10.3969/j.issn.1006-2084.2016.04.002. |
| [7] |
张艳丽, 陈名武, 陈冶, 等. GATA4对心内膜垫发育中相关蛋白表达作用的研究[J].
中华心血管病杂志, 2015, 43(5): 437-41.
DOI: 10.3760/cma.j.issn.0253-3758.2015.05.015. |
| [8] |
Chen MW, Pang YS, Guo Y, et al. GATA4 mutations in Chinese patients with congenital cardiac septal defects[J].
Pediatr Cardiol, 2010, 31(1): 85-9.
DOI: 10.1007/s00246-009-9576-1. |
| [9] |
方锐, 畅飞, 孙照霖, 等. CRISPR/Cas9介导的基因组定点编辑技术[J].
生物化学与生物物理进展, 2013, 40(8): 691-702.
|
| [10] |
郑武, 谷峰. CRISPR/Cas9的应用及脱靶效应研究进展[J].
遗传, 2015, 37(10): 1003-10.
|
| [11] |
沈彬.利用CRISPR/Cas9进行基因编辑[D].南京: 南京大学, 2014.
http://cdmd.cnki.com.cn/Article/CDMD-10284-1014418709.htm
|
| [12] |
Ill-Min C, Govindasamy R. Genetics of congenital heart defects: the NKX2-5 gene, a key player[J].
Genes, 2016, 7(2): pii: Eb.
|
| [13] |
Yilbas AE, Hamilton A, Wang YJ, et al. Activation of GATA4 gene expression at the early stage of cardiac specification[J].
Front Chem, 2014, 2(11): 12.
|
| [14] |
Christine M, Beaver LE, Taylor OR, et al. Efficient targeted mutagenesis in the monarch butterfly using zinc-finger nucleases[J].
Genome Res, 2013, 23(1): 159-68.
DOI: 10.1101/gr.145599.112. |
| [15] |
Geurts AM, Cost GJ, Freyvert Y, et al. Knockout rats via embryo microinjection of zinc-finger nucleases[J].
Science, 2009, 325(5939): 433.
DOI: 10.1126/science.1172447. |
| [16] |
Yang YQ, Li L, Wang J, et al. A novel GATA4 Loss-of-Function mutation associated with congenital ventricular septal defect[J].
Pediatr Cardiol, 2012, 33(4): 539-46.
DOI: 10.1007/s00246-011-0146-y. |
| [17] |
Zhang X, Wang J, Wang B, et al. A novel missense mutation of GATA4 in a Chinese family with congenital heart disease[J].
PLoS One, 2016, 11(7): e0158904.
DOI: 10.1371/journal.pone.0158904. |
| [18] |
Singh MK, Li Y, Li SR, et al. Gata4 and Gata5 cooperatively regulate cardiac myocyte proliferation in mice[J].
J Biol Chem, 2010, 285(3): 1765-72.
DOI: 10.1074/jbc.M109.038539. |
| [19] |
邵斯旻, 徐坤, 张智英. 基因组编辑技术中供体DNA类型及选择[J].
中国生物化学与分子生物学报, 2017, 32(1): 1-10.
|
| [20] |
张敏杰, 孙玲, 刘真, 等. 可编辑核酸酶介导的哺乳动物基因敲入技术最新进展[J].
中国细胞生物学学报, 2016, 38(1): 72-80.
|
| [21] |
雍曾花, 姚合斌. 基因敲入小鼠模型鉴定及表型分析的研究进展[J].
转化医学杂志, 2013, 2(5): 306-9.
|
| [22] |
Li H, Haurigot V, Doyon Y, et al. In vivo genome editing restores haemostasis in a mouse model of haemophilia[J].
Nature, 2011, 475(7355): 217.
DOI: 10.1038/nature10177. |
| [23] |
Brown AJ, Fisher DA, Kouranova E, et al. Whole-rat conditional gene knockout via genome editing[J].
Nat Methods, 2013, 10(7): 638-40.
DOI: 10.1038/nmeth.2516. |
| [24] |
Agnihotri S, Wolf A, Munoz DM, et al. A GATA4-regulated tumor suppressor network represses formation of malignant human astrocytomas[J].
J ExpMed, 2011, 208(4): 689-702.
DOI: 10.1084/jem.20102099. |
| [25] |
Niu Y, Shen B, Cui Y, et al. Generation of gene-modified cynomolgus monkey via Cas9/RNA-mediated gene targeting in onecell embryos[J].
Cell, 2014, 156(4): 836-43.
DOI: 10.1016/j.cell.2014.01.027. |
| [26] |
刘倩男.基于CRISPR/Cas9系统的基因打靶研究[D].开封: 河南大学, 2015.
http://cdmd.cnki.com.cn/Article/CDMD-10475-1015658132.htm
|
| [27] |
Mussolino C, Cathomen T. RNA guides genome engineering[J].
Nat Biotechnol, 2013, 31(3): 208-9.
DOI: 10.1038/nbt.2527. |
| [28] |
Barrangou R. RNA-mediated programmable DNA cleavage[J].
Nat Biotechnol, 2012, 30(9): 836-8.
DOI: 10.1038/nbt.2357. |
| [29] |
Anton T, Leonhardt H, Markaki Y. Visualization of genomicloci in living cells with a fluorescent CRISPR/Cas9 system[J].
Methods Mol Biol, 2016, 1411: 407-17.
DOI: 10.1007/978-1-4939-3530-7. |
| [30] |
Song J, Yang D, Xu J, et al. RS-1 enhances CRISPR/Cas9- and TALEN-mediated knock-in efficiency[J].
Nat Commun, 2016, 7: 10548.
DOI: 10.1038/ncomms10548. |
 2018, Vol. 38
2018, Vol. 38

