2. 贵阳市妇幼保健院 乳腺科,贵州 贵阳 550003
2. Department of Breast, Guiyang Maternal and Children's Healthcare Hospital, Guiyang 550003, China
子宫内膜癌是发生于子宫内膜的一组上皮性恶性肿瘤,好发于围绝经期和绝经后女性。子宫内膜癌的原因迄今尚不明确,一般认为,子宫内膜癌根据发病机制和生物学行为特点可分为雌激素依赖型(Ⅰ型)和非雌激素依赖型(Ⅱ型)[1-2]。子宫内膜癌患者死亡的主要原因与肿瘤的侵袭和转移显著相关[3-8]。
MMPs是一组在细胞外基质降解中起主要作用的锌离子依赖性蛋白酶超家族。较多的MMPs家族基因(如MMP1、MMP2和MMP9)在肿瘤发病过程中高表达并分泌到细胞外降解细胞外基质,从而导致肿瘤细胞的侵袭和转移。MMP20作为该家族成员之一,目前在肿瘤中的研究极少[9-11],在子宫内膜癌中尚没有相关报导。
TCGA数据库收录了大量各类肿瘤基因的表达数据,为我们寻找有研究价值的基因提供了关键线索[12-17]。http://ualcan.path.uab.edu/index.html是一个TCGA数据库数据挖掘网站,能快速初步查询基因在肿瘤中的表达以及与患者预后的关系。因此在本次研究中我们首先在该网站查询了MMP20在子宫内膜癌组织中的表达与预后的关系。进一步通过实时荧光定量PCR和免疫组化验证该基因在子宫内膜癌中的表达水平,最后统计分析MMP20蛋白表达与临床参数和预后之间的关系。
1 材料和方法 1.1 生物信息学分析MMP20在子宫内膜癌中的表达与预后的关系利用在线网站http://ualcan.path.uab.edu/index.html查找MMP20在子宫内膜癌中的表达与预后的关系。具体操作如下:打开网站主页,点击analysis按钮后进入分析页面,在“Scan by genes”框中填入MMP20,在TCGA dataset选择Uterine Corpus endometrial carcinoma,点击Survival Profile查找基因表达及其与预后的关系。
1.2 标本收集收集本院21例新鲜配对子宫内膜癌及子宫内膜标本,液氮保存。收集广州医科大学附属第三医院病理科134例子宫内膜癌组织和34例子宫内膜组织石蜡包埋标本。患者年龄范围在27~82岁之间且所有患者术前未做化疗。样本的获取均已取得医院伦理委员会同意。
1.3 试剂Trizol、逆转录试剂盒及实时荧光定量PCR试剂盒(Takara)。MMP20兔抗人多克隆抗体(Santa Cruze)。免疫组化检测试剂盒(迈新)。
1.4 RNA提取21例配对子宫内膜癌及配对子宫内膜组织使用Trizol常规提取总RNA。总RNA随即被逆转录成cDNA。反应条件如下:总RNA 1 μg与2 μL dNTP mix(10 mmol/L)、2 μL oligo(dT)18(0.5 μg/μL)及无RNA酶去离子水13.5 μL混匀、离心,70 ℃变性5 min,室温静置2 min。随后依次添加5×Buffer 4 μL、0.1 mol/L DTT 1 μL、RNase inhibitor(40 U/μL)0.5 μL、逆转录酶(200 U/μL)1 μL,混匀、离心,放入42 ℃水浴中反应1 h,95 ℃灭活5 min。-20 ℃冷冻备用。
1.5 实时荧光定量PCR实时荧光定量PCR在子宫内膜癌组织中扩增MMP20基因(Sense: 5'-GAGGAACAACTACCGCCT CG-3';Antisense: 5'-CATCAGGAACTCCACAGCGA-3',反应体系为SYBR Premix Ex(2×)10 μL、上下游引物(10 µmoL)各0.4 μL、ROX Reference Dye Ⅱ(50×)0.4 μL、cDNA模板1 μL、灭菌去离子水7.8 μL共20 μL。反应条件如下:94 ℃变性2 min;94 ℃变性12 s;59 ℃退火12 s;72 ℃延伸15 s;45个循环;最后,产物在72 ℃延伸5 min,溶解曲线分析。实验独立重复3次。GAPDH基因作为内参照。
1.6 免疫组化常规SP法检测MMP20蛋白在子宫内膜癌和子宫内膜中的表达。二甲苯将病理石蜡切片脱蜡,梯度乙醇入水,浸泡于10 mmol/L的柠檬酸盐缓冲液里高温高压抗原修复2 min。进一步使用含3%过氧化氢的过氧化物酶抑制剂阻断内源性过氧化物酶;MMP20多克隆抗体1:100稀释,4 ℃孵育过夜。清洗切片后依次用辣根过氧化物酶耦联,DAB显色,苏木素复染后封片,显微镜观察、评分。随机选择10个高倍视野(×400),按阳性细胞数量及着色强度进行评分,阳性细胞比例:无阳性细胞为0分,< 10%为1分,10%~50%为2分,>50%为3分,>75%为4分;着色强度:未着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。结果由两位高年资病理医师通过独立双盲法读片评定[18],评分大于或等于6分为高表达。
1.7 统计分析采用SPSS20.0统计分析软件包进行数据处理。在本研究中,基于目的基因和看家基因实时荧光定量扩增曲线得到Ct值,通过ΔCT=Ct目的基因-Ct看家基因公式计算出目的基因相对于看家基因的表达强度。ΔΔCt=ΔCt(肿瘤样品)-ΔCt(正常样品)。以2-ΔΔCt表示各子宫内膜癌与非癌子宫内膜组织中MMP20基因表达的倍比关系。>1时目的基因表达上调,反之下调。卡方统计分析MMP20蛋白表达与子宫内膜癌患者临床病理参数之间的关系;生存分析采用Kaplan Meier曲线;以Cox比例风险模型进行多因素分析,P < 0.06认为差异有统计学意义。
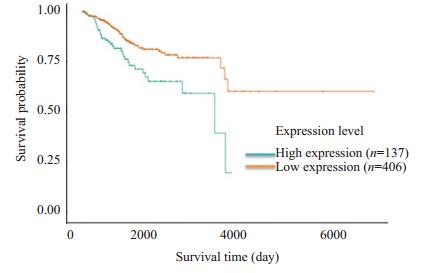
2 结果 2.1 生物信息学分析本研究查询了TCGA数据库中关于MMP20表达与子宫内膜癌患者预后之间的关系。结果显示,MMP20高表达患者的综合生存时间显著低于MMP20低表达患者(P < 0.05,图 1)。
|
图 1 MMP20 mRNA高表达的子宫内膜癌患者预后不良 Figure 1 A high expression of MMP20 mRNA is associated with a poor prognosis in patients with endometrial carcinoma. |
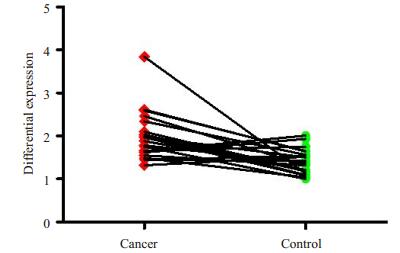
为进一步证实MMP20参与了子宫内膜癌的发病过程,我们利用实时荧光定量PCR检测了21例配对子宫内膜癌与子宫内膜组织中MMP20 mRNA的差异表达。配对T检验分析显示,与对照组织相比,MMP20 mRNA在子宫内膜癌中表达显著升高(P < 0.05,图 2)。
|
图 2 实时荧光定量PCR检测MMP20 mRNA在子宫内膜癌中表达上调 Figure 2 Real-time PCR reveals up-regulated MMP20 mRNA expression in endometrial carcinoma. |
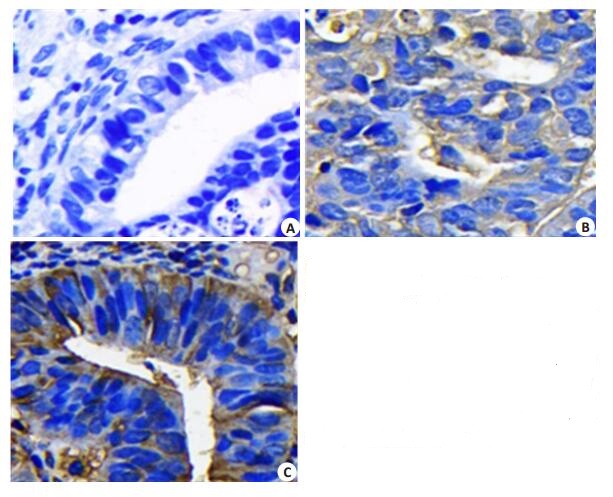
为进一步明确MMP20蛋白在子宫内膜癌中的表达,我们利用免疫组化检测MMP20蛋白在子宫内膜癌与子宫内膜组织中的表达情况。结果显示,MMP20主要表达在子宫内膜癌细胞胞浆中(图 3)。在134例子宫内膜癌组织中,MMP20高表达43例,低表达94例;而在34例子宫内膜组织中,MMP20高表达仅有3例,低表达31例。MMP20蛋白在子宫内膜癌组织中表达显著升高,差异有统计学意义(P < 0.05)。
|
图 3 免疫组化检测MMP20蛋白在子宫内膜癌和子宫内膜组织中的表达 Figure 3 Immunohistochemistry for detecting the expression of MMP20 protein in endometrial carcinoma and endometrial tissues (Original magnification: ×400). A: Negative expression of MMP20 in endometrial tissues; B: Low expression of MMP20 in endometrial cancer tissues; C: High expression of MMP20 in endometrial carcinoma tissues. |
进一步我们分析了MMP20蛋白与子宫内膜癌临床病理参数之间的关系。结果发现过表达的MMP20蛋白与子宫内膜癌患者的FIGO分期呈正相关(P < 0.05);但与组织学分级、淋巴结转移、肌层浸润深度无明显关系(表 1)。
| 表 1 MMP20表达与子宫内膜癌临床病理特征关系 Table 1 Correlation of MMP20 protein expression with the clinicopathological characteristics of patients with endometrial carcinoma |
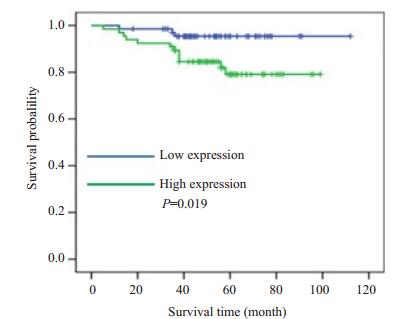
Kaplan Meier生存曲线分析显示,MMP20蛋白高表达的子宫内膜癌患者综合生存时间显著低于MMP20低表达的患者(图 4)。
|
图 4 生存曲线分析 Figure 4 Survival curve analysis of the patients with low and high expressions of MMP20. |
利用Cox比例风险模型分析MMP20表达是否能独立预测子宫内膜癌患者的预后。单变量分析显示,MMP20表达水平、FIGO分期、组织学分级、淋巴结转移以及肌层浸润深度均与子宫内膜患者的预后显著相关。多变量分析显示,FIGO分期(P < 0.05)和肌层浸润深度(P < 0.05)是子宫内膜癌预后的独立预测因子。MMP20高表达是潜在的子宫内膜癌患者预后的独立预测因子(P>0.05,表 2)。
| 表 2 单变量和多变量Cox回归综合生存分析 Table 2 Univariate and multivariate Cox regression analysis of the overall survival of the patients |
MMP家族是一类依赖金属锌离子的蛋白水解酶家族,能有效降解细胞外基质。因此该家族基因在肿瘤的生长和转移过程中均发挥重要作用。在这些家族成员中,MMP1、MMP2和MMP9已经被报导广泛参与了肿瘤的侵袭和转移过程,如RHGG通过抑制NF-κB信号和MMP1表达从而抑制食管鳞状细胞癌的形成和转移[19]。下调HDGF表达可通过抑制MMP2和MMP9从而抑制前列腺癌细胞的游走和侵袭[19]。虽然以上MMPs已经有了广泛的研究,然而MMP20在肿瘤中的研究却极少。MMP20在乳腺癌、大肠癌和肺腺癌中表达[9]。在牙源性肿瘤中,MMP20也被发现有表达[10-11]。抑制MMP20表达能显著降低人口腔鳞状细胞癌干细胞标志物的表达[18]。以上这些结果初步提示了MMP20在肿瘤发病过程中的重要性。然而关于MMP20在肿瘤组织中的表达及与肿瘤患者临床参数和预后之间的关系尚未有报导,包括子宫内膜癌。在本次研究中我们首先通过http://ualcan.path.uab.edu/index.html网站查找了MMP20在子宫内膜癌中的表达以及与临床预后之间的关系。结果显示,过表达MMP20的子宫内膜癌患者综合生存时间显著低于MMP20低表达患者。该结果初步提示MMP20过表达促进了子宫内膜癌的发病。
生物信息学数据为我们实验探讨MMP20在子宫内膜癌中的表达以及与临床参数和预后之间的关系奠定了良好的前期工作基础。在随后的研究中,我们利用实时荧光定量PCR检测了MMP20在子宫内膜癌与子宫内膜组织中的表达差异。有意义的是,我们发现MMP20在子宫内膜癌组织中表达显著上调,该结果不但支持了生物信息学的数据分析结果,而且进一步表明MMP20在子宫内膜癌的发病过程中发挥了促进作用。
随后我们利用免疫组化检测了MMP20蛋白在子宫内膜癌与子宫内膜组织中的表达情况。结果发现,MMP20在两种组织的胞浆中表达,且MMP20蛋白在子宫内膜癌组织中显著高表达。该结果与MMP20的mRNA表达检测结果一致,并与其他研究在乳腺癌、大肠癌、肺腺癌和牙源性肿瘤中的结果类似[9-11],进一步表明MMP20在子宫内膜癌发病过程中的重要性。
在以往的研究中,一些MMPs过表达常常与肿瘤患者临床参数和预后显著相关[20-24]。本研究发现,MMP20蛋白高表达与子宫内膜癌患者FIGO分期呈显著正相关,提示MMP20高表达促进了子宫内膜癌的发病过程。生存曲线分析发现,高表达MMP20蛋白组的子宫内膜癌患者综合生存期显著缩短,而低表达MMP20蛋白组的患者综合生存期则相对较长。Cox比例风险模型多变量分析发现FIGO分期和肌层浸润深度是子宫内膜癌预后的独立预测因子,MMP20高表达是子宫内膜癌预后的潜在独立预测因子。
综合以上结果表明,MMP20表达上调不但促进了子宫内膜癌的发病过程,而且导致了子宫内膜癌患者的不良预后。因此高表达的MMP20可能是子宫内膜癌发病的一个恶性标志物。
| [1] |
Shen F, Gao Y, Ding J, et al. Is the positivity of estrogen receptor or progesterone receptor different between type 1 and type 2 endometrial cancer[J].
Oncotarget, 2017, 8(1): 506-11.
|
| [2] |
van der Putten LJM, Visser NCM, van de Vijver K, et al. Added value of estrogen receptor, progesterone receptor, and L1 cell adhesion molecule expression to histology-based endometrial carcinoma recurrence prediction models: an ENITEC collaboration study[J].
Int J Gynecol Cancer, 2018, 28(3): 514-23.
DOI: 10.1097/IGC.0000000000001187. |
| [3] |
陈晨, 郭遂群. 子宫内膜癌组织中DAPK3和c-Myc的表达及其与患者预后的关系[J].
南方医科大学学报, 2016, 36(6): 863-9.
DOI: 10.3969/j.issn.1673-4254.2016.06.23. |
| [4] |
Zhang Y, Zhao D, Gong C, et al. Prognostic role of hormone receptors in endometrial cancer: a systematic review and metaanalysis[J].
World J Surg Oncol, 2015, 13(4): 208.
|
| [5] |
Li Y, Huo J, Pan X, et al. MicroRNA 302b-3p/302c-3p/302d-3p inhibits epithelial-mesenchymal transition and promotes apoptosis in human endometrial carcinoma cells[J].
Onco Targets Ther, 2018, 11(2): 1275-84.
|
| [6] |
Alonso-Alconada L, Eritja N, Muinelo-Romay L, et al. ETV5 transcription program links BDNF and promotion of EMT at invasive front of endometrial carcinomas[J].
Carcinogenesis, 2014, 35(12): 2679-86.
DOI: 10.1093/carcin/bgu198. |
| [7] |
Mannelqvist M, Stefansson IM, Wik E, et al. Lipocalin 2 expression is associated with aggressive features of endometrial Cancer[J].
BMC cancer, 2012, 12(5): 169.
|
| [8] |
Gómez-Macías GS, Garza-Rodríguez ML, Garza-Guajardo R, et al. Overexpression of the matrix metalloproteinase 11 gene is a potential biomarker for type 1 endometrial cancer[J].
Oncol Lett, 2018, 16(1): 1073-8.
|
| [9] |
Kraus D, Reckenbeil J, Perner S, et al. Expression pattern of matrix metalloproteinase 20 (MMP20) in human tumors[J].
Anticancer Res, 2016, 36(6): 2713-8.
|
| [10] |
äänänen A, Tjäderhane L, Eklund L, et al. Expression of collagen XVⅢ and MMP-20 in developing teeth and odontogenic tumors[J].
Matrix Biol, 2004, 23(3): 153-61.
DOI: 10.1016/j.matbio.2004.04.003. |
| [11] |
Guimarães DM, Antunes DM, Saturno JL, et al. Immunohistochemical expression of WNT5A and MMPs in odontogenic epithelial tumors and cysts[J].
Acta Histochem, 2015, 117(8): 667-74.
DOI: 10.1016/j.acthis.2015.10.006. |
| [12] |
Hou X, He X, Wang K, et al. Genome-Wide Network-Based analysis of colorectal cancer identifies novel prognostic factors and an integrative prognostic index[J].
Cell Physiol Biochem, 2018, 49(5): 1703-16.
DOI: 10.1159/000493614. |
| [13] |
Jonckheere N, Van Seuningen I. Integrative analysis of the cancer genome atlas and cancer cell lines encyclopedia large-scale genomic databases: MUC4/MUC16/MUC20 signature is associated with poor survival in human carcinomas[J].
J Transl Med, 2018, 16(1): 259.
DOI: 10.1186/s12967-018-1632-2. |
| [14] |
Mei Y, Liu YB, Cao S, et al. RIF1 promotes tumor growth and cancer stem cell-like traits in NSCLC by protein phosphatase 1- mediated activation of Wnt/β-catenin signaling[J].
Cell Death Dis, 2018, 9(10): 942.
DOI: 10.1038/s41419-018-0972-4. |
| [15] |
Wang Q, Wu G, Zhang Z, et al. Long non-coding RNA HOTTIP promotes renal cell carcinoma progression through the regulation of the miR-615/IGF-2 pathway[J].
Int J Oncol, 2018, 53(5): 2278-88.
|
| [16] |
Wang HF, Wu JH, Gai JW, et al. MAN1B1 is associated with poor prognosis and modulates proliferation and apoptosis in bladder cancer[J].
Gene, 2018, 679(4): 314-9.
|
| [17] |
Bhandari A, Shen Y, Sindan N, et al. MAL2 promotes proliferation, migration, and invasion through regulating epithelial-mesenchymal transition in breast cancer cell lines[J].
Biochem Biophys Res Commun, 2018, 504(2): 434-9.
DOI: 10.1016/j.bbrc.2018.08.187. |
| [18] |
Nikitakis NG, Gkouveris I, Aseervatham J, et al. DSPP-MMP20 gene silencing downregulates cancer stem cell markers in human oral cancer cells[J].
Cell Mol Biol Lett, 2018, 23(3): 30.
|
| [19] |
刘春花, 江庆萍, 林丹, 等. 子宫内膜癌中丝裂原活化蛋白激酶4和波形蛋白的表达及临床意义[J].
南方医科大学学报, 2017, 37(2): 157-64.
DOI: 10.3969/j.issn.1673-4254.2017.02.03. |
| [20] |
Ming XY, Zhang X, Cao TT, et al. RHCG suppresses tumorigenicity and metastasis in esophageal squamous cell carcinoma via inhibiting NF-κB signaling and MMP1 expression[J].
Theranostics, 2018, 8(1): 185-98.
DOI: 10.7150/thno.21383. |
| [21] |
Yang F, Yu N, Wang H, et al. Downregulated expression of hepatoma-derived growth factor inhibits migration and invasion of prostate cancer cells by suppressing epithelial-mesenchymal transition and MMP2, MMP9[J].
PLoS One, 2018, 13(1): e0190725.
DOI: 10.1371/journal.pone.0190725. |
| [22] |
Wang XH, Liu YN, Tian K, et al. Expression and clinical significance of ARTN and MMP-9 in endometrial carcinoma[J].
J Biol Regul Homeost Agents, 2017, 31(4): 879-87.
|
| [23] |
Ozden F, Saygin C, Uzunaslan D, et al. Expression of MMP-1, MMP-9 and TIMP-2 in prostate carcinoma and their influence on prognosis and survival[J].
J Cancer Res Clin Oncol, 2013, 139(8): 1373-82.
DOI: 10.1007/s00432-013-1453-x. |
| [24] |
Ramachandran RK, Sørensen MD, Aaberg-Jessen C, et al. Expression and prognostic impact of matrix metalloproteinase-2 (MMP-2) in astrocytomas[J].
PLoS One, 2017, 12(2): e0172234.
DOI: 10.1371/journal.pone.0172234. |
 2018, Vol. 38
2018, Vol. 38

