2. 贵州医科大学附属医院 肝胆外科,贵州 贵阳 550001
2. Department of Hepatobiliary Surgery, Affiliated Hospital of Guizhou Medical University, Guiyang 550001, China
胆管癌是一种高度恶性的胆道肿瘤,在世界范围内,胆管癌的发病率和死亡率逐年上升[1-2]。目前尚缺乏有效的预防或治疗手段,手术仍然是唯一的治疗选择,但它仅有少数早期被诊断的患者具有手术治疗的机会[3]。长期炎症、损伤和修复性胆管上皮细胞增生将会诱发胆管癌的发生。MicroRNAs(miRNAs)是一类大小20~22个核苷酸的非编码RNA,在转录后水平通过与靶mRNA结合参与基因表达的调控[4-5]。miRNA在一些人类和动物肿瘤的发生发展过程中起关键作用,表现出极强的诊断价值和成药性[6-7]。在多种人类肿瘤中,miR-29b通过靶向多种基因而影响细胞的增殖、侵袭和转移[8-10]。miR-29在胆管癌细胞株KMCH中表达下调,通过调控Mcl-1影响细胞的凋亡[11]。Okamoto等[12]发现miR-29b与胆管癌细胞株HuH28对吉西他滨的耐药相关,过表达miR-29b可以显著增强细胞的药物敏感性。然而,miR-29b在胆管癌组织中的表达和对胆管癌细胞增殖的作用尚未见报道。鉴于近年来miRNA在蛋白质调控和肿瘤发生中的重要性,我们拟通过细胞功能学实验,同时结合胆管癌临床样本,探讨miR-29b对胆管癌细胞增殖、克隆形成、周期和凋亡的影响。
1 材料和方法 1.1 材料 1.1.1 细胞和试剂人胆管癌细胞株QBC939、良性胆管细胞株H69于37 ℃,5% CO2恒温培养;DMEM, High Glucose培养基,FBS(GIBCO);慢病毒LV-hsa-miR-29b及阴性对照慢病毒LV(吉凯基因);实时荧光定量通用试剂(吉玛);AnnexinV-APC/PI凋亡检测试剂盒(BD)。
1.1.2 组织标本手术切除胆管癌标本30例和正常胆管标本20例收集于贵州医科大学附属医院肝胆外科2015年7月~2017年7月间,液氮冻存,所有标本均经病理学诊断证实,均获患者知情同意。
1.2 方法 1.2.1 构建慢病毒载体PCR扩增miR-29b片段并克隆至GV309载体的AgeI和EcoRI位点,构建重组载体LV-has-miR-29b,所使用的上游引物为:5'- GGAAAGGACGAAACACCGGCTAGGTTGTCTTG GGTTTATTG-3',下游引物为:5'-TGTCTCGAGGT CGAGAATTAAAAAACTTCAGAGCTGTCCCATTC AC-3'。将LV-has-miR-29b转化到大肠杆菌中进行扩增,提取质粒。将LV-has-miR-29b以及病毒包装质粒(Helper 1.0和Helper 2.0)共转染293T细胞,转染48 h后收集上清液,5000 r/min离心10 min去除细胞沉淀,0.22 μm滤膜过滤后分装,-80 ℃保存。用梯度稀释法测定病毒滴度。miR-29b过表达组QBC939细胞的miR-29b较阴性对照组。
1.2.2 细胞转染将对数生长期的QBC939细胞分为3组,空白对照组,阴性对照组,miR-29b过表达组。空白对照组细胞自然生长;阴性对照组和miR-29b过表达组,将含阴性对照和LV-hsa-miR-29b的慢病毒颗粒上清液分别体外感染QBC939细胞,感染48 h后,使用抗生素筛选48 h,荧光显微镜下观察阳性细胞,收集细胞汇合度70%~80%的生长状态良好的细胞进行下游实验。
1.2.3 RT-PCR利用TRIzol提取细胞和组织中的总RNA,按照逆转录试剂盒说明书合成cDNA,按照TaqMan miRNA检测试剂盒说明书在Applied Biosystems 7900 HT上检测miR-29b的表达,采用2-△△CT法检测,U6为内参对照。
1.2.4MTT将处于对数生长期的各组细胞胰酶消化,制成细胞悬液,接种至96孔板(2×103/孔),分别于24、48、72、96、120 h加入20 μL 5 g/L MTT,孵育4 h后离心去掉上清,加入DMSO 150 μL溶解结晶,测定吸光度A490 nm。
1.2.5 克隆形成实验将处于对数生长期的各组细胞胰酶消化,制成细胞悬液,接种至6孔板(500/孔),每个实验组设3个复孔。培养到14 d或绝大多数单个克隆中细胞数大于50,中途每隔3 d进行换液并观察细胞状态。经多聚甲醛固定和GIEMSA染色,拍照记录克隆数。
1.2.6 细胞周期各组细胞感染48 h后,胰酶消化,制成细胞悬液,离心弃上清,预冷PBS洗涤1次,离心弃上清,预冷的75%乙醇固定1 h,离心弃固定液,加入25 μL 0.5% PI染色液和10 μL 10 mg/mL RNase A,4 ℃避光染色30 min,上机检测。
1.2.7 细胞凋亡各组细胞感染48 h后,用不含EDTA的胰酶消化细胞,制成细胞悬液,在100 μL的Binding Buffer中加入5 μL AnnexinV-APC及5 μL的PI染液,混匀。室温避光反应15 min。再加入400 μL的Binding Buffer混匀,上流式细胞仪检测,统计细胞早期凋亡和晚期凋亡的百分比。
1.3 统计学方法采用GraphPad Prism软件进行数据处理,结果以均数±标准差表示,采用t检验进行统计分析。以P < 0.05以为差异有统计学意义。
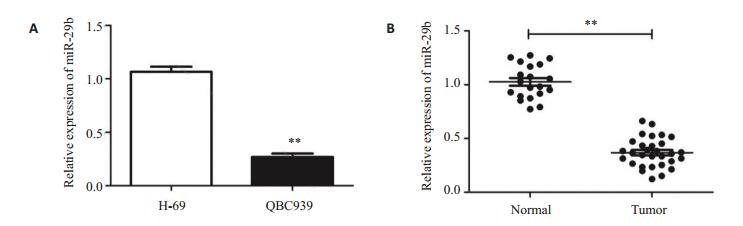
2 结果 2.1 miR-29b在胆管癌细胞和组织中表达降低RT-PCR检测结果显示,在QBC939细胞中miR- 29b的表达低于H-69(3.77±0.30),差异具有统计学意义(P < 0.01,图 1A)。与正常胆管癌组织相比,miR-29b在胆管癌组织中表达降低(3.24±1.51),差异具有统计学意义(P < 0.01,图 1B)。
|
图 1 miR-29b在胆管癌细胞和组织中的表达 Figure 1 Relative miR-29b expression in cholangiocarcinoma cells (A) and tissues (B). **P < 0.01 vs H-69 cells or normal tissues. |
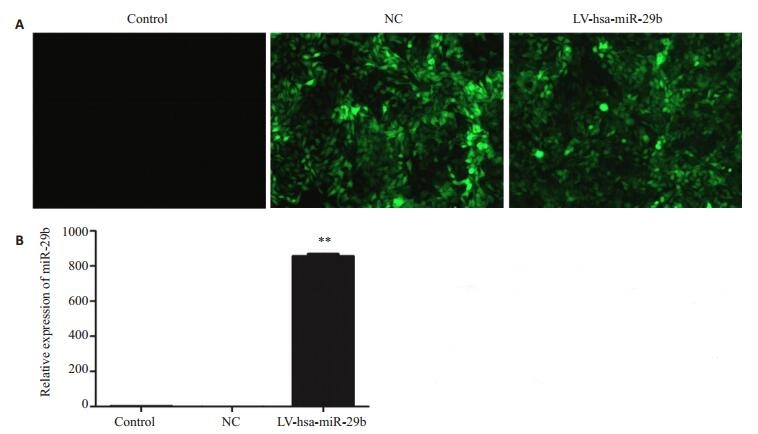
慢病毒载体感染QBC939细胞48 h后,在荧光显微镜下可以看出,感染组细胞出现较强的荧光(图 2A)。RT-PCR检测结果显示,miR-29b的表达在LV-hsa-miR- 29b感染组高于阴性对照组和空白组,差异具有统计学意义(P < 0.01),上调(791.15±20.30)倍(图 2B)。
|
图 2 miR-29b转染效率的检测 Figure 2 Transfection efficiency of miR-29b. A: Representative fluorescence images of the cells after transfection (Original magnification: × 100); B: Relative miR-29b expression detected by RT-PCR. **P < 0.01 vs control or NC. Control NC LV-hsa-miR-29b 1000 800 600 400 200 0 Rel |
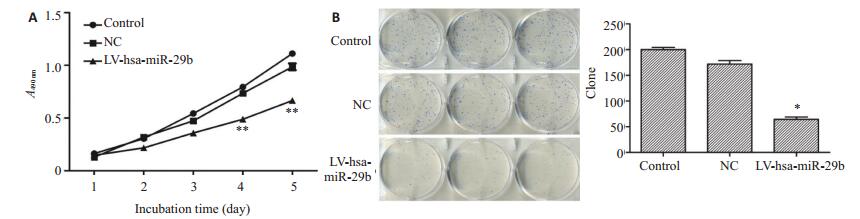
MTT结果显示,过表达miR-29b后,QBC939细胞的增殖能力减弱,与阴性对照组和空白组相比,在96 h和120 h差异均具有统计学意义(P < 0.05,图 3A)。如图 3B所示,过表达miR-29b的胆管癌细胞株QBC939形成的克隆数为64±8,而空白对照组与阴性对照组分别为198±7和162±10。细胞克隆形成实验显示,过表达miR-29b可以显著减少QBC939细胞的克隆形成数,而阴性对照组和空白组之间差异具无显著统计学意义。
|
图 3 过表达miR-29b显著抑制QBC939细胞的增殖和克隆形成 Figure 3 Overexpression of miR-29b inhibits QBC939 cell proliferation and clone formation. A: Cell proliferation was detected by MTT assay; B: Cell clone formation assay. *P < 0.05 vs control or NC, **P < 0.01 vs control or NC. |
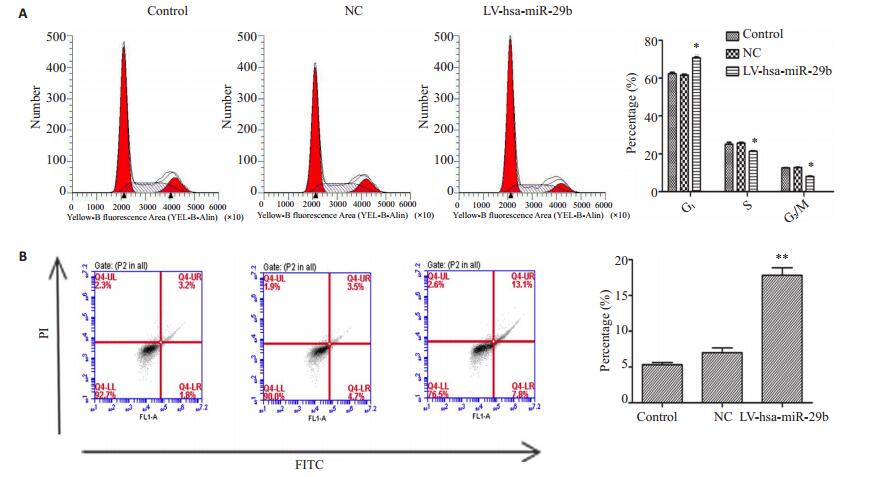
流式细胞术分析发现,过表达miR-29b显著改变了细胞周期的分布,过表达miR-29b显著改变了胆管癌细胞株QBC939周期的分布,与阴性对照组和空白细胞比较,LV-hsa-miR-29b组细胞S期比例降低,为(21.27 ± 0.34)%,G2/M期比例减少,为(8.05±0.27)%,而G1期比例增高,为(70.68±0.49)%,故过表达miR-29b可使胆管癌细胞QBC939阻滞在S期,与阴性对照组和空白组比较,差异具有显著性统计学意义(P < 0.05,图 4A)。Annexin V-FITC/PI法检测细胞凋亡情况,LV-hsa-miR- 29b组细胞凋亡率明显增加,与阴性对照组和空白组之间差异有统计学意义(P < 0.01),空白组和阴性对照组之间差异无统计学意义(图 4B)。
|
图 4 过表达miR-29b阻滞QBC939细胞于S期和诱导细胞的凋亡 Figure 4 Overexpression of miR-29b blocks cell cycle at the S phase and induces cell apoptosis. A: Overexpression of miR-29b increases G1 phase cells and reduces G2/M phase cells; B: Overexpression of miR-29b induces cell apoptosis shown by flow cytometry. *P < 0.05 vs control or NC, **P < 0.01 vs control or NC. |
胆管癌恶性程度高,手术切除率低且复发率高,病人预后较差[1-3]。胆管癌的发生是一种多基因多因素共同作用的结果,其发病机制复杂,涉及许多分子和信号级联的改变,如Wnt/β-catenin,PI3K/Akt /mTOR,Notch信号通路等[13-16]。随着对胆管癌发病机制的研究深入,肿瘤生物靶向治疗为广大胆管癌患者的治疗带来了新的希望,生物靶向治疗可以部分弥补传统手术治疗、放化疗的不足之处,在一定程度上改善肿瘤患者的预后[17]。因此,深入研究胆管癌发病的分子机制和寻找新的治疗靶点,将为胆管癌的靶向治疗提供新的策略。
在大部分哺乳动物中,miRNAs通过不完全互补导致靶mRNA翻译受到抑制,而在大部分植物中,miRNA能与靶mRNA完全互补使其发生降解。miRNA在细胞分化、生物发育及疾病发生发展过程中发挥巨大作用,特别是在肿瘤中引起越来越多的关注[18-20]。有研究发现褪黑激素通过上调miR-526b-3p和miR- 590-5p通过靶向SMAD7增强SMAD1磷酸化而促进人类骨髓间充质干细胞成软骨分化[21]。研究表明由前列腺癌细胞分泌的miR-149-3p可诱导受体血管内皮细胞中的DAB2IP下调,刺激其增殖和迁移[22]。目前,多个miRNA已经进入临床试验阶段,如miR-34 [23],miR-122 [24]。因此,miRNA不仅可以成为胆管癌新型的生物标志物,进一步研究特异性表达的miRNA可以为胆管癌的临床治疗提供新的研究方向。
miRNA可以通过靶向作用于不同的目标基因,影响肿瘤细胞的增殖、转移、侵袭和耐药等。如miR-1246在前列腺癌临床组织和细胞系中下调,并选择性释放到外泌体中,过表达miR-1246可显著抑制体内异种移植肿瘤生长,增加体外细胞凋亡并降低增殖,侵袭和迁移[25]。同样,miR-26b在肝癌细胞中表达降低,并且能够抑制细胞上皮-间质转化[26]。许多miRNA表现出双重的作用,即抑癌miRNA和原癌miRNA。在既往的研究中,miR-29b被证实可以靶向MCL1,BCL2,AKT2,CCND2和CDC42促进癌细胞的凋亡,靶向DNMT3A和DNMT3B抑制细胞的增殖与转移[27]。另一方面,在胃癌细胞中miR-29b可以靶向KDM2A抑制癌细胞的增殖与转移[28]。以上研究表明,miR-29b参与多种肿瘤的发生发展,并且在不同肿瘤中发挥不同的作用,而在胆管癌中,目前的研究仅限于胆管癌细胞株,且其对胆管癌细胞增殖、克隆形成、周期和凋亡的影响缺乏相关研究。
为探讨miR-29b在胆管癌中的生物学功能,我们采用Realtime-PCR对胆管癌细胞和组织进行定量分析,发现miR-29b与胆管癌的发生相关,其在胆管癌细胞和组织中表达明显低于正常胆管细胞和组织;除此之外,为分析miR-29b在胆管癌进程中的生物学功能,我们构建了慢病毒载体过表达LV-hsa-miR-29b,在QBC939细胞中,通过MTT实验和克隆形成实验,证实过表达miR-29b可以明显抑制胆管癌细胞的增殖和克隆形成。流式细胞术结果显示,与对照组相比,过表达miR-29b可以显著诱导细胞的凋亡,同时可使细胞周期阻滞于S期。以上证据表明,miR-29b在胆管癌中是一种抑癌miRNA。这与Zhao等[29]报道的内容相似,miR-29b可作为抑癌因子,抑制乳腺癌细胞的增殖。但miR-29b在胆管癌中的作用机制尚不明了。有研究显示miR-29b通过靶向作用Akt3抑制血管生成和肿瘤发生,从而抑制肿瘤增殖;同时也可抑制炎症细胞,联合发挥抗肿瘤作用[30]。
综上所述,本研究表明miR-29b在胆管癌中低表达,过表达miR-29b可以显著抑制胆管癌细胞的增殖,诱导细胞凋亡,发挥着抑癌miRNA的作用,miR-29b有望为胆管癌患者的靶向治疗提供新的策略。
| [1] |
Esnaola NF, Meyer JE, Karachristos A, et al. Evaluation and management of intrahepatic and extrahepatic cholangiocarcinoma[J].
Cancer, 2016, 122(9): 1349-69.
DOI: 10.1002/cncr.v122.9. |
| [2] |
Zhang H, Yang T, Wu M, et al. Intrahepatic cholangiocarcinoma: Epidemiology, risk factors, diagnosis and surgical management[J].
Cancer Lett, 2016, 379(2): 198-205.
DOI: 10.1016/j.canlet.2015.09.008. |
| [3] |
Simo KA, Halpin LE, Mcbrier NM, et al. Multimodality treatment of intrahepatic cholangiocarcinoma: A review[J].
J Surg Oncol, 2016, 113(1): 62-83.
DOI: 10.1002/jso.v113.1. |
| [4] |
Fabbri M, Croce CM, Calin GA. MicroRNAs[J].
Cancer J, 2007, 14(1): 759-74.
|
| [5] |
Filipowicz W, Bhattacharyya SN, Sonenberg N. Mechanisms of post-transcriptional regulation by microRNAs: are the answers in sight?[J].
Nat Rev Genet, 2008, 9(2): 102-14.
DOI: 10.1038/nrg2290. |
| [6] |
Hibner G, Kimsa-Furdzik M, Francuz T. Relevance of MicroRNAs as potential diagnostic and prognostic markers in colorectal cancer[J].
Int J Mol Sci, 2018, 19(10): 2944.
DOI: 10.3390/ijms19102944. |
| [7] |
Yang Y, Alderman C, Sehlaoui A, et al. MicroRNAs as immunotherapy targets for treating gastroenterological cancers[J].
Can J Gastroenterol, 2018, 12(8): 9740357.
|
| [8] |
Langsch S, Baumgartner U, Haemmig S, et al. miR-29b mediates NF-κB signaling in KRAS-Induced Non-Small cell lung cancers[J].
Cancer Res, 2016, 76(14): 4160-9.
DOI: 10.1158/0008-5472.CAN-15-2580. |
| [9] |
Lv M, Zhong Z, Huang M, et al. lncRNA H19 regulates epithelialmesenchymal transition and metastasis of bladder cancer by miR- 29b-3p as competing endogenous RNA[J].
Biochim Bio Acta-Mol Cell Res, 2017, 1864(10): 1887-99.
DOI: 10.1016/j.bbamcr.2017.08.001. |
| [10] |
Ivanovic RF, Viana NI, Morais DR, et al. miR-29b enhances prostate cancer cell invasion independently of MMP-2 expression[J].
Cancer Cell Int, 2018, 18(1): 18.
DOI: 10.1186/s12935-018-0516-0. |
| [11] |
Mott JL, Kobayashi S, Bronk SF, et al. mir-29 regulates Mcl-1 protein expression and apoptosis[J].
Oncogene, 2007, 26(42): 6133-40.
DOI: 10.1038/sj.onc.1210436. |
| [12] |
Okamoto K, Miyoshi K, Murawaki Y. miR-29b, miR-205 and miR- 221 enhance chemosensitivity to gemcitabine in HuH28 human cholangiocarcinoma cells[J].
PLoS One, 2013, 8(10): e77623.
DOI: 10.1371/journal.pone.0077623. |
| [13] |
Zhang F, Wan M, Xu Y, et al. Long noncoding RNA PCAT1 regulates extrahepatic cholangiocarcinoma progression via the Wnt/β-catenin-signaling pathway[J].
Biomed Pharmacother, 2017, 94(8): 55-62.
|
| [14] |
Ewald F, Nörz D, Grottke A, et al. Dual inhibition of PI3K-AKTmTOR- and RAF-MEK-ERK-signaling is synergistic in cholangiocarcinoma and reverses acquired resistance to MEKinhibitors[J].
Invest New Drugs, 2014, 32(6): 1144-54.
DOI: 10.1007/s10637-014-0149-7. |
| [15] |
Chong DQ, Zhu AX. The landscape of targeted therapies for cholangiocarcinoma: current status and emerging targets[J].
Oncotarget, 2016, 7(29): 46750-67.
|
| [16] |
Zender S, Nickeleit I, Wuestefeld T, et al. A critical role for notch signaling in the formation of cholangiocellular carcinomas[J].
Cancer Cell, 2013, 23(6): 784-95.
DOI: 10.1016/j.ccr.2013.04.019. |
| [17] |
Oldham RK. Cancer biotherapy: more than immunotherapy[J].
Cancer Biother Radiopharm, 2017, 32(4): 111-4.
DOI: 10.1089/cbr.2017.28999.old. |
| [18] |
Chen X, Yan CC, Zhang X, et al. WBSMDA: within and between score for MiRNA-Disease association prediction[J].
Sci Rep, 2016, 6(3): 21106.
|
| [19] |
Rupaimoole R, Calin GA, Lopez-Berestein G, et al. miRNA deregulation in cancer cells and the tumor microenvironment[J].
Cancer Discov, 2016, 6(3): 235-46.
DOI: 10.1158/2159-8290.CD-15-0893. |
| [20] |
Mishra S, Yadav T, Rani V. Exploring miRNA based approaches in cancer diagnostics and therapeutics[J].
Crit Rev Oncol Hematol, 2016, 98(11): 12-23.
|
| [21] |
Wu Z, Qiu X, Gao B, et al. Melatonin-mediated miR-526b-3p and miR-590-5p upregulation promotes chondrogenic differentiation of human mesenchymal stem cells[J].
J Pineal Res, 2018, 65(1): e12483.
DOI: 10.1111/jpi.2018.65.issue-1. |
| [22] |
Bellazzo A, Di Minin G, Valentino E, et al. Cell-autonomous and cell non-autonomous downregulation of tumor suppressor DAB2IP by microRNA-149-3p promotes aggressiveness of cancer cells[J].
Cell Death Differ, 2018, 25(7): 1224-38.
DOI: 10.1038/s41418-018-0088-5. |
| [23] |
Bouchie A. First microRNA mimic enters clinic[J].
Nat Biotechnol, 2013, 31(7): 577.
DOI: 10.1038/nbt0713-577. |
| [24] |
Krützfeldt J, Rajewsky N, Braich R, et al. Silencing of microRNAs in vivo with 'antagomirs'[J].
Nature, 2005, 438(768): 685-9.
|
| [25] |
Bhagirath D, Yang TL, Bucay N, et al. microRNA-1246 is an exosomal biomarker for aggressive prostate cancer[J].
Cancer Res, 2018, 78(7): 1833-44.
DOI: 10.1158/0008-5472.CAN-17-2069. |
| [26] |
Dong N, Xu B, Benya SR, et al. MiRNA-26b inhibits the proliferation, migration, and epithelial-mesenchymal transition of lens epithelial cells[J].
Mol Cell Biochem, 2014, 396(1/2): 229-38.
|
| [27] |
Yan B, Guo Q, Fu FJ, et al. The role of miR-29b in cancer: regulation, function, and signaling[J].
Onco Targets Ther, 2015, 8(5): 539-48.
|
| [28] |
Kong Y, Zou S, Yang F, et al. RUNX3-mediated up-regulation of miR-29b suppresses the proliferation and migration of gastric cancer cells by targeting KDM2A[J].
Cancer Lett, 2016, 381(1): 138-48.
DOI: 10.1016/j.canlet.2016.07.038. |
| [29] |
Zhao H, Wilkie T, Deol Y, et al. Erratum to: miR-29b defines the pro-/anti-proliferative effects of S100A7 in breast cancer[J].
Mol Cancer, 2015, 14(1): 195.
DOI: 10.1186/s12943-015-0451-9. |
| [30] |
Li Y, Cai BL, Shen LL, et al. MiRNA-29b suppresses tumor growth through simultaneously inhibiting angiogenesis and tumorigenesis by targeting Akt3[J].
Cancer Lett, 2017, 397(8): 111-9.
|
 2018, Vol. 38
2018, Vol. 38

