2. 蚌埠医学院生理学教研室,安徽 蚌埠 233030
2. Department of Physiology, Bengbu Medical College, Bengbu 233030, China
高血糖引起的心血管并发症涉及到心肌病变和血管病变,与非糖尿病人群相比,糖尿病患者有较高的室性心律失常的发生率,存在QT间期延长,心肌纤维化的程度更高[1]。间质、斑片状或致密斑痕形式的纤维化构成心律失常的关键组织学基质,其与心肌细胞形成直接电偶联,导致电生理学的严重干扰[2]。高糖饮食可导致电生理改变,导致QRS延长,传导速度降低和再灌注心律失常增加[3]。代谢紊乱和异常电传导有关,在糖尿病心肌中增加猝死和恶性心律失常风险,但是其潜在的病理生理学机理仍有待完全阐明。
双孔钾通道(K2P)是在20世纪90年代末在哺乳动物中新发现的一类钾离子通道。TASK-1通道属于K2P双孔钾通道家族,其可调节肺动脉平滑肌的收缩、参与室性心肌动作电位平台期的形成;同时还有影响神经传导、内分泌及神经肌肉兴奋性的生理功能[4-7]。双孔钾通道可以调节细胞的兴奋性,TASK-1电流可延长房颤和心衰小鼠心房肌细胞的动作电位时程(APD),同时也和肥胖症小鼠饱腹感信号的损害有关[8-9]。心肌细胞肥大、心肌梗死和心功能不全等多种心脏疾病不仅导致组织重构,还可引起心肌钾通道活性异常,伴有心肌细胞钾通道密度的改变,最终可导致心电活动异常,发生心律失常[10-11]。但是,TASK-1在糖尿病大鼠心肌损伤中存在何种变化,其在糖尿病大鼠心室重构及心律失常中发挥怎样的作用,目前仍未见报道。因此,本实验通过构建糖尿病大鼠心肌损伤模型,探讨双孔钾通道TASK-1在糖尿病大鼠不同时期心肌损伤中的变化,进一步分析其可能机制,为糖尿病心肌损伤的临床治疗提供理论依据。
1 材料和方法 1.1 材料2月龄清洁级雄性(SD)大鼠,(蚌埠医学院实验动物中心);链脲佐菌素(STZ,Sigma);ECL试剂盒(Millipore);TASK-1抗体(Abcam);ML-365(MCE),
1.2 方法 1.2.1 实验分组和糖尿病心肌病模型制备36只SD大鼠随机分3组。雄性SD大鼠适应性喂养1周后随机分为3组,12只/组,分为正常对照组(N)、糖尿病4周组(DM 4W)和糖尿病8周组(DM 8W)。糖尿病大鼠模型的制备采用腹腔注射STZ 55 mg/kg,3 d后测定大鼠空腹血糖,血糖≥16.7 mmol/L持续1周糖尿病模型复制成功[12]。DM 4W组糖尿病大鼠造模成功后继续喂养至4周,形成稳定的高血糖,4周测1次血糖,剔除不合格者,DM 8W组在糖尿病大鼠造模成功后继续喂养至8周,糖尿病心肌病模型建立成功,N组大鼠常规喂养持续至8周[13]。
1.2.2 小动物超声测定大鼠心功能分别在实验的不同时期测定大鼠心功能,以大鼠心电图的QRS波群和T波作为收缩期和舒张期标志,结合图像上二尖瓣的开闭进行各房室内径的测量。在左心长轴切面上测量并记录大鼠心脏的舒张末期左室内径(LVIDd),收缩末期左室内径(LVIDs);通过M型超声获得射血分数(EF)和左室内径缩短率(FS),所有数据均测量3次取平均值,为减少大鼠个体差异所造成的误差,采用体表面积进行校正,体表面积(m2)=0.09×[体质量(kg)]2/3。
1.2.3 大鼠心系数测定大鼠禁食12 h,测大鼠体质量(g),实验结束后称取大鼠心脏质量(mg),心系数=心脏重量/大鼠体质量×100%。
1.2.4 Masson染色大鼠处死后取心尖部,4%的多聚甲醛固定,石蜡包埋,Masson染色,镜下观察心肌组织的变化及胶原分布。
1.2.5 Western印迹分析检测TASK-1的蛋白表达取0.1 g心肌组织进行裂解获取组织匀浆,4 ℃离心(12 000 r/min,15 min),取上清,蛋白定量后,经15% SDS-PAGE分离,随后,电转膜至PVDF膜,先后加入TASK-1或β-acin一抗,4 ℃过夜。次日洗涤并加入HRP的二抗IgG孵育,ECL试剂盒进行曝光成像。凝胶成像系统进行条带的灰度值测量,计算TASK-1/β-actin蛋白表达的相对量。
1.2.6 心室肌动作电位时程(APD)及TASK-1电流测定对造模成功的糖尿病大鼠(糖尿病心肌病状态)及正常组大鼠心肌进行急性分离大鼠麻醉后,迅速开胸取心脏,将心脏悬挂与langendorff装置上先循环灌流无钙台氏液,后循环灌流酶液,酶解完成后取左心室,迅速置于含0.5 mg/mL BSA的KB液中,剪碎,吹打数次后离心,去上清,温育在含有0.5 mg/mL BSA的KB液中35 min。梯度复钙。根据实验需要进行电流记录;TASK-1电流的记录:应用全细胞膜片钳技术记录TASK-1电流,分别在电流钳和电压钳下记录细胞膜电位(Em)和电流;不同实验组电流的比较采用电流密度;电流密度为电流强度与膜电容的比值(pA/pF),以消除不同面积细胞间的电流误差;APD的记录在大鼠心肌细胞上,电流钳下记录动作电位,观察不同组间的变化。
1.3 统计方法应用SPSS20.0软件包进行统计分析,以均数±标准差表示实验数据,多组间比较采用单因素方差分析,两两比较采用t检验,P < 0.05认为差异有统计学意义。
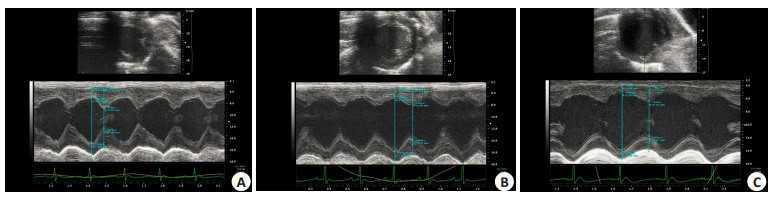
2 结果 2.1 各组大鼠心功能的变化与正常对照组比较DM 4W组和DM 8W组LVIDd、LVIDs增加明显(P < 0.01),EF及FS降低明显,心功能降低;在糖尿病不同病程中,DM 8W组较DM 4W组EF及FS降低,心功能进一步下降(P < 0.01,表 1,图 1)。
| 表 1 各组大鼠心功能变化 Table 1 Changes of cardiac function in the rats (Mean±SD, n=6) |
|
图 1 各组大鼠心功能变化 Figure 1 Cardiac ultrasonography showing cardiac function changes in the rats. A: N group; B: DM 4W group; C: DM 8W group. |
与正常对照组比较,DM 4W组和DM 8W组大鼠的体质量、心脏质量减轻明显(P < 0.05),同时心系数较前增加(P < 0.05);在糖尿病不同病程中,DM 8W组较DM 4W组心脏质量增加(P < 0.05),心系数继续增加(P < 0.01,表 2)。
| 表 2 各组大鼠心脏重量、体质量和心体比变化 Table 2 Changes of heart weight and body weight in the rats (Mean±SD, n=6) |
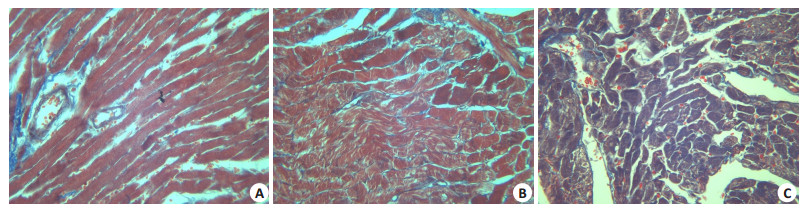
Masson染色后,心肌细胞呈红色,胶原纤维呈蓝绿色,同正常对照组相比,N组心肌排列整齐且分布均匀,胶原纤维散在分布或呈条索状,DM 4W组胶原纤维粗大,交织成网状或堆积成片状,排列分布不均,沉积增多,随着糖尿病病程的进展,DM 8W组胶原纤维增加更明显,提示心肌纤维化程度加重(图 2)。
|
图 2 各组大鼠心肌组织Masson染色 Figure 2 Masson staining of rat myocardial tissues in different groups (Original magnification: × 100, n=4). A: N group; B: DM 4W group; C: DM 8W group. |
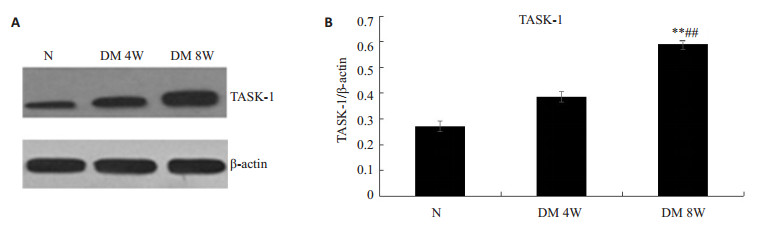
与正常对照组相比,糖尿病大鼠心肌TASK-1表达明显(P < 0.01);与DM 4W组相比,DM 8W组TASK-1进一步增加,提示TASK-1在糖尿病心肌损伤中表达升高(P < 0.01,图 3)。
|
图 3 各组大鼠心肌组织TASK-1的蛋白表达变化 Figure 3 Expression of TASK-1 protein in myocardial tissue (Mean±SD, n=5); A: Western blotting of TASK-1 and β-actin in the myocardial tissue; B: Quantitative analysis of TASK-1 protein expression. **P < 0.01 vs N group; ##P < 0.01 vs DM 4W group. |
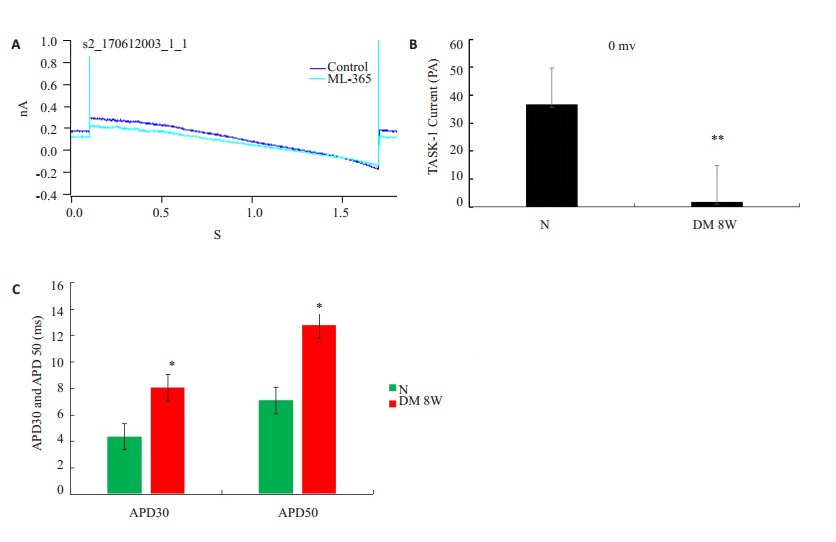
与正常对照组心室肌细胞相比,DM 8W组心肌细胞APD30和APD50明显延长(P < 0.05),应用TASK-1特异性抑制剂ML-365,糖尿病大鼠心室肌细胞TASK-1电流受到抑制,与正常组比较,DM 8W组TASK-1的电流明显减少,电流受到显著抑制,差异具有统计学意义(P < 0.01,图 4)。
|
图 4 心室肌细胞TASK-1电流和动作电位时程的变化 Figure 4 Changes of TASK-1 current in ventricular myocytes and the time course of ventricular myocyte APD in different groups. A: Effect of TASK-1 inhibitor ML-365 in different groups; B: TASK-1 current in different groups; C: Time of APD30 and APD50 in different groups. *P< 0.05 vs N group. |
糖尿病心肌病是糖尿病患者易患的一种独特心肌病,病程发展到一定阶段引起心肌结构重构和电重构、心肌收缩、舒张功能降低,最终出现临床心力衰竭[14]。本研究中,我们观察到DM组大鼠心系数(HW/BW)、大鼠LVIDd及LVIDs增加,左室内径缩短率(FS)及射血分数(EF)均下降,Masson染色显示心肌胶原纤维粗大,交织成网状,排列不均匀,沉积增多,这些结果显示:心肌纤维化发生,心功能降低,提示糖尿病已经引起心肌损伤的发生,我们推测这可能与心肌重构有关;同时,我们还可以观察到,DM组TASK-1的电流减少,但蛋白表达增加,动作电位时程延长明显。进一步提示:TASK-1电流和蛋白变化可能与心肌重构相关。
心室重构是心肌缺血和梗死的必然历程,因此抑制心室重构成为临床改善患者生活治疗及预后的关键环节[15-16]。双孔钾通道是一种背景钾离子通道,其改变参与电重构的发生;TASK-1是双孔钾通道家族的重要一员。研究发现:房颤患者心房肌组织中TASK-1mRNA表达水平升高的同时APD也存在延长;TASK-1阻滞剂可延长正常大鼠心室肌的动作电位[17-19],本课题组的前期研究观察到,TASK-1在人肺动脉平滑肌细胞高表达,急性缺氧后电流减少,酪氨酸激酶c-Src可调节TASK-1的表达[20],以上报道提示TASK-1通道改变引起的电重构可能是糖尿病心肌损伤的重要机制之一。本研究结果显示,糖尿病心肌病大鼠TASK-1电流密度较正常组降低明显;进一步急性分离大鼠心室肌细胞,应用ML365特异性阻断TASK-1通道,观察到TASK-1的电流表达明显降低,表明TASK-1参与心室肌电流的变化。
糖尿病心肌病是一种独立的慢性疾病,心功能损伤是糖尿病心肌病的重要特征之一,在糖尿病的高血糖条件下,心肌细胞受到持续的损伤,心脏功能无法保持原有状态,依次出现舒张功能异常和收缩功能紊乱[21-22],同时,大量证据表明,心肌纤维化是引起糖尿病心肌病的潜在推动力,心肌纤维化导致异常的细胞外基质沉积增加,引起心脏僵硬度增加,进一步损伤心功能导致左心室收缩和舒张功能障碍[23-24]。本实验中,我们以STZ成功构建糖尿病大鼠心肌损伤模型,观察糖尿病大鼠不同时间周期心功能和心肌纤维化情况。与正常大鼠相比,DM组大鼠HW/BW、LVIDd及LVIDs增加,FS及EF均下降,Masson染色显示DM组心肌胶原纤维粗大,交织成网状,排列不均匀,沉积增多;随着糖尿病病程延长,DM组HW/BW、LVIDd及LVIDs增加更加明显,FS及EF持续下降。这结果表明,糖尿病可引起心室重构,这种结构重构随糖尿病病程延长逐渐加重,而这种心脏结构重塑正是心血管事件发生率和死亡率增高的主要原因。
细胞钾离子通道在心肌重构过程中起关键的作用,细胞内的钾在维持胞内离子稳态、细胞周期和抑制胞浆和胞核中与增殖相关的酶等方面起重要的作用;调控离子通道已成为逆转心脏结构和生物电重构的一个新的治疗策略。以往研究结果显示:心梗后发生的氧化应激不仅导致心脏组织重构,还可引起心肌钾通道活性异常,从而参与心脏电重构,过高的氧化应激是心肌重构重要的驱动因素[25-26]。使用TASK-1阻滞剂后可延长大鼠心室肌的动作电位,表明TASK-1参与形成心肌动作电位平台期的外向电流[27]。糖尿病可引起心肌细胞动作电位时程延长,AP复极20%、50%和90%的时程均明显延长,而瞬时外向钾电流幅度降低[28]。本实验研究发现DM组TASK-1电流降低,而蛋白表达却增加明显,显示出糖尿病心肌细胞上双孔钾通道TASK-1受到了明显损伤,同时,我们发现糖尿病心肌病使心肌发生重构的同时,AP复极30%和50%的时程较正常组明显延长,进一步提示:糖尿病心肌细胞APD延长可能是双孔钾通道TASK-1电流明显减少引起。
本实验中通过STZ诱导糖尿病心肌损伤模型,发现双孔钾通道TASK-1蛋白表达上调的同时电流密度降低,APD延长,大鼠心功能受损并出现心肌纤维化,提示TASK-1在糖尿病诱发心肌损伤的进展中可能发挥重要作用,我们首次报道糖尿病心肌损伤中TASK-1的表达变化,为糖尿病在临床治疗方面的研究提供了一条新的线索,但其具体机制有待于进一步研究。
| [1] |
Ashrafi R, Modi P, Oo AY, et al. Arrhythmogenic gene remodelling in elderly patients with type 2 diabetes with aortic stenosis and normal left ventricular ejection fraction[J].
Exp Physiol, 2017, 102(11): 1424-34.
DOI: 10.1113/EP086412. |
| [2] |
Nguyen MN, Kiriazis H, Gao XM, et al. Cardiac fibrosis and arrhythmogenesis[J].
Compr Physiol, 2017, 7(3): 1009-49.
|
| [3] |
Axelsen LN, Calloe K, Braunstein TH, et al. Diet-induced prediabetes slows cardiac conductance and promotes arrhythmogenesis[J].
Cardiovasc Diabetol, 2015, 14(5): 87.
|
| [4] |
Momparler RL, Côté S, Momparler LF, et al. Epigenetic therapy of acute myeloid leukemia using 5-aza-2'-deoxycytidine (decitabine) in combination with inhibitors of histone methylation and deacetylation[J].
Clin Epigenetics, 2014, 6(1): 19.
DOI: 10.1186/1868-7083-6-19. |
| [5] |
Kang D, Han J, Talley EM, et al. Functional expression of TASK-1/TASK-3 heteromers in cerebellar granule cells[J].
J Physiol, 2004, 554(Pt 1): 64-77.
|
| [6] |
Lesage F, Lazdunski M. Molecular and functional properties of twopore-domain Potassium channels[J].
Am J Physiol Renal Physiol, 2000, 279(5): F793-801.
DOI: 10.1152/ajprenal.2000.279.5.F793. |
| [7] |
Donner BC, Schullenberg M, Geduldig N, et al. Functional role of TASK-1 in the heart: studies in TASK-1-deficient mice show prolonged cardiac repolarization and reduced heart rate variability[J].
Basic Res Cardiol, 2011, 106(1): 75-87.
DOI: 10.1007/s00395-010-0128-x. |
| [8] |
Wiedmann F, Schulte JS, Gomes B, et al. Atrial fibrillation and heart failure-associated remodeling of two-pore-domain Potassium (K2P) channels in murine disease models: focus on TASK-1[J].
Basic Res Cardiol, 2018, 113(4): 27.
DOI: 10.1007/s00395-018-0687-9. |
| [9] |
Park SJ, Yu Y, Wagner B, et al. Increased TASK channel-mediated currents underlie high-fat diet induced vagal afferent dysfunction[J].
Am J Physiol Gastrointest Liver Physiol, 2018, 315(4): G592-601.
DOI: 10.1152/ajpgi.00335.2017. |
| [10] |
Mccarty MF. Practical prevention of cardiac remodeling and atrial fibrillation with full-spectrum antioxidant therapy and ancillary strategies[J].
Med Hypotheses, 2010, 75(2): 141-7.
DOI: 10.1016/j.mehy.2009.12.025. |
| [11] |
Liu P, Su JF, Song XX, et al. Activation of nuclear beta-catenin/cMyc axis promotes oxidative stress injury in streptozotocin-induced diabetic cardiomyopathy[J].
Biochem Biophys Res Commun, 2017, 493(4): 1573-80.
DOI: 10.1016/j.bbrc.2017.10.027. |
| [12] |
王洪巨, 康品方, 叶红伟, 等. 乙醛脱氢酶2在糖尿病大鼠心肌缺血/再灌注损伤中的抗凋亡作用[J].
南方医科大学学报, 2012, 32(3): 345-8.
|
| [13] |
Wang HJ, Kang PF, Wu WJ, et al. Changes in cardiac mitochondrial aldehyde dehydrogenase 2 activity in relation to oxidative stress and inflammatory injury in diabetic rats[J].
Mol Med Rep, 2013, 8(2): 686-90.
DOI: 10.3892/mmr.2013.1524. |
| [14] |
Lin JL, Sung KT, Su CH, et al. Cardiac structural remodeling, longitudinal systolic strain, and torsional mechanics in lean and nonlean dysglycemic Chinese adults[J].
Circ Cardiovasc Imaging, 2018, 11(5): e007047.
|
| [15] |
Tompkins BA, Rieger AC, Florea V, et al. Comparison of mesenchymal stem cell efficacy in ischemic versus nonischemic dilated cardiomyopathy[J].
J Am Heart Assoc, 2018, 7(14): 142.
|
| [16] |
Benitez-Amaro A, Samouillan V, Jorge E, et al. Identification of new biophysical markers for pathological ventricular remodelling in tachycardia-induced dilated cardiomyopathy[J].
J Cell Mol Med, 2018, 22(9): 4197-208.
DOI: 10.1111/jcmm.2018.22.issue-9. |
| [17] |
Decher N, Wemhöner K, Rinné S, et al. Knock-out of the Potassium Channel TASK-1 leads to a prolonged QT interval and a disturbed QRS complex[J].
Cell Physiol Biochem, 2011, 28(1): 77-86.
DOI: 10.1159/000331715. |
| [18] |
Bayliss DA, Barhanin J, Gestreau C, et al. The role of pH-sensitive TASK channels in central respiratory chemoreception[J].
Pflugers Arch, 2015, 467(5): 917-29.
DOI: 10.1007/s00424-014-1633-9. |
| [19] |
Hanif W, Alex L, Su Y, et al. Left atrial remodeling, hypertrophy, and fibrosis in mouse models of heart failure[J].
Cardiovasc Pathol, 2017, 30(8): 27-37.
|
| [20] |
田真, 唐碧, 蔡鑫, 等. 缺氧对人肺动脉平滑肌细胞双孔钾通道TASK-1影响及非受体酪氨酸激酶的调节作用[J].
中国应用生理学杂志, 2016, 32(1): 26-31.
|
| [21] |
Tobita T, Nomura S, Fujita T, et al. Genetic basis of cardiomyopathy and the genotypes involved in prognosis and left ventricular reverse remodeling[J].
Sci Rep, 2018, 8(1): 1998.
DOI: 10.1038/s41598-018-20114-9. |
| [22] |
Guido MC, Marques AF, Tavares ER, et al. The effects of diabetes induction on the rat heart: differences in oxidative stress, inflammatory cells, and fibrosis between subendocardial and interstitial myocardial areas[J].
Oxid Med Cell Longev, 2017, 25(8): 5343972.
|
| [23] |
Daniels A, van Bilsen M, Goldschmeding R, et al. Connective tissue growth factor and cardiac fibrosis[J].
Acta Physiologica, 2009, 195(3): 321-38.
DOI: 10.1111/aps.2009.195.issue-3. |
| [24] |
Shyu KG, Wang BW, Cheng WP, et al. MicroRNA-208a increases myocardial endoglin expression and myocardial fibrosis in acute myocardial infarction[J].
Can J Cardiol, 2015, 31(5): 679-90.
DOI: 10.1016/j.cjca.2014.12.026. |
| [25] |
Gumieniczek A, Owczarek B, Pawlikowska B. Oxidative/nitrosative stress and protein damages in aqueous humor of hyperglycemic rabbits: effects of two oral antidiabetics, pioglitazone and repaglinide[J].
Exp Diabetes Res, 2012, 8(12): 653678.
|
| [26] |
Mccarty MF. Practical prevention of cardiac remodeling and atrial fibrillation with full-spectrum antioxidant therapy and ancillary strategies[J].
Med Hypotheses, 2010, 75(2): 141-7.
DOI: 10.1016/j.mehy.2009.12.025. |
| [27] |
Putzke C, Wemhöner K, Sachse FB, et al. The acid-sensitive Potassium Channel TASK-1 in rat cardiac muscle[J].
Cardiovasc Res, 2007, 75(1): 59-68.
DOI: 10.1016/j.cardiores.2007.02.025. |
| [28] |
张中亚, 於席芳, 刘鲜梅, 等. 糖尿病对大鼠心肌细胞动作电位和瞬时外向钾电流的影响[J].
中国心脏起搏与心电生理杂志, 2012, 26(5): 437-40.
|
 2018, Vol. 38
2018, Vol. 38

