2. 浙江中医药大学 附属第一医院 风湿科 浙江 杭州 310000;
3. 浙江中医药大学 附属第一医院 肺功能室,浙江 杭州 310000
2. Department of Rheumatology First Hospital Affiliated to Zhejiang Chinese Medical University, Hangzhou 310000, China;
3. Pulmonary Function Test Room, First Hospital Affiliated to Zhejiang Chinese Medical University, Hangzhou 310000, China
慢性阻塞性肺疾病(COPD)和哮喘可存在于同一患者中,称为哮喘-慢性阻塞性肺疾病重叠(ACO),目前ACO的全身炎症及气道炎症机制仍不清楚。有研究发现ACO患者血清2型辅助性T细胞(Th2)相关的炎症因子白介素-5及非Th2相关的炎症因子白介素-8水平均介于哮喘及COPD患者之间,提示ACO患者全身炎症同时包含Th2炎症与非Th2炎症[1]。而在气道炎症方面,有研究发现ACO患者痰液中性粒细胞比例与嗜酸性粒细胞比例均较高[2],提示ACO患者的气道炎症可能同时由中性粒细胞和嗜酸粒细胞两方面介导。此外,Iwamoto等[3]发现ACO患者痰中性粒细胞明胶酶相关脂质运载蛋白水平与COPD患者相比显著升高,提示ACO患者具有更严重的中性粒细胞气道炎症或气道上皮损伤,并提出可以作为ACO患者与COPD患者相鉴别的指标。基于上述研究,可以发现ACO患者气道炎症存在中性粒细胞性及嗜酸性粒细胞性两种炎症,并且某些炎症因子可能是潜在的可用于鉴别诊断的生物标记物。
髓过氧化物酶(MPO)能诱导气道上皮细胞表达白介素-8等炎症因子,促进气道慢性炎症和持续损伤,在COPD的病理中扮演重要角色[4]。嗜酸粒细胞阳离子蛋白(ECP)能引起气道上皮坏死、剥脱,诱发气道高反应,是造成哮喘气道炎症的重要介质[5]。我们进一步猜想MPO及ECP是否能作为ACO患者与COPD患者及哮喘患者相鉴别的痰生物标记物?此外,目前普遍认为与单纯的哮喘患者或COPD患者相比,ACO患者急性加重更频繁,生活质量差,肺功能下降快,死亡率增高[6]。MPO及ECP分别与COPD及哮喘的肺功能下降、急性加重风险等临床特征相关[7-9],那么MPO及ECP是否与ACO临床特征相关?本研究重点探讨MPO及ECP及其与临床症状、肺功能间的相关性,协助诊断及判断预后。
1 资料和方法 1.1 临床资料2016年11月~2017年5月于我院呼吸科门诊连续性收录ACO患者20例作为受试者。从同期在我院呼吸科门诊就诊的COPD患者387例、哮喘患者475例以及于体检中心体检的正常健康人383例中,采用随机数字表法选取COPD患者、哮喘患者以及正常健康人各20例作为受试者。
1.1.1 诊断标准ACO患者的诊断依据支气管哮喘全球倡议(GINA)2016年修订版[6],同时符合以下特征的患者考虑诊断ACO:(1)吸烟史大于10年;(2)同时出现COPD的典型临床症状(如劳力性呼吸困难)及哮喘的典型临床症状(如反复发作的喘息、气急、胸闷,夜间及晨间多发);(3)持续存在的气流受限:吸入支气管舒张剂后第1秒用力呼气量/用力肺活量(FEV1/ FVC) < 70%;(4)支气管舒张试验阳性:吸入支气管舒张剂后FEV1改善率≥12%,同时改善量≥200 mL。COPD患者的诊断依据为慢性阻塞性肺疾病诊断、处理和预防全球策略2016年修订版[10]。哮喘患者的诊断依据为GINA2016年修订版[6]。正常对照组要求无肺部疾病史、肺功能检查正常、肺部CT检查正常。
1.1.2 排除标准(1)2周内有急性呼吸道感染史者;(2)患有其他肺部疾病、心力衰竭、肝肾功能不全、代谢疾病、怀孕及哺乳期者;(3)试验前1月内使用过全身糖皮质激素及其他免疫调节剂者。本研究已经我院医学伦理委员会审批,并与患者签订知情同意书。
1.1.3 一般资料比较COPD组年龄比对照组大(P < 0.05),ACO组年龄与各组差异均无统计学意义(P> 0.05)。各组体质量指数(BMI)、性别比例差异无统计学意义(P> 0.05,表 1)。
| 表 1 各组年龄、BMI与性别比例比较 Table 1 Comparison of age, BMI and gender ratio among the groups (Mean±SD, n=20) |
BX20型光学显微镜(日本Olympus),全波长多功能酶标仪(美国Thermo),Master Screen型肺功能仪器(德国Alfred Jäger)。瑞氏染色液(江苏南通凯恒生物科技发展有限公司),人MPO酶联免疫吸附测定试剂盒、人ECP酶联免疫吸附测定试剂盒(上海酶联生物科技有限公司)。
1.2.2 诱导痰检查诱导痰检查前要求受试者停用β2受体激动剂、抗胆碱能药物、茶碱、吸入性糖皮质激素24 h以上。参考Gao等[2]方法对受试者进行诱导痰检查,主要步骤为吸入沙丁胺醇400 μg,15 min后通过超声雾化器以浓度为3%的高渗盐水雾化15 min,咳出痰液至消毒平皿。痰标本中加入0.1%二硫苏糖醇充分混合并漩涡震荡10 min,置37 ℃水浴10 min。300目尼龙网过滤掉黏液和碎片,以4000 r/min离心10 min后吸出上清液置-80 ℃保存用于痰液MPO、ECP测定。离心沉渣制作细胞涂片用于细胞分类计数。
1.2.3 指标检测(1)临床症状量表评分:COPD组及ACO组采用COPD患者自我评估测试(CAT)进行生活质量评估[10],哮喘组及ACO组采用哮喘控制测试(ACT)问卷进行哮喘控制评估[6]。(2)肺功能测定:所有受试者在检查前6 h未用过短效支气管舒张剂,24 h未用过长效支气管舒张剂及吸入性糖皮质激素。测定受试者FEV1、FVC、FEV1/FVC、呼气流量峰值(PEF)、最大呼气中期流量(MMF25/75)等肺通气功能参数。FEV1 < 80%预计值者加做支气管舒张试验。(3)痰液细胞分类计数:瑞氏染色后采用低倍镜(100×)观察细胞,鳞状上皮细胞 < 10%者为标本合格。油镜下(1000×)计数200个非鳞状上皮细胞,记录中性粒细胞及嗜酸粒细胞计数绝对值并计算比例。(4)痰液MPO、ECP表达测定:采用酶联免疫吸附测定法进行检测。在酶标包被板上设置空白对照孔、标准品孔和样本孔,空白对照孔不加样品及酶标试剂,其余各步操作相同;标准品孔各加不同浓度的标准品50 μL;样品孔中先加样品稀释液40 μL,再加待测上清液10 μL(最终稀释度为5倍)。除空白孔外每孔加入酶标试剂100 μL,37 ℃避光温育60 min。洗板5次。每孔先后加入显色剂A、B各50 μL,37 ℃避光显色15 min后加终止液50 μL终止反应。以空白孔调零,450 nm波长依序测量各孔的吸光度。
1.3 统计学分析采用SPSS20.0统计软件进行分析。计数资料比较采用χ2检验,计量资料以均数±标准差表示。各组数据若符合正态分布和方差齐性,则进行ANOVA单因素方差分析,组间比较采用Bonferroni检验;若方差不齐则采用秩和检验。两因素之间的相关性用Pearson相关分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 临床症状评分比较哮喘组未行CAT评分,ACO组与COPD组的CAT评分差异无统计学意义(P> 0.05)。COPD组未行ACT评分,ACO组的ACT评分小于哮喘组(P < 0.05,表 2)。
| 表 2 各组临床症状评分比较 Table 2 Comparison of CAT and ACT scores (Mean±SD, n=20) |
对照组的FEV1、FVC、PEF、MMF25/75均大于其余3组(P < 0.01),COPD组及ACO组吸入支气管舒张剂前的FEV1均小于哮喘组(P < 0.01,P < 0.05),COPD组与ACO组的FEV1差异无统计学意义(P> 0.05)。COPD组的FVC小于哮喘组及ACO组(P < 0.05),哮喘组与ACO组的FVC差异无统计学意义(P> 0.05)。COPD组及ACO组的PEF均小于哮喘组(P < 0.01),COPD组与ACO组的PEF差异无统计学意义(P> 0.05)。COPD组及ACO组的MMF25/75小于哮喘组(P < 0.05),COPD组与ACO组的MMF25/75差异无统计学意义(P> 0.05,表 3)。
| 表 3 各组肺功能比较 Table 3 Comparison of pulmonary function test parameters (Mean±SD, n=20) |
COPD组痰液中性粒细胞比例高于对照组及哮喘组(P < 0.01)。哮喘组痰液嗜酸性粒细胞比例高于对照组、COPD组(P < 0.05)。ACO组痰液中性粒细胞比例高于对照组及哮喘组(P < 0.01),痰液嗜酸性粒细胞比例高于对照组及COPD组(P < 0.01,表 4,图 1)。
| 表 4 各组痰细胞分类计数比较 Table 4 Comparison of differential counts of inflammatory cells in sputum (Mean±SD, n=20) |
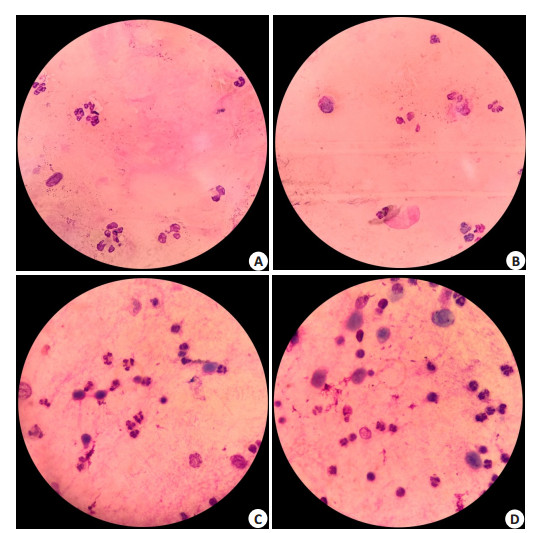
|
图 1 各组痰液涂片瑞氏染色比较 Figure 1 Wright staining of sputum smear (Original magnification: ×1000). A: Control group; B: Asthma group; C: COPD group; D: ACO group. |
COPD组痰液MPO表达高于对照组及哮喘组(P < 0.01,P < 0.05)。哮喘组痰液ECP表达高于对照组(P < 0.01),与COPD组ECP表达差异无统计学意义(P> 0.05)。ACO组痰液MPO水平高于对照组及哮喘组(P < 0.01,P < 0.05),与COPD组比较差异无统计学意义(P> 0.05)。ACO组痰液ECP水平高于对照组、哮喘组、COPD组(P < 0.01,P < 0.05,P < 0.01,表 5)。
| 表 5 各组痰液MPO、ECP表达比较 Table 5 Comparison of MPO and ECP expression in sputum (Mean±SD, n=20) |
ACO组痰MPO水平与痰中性粒细胞比例呈正相关(r=0.8358,P < 0.01),痰ECP水平与痰嗜酸性粒细胞比例呈正相关(r=0.4666,P < 0.05,图 2)。ACO组痰MPO水平与CAT评分无相关性(r=0.2967,P> 0.05),痰ECP水平与ACT评分呈负相关(r=-0.4966,P < 0.05,图 3)。ACO组痰MPO水平与FEV1不相关(r=0.1251,P> 0.05),痰ECP水平与FEV1呈负相关(r=- 0.4610,P < 0.05,图 4)。
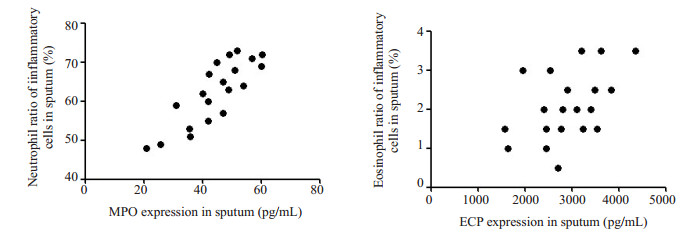
|
图 2 ACO组痰液MPO、ECP水平与炎症细胞分类计数的相关性 Figure 2 Correlation between the expressions of MPO and ECP and inflammatory cell counts in the sputum of patients with ACO. |
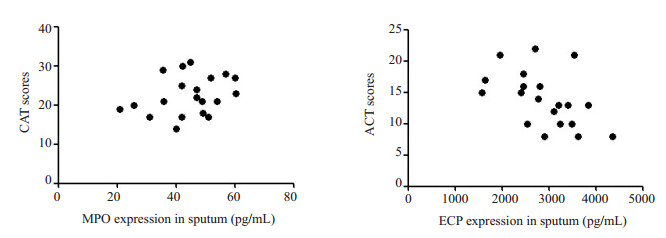
|
图 3 ACO组痰MPO、ECP水平与临床症状的相关性 Figure 3 Correlation between expressions of MPO and ECP in sputum and the clinical symptoms of patients with ACO. |
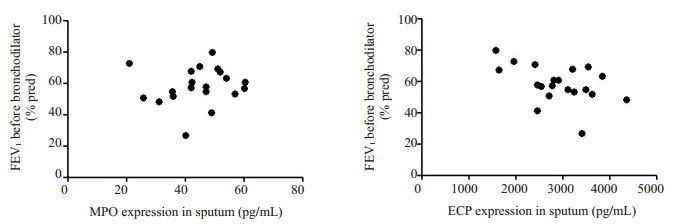
|
图 4 ACO组痰MPO、ECP水平与FEV1的相关性 Figure 4 Correlation between expressions of MPO and ECP in the sputum and FEV1 of patients with ACO. |
本研究中ACO患者年龄及体质量指数与COPD患者、哮喘患者比较差异均无统计学意义,这与国外的研究有所不同,有研究显示ACO患者年龄比哮喘患者较大[11],比COPD患者较小[12]。在临床症状上,本研究中ACO患者的临床症状与COPD患者相仿,但哮喘控制水平相比哮喘患者较差,提示ACO患者或许应该受到更多的关注及增高阶梯的药物治疗。这与国外的研究结果不同,有研究ACO患者比COPD患者咳痰更多,但与哮喘患者相比哮喘发作次数及急诊次数无明显差异[11]。有关日本人群的研究显示,ACO患者相比COPD患者较轻的呼吸困难症状,但两组患者的1年急性加重频率无明显差异[12]。研究结果的差异可能与纳入的受试人群的地域及样本量大小有关。
在肺功能上,本研究发现ACO患者阻塞性气流受限程度与COPD患者相仿,但无论在大气道(FEV1、PEF)或小气道(MMF25/75)阻塞程度上与哮喘患者比较均更严重。同时,ACO患者的限制性气流受限程度(FVC)与COPD患者比较减轻。有研究显示,ACO患者吸入舒张剂前FEV1、FVC相对COPD患者较低[11],提示阻塞性及限制性气流受限程度均更严重。而有学者则发现ACO患者气道阻塞相比COPD患者较轻[2, 12],但相比哮喘患者更严重[2]。可见不同研究中关于ACO患者与COPD患者肺功能的比较结果有一定的差异,但在ACO患者相对于哮喘而言阻塞性气流受限程度更严重的观点则比较一致。
中性粒细胞性炎症是COPD的突出特征,与肺功能下降速率[13]及外周气道功能紊乱相关[14],同时也是COPD急性加重的特征[15]。嗜酸性粒细胞则是哮喘的重要参与成分,与哮喘疾病严重程度及急性发作的频率相关[16]。本研究发现ACO患者痰液中性粒细胞及嗜酸性粒细胞比例均较高,与Gao等[2]研究结果相似,提示ACO患者气道炎症方面同时拥有中性粒细胞型炎症及嗜酸性粒细胞性炎症。
有研究发现通过抑制MPO的活性可以显著抑制肺气肿、肺动脉高压、小气道重构等COPD病理改变[17],提示MPO在COPD病理过程中扮演重要角色。稳定期的COPD患者痰液MPO水平较正常人增高,且与呼吸道中性粒细胞数呈正相关[18],而急性加重期的COPD患者痰液MPO水平增高[19]。在ACO患者中,痰MPO表达较正常人明显增高,吸入性糖皮质激素治疗可以显著降低痰MPO表达[20]。Gao等[21]研究发现ACO患者痰液MPO水平与COPD患者相仿,相比哮喘患者较高,这与本研究结果一致,提示MPO介导的中性粒细胞性炎症是ACO气道炎症中的重要成分。本研究同时发现MPO水平与痰中性粒细胞比例呈正相关,提示MPO是反映中性粒细胞炎症的良好生物标记物。Parr等[22]发现痰液MPO的高表达可作为COPD患者4年内FEV1的快速下降的预测因子。然而本研究中ACO患者的痰MPO水平与CAT评分及FEV1并无明显相关性,提示单纯应用痰MPO测定并不能反映ACO患者的临床症状的严重程度及现阶段肺功能的损害程度。
作为活化的嗜酸性粒细胞所释放的颗粒成分,ECP在嗜酸性炎症反应中显著增加,并具有诱导细胞损伤及气道高反应性,促进气道分泌粘液等功能[23]。哮喘患者的血清ECP水平较正常人显著增高,且与哮喘严重程度呈正相关[24-25]。本研究显示,ACO患者痰液ECP表达较哮喘组、COPD组均增大,同时ECP水平与痰嗜酸性粒细胞比例呈正相关,提示ECP介导的嗜酸性性粒细胞性炎症不仅是ACO气道炎症中的重要成分,且炎症水平较哮喘患者更剧烈。Cianchetti等[26]发现痰液ECP水平与痰嗜酸性粒细胞数及哮喘的严重程度呈正相关,而与FEV1、PEF、急救β受体激动剂的使用频率、整体症状评分等均呈负相关。Yalcin等[27]发现12月的抗IgE单克隆抗体Omalizumab治疗显著降低了ACO患者血清ECP表达,并改善了FEV1及ACT评分,提示血清ECP可能与阻塞性气流受限程度及哮喘控制水平存在着一定的相关性。而本研究进一步证实ACO患者的痰ECP水平与ACT评分及FEV1均呈负相关,提示痰ECP水平或许可以作为评估ACO患者哮喘控制水平及肺功能损害程度的标志物。本研究中ACO组痰嗜酸性粒细胞比例与哮喘组比较差异无统计学意义,但痰ECP水平相比哮喘组明显增高,提示痰ECP水平比痰嗜酸性粒细胞比例在反映ACO患者嗜酸性炎症上敏感性更高,或许能作为区分ACO与哮喘患者的生物标记物,值得更进一步的研究。
本研究仍有一定的不足之处:纳入的病例数相对较少,未能做到大样本量及多中心研究。相信随着医学界对ACO这一特殊人群的日益重视及研究的深入,特别是加强目前尚缺乏的动物实验方面探索,未来定能更好地揭示其病理机制。
| [1] |
de Llano LP, Cosío BG, Iglesias A, et al. Mixed Th2 and non-Th2 inflammatory pattern in the asthma-COPD overlap: a network approach[J].
Int J Chron Obstruct Pulmon Dis, 2018, 13(3): 591-601.
|
| [2] |
Gao J, Zhou W, Chen B, et al. Sputum cell count: biomarkers in the differentiation of asthma, COPD and asthma-COPD overlap[J].
Int J Chron Obstruct Pulmon Dis, 2017, 12(8): 2703-10.
|
| [3] |
Iwamoto H, Gao J, Koskela J, et al. Differences in plasma and sputum biomarkers between COPD and COPD-asthma overlap[J].
Eur Respir J, 2014, 43(2): 421-9.
|
| [4] |
Ray RS, Katyal A. Myeloperoxidase: bridging the gap in neurodegeneration[J].
Neurosci Biobehav Rev, 2016, 68(9): 611-20.
|
| [5] |
Bartoli ML, Bacci E, Carnevali S, et al. Clinical assessment of asthma severity partially corresponds to sputum eosinophilic airway inflammation[J].
Respir Med, 2004, 98(2): 184-93.
DOI: 10.1016/j.rmed.2003.09.012. |
| [6] |
Global Initiative for Asthma: The global strategy for asthma management and prevention(Revised 2016)[OL]. http://www.ginasthma.org.
|
| [7] |
Park HY, Man SF, Tashkin D, et al. The relation of serum myeloperoxidase to disease progression and mortality in patients with chronic obstructive pulmonary disease (COPD)[J].
PLoS One, 2013, 8(4): e61315-9.
DOI: 10.1371/journal.pone.0061315. |
| [8] |
Guo CL, Sun XM, Wang XW, et al. Serum eosinophil cationic protein is a useful marker for assessing the efficacy of inhaled corticosteroid therapy in children with bronchial asthma[J].
Tohoku J Exp Med, 2017, 242(4): 263-71.
DOI: 10.1620/tjem.242.263. |
| [9] |
Mogensen I, Alving K, Bjerg A, et al. Simultaneously elevated exhaled nitric oxide and serum-eosinophil cationic protein Relate to recent asthma events in asthmatics in a cross-sectional populationbased study[J].
Clin Experim Allergy, 2016, 46(12): 1540-8.
|
| [10] |
Global Initiative for Chronic Obstructive Lung Disease. Global Strategy for Prevention, Diagnosis and Management of Chronic Obstructive Lung Disease, 2016[OL]. www.goldcopd.org.
|
| [11] |
Hahn B, Lafeuille MH, Bell C, et al. Comparison of health characteristics in subjects with asthma, COPD, and Asthma-COPD overlap using the NHANES database[J].
Chest, 2017, 152(4, S): A816-22.
DOI: 10.1016/j.chest.2017.08.847. |
| [12] |
Inoue H, Nagase T, Morita S, et al. Prevalence and characteristics of asthma-COPD overlap syndrome identified by a stepwise approach[J].
Int J Chron Obstruct Pulmon Dis, 2017, 12(6): 1803-10.
|
| [13] |
Stănescu D, Sanna A, Veriter C, et al. Airways obstruction, chronic expectoration, and rapid decline of FEV1 in smokers are associated with increased levels of sputum neutrophils[J].
Thorax, 1996, 51(3): 267-71.
DOI: 10.1136/thx.51.3.267. |
| [14] |
O'donnell RA, Peebles C, Ward JA, et al. Relationship between peripheral airway dysfunction, airway obstruction, and neutrophilic inflammation in COPD[J].
Thorax, 2004, 59(10): 837-42.
DOI: 10.1136/thx.2003.019349. |
| [15] |
Gompertz S, O'brien C, Bayley DL, et al. Changes in bronchial inflammation during acute exacerbations of chronic bronchitis[J].
Europ Respirat J, 2001, 17(6): 1112-9.
DOI: 10.1183/09031936.01.99114901. |
| [16] |
Price DB, Rigazio A, Campbell JD, et al. Blood eosinophil count and prospective annual asthma disease burden: a UK cohort study[J].
Lancet Respir Med, 2015, 3(11): 849-58.
DOI: 10.1016/S2213-2600(15)00367-7. |
| [17] |
Churg A, Marshall CV, Sin DD, et al. Late intervention with a myeloperoxidase inhibitor stops progression of experimental chronic obstructive pulmonary disease[J].
Am J Respir Crit Care Med, 2012, 185(1): 34-43.
DOI: 10.1164/rccm.201103-0468OC. |
| [18] |
Ronchi MC, Piragino C, Rosi E, et al. Role of sputum differential cell count in detecting airway inflammation in patients with chronic bronchial asthma or COPD[J].
Thorax, 1996, 51(10): 1000-4.
DOI: 10.1136/thx.51.10.1000. |
| [19] |
Zhu A, Ge D, Zhang J, et al. Sputum myeloperoxidase in chronic obstructive pulmonary disease[J].
Eur J Med Res, 2014, 19(1): 12-8.
|
| [20] |
Feng JX, Lin Y, Lin J, et al. Relationship between Fractional Exhaled Nitric Oxide Level and Efficacy of Inhaled Corticosteroid in Asthma-COPD Overlap Syndrome Patients with Different Disease Severity[J].
J Korean Med Sci, 2017, 32(3): 439-47.
DOI: 10.3346/jkms.2017.32.3.439. |
| [21] |
Gao J, Iwamoto H, Koskela J, et al. Characterization of sputum biomarkers for asthma-COPD overlap syndrome[J].
Int J Chron Obstruct Pulmon Dis, 2016, 11(1): 2457-65.
|
| [22] |
Parr DG, White AJ, Bayley DL, et al. Inflammation in sputum relates to progression of disease in subjects with COPD: a prospective descriptive study[J].
Respir Res, 2006, 7(1): 136-42.
DOI: 10.1186/1465-9921-7-136. |
| [23] |
Begum A, Ahmed MU. Eosinophilic cationic protein in bronchial asthma-current concepts[J].
Banglad J Med Microbiol, 2013, 7(2): 25-7.
|
| [24] |
Badreldin OM, Elsawy IH, Elazzouni OE, et al. Eosinophil cationic protein as a serological marker of disease activity in childhood bronchial asthma[J].
East Mediterr Health J, 1999, 5(4): 664-75.
|
| [25] |
Sileem AE, Embarak S, Meleha MS. Serum eosinophilic cationic protein and high sensitive C-reactive protein as alternative parameters for differentiation of severity stages and monitoring control in bronchial asthma patients[J].
Egyp J Chest Dis Tubercul, 2014, 63(4): 765-70.
|
| [26] |
Cianchetti S, Bacci E, Ruocco L, et al. Are sputum eosinophil cationic protein and eosinophils differently associated with clinical and functional findings of asthma[J].
Clin Exp Allergy, 2014, 44(5): 673-80.
|
| [27] |
Yalcin AD, Celik B, Yalcin AN. Omalizumab (anti-IgE) therapy in the asthma-COPD overlap syndrome (ACOS) and its effects on circulating cytokine levels[J].
Immunopharmacol Immunotoxicol, 2016, 38(3): 253-6.
DOI: 10.3109/08923973.2016.1173057. |
 2018, Vol. 38
2018, Vol. 38

