2. 皖南医学院法医学院实验中心,安徽 芜湖 241002;
3. 皖南医学院生物化学与分子生物学教研室,安徽 芜湖 241002
2. School of Forensic Medicine Experimental Center, Wannan Medical College, Wuhu 241002, China;
3. Department of Biochemistry and Molecular Biology, Wannan Medical College, Wuhu 241002, China
白杨素又称白杨黄素(图 1),化学名为5,7-二羟基黄酮,是从紫葳科植物木蝴蝶中提取的具有广泛药理活性的天然黄酮类化合物[1],它在蜂胶中含量较高,是蜂胶的主要有效成分[2]。研究表明,白杨素具有抗肿瘤、抗炎、抗氧化等多种药理作用[3-6]。我们前期的研究结果表明,白杨素能有效阻断ROS介导的JAK-STATs信号活化,从而抑制LPS诱导的RAW264.7细胞炎症反应[7]。
|
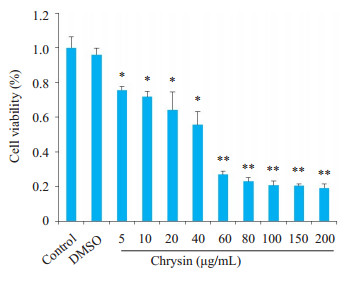
图 1 白杨素对SMMC-7721细胞存活率的影响 Figure 1 Chrysin inhibited SMMC-7721 cell viability. *P < 0.05, **P < 0.01 vs Control group. |
白杨素通过刺激ROS的生成激活ASK1,导致JNK活化,进而上调Bim表达,并最终促进人肝癌Hep3B细胞凋亡[10]。亚细胞毒性浓度的白杨素具有敏化rhsTRAIL诱导人肝癌Bel-7402细胞凋亡作用[11]。白杨素通过调控p53/Bcl-2/caspase-9信号途径诱导肝癌HepG2和QGY7701细胞凋亡[12]。李欣等研究表明白杨素能够提高肿瘤坏死因子-α诱导肝癌细胞HepG2凋亡能力[13]。白杨素能够促进或者敏化多种肝癌细胞系的凋亡,但对SMMC 7721细胞系的作用,目前尚未见报道。
丝裂原活化蛋白激酶家族(MAPKs)是细胞内重要的信号传导通路,主要参与凋亡调控,细胞代谢,细胞分化和肿瘤发生等生命过程[14-16]。MAPKs包括3个主要成员,分别是细胞外信号调节蛋白激酶(extracellular-signal regulated protein kinase,ERK)、c-Jun氨基末端激酶(c-Jun amino-terminal kinase,JNK)和P38 MAPK[17-18]。多种天然黄酮类化合物,如甘草素,黄芪和丹参提取物,良姜等,在诱导肝癌细胞凋亡时,均激活或者抑制MAPKs信号通路[19-22]。天然黄酮类化合物白杨素对MAPKs信号通路是否具有调控作用,需要进一步阐明。
SMMC 7721是耐药型肝癌细胞株,具有高转移和侵袭潜能,白杨素对肝癌SMMC-7721株细胞增殖的影响,目前尚未见报道。本研究拟在细胞和分子水平,探讨白杨素能否抑制肝癌SMMC-7721细胞增殖,诱导其凋亡,并试图阐明MAPKs信号通路在白杨素凋亡诱导作用中的功能,为拓展白杨素的临床用药范围以及肝癌的防治提供理论依据。
1 材料和方法 1.1 材料人肝癌细胞株SMMC-7721由本实验室保存。白杨素(阿拉丁);1640完全培养液、胎牛血清(Hyclone);CCK-8,DAPI购自Sigma;MAPKs,PARP、procaspase-3、GAPDH、β- actin抗体购自CST(Cell Signaling Technology);IRDye800荧光标记二抗购自Odessey;AnnexinV-FITC/PI试剂盒购自BD(Becton, Dickinson and Company)。
1.2 细胞培养用含10%胎牛血清和抗生素(100 U·mL-1青霉素和100 mg·L-1链霉素)的1640完全培养基在37 ℃,5% CO2条件下,培养SMMC-7721细胞株,隔2~3 d传代1次,选取对数生长期细胞进行实验。
1.3 CCK-8检测法细胞存活率用细胞将CCK-8还原成甲瓒的能力来衡量。将SMMC-7721细胞提前24 h接种于96孔板,细胞密度为5×104。设置空白对照组和溶剂对照组,空白对照组细胞不做任何处理,溶剂对照组加入100 μL二甲基亚砜(DMSO),药物组用不同浓度(5,10,20,40,60,80,100,150,200 μg/mL)白杨素分组处理细胞24 h后,每孔加入10 μL CCK-8(5 g·L-1)继续培养4 h。每组设5个复孔,每组设空白调零孔。酶标仪检测各孔450 nm波长的光密度D(λ)值。
| ${\rm{细胞活力}}\left( {\rm{\% }} \right){\rm{ = }}\frac{{\mathit{D}{{{\rm{(}}\mathit{\lambda }{\rm{)}}}_{{\rm{实验组}}}}{\rm{ - }}\mathit{D}{{{\rm{(}}\mathit{\lambda }{\rm{)}}}_{{\rm{调零孔}}}}}}{{\mathit{D}{{{\rm{(}}\mathit{\lambda }{\rm{)}}}_{{\rm{空白对照组}}}}{\rm{ - }}\mathit{D}{{{\rm{(}}\mathit{\lambda }{\rm{)}}}_{{\rm{调零孔}}}}}} $ |
提前24 h将SMMC-7721细胞接种于6孔板,密度为2×105个/mL,细胞贴壁后,换新鲜培养液,除空白对照组和溶剂对照组外,加入终浓度分别为5,10,20 μg/mL白杨素进行处理,24 h后倒置显微镜下观察细胞形态学变化,并进行拍照(×200)。
1.5 DAPI染色法细胞处理及分组同1.4项,吸尽各组的培养液,加入PBS进行漂洗,漂洗3次,每次3 min。每组加入1 mL DAPI(1 mg·L-1)避光染色3 min,再用PBS避光洗3次,荧光显微镜下观察各组细胞核变化情况,并拍照分析。
1.6 流式细胞术收集各组细胞样品,用预冷的PBS清洗2次,2000 r·min-1离心收集细胞,加入l × Binding buffer 500 μL重悬细胞,制成单细胞悬液后,分别加入5 μL Annexin V-FITC和5 μL PI,避光孵育。流式细胞术检测四个象限细胞数,分析细胞凋亡率。
1.7 免疫印迹Western blot细胞分组处理后,预冷的PBS清洗3遍,RAPI裂解,收集各组细胞裂解物,离心后收集上清液。Bicinchoninicacid(BCA)法测定样品蛋白质浓度,加入2×上样缓冲液,煮沸5 min,于4 ℃条件下保存。依据蛋白质浓度测定结果上等量样品,进行SDS-PAGE(10%或12%)后,恒流350 mA,100 min,将蛋白转至NC膜上。用含5%脱脂奶粉的TBS封闭液,将膜室温封闭1 h,加入一抗4 ℃孵育过夜,吸尽一抗,加入荧光标记二抗室温避光孵育1 h,吸尽二抗,用现配的TBST清洗,Odyssey红外双色激光成像系统进行扫描。
1.8 统计学处理用SPSS 13.0软件进行统计分析,组间比较用单因素方差分析,P<0.05为有统计学意义。
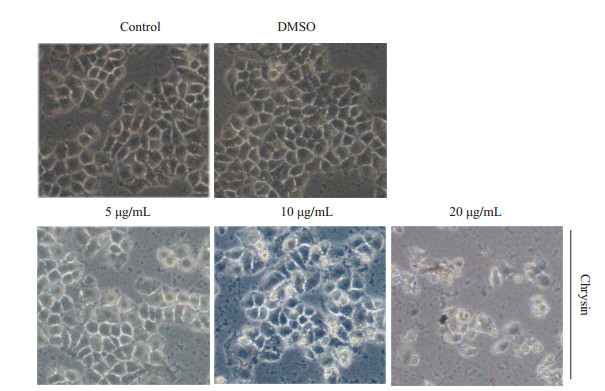
2 结果 2.1 白杨素抑制SMMC-7721细胞增殖运用CCK-8法检测细胞增殖情况,用不同浓度白杨素预处理SMMC-7721细胞24 h后,细胞增殖速度减慢,存活率显著降低(图 1)。倒置显微镜下,对照组细胞和溶剂组细胞大小匀称,自然贴壁生长,细胞轮廓清晰;5 μg/mL白杨素组大部分细胞贴壁生长,少量细胞轮廓模糊,边缘皱缩,脱落,20 μg/mL组细胞仅有少量细胞贴壁,大部分细胞皱缩,脱落,漂浮(图 2)。
|
图 2 白杨素对SMMC-7721细胞形态的影响 Figure 2 Chrysin caused changes in SMMC-7721 cell morphology. |
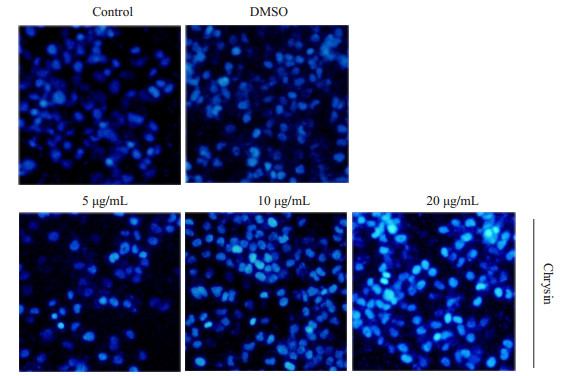
经DAPI染色后,对照组和溶剂组细胞核均匀蓝染,细胞核形态呈椭圆形。经白杨素处理后,出现蓝色高亮区,染色质浓缩,细胞核呈梭形,偶见凋亡小体,呈现典型的细胞凋亡细胞核形态变化(图 3)。
|
图 3 白杨素对SMMC-7721细胞核形态的影响 Figure 3 Chrysin caused changes in SMMC-7721 nuclear morphology. |
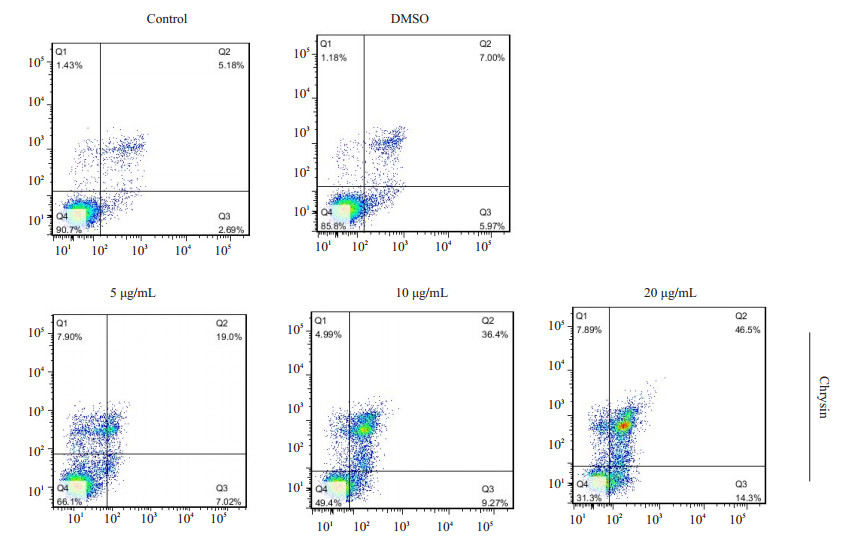
Annexin V-FITC/PI双染结果显示,空白对照组和DMSO溶剂对照组细胞凋亡率分别为9.3%和14.2%,5 μg/mL白杨素处理后,细胞凋亡率增加到33.9%,随着白杨素浓度的增加,20 μg/mL组细胞凋亡率为68.7%,细胞凋亡现象显著(图 4)。因此,我们初步推测,白杨素抑制SMMC-7721细胞增殖,可能是通过诱导细胞凋亡发挥作用的。
|
图 4 白杨素对SMMC-7721细胞凋亡率的影响 Figure 4 SMMC-7721 cell apoptosis induced by Chrysin. |
与对照组和溶剂组相比,白杨素处理后,Western blot法检测procaspase-3和PARP蛋白水平以及切割蛋白的生成情况。结果显示,procaspase-3表达量下降,PARP切割显著增加。进一步证实白杨素通过诱导SMMC-7721细胞凋亡达到抑制细胞增殖的作用(图 5)。
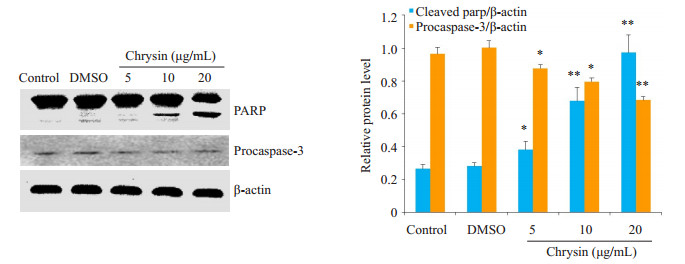
|
图 5 白杨素对SMMC-7721细胞相关凋亡蛋白的影响 Figure 5 Chrysin induced SMMC-7721 cell apoptosis and cleavage of related proteins. *P < 0.05, **P < 0.01 vs Control group. |
为了探寻MAPKs信号分子是否参与调控白杨素诱导的细胞凋亡,我们采用Western blotting法检测P38、ERK和JNK的磷酸化水平。结果显示,在不同剂量的白杨素组中,P38、ERK和JNK均有不同程度的活化,高浓度组磷酸化显著。用10 μg/mL白杨素作用SMMC-7721细胞不同时间,发现P38、ERK、JNK在15 min开始激活并达到峰值,60 min基本恢复到本底水平。白杨素处理前后P38、ERK、JNK的表达量不变(图 6)。
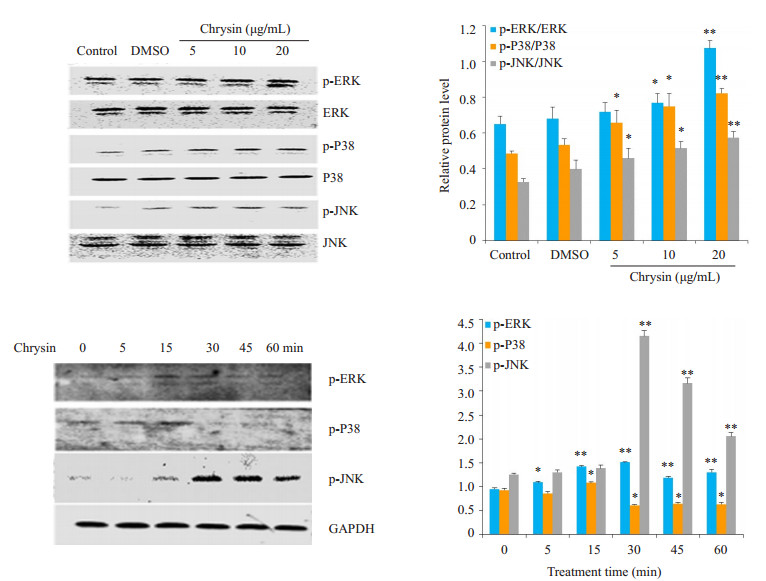
|
图 6 白杨素诱导ERK、P38和JNK的磷酸化 Figure 6 Chrysin induced ERK, P38 and JNK phosphorylation. *P < 0.05, **P < 0.01 vs Control group. |
为了证实MAPKs参与调控白杨素诱导的细胞凋亡,分别用SB203580、U0126、SP600125预处理2 h,再加入10 μg/mL白杨素分别作用15 min和24 h后,Western blotting检测发现,SB203580、U0126、SP600125能够显著抑制白杨素诱导的P38、ERK和JNK的磷酸化(图 7)和PARP切割(图 8)。以上结果证实白杨素通过激活MAPKs家族中P38、ERK和JNK信号分子,诱导细胞凋亡的发生。
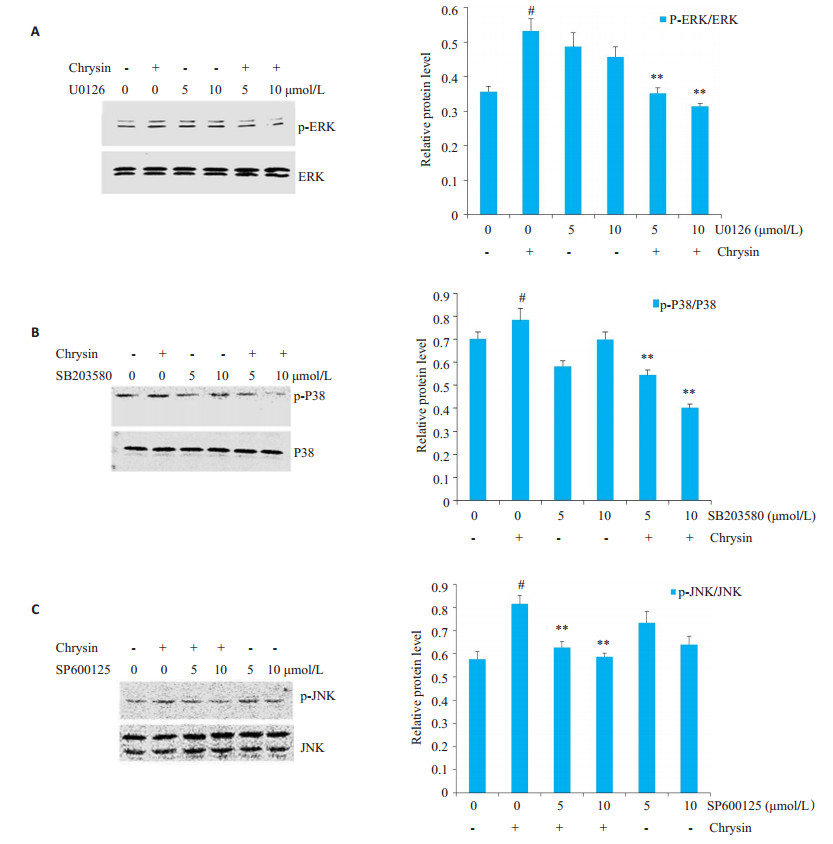
|
图 7 U0126、SB203580和SP600125处理对白杨素诱导的MAPKs活化的影响 Figure 7 Effects of U0126, SB203580 and SP600125 on chrysin-induced MAPKs activation. #P < 0.05 vs Control group; *P < 0.05, **P < 0.01 vs Chrysin group. |
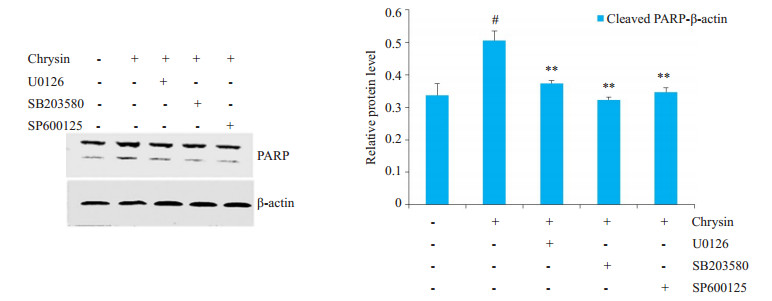
|
图 8 U0126, SB203580和SP600125对PARP切割的影响 Figure 8 Effects of U0126, SB203580 and SP600125 on PARP cleavage. #P < 0.05 vs Control group; *P < 0.05, **P < 0.01 vs Chrysin group. |
MAPKs级联激活是多种信号通路的中心,是接收膜受体转换与传递的信号并将其带入细胞核内的一类重要分子,在许多细胞增殖相关信号通路中具有关键作用。在未受刺激的细胞内,MAPKs处于静止状态。细胞受到生长因子或其他因素刺激后,MAPKs接收MKK和MKKK的活化信号而被激活,表现为逐级磷酸化[23-24]。本研究证实,用白杨素处理肝癌SMMC-7721细胞后,ERK在60 min内均有不同程度的激活,在15 min时达到峰值,从30 min开始减弱。JNK从15 min开始激活,一直持续到60 min。P38在15 min时有显著激活,30 min激活减弱。用不同浓度的白杨素处理SMMC-7721,随着药物浓度的加大,ERK,JNK和P38的激活程度显著增强。为了进一步探究MAPKs通路在白杨素诱导细胞凋亡中的作用,我们分别用ERK特异性抑制剂U0126,P38特异性抑制剂SB203580和JNK特异性抑制剂SP600125阻断细胞内MAPKs信号通路,结果显示,抑制剂均能够显著抑制白杨素诱导的ERK,JNK和P38的磷酸化,且能够逆转白杨素诱导的PARP切割。因此,在白杨素诱导的SMMC-7721细胞凋亡中,ERK,JNK和P38共同发挥促进细胞凋亡的作用。
肝癌细胞肿瘤微环境中主要是由于促炎和抗炎细胞因子比例失调,肿瘤相关巨噬细胞及其产生的细胞因子具有促进肝癌细胞增殖、侵袭和转移的特征[25-26]。我们前期实验结果证实白杨素能够有效阻断ROS介导的JAK-STATs信号活化,从而抑制LPS诱导的巨噬细胞系RAW264.7细胞的炎症反应[7]。因此,我们推测,在SMMC-7721细胞中,白杨素可能通过清除细胞内ROS,进而调控ROS下游的MAPKs家族蛋白信号分子,激活ERK,JNK和P38促进细胞凋亡的发生,抑制肝癌细胞增殖。这也将是我们后续实验的研究重点。
细胞内凋亡现象的发生,无论是死亡受体途径还是线粒体途径,都涉及到半胱氨酸蛋白酶家族的级联反应,从而引起关键的执行分子pro-caspase-3的活化。pro-caspase-3本身并没有催化活性,在活化时首先由颗粒酶B(GrzB)或caspase-10在D175剪切下小片段后它才被部分活化,随后则可进行下一步的自我催化。在活化时caspase-3最主要的底物是多聚(ADP-核糖)聚合酶PARP(poly (ADP-ribose) polymerase,PARP),在细胞凋亡启动时,116kD的PARP在Asp216-Gly217之间被caspase-3剪切成31 kD和85 kD两个片段,结果使受PARP负调控影响的Ca2+/Mg2+依赖性核酸内切酶的活性增高,裂解核小体间的DNA,引起细胞凋亡[27, 28]。因此,我们可以通过检测pro-caspase-3和PARP的原始蛋白的减少和切割蛋白的产生,判断细胞凋亡的发生和凋亡程度。
细胞内众多信号通路通过caspase家族介导细胞凋亡,MAPKs是其中最重要的信号通路之一[29-30]。在我们的实验中,用不同浓度的白杨素处理SMMC-7721细胞后,MAPKs信号通路活化,细胞形态呈现典型的凋亡特征。形态学观察显示SMMC-7721细胞胞质浓缩,细胞体积缩小,在高剂量组细胞贴壁差,悬浮细胞增多。DAPI染色后,白杨素处理组细胞的细胞核内染色质凝聚,呈现蓝色高亮区,镜下可见凋亡小体。流式细胞术结果表明不同剂量白杨素处理细胞后,细胞凋亡率显著增加。Western blot结果证实白杨素能够激活caspase-3,procaspase-3表达降低,并且其底物PARP切割也增多。用特异性抑制剂分别抑制ERK,JNK和P38的活化后,白杨素诱导的PARP切割显著减少。
综上所述,本研究证实白杨素通过激活MAPKs信号通路中的ERK,JNK和P38信号分子,抑制SMMC-7721细胞增殖,启动细胞内caspase信号级联,最终引起典型凋亡形态改变和PARP切割。本文首次阐明了白杨素对肝癌细胞SMMC-7721的凋亡诱导作用和具体分子机制,拓展了白杨素的药理作用,为白杨素的临床应用提供理论依据。
| [1] |
伍石华, 罗招阳, 张坚松. 白杨素的抗肿瘤作用及机理研究[J].
湖南师范大学学报:医学版, 2006, 3(4): 78-81.
|
| [2] |
曹炜, 符军放, 索志荣, 等. 蜂胶中白杨素和高良姜素的HPLC分析[J].
药物分析杂志, 2007, 27(4): 522-6.
|
| [3] |
景临林, 范小飞, 马慧萍, 等. 以白杨素为原料简便合成A环多氧黄酮的方法[J].
化学试剂, 2013, 35(9): 782-4, 800.
|
| [4] |
Chen YH, Yang ZS, Wen CC, et al. Evaluation of the structureactivity relationship of flavonoids as antioxidants and toxicants of zebrafish larvae[J].
Food Chem, 2012, 134(2): 717-24.
DOI: 10.1016/j.foodchem.2012.02.166. |
| [5] |
Calderwood DA, Ginsberg MH. Talin forges the links between integrins and actin[J].
Nat Cell Biol, 2003, 5(8): 694-7.
DOI: 10.1038/ncb0803-694. |
| [6] |
Gresa-Arribas N, Serratosa J, Saura J, et al. Inhibition of CCAAT/ enhancer binding protein δ expression by chrysin in microglial cells results in anti-inflammatory and neuroprotective effects[J].
J Neurochem, 2010, 115(2): 526-36.
DOI: 10.1111/jnc.2010.115.issue-2. |
| [7] |
齐世美, 李强, 姜琦, 等. 白杨素通过JAK-STATs信号通路抑制内毒素诱导的巨噬细胞炎症反应[J].
南方医科大学学报, 2018, 38(3): 243-50.
|
| [8] |
康颖, 刘红光, 谷依学, 等. 白杨素对人胃癌SGC-7901细胞的体内抑制作用[J].
南华大学学报:医学版, 2009, 37(2): 170-2.
|
| [9] |
张强, 赵新淮. 黄酮和黄酮醇通过诱导PIG3表达引发人食管癌细胞凋亡[J].
生物化学与生物物理进展, 2009, 36(2): 213-9.
|
| [10] |
徐成坤, 阳波, 曹建国. 白杨素诱导肝癌Hep3B细胞凋亡机制研究[J].
医药导报, 2014, 33(3): 295-8.
DOI: 10.3870/yydb.2014.03.006. |
| [11] |
邱艳君, 刘飞, 曹建国, 等. 白杨素敏化rhsTRAIL诱导人肝癌Bel-7402细胞凋亡[J].
湖南师范大学学报:医学版, 2009, 6(3): 5-8.
|
| [12] |
Zhang QY, Ma S, Liu B, et al. Chrysin induces cell apoptosis via activation of the p53/Bcl-2/caspase-9 pathway in hepatocellular carcinoma cells[J].
Exp Ther Med, 2016, 12(1): 469-74.
|
| [13] |
李欣, 王剑宁, 熊习昆, 等. 白杨素提高肿瘤坏死因子-α诱导肝癌细胞HepG2凋亡能力的研究[J].
中草药, 2010, 41(11): 1828-34.
|
| [14] |
Hu KH, Li WX, Sun MY, et al. Cadmium induced apoptosis in MG63 cells by increasing ROS, activation of p38 MAPK and inhibition of ERK 1/2 pathways[J].
Cell Physiol Biochem, 2015, 36(2): 642-54.
|
| [15] |
Kim EK, Choi EJ. Pathological roles of MAPK signaling pathways in human diseases[J].
Biochimi Biophys Acta-Mol Basis Dis, 2010, 1802(4): 396-405.
DOI: 10.1016/j.bbadis.2009.12.009. |
| [16] |
Blüthgen N, Legewie S. Systems analysis of MAPK signal transduction[J].
Essays Biochem, 2008, 45: 95-107.
DOI: 10.1042/bse045095. |
| [17] |
Junttila MR, Li SP, Westermarck J. Phosphatase-mediated crosstalk between MAPK signaling pathways in the regulation of cell survival[J].
FASEB J, 2008, 22(4): 954-65.
|
| [18] |
Cuevas BD, Abell AN, Johnson GL. Role of mitogen-activated protein kinase kinase kinases in signal integration[J].
Oncogene, 2007, 26(22): 3159-71.
DOI: 10.1038/sj.onc.1210409. |
| [19] |
Su L, Chen X, Wu J, et al. Galangin inhibits proliferation of hepatocellular carcinoma cells by inducing endoplasmic reticulum stress[J].
Food Chem Toxicol, 2013, 62: 810-6.
|
| [20] |
Zheng ZP, Yan Y, Xia J, et al. A phenylacetaldehyde-flavonoid adduct, 8-C-(E-phenylethenyl)-norartocarpetin, exhibits intrinsic apoptosis and MAPK pathways-related anticancer potential on HepG2, SMMC-7721 and QGY-7703[J].
Food Chem, 2016, 197(Pt B): 1085-92.
|
| [21] |
Wang D, Lu J, Liu Y, et al. Liquiritigenin induces tumor cell death through mitogen-activated protein kinase-(MPAKs-)mediated pathway in hepatocellular carcinoma cells[J]. 2014: 965316.
http://www.ncbi.nlm.nih.gov/pubmed/24738081
|
| [22] |
Boye A, Wu C, Jiang Y, et al. Compound astragalus and salvia miltiorrhiza extracts modulate MAPK-regulated TGF-β/Smad signaling in hepatocellular carcinoma by multi-target mechanism[J].
J Ethnopharmacol, 2015, 169(169): 219-28.
|
| [23] |
Cargnello M, Roux PP. Activation and function of the MAPKs and their substrates, the MAPK-activated protein kinases[J].
Microbiol Mol Biol Rev, 2011, 75(1): 50-83.
DOI: 10.1128/MMBR.00031-10. |
| [24] |
Wada T, Penninger JM. Mitogen-activated protein kinases in apoptosis regulation[J].
Oncogene, 2004, 23(16): 2838-49.
DOI: 10.1038/sj.onc.1207556. |
| [25] |
Kitaoka S, Shiota G, Kawasaki H. Serum levels of interleukin-10, interleukin-12 and soluble interleukin-2 receptor in chronic liver disease type C[J].
Hepatogastroenterology, 2003, 50(53): 1569-74.
|
| [26] |
Song le H, Binh VQ, Duy DN, et al. Serum cytokine profiles associated with clinical presentation in Vietnamese infected with hepatitis B virus[J].
J Clin Virol, 2003, 28(1): 93-103.
DOI: 10.1016/S1386-6532(02)00271-8. |
| [27] |
Crawford ED, Wells JA. Caspase substrates and cellular remodeling[J].
Annu Rev Biochem, 2011, 80: 1055-87.
|
| [28] |
Boatright KM, Salvesen GS. Mechanisms of caspase activation[J].
Curr Opin Cell Biol, 2003, 15(6): 725-31.
|
| [29] |
Chang LF, Karin M. Mammalian MAP kinase signalling cascades[J].
Nature, 2001, 410(6824): 37-40.
DOI: 10.1038/35065000. |
| [30] |
Xia Z, Dickens M, Raingeaud J, et al. Opposing effects of ERK and JNK-p38 MAP kinases on apoptosis[J].
Science, 1995, 270(5240): 1326-31.
DOI: 10.1126/science.270.5240.1326. |
 2018, Vol. 38
2018, Vol. 38

