2. 西安交通大学医学 部生理学与病理生理学系//教育部环境与疾病相关基因重点实验室,陕西 西安 710061
2. Department of Physiology and Pathophysiology; Key Laboratory of Environment and Genes Related to Diseases, Ministry of Education, Xi'an Jiaotong University School of Medicine, Xi'an 710061, China
孤束核作为一般味觉信息传入的第一级中枢换元站[1],不仅是咸味觉信号传递过程中必要的中枢驿站,而且在咸味觉形成的过程中也发挥重要的调节作用[2]。Formenti等[3]研究发现,在大鼠第四脑室慢性长期给予醛固酮后,大鼠的钠盐摄入量显著增多,且呈现剂量依赖性。Koneru等[4]学者的实验结果同样显示慢性给予醛固酮后,可明显增加大鼠的摄钠量,通过shRNA干扰孤束核内盐皮质激素受体的表达来抑制此现象。可见,醛固酮在孤束核内对钠盐摄入发挥着显著的影响。醛固酮除具有经典的基因组作用外,还可在体内广泛地发挥,快速的非基因组作用[5]。最近,本实验室的研究已表明,双侧孤束核注入不同剂量醛固酮可引起大鼠快速摄钠行为[6]。
另一方面,杏仁中央核(CeA)是杏仁核内一个重要的亚核,参与多项生理功能的调节,与其他脑区之间存在复杂的神经投射联系[7-8]。大量的损毁实验研究和神经药理学研究表明,CeA可影响钠盐摄入行为及肾脏对钠盐的重吸收和排泄过程,进而调节体钠平衡。CeA注射谷氨酸可引起下丘脑前区AngⅡ敏感神经元放电频率加快[9]。大鼠侧脑室注射AngⅡ后,CeA内神经元c-Fos免疫阳性率显著增加[10]。电解损毁大鼠双侧CeA,可导致自发性钠盐摄入量显著减少,同时,皮下注射AngⅡ、盐皮质激素去氧皮质酮、α2-肾上腺素能受体拮抗剂育亨宾、速尿剂-呋塞米或脑室注射肾素所诱导的摄钠量也明显降低[11-12]。然而,双侧电解损毁CeA后,却对大鼠皮下注射AngⅡ或脱水引起的摄水量并不影响,表明CeA对钠盐摄入调控具有特异性。单纯损毁CeA中间内侧区后,醛固酮引发的钠欲被消除,但急性脱钠所引发的钠欲并不受影响[13-15];若损毁CeL大部分,可消除外源性醛固酮和急性脱钠诱导的钠欲,提示CeA对不同模型所诱发的钠欲调控机制具有差异性,可能通过不同的神经回路进行参与。此外,研究发现GABAA受体激动剂或5-HT受体阻断剂注入臂旁核能够显著增加脱钠大鼠钠盐摄入量[16],但若预先损毁CeA可明显减弱此效应[17]。
同时,CeA接受脑干众多核团的上行纤维投射,如孤束核、臂旁核、迷走神经背核和蓝斑等部位,同时其也发出纤维投射至孤束核、臂旁核、迷走神经背核和导水管周围灰质等。近些年研究发现,CeA是边缘前脑进行信息整合的重要结构,也是调控脑干咸味觉信息传递的重要部位,与调控摄钠行为的多个相关脑区间存在密切纤维联系,如孤束核中的醛固酮敏感神经元经臂旁核中继,投射至CeL,再由CeM发出下行投射纤维至醛固酮敏感神经元,此投射可能为CeA参与摄钠调控的一个重要神经环路,也是CeA调控钠欲的神经解剖基础。
由此可见,CeA是机体调控摄钠的重要神经结构,并与延髓水平的神经调控相互作用,但其能否影响醛固酮在孤束核水平调控钠盐摄入的非基因组作用呢?若有作用,又是如何调控?仍尚待阐明。因此,本实验在前期研究结果的基础上,电解损毁单侧或双侧CeA后,运用精细的脑内核团微量注射法,双侧孤束核微量注入50 ng/μL醛固酮后,观察短时间内(30 min)大鼠对高浓度NaC(l 0.3 mol/L)溶液摄入量的变化,探讨CeA能否影响醛固酮在孤束核水平调控钠盐摄入的非基因组作用及下行调控机制。
1 材料和方法 1.1 实验动物本研究中所用的成年雄性Sprague-Dawley大鼠,体质量为250±20 g,均由西安交通大学医学部实验动物中心提供。所有大鼠适应环境[湿度为(55±10)%、室温维持在23±2 ℃及光暗周期为12:12 h(08:00~20:00)的房间]1周,大鼠在各个普通的不锈钢吊笼里随意进食饲料,自由饮水。整个实验过程严格遵守IASP规则及西安交通大学实验动物保护委员会制定的条例,最大程度减少所用实验动物的数量并减轻实验动物的痛苦。
1.2 实验材料和仪器本实验所用药物醛固酮(Sigma);所用药品由DMSO-H2O 1:100的溶液配制,且此溶液作为对照组注射液体。双侧孤束核微量注射溶液体积为0.1 μL。Aldosterone的浓度均为50 ng/μL。所用药物的浓度是参考之前相关文献而确定[3, 18-20]。1 μL微量注射器(汉密尔顿);脑立体定位仪上(SN-2N,Narishige);同心圆损毁电极(CEA 200, MicroProbes);直流电损毁仪(53500,Ugo Basile);代谢笼为摄食-摄水-活动度分析仪(型号41800111213,UGO);小动物麻醉机(瑞沃德)。
1.3 CeA电解损毁术腹膜腔内注射10%(w/v)水合氯醛(300 mg/kg)使大鼠麻醉后,将其固定于脑立体定位仪上,使前、后囟门处于同一水平面,颅骨左右对称。酒精消毒,去除颅顶毛发及皮肤,暴露颅骨,根据大鼠脑图谱确定CeA的位置(前囟后2.5 mm,中线旁开4.2 mm,颅骨表面下7.5 mm)。用微型电钻在CeA描点处开孔至暴露硬脑膜,去除碎骨片及硬脑膜,植入双侧同心圆损毁电极,电极正、负极分别与直流电损毁仪输出端对应相接。地线接头夹于大鼠后肢上。开始实施电损毁刺激,即直流电刺激,400 μA,持续25 s,假损毁组操作时,断开刺激输出,其他操作步骤相同。而单侧CeA电损毁时,仅大鼠颅部左侧电极实施电损毁刺激,右侧电极断开刺激输出,其他操作步骤相同。大鼠双侧或单侧CeA电损毁后,恢复3~5 d,进行后续实验。
1.4 孤束核注射套管置入手术在大鼠CeA电损毁后,恢复3~5 d,进行套管置入术,具体操作如下:腹膜腔内注射10%(w/v)水合氯醛(300 mg/kg)使大鼠麻醉后,将其固定于脑立体定位仪上,使前、后囟门处于同一水平面,颅骨左右对称。酒精消毒,去除颅顶毛发及皮肤,暴露颅骨,根据大鼠脑图谱确定孤束核的位置(前囟后13.9 mm,中线旁开0.5 mm,颅骨表面下7.8 mm)。首先在顶骨内植入两颗小螺钉(直径1.2 mm,辅助套管固位之用),再用微型电钻在孤束核上方开孔,去除硬脑膜。将双头不锈钢导管由脑表面向下垂直放置孤束核上方1 mm处,暴露表面涂抹红霉素软膏,玻璃离子水门汀覆盖整颅骨,固定导管和螺钉,最后导管帽封闭套管。手术中所有手术器械常规消毒,过程无菌操作。术后连续3 d肌肉注射20万单位青霉素,预防感染。所有大鼠术后在代谢笼内恢复至少7 d才能进行实验,恢复期间同步进行双瓶测试训练。代谢笼为摄食-摄水-活动度分析仪的组件之一。
1.5 脑内微量注射双侧孤束核核团注射时使用的是1 μL微量注射器,该注射器通过聚乙烯管(PE-10)与注射内管(比导向套管长1 mm)相连。使用小动物麻醉机吸入性麻醉大鼠,用1 μL微量注射器吸取0.1 μL所需注射药品,经导向套管插入脑内,缓慢推药,持续30 s,注射后注射内管停留1 min,以最大程度减少回流。注射完毕后,套管內芯重新放回。实验正式开始前,对大鼠进行3次适应性注射,以使其习惯注射过程。
1.6 0.3 mol/L NaCl/DW双瓶选择实验及实验分组电解损毁CeA后,大鼠恢复3 d,行孤束核套管置入术后,恢复7 d,然后进行实验,恢复期间同步进行双瓶测试训练。
(1) 电解损毁大鼠双侧杏仁中央核后,双侧孤束核注入醛固酮(50 ng/μL)或对照溶液对0.3 mol/L NaCl摄入量的影响。
实验当天将大鼠分成电解损毁组(n=28)和假损毁组(n=28):每组又分为两亚组,分别注射对照溶液及醛固酮(50 ng/μL)。注射完毕后放入代谢笼,摄食-摄水-活动度分析仪自动记录实验动物30 min内的0.3 mol/L NaCl溶液的累计摄入量(mL)。测试期间,大鼠禁食。
(2) 电解损毁大鼠单侧杏仁中央核后,双侧孤束核注入醛固酮(50 ng/μL)或对照溶液对0.3 mol/L NaCl摄入量的影响。
实验当天将大鼠分成电解损毁组(n=28)和假损毁组(n=26):每组又分为两亚组,分别注射对照溶液及醛固酮(50 ng/μL)。注射完毕后放入代谢笼,摄食-摄水-活动度分析仪自动记录实验动物30 min内的0.3 mol/L NaCl溶液的累计摄入量(mL)。测试期间,大鼠禁食。
1.7 组织学鉴定实验完成后,再经微注射套管,于同一脑区位置,注入2%膀胺天蓝溶液0.2 μL,标记位点。然后,大鼠腹腔注射高剂量10%水合氯醛进行深度麻醉,将其置于仰卧位,剪开双侧肋骨,去除胸骨,暴露心脏,灌流针顺行插入升主动脉,然后依次用100 mL生理盐水和4%的多聚甲醛溶液500 mL进行灌注。结束后,打开颅腔取出完整脑组织,放入4%的多聚甲醛溶液进行3~7 d的后固定,接着浸入4 ℃,20%蔗糖溶液脱水使之沉底。然后进行冰冻切片,冠状切片,片厚40 μm,PBS漂洗后,裱于载玻片上,在光学显微镜下观察结果,寻找膀胺天蓝染色点,确定实验微量注射点的位置,参考大鼠脑立体定位图谱进行组织学再建。
尼氏染色:选取CeA脑区的冠状切片,水化后,切片浸入0.1%焦油紫染液中染色,时间为30 min,分色,通过镜下观察控制染色时间,以观察到清晰的尼氏小体为准;蒸馏水冲洗后,分别在85%乙醇、95%乙醇、100%乙醇中依次进行脱色,时间为1 min,二甲苯透明2次,每次时间5 min;最后滴加适量中性树胶,覆盖盖玻片,进行封片。镜下观察各组CeA电损毁具体部位及范围。
1.8 数据分析数据统一以均数±标准差来表示,结果使用SPSS 13.0软件进行统计分析。统计方法选用的为双因素重复测量方差分析,对时间和处理的主效应及其交互效应进行分析,进一步多重比较采用LSD检验方法。P<0.05为差异具有统计学意义。
2 结果 2.1 组织学定位分析本实验中共使用110只大鼠,组织学定位显示(图 1),其中80只套管放置位置准确,且多数注射位置位于孤束核的中间部位,此些大鼠的数据将用于分析所用药物作用于孤束核对钠盐摄入的影响。而组织学显示定位不准确的大鼠数据与对照组相比,对钠盐及水摄入的影响并无明显差异,因此其数据未纳入统计学分析。
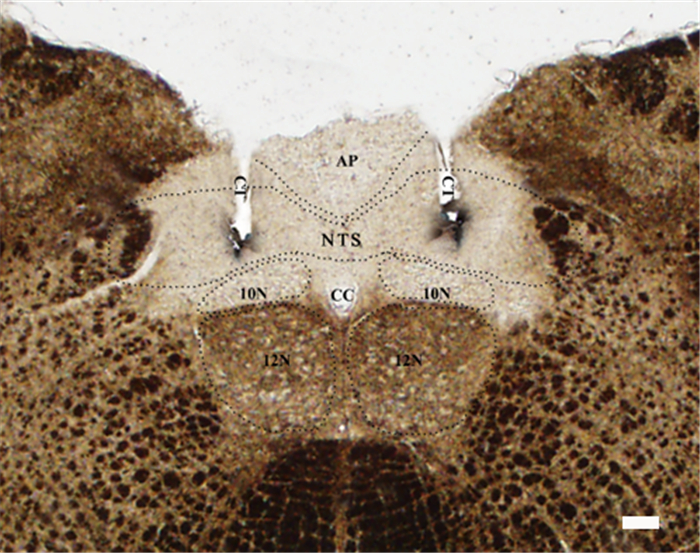
|
图 1 双侧孤束核注射位点的代表性大鼠脑片显微照片 Figure 1 Bilateral microinjection sites in the nucleus of the solitary tract (NTS), highlighted by deposits of Pontamine Sky Blue dye. AP: Area postrema; CC: Central canal; CT: Cannula tract; 10N: Dorsal motor nucleus of the vagus; 12N: Hypoglossal nucleus. Scale bar=200 μm. |
典型CeA双侧电解损毁示意图如图 2(A)所示。图 2(B)所示的为假损毁大鼠脑冠状断层片中,杏仁核复合物内不同核团的位置。双侧CeA损毁部位位于视束尖端的背外侧;杏仁基底外侧核的背内侧及杏仁基底内侧核和杏仁内侧核的背侧。85%以上的吻尾向CeA被电解损毁所破坏。
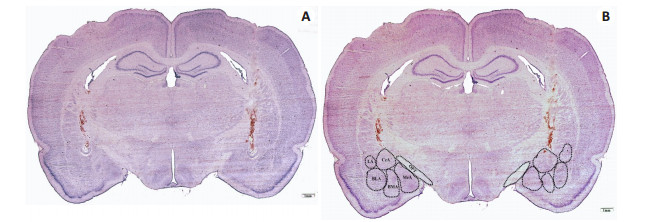
|
图 2 双侧电解损毁杏仁中央核的代表性大鼠冠状断层脑片及杏仁复合体不同核团位置的显微照片 Figure 2 Coronal sections of a sham-operated rat brain showing the typical sites of bilateral electrolytic lesions of the CeA (A) and the position of the different nuclei of the amygdaloid complex (B). BLA: Basolateral amygdala; BMA: Basomedial amygdala; CeA: Central nucleus of the amygdala; LA: Lateral amygdala; MeA: Medial amygdala; OPT: Optic tract. |
在假损毁大鼠双侧孤束核注入醛固酮(50 ng/μL)可诱导0.3 mol/L NaCl摄入量明显增加;电解损毁大鼠双侧CeA可消除双侧孤束核注入醛固酮诱发的0.3 mol/L NaCl摄入增加量(图 3)。
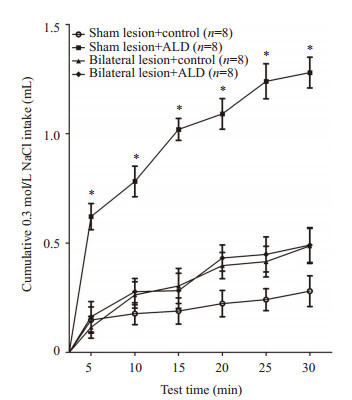
|
图 3 双侧杏仁中央核电解损毁后,大鼠对0.3 mol/L NaCl累积摄入量的变化 Figure 3 Cumulative 0.3 mol/L NaCl intake by rats with bilateral sham or electrolytic lesions of the CeA after bilateral microinjections of aldosterone (50 ng/μL) or vehicle solution into the NTS. *P < 0.05 vs vehicle group. |
从总共测试的110只动物中,16只双侧假损毁大鼠和17只单侧假损毁双侧正确注射入孤束核内,5只假损毁大鼠注射位置位于孤束核外,20只双侧正确损毁CeA大鼠和17只单侧损毁CeA大鼠双侧正确注射至孤束核内。所有其他动物都有一次或两次孤束核外的注射,连同一侧或两侧的损毁位置在CeA之外或在脑区其它部位无明显损毁,这些结果均不被分析。
电解损毁大鼠单侧CeA可减少双侧孤束核注入醛固酮(50 ng/μL)所诱发的0.3 mol/L NaCl摄入增加量,与对照组相比,在前15 min内单侧损毁组摄钠量有统计学差异,而后15 min内已无显著差异(P>0.05,图 4)。
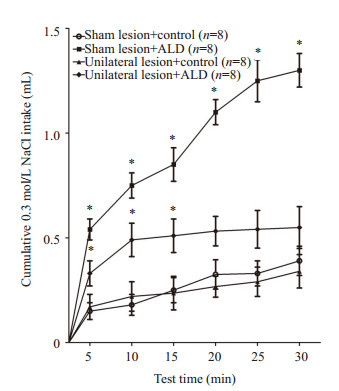
|
图 4 单侧杏仁中央核电解损毁后,大鼠对0.3 mol/L NaCl累积摄入量的变化 Figure 4 Cumulative NaCl intake by rats with unilateral sham or electrolytic lesions of the CeA after bilateral injections of aldosterone (50 ng/μL) or vehicle solution into the NTS. *P < 0.05 vs vehicle group. |
在假电解损毁的大鼠中,注射醛固酮(50 ng/μL)至双侧孤束核部位之外(错位注射),并不能引起0.3 mol/L NaCl摄入量的快速增加[F(1, 6)=2.4;P>0.05]。
3 讨论本结果表明电解损毁大鼠双侧CeA可以消除双侧孤束核给予醛固酮所引起的快速钠盐摄入增加作用,提示CeA内存在易化机制,且此机制对醛固酮在孤束核水平引起大鼠快速钠盐摄入增加的作用中是不可或缺的。
杏仁核属于前脑边缘系统,其位于大脑颞叶背内侧,侧脑室下角尖端,海马旁回沟深部,由许多大小不等的核团组成,各亚区存在独特的联系特征[21-26]。CeA是杏仁核组分之一,主要接受脑干许多核团的上行纤维投射,同时其发出纤维投射到达迷走神经背核、孤束核、导水管周围灰质和脑桥网状核等。近年来研究发现CeA与钠盐摄入调控的多个相关的脑区之间存在着密切的纤维联系,如孤束核中的HSD2神经元[27]经臂旁核中继,上行投射至CeL,再由CeM向下发出纤维直接投射到HSD2神经元,这可能是CeA参与对钠盐摄入调控的一个重要的神经环路[28]。此外,CeA还与奖赏系统核团存在纤维联系,并且向神经内分泌核团如室旁核发出纤维投射。由于CeA与传递味觉和内脏信息的脑干核团之间存在双向的纤维联系,还与前脑奖赏神经环路、室周器官存在密切的联系,因此可推定CeA在体钠稳态的调控中扮演着重要的角色。侧脑室注射AngⅡ显着增强大鼠CeA中的c-Fos免疫反应性[29]。CeA内注射谷氨酸引起下丘脑前区AngⅡ敏感神经元放电频率增加。脑室注射肾素或皮下注射呋塞米再辅以24 h无钠饮食所诱导的钠盐摄入也因电解毁损双侧CeA而减少。然而,毁损CeA不影响大鼠皮下注射AngⅡ或细胞脱水诱导的水的摄入量,表明CeA的损毁特异性地降低钠盐摄入[30]。
本结果发现,单侧损毁CeA亦能减少醛固酮注入双侧孤束核所引起的钠盐摄入增加量,但是单侧损毁CeA与双侧损毁CeA对孤束核水平醛固酮引发钠盐摄入增加作用的影响有所不同。双侧损毁CeA是完全消除醛固酮引起的钠盐摄入增加,而单侧损毁CeA仅是部分减少醛固酮引起的钠盐摄入增加量。单侧损毁CeA的大鼠给予醛固酮至孤束核后,可在整个测试过程中,缓慢的引起0.3 mol/L NaCL摄入的增加,主要是在测试的前半段时间内。
CeA内调控钠盐摄入的易化机制已被前期多个研究结果所证实。电解毁损双侧CeA,大鼠自发的钠盐摄入则明显减少,并降低皮下注射盐皮质激素去氧皮质酮、α2-肾上腺素能受体拮抗剂或AngⅡ所诱导的钠盐摄入;这些前期的研究提示多种不同的易化刺激如AngⅡ、盐皮质激素等所诱发的钠欲依赖于CeA的易化机制。本研究结果也表明CeA内的易化机制对于醛固酮在孤束核水平引起的钠盐摄入也是必须的。但是,与之前的研究相比,本研究结果显示损毁双侧CeA对测试期间的钠盐摄入并无显著影响。此种差异的原因并不十分清楚,推测可能是本研究观测的是短时间内(30 min)的钠盐摄入量,并不是长期的钠盐摄入量。此外,多数以前研究观测的是0.5 mol/L NaCl的摄入量,与本研究中所采用的0.3 mol/L NaCl相比,具有更强的厌恶性。总之,本实验结果表明CeA对醛固酮在孤束核水平通过非基因组作用调控钠盐摄入的过程是必须的。CeA内存在对醛固酮在孤束核水平调控钠盐摄入的下行调控机制,且完整的CeA对于醛固酮正常发挥快速调控钠盐摄入的非基因组作用是必须的。
| [1] |
Gamboa-Esteves F, Mcwilliam PN, Batten TF. Substance P(NK1) and somatostatin(sst2A)receptor immunoreactivity in NTS-projecting rat dorsal Horn neurones activated by nociceptive afferent input[J].
J Chem Neuroanat, 2004, 27(4): 251-66.
DOI: 10.1016/j.jchemneu.2004.04.001. |
| [2] |
Imbe H, Dubner R, Ren K. Masseteric inflammation-induced Fos protein expression in the trigeminal interpolaris/caudalis transition zone:contribution of somatosensory-vagal-adrenal integration[J].
Brain Res, 1999, 845(2): 165-75.
DOI: 10.1016/S0006-8993(99)01913-7. |
| [3] |
Formenti S, Bassi M, Nakamura NB, et al. Hindbrain mineralocorticoid mechanisms on Sodium appetite[J].
Am J Physiol Regul Integr Comp Physiol, 2013, 304(3): R252-9.
DOI: 10.1152/ajpregu.00385.2011. |
| [4] |
Koneru B, Bathina CS, Cherry BH, et al. Mineralocorticoid receptor in the NTS stimulates saline intake during fourth ventricular infusions of aldosterone[J].
Am J Physiol Regul Integr Comp Physiol, 2014, 306(1): R61-6.
DOI: 10.1152/ajpregu.00434.2013. |
| [5] |
Williams JS. Evolving research in nongenomic actions of aldosterone[J].
Curr Opin Endocrinol Diabetes Obes, 2013, 20(3): 198-203.
DOI: 10.1097/MED.0b013e328360c200. |
| [6] |
Qiao H, Hu B, Zhou H, et al. Aldosterone induces rapid Sodium intake by a nongenomic mechanism in the nucleus tractus solitarius[J].
Sci Rep, 2016, 6: 38631.
DOI: 10.1038/srep38631. |
| [7] |
Sah P, Faber ES, Lopez De Armentia M, et al. The amygdaloid complex: anatomy and physiology[J].
Physiol Rev, 2003, 83(3): 803-34.
DOI: 10.1152/physrev.00002.2003. |
| [8] |
Geerling JC, Loewy AD. Central regulation of Sodium appetite[J].
Exp Physiol, 2008, 93(2): 177-209.
DOI: 10.1113/expphysiol.2007.039891. |
| [9] |
Hagiwara Y, Nishigori Y, Fukumori R, et al. The medial amygdaloid area is involved in activation of angiotensin Ⅱ-sensitive neurons in the anterior hypothalamic area[J].
Brain Res, 2005, 1033(2): 128-34.
DOI: 10.1016/j.brainres.2004.11.015. |
| [10] |
Asami R, Ono K, Nakanishi O, et al. Distinct mechanisms underlie the regulation of body fluid balance by neurokinin B and angiotensin Ⅱ in the rat brain[J].
Brain Res, 2011, 1383: 179-86.
DOI: 10.1016/j.brainres.2011.01.072. |
| [11] |
Zardetto-Smith AM, Beltz TG, Johnson AK. Role of the central nucleus of the amygdala and bed nucleus of the stria terminalis in experimentally-induced salt appetite[J].
Brain Res, 1994, 645(1/2): 123-34.
|
| [12] |
Galaverna O, De Luca LA, Jr, et al. Deficits in NaCl ingestion after damage to the central nucleus of the amygdala in the rat[J].
Brain Res Bull, 1992, 28(1): 89-98.
DOI: 10.1016/0361-9230(92)90234-O. |
| [13] |
Nitabach MN, Schulkin J, Epstein AN. The medial amygdala is part of a mineralocorticoid-sensitive circuit controlling NaCl intake in the rat[J].
Behav Brain Res, 1989, 35(2): 127-34.
DOI: 10.1016/S0166-4328(89)80113-5. |
| [14] |
Schulkin J, Marini J, Epstein AN. A role for the medial region of the amygdala in mineralocorticoid-induced salt hunger[J].
Behav Neurosci, 1989, 103(1): 179-85.
|
| [15] |
Zhang DM, Epstein AN, Schulkin J. Medial region of the amygdala: involvement in adrenal-steroid-induced salt appetite[J].
Brain Res, 1993, 600(1): 20-6.
DOI: 10.1016/0006-8993(93)90396-5. |
| [16] |
Andrade-Franzé GM, Andrade CA, De Luca LA, et al. Lateral parabrachial nucleus and central amygdala in the control of Sodium intake[J].
Neuroscience, 2010, 165(3): 633-41.
DOI: 10.1016/j.neuroscience.2009.11.011. |
| [17] |
Andrade-Franze GM, Andrade CA, De Luca LA Jr, et al. Lesions in the central amygdala impair sodium intake induced by the blockade of the lateral parabrachial nucleus[J].
Brain Res, 2010, 1332: 57-64.
DOI: 10.1016/j.brainres.2010.03.055. |
| [18] |
Brailoiu GC, Benamar K, Arterburn JB, et al. Aldosterone increases cardiac vagal tone via G protein-coupled oestrogen receptor activation[J].
J Physiol, 2013, 591(17, SI): 4223-35.
DOI: 10.1113/jphysiol.2013.257204. |
| [19] |
Francis J, Weiss RM, Wei SG, et al. Central mineralocorticoid receptor blockade improves volume regulation and reduces sympathetic drive in heart failure[J].
Am J Physiol Heart Circ Physiol, 2001, 281(5): H2241-51.
DOI: 10.1152/ajpheart.2001.281.5.H2241. |
| [20] |
Yau JL, Noble J, Seckl JR. Continuous blockade of brain mineralocorticoid receptors impairs spatial learning in rats[J].
Neurosci Lett, 1999, 277(1): 45-8.
DOI: 10.1016/S0304-3940(99)00858-7. |
| [21] |
Davis M, Whalen PJ. The amygdala: vigilance and emotion[J].
Mol Psychiatry, 2001, 6(1): 13-34.
DOI: 10.1038/sj.mp.4000812. |
| [22] |
Pitkanen A, Savander V, Ledoux JE. Organization of intraamygdaloid circuitries in the rat: an emerging framework for understanding functions of the amygdala[J].
Trends Neurosci, 1997, 20(11): 517-23.
DOI: 10.1016/S0166-2236(97)01125-9. |
| [23] |
Swanson LW, Petrovich GD. What is the amygdala?[J].
Trends Neurosci, 1998, 21(8): 323-31.
DOI: 10.1016/S0166-2236(98)01265-X. |
| [24] |
Mcdonald AJ. Cytoarchitecture of the central amygdaloid nucleus of the rat[J].
J of Comp Neurol, 1982, 208(4): 401-18.
DOI: 10.1002/(ISSN)1096-9861. |
| [25] |
Jolkkonen E, Pitkanen A. Intrinsic connections of the rat amygdaloid complex: Projections originating in the central nucleus[J].
J Comp Neurol, 1998, 395(1): 53-72.
|
| [26] |
Harding AJ, Stimson E, Henderson JM, et al. Clinical correlates of selective pathology in the amygdala of patients with Parkinson's disease[J].
Brain, 2002, 125(Pt 11): 2431-45.
|
| [27] |
Geerling JC, Engeland WC, Kawata M, et al. Aldosterone target neurons in the nucleus tractus solitarius drive Sodium appetite[J].
J Neurosci, 2006, 26(2): 411-7.
DOI: 10.1523/JNEUROSCI.3115-05.2006. |
| [28] |
Johnson AK, Thunhorst RL. The neuroendocrinology of thirst and salt appetite: Visceral sensory signals and mechanisms of central integration[J].
Front Neuroendocrinol, 1997, 18(3): 292-353.
DOI: 10.1006/frne.1997.0153. |
| [29] |
De Lucca JW, Franci CR. Angiotensinergic pathway through the median preoptic nucleus in the control of oxytocin secretion and water and Sodium intake[J].
Brain Res, 2004, 1014(1/2): 236-43.
|
| [30] |
Norgren R, Hajnal A, Mungarndee SS. Gustatory reward and the nucleus accumbens[J].
Physiol Behav, 2006, 89(4): 531-5.
DOI: 10.1016/j.physbeh.2006.05.024. |
 2018, Vol. 38
2018, Vol. 38

