2. 南方医科大学药学院 广东省新药筛选重点实验室,广东 广州 510515;
3. 南方医科大学药学院 抗肿瘤药物药理学课题组,广东 广州 510515
2. Guangdong Provincial Key Laboratory of New Drug Screening, Southern Medical University, Guangzhou 510515, China;
3. Cancer Therapeutics & Drug Discovery Center, School of Pharmaceutical Sciences, Southern Medical University, Guangzhou 510515, China
PLGA是一类应用广泛的生物降解性合成高分子材料,已被美国FDA批准作为可注射微球的药用辅料,如已上市的多肽微球制剂TrelstarTM就是以PLGA为囊材制得,缓释时间可长达一个月[1-4]。PLGA的生物降解性能高度可调且变化范围大[5-6],然而,其降解产物(乙醇酸、丙醇酸)使微球的微环境酸化(约pH 2),进而导致微球中所载蛋白类药物变性失活[7-9]。
为了降低PLGA微球中所载蛋白类药物受酸性微环境的影响,提高蛋白药物在贮存与给药过程中的稳定性与生物利用度,研究一种低细胞毒性、生物相容性好的阳离子聚合物作为PLGA微球微环境酸化的缓冲材料是很有必要的[10-11]。由低相对分子质量PEI1800与PEG2000过酰胺键相互交联而成的水溶性交联物PEIco- PEG被报道具有细胞毒性小的优点[12]。然而直至目前,PEI-co-PEG与PLGA组成的两亲性嵌段共聚物及其应用方面的研究却未见报道。本研究拟设计并合成了一种生物可降解及低细胞毒性的两亲性嵌段共聚物PLGA-b-(PEI-co-PEG),我们期望PLGA-b-(PEI-co- PEG)通过在水中发生自组装形成电正性胶束,并在pH 7.4条件下PLGA-b-(PEI-co-PEG)胶束与带负电荷的胰岛素以静电作用形成纳米尺寸的胶束/胰岛素复合物。本文对电正性PLGA-b-(PEI-co-PEG)胶束及胶束/胰岛素复合物进行较全面的表征,为保护PLGA微球中蛋白药物免受酸性微环境的破坏提供一定的研究基础。
1 材料和方法 1.1 材料猪胰岛素(26.9 IU/mg)购自徐州万邦金桥制药有限公司;D,L-丙交酯购自上海笛柏生物科技有限公司;乙交酯、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC·HCl)购自广州市齐云生物技术有限公司;胆酸、辛酸亚硒、PEI1800与PEG2000、4-二甲氨基吡啶(DAMP)、氘代氯仿(CDCl3)、异硫氰酸荧光素(FITC)均购自上海阿拉丁生化科技股份有限公司;1-羟基苯并三唑一水物(HOBt·H2O)、无水四氢呋喃、丁二酸酐均购自国药集团化学试剂有限公司;氘代二甲基亚砜(d6-DMSO)、重水(D2O)购自美国剑桥同位素实验室;人乳腺癌细胞株MCF-7购于南京科佰生物科技有限公司;四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)均购自SIGMA公司;RPMI 1640干粉、胎牛血清、DMEM培养基、胰蛋白酶均购自美国Gibco公司;其他试剂均为分析纯。
1.2 PLGA-b-(PEI-co-PEG)的合成与表征 1.2.1 PLGA(50:50)的合成称取D,L-丙交酯(2.88 g,20 mmol)、乙交酯(2.32 g,20 mmol),引发剂水(10 mg,0.56 mmol),辛酸亚硒(16 mg,0.1%mol单体的量)于一圆底烧瓶中,3次抽真空,通氮气,150 ℃,反应24 h。反应结束后,冷却至室温,用二氯甲烷将产物溶解,在过量冷甲醇中沉淀,纯化[13-14]。将粘稠物倒在锡箔纸上,40 ℃真空干燥箱中真空干燥24 h,得白色块状固体产物4.45 g。
1.2.2 合成HOOC-PEG-COOH称取PEG(2.00 g,1.00 mmol),丁二酸酐(0.4 g,4.00 mmol),DMAP(0.20 g,1.63 mmol),三乙胺(0.20 g,1.97 mmol),加入20 mL无水四氢呋喃,抽真空,通氮气,室温搅拌24 h[15]。反应结束后,旋转蒸发去除反应溶剂,将剩余浓缩液溶于少量氯仿中,过滤除去不溶性沉淀,滤液在过量冷乙醚中沉淀,抽滤,纯化,室温真空干燥48 h,得白色粉末状固体1.83 g。
1.2.3 水溶性聚乙二醇-聚乙烯亚胺交联物(PEI-co-PEG)的合成基于文献[12]合成PEI与PEG的交联共聚物PEI-co-PEG。称取羧基化PEG(1.00 g,0.46 mmol),HOBt·H2O(0.30 g,1.96 mmol),过量的EDC·HCl(0.40 g,2.08 mmol),加入二氯甲烷50 mL,再加入三乙胺200 μL,室温搅拌1 h,得羧基化PEG的活性中间体。将上述PEG活性中间体溶液转移至恒压滴液漏斗中,滴入完全溶解于50 mL二氯甲烷的PEI(1.20 g,0.67 mmol)溶液中,滴加速度:约滴/4s,约2 h滴加完毕,室温继续搅拌12 h。反应结束后,室温减压旋转蒸发去除有机溶剂,所得浓缩产物加入30 mL双蒸馏水,室温继续减压旋转蒸发去除残留二氯甲烷,所得淡黄色水溶液通过蒸馏水室温透析24 h(透析袋截留相对分子质量:8000~ 14 000),然后将其冷冻干燥24 h,得淡黄色疏松状固体产物0.78 g。
1.2.4 合成PLGA-b-(PEI-co-PEG)称取PLGA(0.40 g,约0.05 mmol),HOBt·H2O(0.03 g,0.20 mmol),过量的EDC·HCl(0.04 g,0.21 mmol),溶解于10 mLDMSO,再加入50 μL三乙胺,室温搅拌1 h后,使PLGA末端羧基活化,再使用恒压滴液漏斗将其逐滴加入到PEI-co- PEG的DMSO溶液中(5 mL,80 mg/mL),室温搅拌24 h后,粗产物通过蒸馏水透析48 h(透析袋截留相对分子质量:25000),然后冷冻干燥24 h,得淡黄色疏松状粉末0.45 g。
1.2.5 聚合物的表征聚合物的结构由核磁共振氢谱(1H-NMR,400 MHz,Bruker)进行表征;PLGA与PEIco- PEG的分子量由凝胶渗透色谱(GPC,waters 5510,USA)测定,以一系列单分散的聚苯乙烯与聚乙二醇分别作为标准品,以四氢呋喃或Na2SO4(0.1 mol/L)水溶液分别作为流动相,流速均为0.5 mL/min。根据PEIco- PEG在37 ℃PBS中孵育不同时间的相对分子质量变化情况,评估其生物降解性[16],取PEI-co-PEG(500 mg)溶解于2 mL PBS(pH 7.4,10 mmol/L)中,于37 ℃水浴恒温震荡,在一定的时间间隔后将样品冷冻干燥,通过GPC法测定其相对分子质量分布。
1.3 细胞毒性将MCF-7单细胞悬液接种于96孔板,1×104/孔,每孔加培养基总量100 μL(培养基:RPMI 1640细胞培养基),于37 ℃,5% CO2培养箱中预培养24 h。精密称取PLGA-b-(PEI-co-PEG)与PEI-co-PEG适量,加入DMSO完全溶解,使其浓度均为20 mg/mL,分别加培养基稀释成浓度梯度范围:25~1000 μg/mL。每孔加以上梯度浓度的样品100 μL,继续培养24 h后加MTT处理,每孔加5 mg/mLMTT溶液10 μL(避光操作),继续孵育4 h。然后吸尽孔内培养液,加入DMSO(200 μL/孔),将平板置于微孔板振荡器上室温振荡10 min,使结晶物(甲臜)溶解。通过酶标仪(iMark, BIO-RAD, USA)检测各孔A570,计算细胞存活率及IC50值。细胞存活率的公式如下[11]:
| $细胞存活率\left( \% \right) = \frac{{{A_{{\rm{treat}}}} - {A_{{\rm{blank}}}}}}{{{A_{{\rm{control}}}} - {A_{{\rm{blank}}}}}} \times 100{\rm{\% }}$ |
实验组A:加入不同梯度浓度样品干预的细胞孔A570;对照组A570:不加样品干预,其他条件与实验组一致的细胞孔A570;空白组A570:无细胞与样品,只加与实验组一致的培养液、MTT与DMSO的培养孔A570。
1.4 PLGA-b-(PEI-co-PEG)电正性胶束的制备与表征采用标准透析法制备PLGA-b-(PEI-co-PEG)电正性胶束。称取0.40 g PLGA-b-(PEI-co-PEG),加入10mL DMSO完全溶解,再加入10 mL蒸馏水,溶液随即呈现蓝色乳光。将上述溶液转移至透析袋(截留相对分子质量:25000)中,通过蒸馏水透析48 h。透析结束后,用0.22 μm微孔滤膜滤过,即得PLGA-b-(PEI-co-PEG)胶束,所得胶束贮藏于4 ℃冰箱或冷冻干燥,备用。
采用简单混合法,制备胶束/胰岛素复合物。取PLGA-b-(PEI-co-PEG)胶束(1 mL,5 mg/mL)于安瓿瓶中,加入5 mg/mL胰岛素溶液(PBS 7.4,25 mmol/L)适量,使胶束与胰岛素的质量比为6:1,用移液枪吹打均匀,室温静置30 min。根据上述方法,在不同pH(3~8)条件下制备胶束/胰岛素复合物(质量比为6),研究pH值对胶束/胰岛素复合物形成的影响。
使用马尔文激光粒度分析仪(Malvern-3000 Hs,UK),通过动态光散射技术测定PLGA-b-(PEI-co- PEG)胶束的粒径分布,通过激光多普勒微量电泳法测定其Zeta电位。光源:He-Ne激光器(633 nm),散射角:90°,检测温度:25 ℃。胶束及胶束/胰岛素复合物的形貌由透射电子显微镜(Hitachi, H-7650, Japan)进行表征,取一滴样品滴于碳涂层铜网上,用滤纸从液珠边缘吸去多余的液体,滴上3%磷钨酸水溶液负染2 min,然后用滤纸吸去染液,室温自然风干后进行观察。
1.5 盐离子稳定性制备FITC标记的胰岛素(FITC-胰岛素)用于研究胶束/胰岛素复合物在不同浓度盐离子溶液中的稳定性。首先,将FITC的丙酮溶液(5 mg/mL)逐滴加入到含0.2 mol/L EDTA的胰岛素溶液中(10 mg/mL, PBS 7.4),室温避光条件下搅拌过夜[17]。然后加入适量的盐酸(0.1 mol/L)使FITC-胰岛素沉淀,同时去除游离的FITC。FITC-胰岛素通过PBS溶液(pH 7.0, 10 mmol/L)透析4 d(截留相对分子质量:3500)进行纯化。向胶束/FITC-胰岛素复合物(质量比为2)中加入不同量的NaCl溶液(6 mol/L),使用荧光光谱仪(Shimadzu,RF-5301PC,Japan)测定其在不同浓度盐离子溶液中的荧光强度,激发波长:495 nm[18]。并采用荧光显微镜观察PLGA-b-(PEI-co-PEG)胶束对FITC-胰岛素的荧光猝灭过程。
2 结果 2.1 两亲性嵌段共聚物PLGA-b-(PEI-co-PEG)的合成与表征采用开环聚合法合成PLGA(图 1A),根据1H-NMR可确定其结构(图 2A),通过乳酸与羟基乙酸所属氢的积分比计算得二者的比例(LA/GA)为50:50.5,这与理论值50:50十分接近,1H-NMR(CDCl3):a(δ=1.57 ppm,LA:-CH3),b(δ=5.22 ppm,LA:-CH-),c(δ=4.82 ppm,GA:-CH2-)。通过GPC法测得其相对重均分子质量为7865(图 2D)。
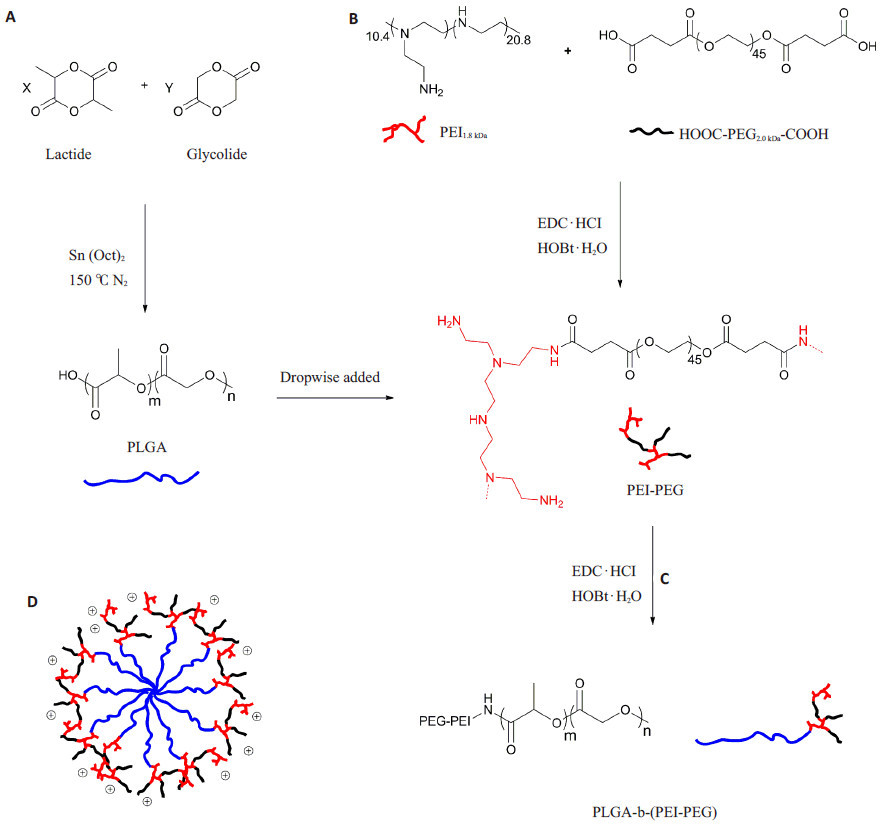
|
图 1 端羧基PLGA(A)、PEI-co-PEG(B)及PLGA-b-(PEI-co-PEG)(C)的合成步骤;PLGA-b-(PEI-co-PEG)电正性胶束的示意图(D) Figure 1 Synthesis of carboxyl-terminated PLGA (A), PEI-co-PEG (B) and PLGA-b-(PEI-co-PEG) (C) and schematic illustration of cationic PLGA-b-(PEI-co-PEG) micelles (D). |
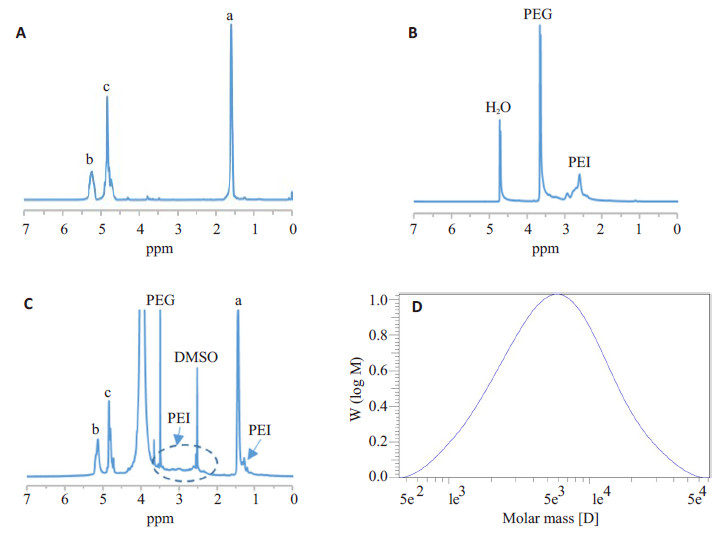
|
图 2 PLGA(A)、PEI-co-PEG(B)及PLGA-b-(PEI-co-PEG)(C)的1H-NMR图;通过GPC法测得的PLGA相对分子质量分布图(D) Figure 2 Typical 1H-NMR spectrum of PLGA (A), PEI-co-PEG (B) and PLGA-b-(PEI-co-PEG) (C) and molecularweight distribution of PLGAmeasured by GPC (D). |
采用脱水缩合法,使PEI与PEG通过生物可降解的酰胺键相互交联,从而合成了亲水性树枝状共聚物PEIco- PEG(图 1B)。由1H-NMR(D2O)中分别属于PEI(δ= 2.23~3.00 ppm,-CH2CH2NH-)与PEG的质子信号峰(δ= 3.63 ppm,-CH2CH2O-)积分值之比计算得PEI与PEG的质量比(PEI/PEG)为83.6%(图 2B)。如图 3A所示,通过GPC法测得其重均相对分子质量为9706。PEIco- PEG在37 ℃ PBS中的降解半衰期约为48 h(相对分子质量为4865),表明PEI-co-PEG具有良好的降解性(图 3B~D)。
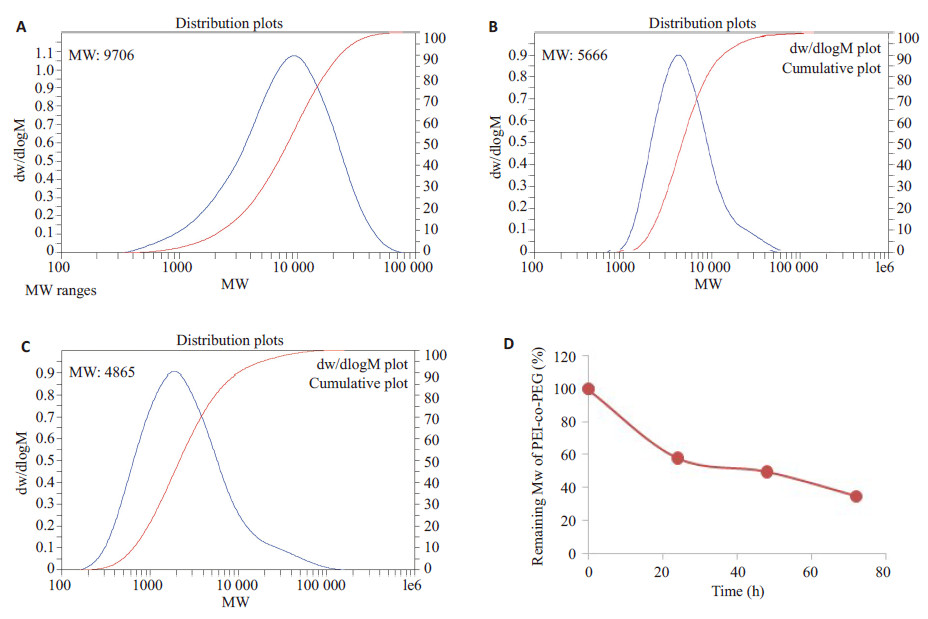
|
图 3 PEI-co-PEG的相对分子质量分布图(A)及其在37 ℃ PBS中的孵育24 h(B),48 h(C)后的相对分子质量分布;PEI-co-PEG在37 ℃ PBS中的降解过程(D) Figure 3 Molecular weight distribution of PEI-co-PEG (A) and its changes after incubation in PBS at 37 ℃ for 24 h (B) and 48 h (C) and degradation of PEI-co-PEG in PBS at 37 ℃(D). |
疏水性的PLGA与水溶性的PEI-co-PEG通过进一步脱水缩合,形成树枝状两亲性嵌段共聚物PLGA-b- (PEI-co-PEG)(图 1C)。1H-NMR(d6-DMSO):a(δ=1.45 ppm,LA:-CH3),b(δ=5.15 ppm,LA:-CH-),c(δ=4.82 ppm,GA:-CH2-),d(δ=3.48 ppm,PEG:-CH2CH2O-),PEI(1.28 ppm;2.29~3.61 ppm)。3.80~4.05 ppm处的信号峰很可能为冷冻干燥不完全导致的残留水峰,但不影响PLGA-b-(PEI-co-PEG)特征峰的辨认(图 2C)。
2.2 细胞毒性不同浓度的PLGA-b-(PEI-co-PEG)与PEI-co- PEG对MCF-7的细胞毒性如图 4所示。使用SPSS 22.0软件probit回归法计算得PLGA-b-(PEI-co-PEG)与PEI-co-PEG对MCF-7的IC50值分别为1375.7 μg/mL与425.1 μg/mL。通过单向方差分析(one-way ANOVA),同一浓度条件下,PLGA-b-(PEI-co-PEG)对MCF-7的细胞毒性均显著性低于PEI-co-PEG(P < 0.05)。
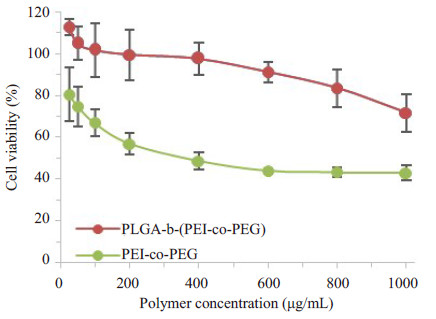
|
图 4 PLGA-b-(PEI-co-PEG)与PEI-co-PEG对MCF-7的细胞毒性 Figure 4 Cytotoxicity of PLGA-b- (PEI-co-PEG) and PEIco-PEG in MCF-7 cells (Mean±SD, n=4). |
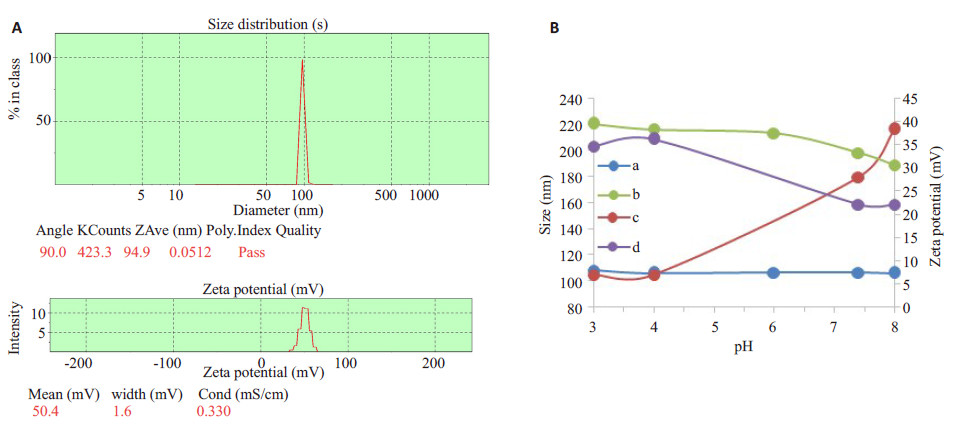
如图 5A所示,通过马尔文粒度仪测得PLGA-b-(PEI-co-PEG)胶束在蒸馏水中(pH约6.5)的粒径为99.5±3.83 nm(PDI:0.12±0.06),Zeta电位为52.9±2.38 mV(平均值±标准偏差,n=3),结果表明:PLGA-b-(PEIco- PEG)自组装胶束的粒径较均匀,并呈现较高的电正性。胶束/胰岛素复合物(质量比为6)在不同pH条件下的粒径分布与Zeta电位如图 5B所示,结果表明:pH低于胰岛素的等电点时(5.3~5.4),胶束的粒径基本保持不变;而当pH大于胰岛素等电点时,胰岛素显负电,胶束与胰岛素通过静电作用结合,粒径显著增大。在pH3~8范围内,空白胶束的Zeta电位呈现降低的趋势,主要由于亲水嵌段中的PEI在不同pH条件下具有不同的质子化程度,在低pH条件下,质子化程度较高,故显示较高的电正性。胶束与胶束/胰岛素复合物的形貌特征由透射电镜进行表征(图 6),胶束与胶束/胰岛素复合物(WR=6)在透射电镜下均呈较均匀的球形,其粒径分别约为50 nm与90 nm。通过透射电镜所测得胶束与胶束/胰岛素复合物的粒径明显小于由动态光散射法所测得的粒径,这可能由于胶束与胶束/胰岛素复合物在自然风干的过程中有皱缩的趋势。
|
图 5 PLGA-b-(PEI-co-PEG)胶束在DDW中的粒径与Zeta电位(A);不同pH条件下PLGA-b-(PEI-co-PEG)胶束与胶束/胰岛素复合物(WR=6)的粒径(a,b)与Zeta电位(c,d)(B) Figure 5 Particle size and Zeta potential of PLGA-b-(PEI-co-PEG) micelles and micelle/insulin complexes. A: Particle size and Zeta potential of PLGA-b-(PEI-co-PEG) micelles inDDW; B: Particle size (a, b) and Zeta potential (c, d) of PLGA-b-(PEI-co-PEG) micelles and micelle/insulin complexes (WR=6) under different pH conditions (B). |

|
图 6 PLGA-b-(PEI-co-PEG)胶束(A)与胶束/胰岛素复合物(WR=6)的透射电镜图(B) Figure 6 Transmission electron microscopy of PLGA-b-(PEI-co-PEG) micelles (A) and micelle/insulin complexes (WR=6) (B). |
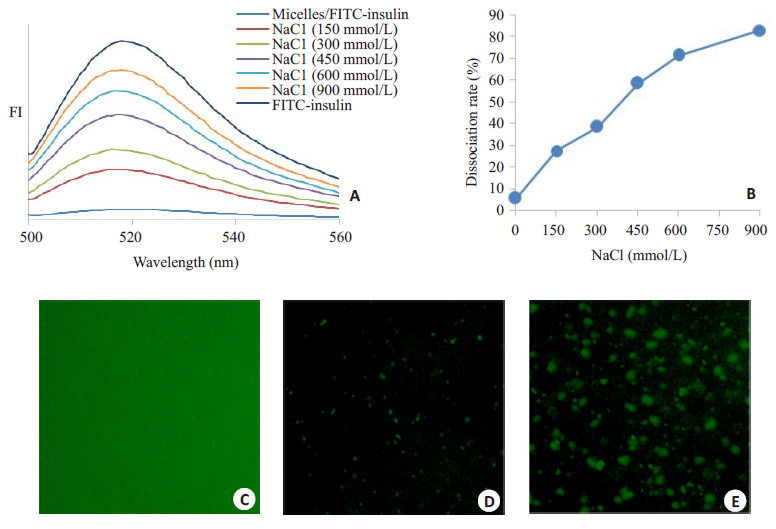
采用荧光猝灭法测定电正性PLGA-b-(PEI-co- PEG)胶束与胰岛素的结合与解离的过程,评估胶束/胰岛素复合物在不同浓度盐离子溶液中的稳定性。在pH 7.4(PBS,25 mmol/L)条件下,胶束/胰岛素复合物的荧光强度仅为FITC-胰岛素的5.7%(图 7A~B),说明胶束与胰岛素在此条件下有着较高的结合率。在荧光显微镜下,进一步验证了PLGA-b-(PEI-co-PEG)胶束对FITC-胰岛素的荧光猝灭过程(图 7C~E)。同时,随着NaCl溶液浓度的增大,胶束/FITC-胰岛素复合物的解离率(相对于FITC-胰岛素的荧光强度)呈增大趋势(图 7A~B)。在生理NaCl浓度条件(150 mmol/L)下,胶束/ FITC-胰岛素复合物的解离率仅为27.6%,而当NaCl浓度增加至600 mmol/L时其解离率达到71.6%,这表明胶束/胰岛素复合物在生理条件下具有良好的盐离子稳定性,但在高浓度盐离子溶液中表现出较高的解离率。
|
图 7 FITC-胰岛素与不同NaCl浓度条件下胶束/FITC-胰岛素复合物的荧光光谱图(A);胶束/FITC-胰岛素(WR=2)复合物在不同NaCl浓度条件下的解离率(B);FITC-胰岛素(C)、胶束/FITC-胰岛素复合物(D)与胶束/FITC-胰岛素复合物(含150 mmol/L NaCl)(E)的荧光显微图 Figure 7 Fluorescent spectra of FITC-insulin and micelle/FITC-insulin complexes at different NaCl concentrations (A); Dissociation rate of micelle/FITC-insulin complexes (WR=2) in various NaCl conditions (B); Fluorescent images of FITC-insulin (C), micelle/FITC- insulin complexes (D) and micelle/FITC-insulin complexes containing150 mmol/LNaCl (E). |
据报道,对于一般细胞而言,低相对分子质量的PEI(< 2000)具有细胞毒性小的特点[19-20]。同时,以PEG修饰PEI往往可一定程度上降低PEI的细胞毒性,并保留PEI的强质子缓冲能力[21-23]。本文采用EDC脱水缩合法使羧基化的PEG与PEI相互交联合成PEI-co- PEG。由于PEI分子中一级胺的数量较多,反应容易生成高度交联难溶于水的PEI-co-PEG产物,所以合成过程中应控制好反应物的初始浓度、摩尔比(PEI/PEG)、滴加速度,以及反应温度、搅拌速度等因素。一般情况下,低初始浓度与高摩尔比的反应物可生成溶于水的交联产物[12]。在PEI-co-PEG中,PEI与PEG以生物可降解的酰胺键相互交联,PEI-co-PEG在体外的降解半衰期(约为48 h)略大于Park等所报道的PEI-alt-PEG(约25 h,PEI与PEG以酯键交联)[16],这可能由于酰胺键的水解稳定性强于酯键。
近年来,开发新型药物输送载体以提高药物的稳定性与治疗效果越来越受关注,而低细胞毒性是载药材料的重要指标之一[24-26]。本研究合成一种阳离子型两亲性嵌段共聚物PLGA-b-(PEI-co-PEG),对于MCF-7细胞而言,PLGA-b-(PEI-co-PEG)的细胞毒性(IC50:1375.7 μg/mL)远低于Mishra等所报道的嵌段共聚物(PLGA36 000)2-b-bPEI25 000(IC50约为110 μg/mL)。一方面由于本实验所采用低相对分子质量PEI其细胞毒性本身较低,另一方面PEI的PEG化进一步降低了其细胞毒性,所以即使当PLGA-b-(PEI-co-PEG)的浓度高达800 μg/mL时,MCF-7细胞依然具有较高的存活率(> 80%)。
两亲性PLGA-b-(PEI-co-PEG)嵌段共聚物难溶于二氯甲烷与四氢呋喃等非极性溶剂,同时,也难溶于丙酮与水等极性溶剂,但易溶于DMSO,故以DMSO溶液制备其电正性PLGA-b-(PEI-co-PEG)胶束。如图 1(D)所示,PLGA-b-(PEI-co-PEG)以PLGA为“内核”,PEIco- PEG为“外壳”的形式自组装形成电正性胶束。PLGA-b-(PEI-co-PEG)胶束有较高的Zeta电位,所以其在水中具有较好的动力学稳定性,可在4 ℃冰箱中长时间(1个月)存放不发生聚集。在pH 7.4条件下,胰岛素等带负电荷的蛋白药物可与PLGA-b-(PEI-co-PEG)胶束“外壳”部分的PEI通过静电作用结合,所形成的胶束/蛋白复合物在生理NaCl浓度条件下具有较好稳定性,这与Park等所报道的mPEG-bOEI-pHis/胰岛素复合物结果类似[11]。若将蛋白类药物以胶束/蛋白复合物的形式载于PLGA微球体系中,电正性PLGA-b-(PEIco- PEG)胶束可能对PLGA微球降解所产生的酸性微环境有一定的缓冲作用,从而对微球中所载蛋白类药物起一定的保护所用。
本研究成功合成并表征了一种生物降解性、低细胞毒性的两亲性嵌段共聚物PLGA-b-(PEI-co-PEG),并对其胶束化行为进行了一系列的研究。PLGA-b-(PEIco- PEG)胶束具有有较强的电正性,即使与带负电的胰岛素结合后形成胶束/胰岛素复合物(质量比6,Zeta电位:约20 mV)也依然能保持一定的电正性,因此,PLGA-b-(PEI-co-PEG)胶束有望应用于胰岛素等蛋白药物的缓控释体系,尤其是以PLGA为基质的纳米粒或微球等载药体系,对于增加所载蛋白药物的稳定性方面可能提供很好的帮助。同时,由于PLGA-b-(PEI-co- PEG)相对于PEI-co-PEG具有显著较低的细胞毒性(P < 0.05),PLGA-b-(PEI-co-PEG)胶束作为siRNA、pDNA等基因药物的转染载体亦可能具有较好的前景。
| [1] |
Garner J, Skidmore S, Park H, et al. A protocol for assay of poly (lactide-co-glycolide) in clinical products[J].
Int J Pharm, 2015, 495(1): 87-92.
DOI: 10.1016/j.ijpharm.2015.08.063. |
| [2] |
Anderson JM, Shive MS. Biodegradation and biocompatibility of PLA and PLGA microspheres[J].
Adv Drug Deliv Rev, 2012, 64(S): 72-82.
|
| [3] |
Mir M, Ahmed N, Rehman AU. Recent applications of PLGA based nanostructures in drug delivery[J].
Colloids Surf B Biointerfaces, 2017, 159: 217-31.
DOI: 10.1016/j.colsurfb.2017.07.038. |
| [4] |
Yun YH, Lee BK, Park K. Controlled drug delivery: historical perspective for the next generation[J].
J Control Release, 2015, 219: 2-7.
DOI: 10.1016/j.jconrel.2015.10.005. |
| [5] |
Ungaro F, D'angelo I, Miro A, et al. Engineered PLGA nano-and micro-carriers for pulmonary delivery: challenges and promises[J].
J Pharm Pharmacol, 2012, 64(9): 1217-35.
DOI: 10.1111/j.2042-7158.2012.01486.x. |
| [6] |
Xu Y, Kim CS, Saylor DM, et al. Polymer degradation and drug delivery in PLGA-based drug-polymer applications: A review of experiments and theories[J].
J Biomed Mater Res B Appl Biomater, 2017, 105(6): 1692-716.
DOI: 10.1002/jbm.b.v105.6. |
| [7] |
Park JH, Kang HJ, Kwon DY, et al. Biodegradable poly (lactide-coglycolide- co- epsilon- caprolactone) block copolymers-evaluation as drug carriers for a localized and sustained delivery system[J].
J Mater Chem B, 2015, 3(41): 8143-53.
DOI: 10.1039/C5TB01542A. |
| [8] |
Wang X, Wenk E, Hu X, et al. Silk coatings on PLGA and alginate microspheres for protein delivery[J].
Biomaterials, 2007, 28(28): 4161-9.
DOI: 10.1016/j.biomaterials.2007.05.036. |
| [9] |
Lim HP, Tey BT, Chan ES. Particle designs for the stabilization and controlled-delivery of protein drugs by biopolymers: a case study on insulin[J].
J Control Release, 2014, 186: 11-21.
DOI: 10.1016/j.jconrel.2014.04.042. |
| [10] |
Kang HC, Lee JE, Bae YH. Nanoscaled buffering zone of charged (PLGA)n-b-bPEI micein acidic microclimate for potential protein delivery application[J].
J Control Release, 2012, 160(3): 440-50.
DOI: 10.1016/j.jconrel.2012.02.024. |
| [11] |
Park W, Kim D, Kang HC, et al. Multi-arm histidine copolymer for controlled release of insulin from poly(lactide-co-glycolide) microsphere[J].
Biomaterials, 2012, 33(34): 8848-57.
DOI: 10.1016/j.biomaterials.2012.08.042. |
| [12] |
Ahn CH, Chae SY, Bae YH, et al. Biodegradable poly(ethylenimine) for plasmid DNA delivery[J].
J Control Release, 2002, 80(1/3): 273-82.
|
| [13] |
Chen Y, Yang Z, Liu C, et al. Synthesis, characterization, and evaluation of paclitaxel loaded in six-arm star-shaped poly (lactic-coglycolic acid)[J].
Int J Nanomedicine, 2013, 8: 4315-26.
|
| [14] |
Mei FF, Peng Y, Lu ST, et al. Synthesis and characterization of biodegradable poly (lactic-co-glycolic acid)[J].
J Macromol Sci, Part B: Physics, 2015, 54(5): 562-70.
DOI: 10.1080/00222348.2014.1002325. |
| [15] |
Gou PF, Zhu WP, Xu N, et al. Synthesis and characterization of welldefined cyclodextrin-centered seven-arm star poly(epsilon-caprolactone) s and amphiphilic star poly (epsilon-caprolactone-b-ethylene glycol) s[J].
J Polym SciAPolym Chem, 2008, 46(19): 6455-65.
DOI: 10.1002/pola.v46:19. |
| [16] |
Park MR, Han KO, Han IK, et al. Degradable polyethylenimine- altpoly (ethylene glycol) copolymers as novel gene carriers[J].
J Control Release, 2005, 105(3): 367-80.
DOI: 10.1016/j.jconrel.2005.04.008. |
| [17] |
Jacob D, Joan Taylor M, Tomlins P, et al. Synthesis and identification of FITC-insulin conjugates produced using human insulin and insulin analogues for biomedical applications[J].
J Fluoresc, 2016, 26(2): 617-29.
DOI: 10.1007/s10895-015-1748-1. |
| [18] |
Park W, Park SJ, Na K. The controlled photoactivity of nanoparticles derived from Ionic interactions between a water soluble polymeric photosensitizer and polysaccharide quencher[J].
Biomaterials, 2011, 32(32): 8261-70.
DOI: 10.1016/j.biomaterials.2011.07.023. |
| [19] |
郭圣荣.
药用高分子材料[M]. 北京: 人民卫生出版社, 2009: 390-1.
|
| [20] |
Sawant RR, Sriraman SK, Navarro G, et al. Polyethyleneimine-lipid conjugate-based pH-sensitive micellar carrier for gene delivery[J].
Biomaterials, 2012, 33(15): 3942-51.
DOI: 10.1016/j.biomaterials.2011.11.088. |
| [21] |
Tang GP, Zeng JM, Gao SJ, et al. Polyethylene glycol modified polyethylenimine for improved CNS gene transfer: effects of PEGylation extent[J].
Biomaterials, 2003, 24(13): 2351-62.
DOI: 10.1016/S0142-9612(03)00029-2. |
| [22] |
Endres TK, Beck-Broichsitter M, Samsonova OA, et al. Selfassembled biodegradable amphiphilic PEG-PCL-lPEI triblock copolymers at the borderline between micelles and nanoparticles designed for drug and gene delivery[J].
Biomaterials, 2011, 32(30): 7721-31.
DOI: 10.1016/j.biomaterials.2011.06.064. |
| [23] |
Lv J, Yang J, Hao XE, et al. Biodegradable PEI modified complex micelles as gene carriers with tunable gene transfection efficiency for ECs[J].
J Mater Chem B, 2016, 4(5): 997-1008.
DOI: 10.1039/C5TB02310F. |
| [24] |
Ramezani M, Ebrahimian M, Hashemi M. Current strategies in the modification of PLGA-based gene delivery system[J].
Curr Med Chem, 2017, 24(7): 728-39.
DOI: 10.2174/0929867324666161205130416. |
| [25] |
Yin L, Yuvienco C, Montclare JK. Protein based therapeutic delivery agents: Contemporary developments and challenges[J].
Biomaterials, 2017, 134: 91-116.
DOI: 10.1016/j.biomaterials.2017.04.036. |
| [26] |
Wong CY, Al- Salami H, Dass CR. Potential of insulin nanoparticle formulations for oral delivery and diabetes treatment[J].
J Control Release, 2017, 264: 247-75.
DOI: 10.1016/j.jconrel.2017.09.003. |
| [27] |
Mishra D, Kang HC, Bae YH. Reconstitutable charged polymeric (PLGA) (2)-b-PEI micelles for gene therapeutics delivery[J].
Biomaterials, 2011, 32(15): 3845-54.
DOI: 10.1016/j.biomaterials.2011.01.077. |
 2018, Vol. 38
2018, Vol. 38

