视觉是人类和高等动物认识客观世界的主要感觉之一,大脑接受的全部信息中有70%以上和视觉信息有关。视觉信号始于视网膜,由感受器视杆细胞和视锥细胞接受光信号,转化为电信号传到双极细胞层,经水平细胞和无长突细胞对神经信号进行横向调制传到神经节细胞(RGC),最终由视神经节细胞传输到大脑[1]。RGC作为视网膜中唯一的输出神经元,在整个视觉形成中至关重要。
细胞膜固有特性和突触稳定性随发育变化,可表现为电生理特性的改变[2-3]。膜固有特性包括主动和被动特性。主动特性是细胞膜产生动作电位的特性,如阈值、半峰宽、发放模式和最大发放速率;被动特性有膜的电阻性和电容性,或时间常数[4-6]。近年来,全细胞膜片钳技术的运用,实现了在分子水平了解细胞膜的固有特性和突触稳定性[7-8]。很多文献应用这种技术,通过分析神经环路中细胞膜的兴奋性和动作电位发放特点来研究发育过程中细胞膜的固有特性[9-10];通过记录微小型兴奋性突触后电流(mEPSC)相关指标,包括mEPSC的幅度(反应单位时间内递质量的释放情况)、频率(反应单位时间内突触前膜每次释放囊泡的个数)并分析这些指标来研究突触的兴奋性[11-12]。
RGC膜固有特性在发育过程中是如何变化的还不明确。RGC接受双极细胞和水平细胞等的突触联系,在发育过程中趋于稳定[13-14],可何时发育成熟也不明确。本文应用这种技术,从膜特性中主动和被动特性两个方面来阐述RGC膜特性的发育变化;并通过分析mEPSC的上升下降时间来分析发育过程中突触后膜上受体开放关闭情况,进一步研究RGC发育过程中突触稳定性的变化。
1 材料和方法 1.1 视网膜片制备和孵育由于正常SD大鼠睁眼(即受光刺激)年龄在出生后13 d左右,本文选取发育过程中睁眼前(出生后7 d,P7)、睁眼后(P15)以及成年后(P40)3个年龄段大鼠。本实验采用7~40 d新生的Sprague-Dawley大鼠(购自南方医科大学实验动物中心),观察个体基本发育,称重后戊巴比妥钠麻醉(剂量:0.2 mL/100 g),快速取出眼球置于预冷的切片液中急速冷却2 min,迅速在0~4 ℃切片液中剥离视网膜组织(切片液:in mmol 2KCl,12 MgSO4,1.3 NaH2PO4,26 NaHCO3,25 D-glucose,220 Surose,0.2 CaCl2,试剂均来自Sigma)。取组织转移到事先准备好的40 ℃琼脂培养皿中,盖好盖子置于-20 ℃冰箱极速冷冻2 min,取出培养皿修饰琼脂块成长方体形状固定于切片板上,移入切片槽中行冠状切片,切片厚度300 μm(切片液:预冷冰水混合物,切片机:Vibratome 1200 Series.Leica.德国)。快速吸取含视网膜的琼脂片置于装有人工脑脊液孵育槽中37 ℃电热恒温水浴锅中恒温孵育30 min(孵育液:in mmol 124 NaCl,2.5 KCl,2MgSO4,1.25 NaH2PO4,26 NaHCO3,25 D-glucose,2CaCl2试剂均来自Sigma)。整个制备与孵育过程中,人工脑脊液都用混合气(95% O2, 5% CO2)持续供氧。
1.2 电生理记录取孵育槽中视网膜片移至1 mL记录槽内,槽内人工脑脊液通氧,30 ℃恒温循环灌流温度自动控制器(TC-344B, WARNER)。红外光差显微镜(FN-S2N, Nikon, Japan)下观察视网膜片节细胞区域神经元,通过微型操控器(MP225, SUTTER, USA)将有一定正压的玻璃微电极移至神经节细胞胞体表面,撤去正压形成高阻封接(大于1 GΩ将),稳定后口吸破膜形成全细胞记录。电流钳模式下,向细胞注入步阶电流记录其反应(步阶电流范围:-100 pA至+500 pA,步阶间隔10 pA,步阶时长100 ms),全细胞记录系统采用EPC10放大器(HEKA, Lambrcht, Germany)和Patchmaster数据采集与存储。记录mEPSC时,将记录模式转换成电压钳,钳制电压设定在-70 mv,稳定3 min后,循环的外液中加入TTX,单个细胞持续记录10 min。记录玻璃微电极由P- 97型拉制仪拉制(SUTTER, USA),填充电极内液后阻抗为10~12 MΩ,电极内液成分(in mmol:140 Kgluconate,4.5 MgCl2,5EGTA,4 Mg-ATP,0.3 GTP,4.4 Phosphocreatine disodium salt hydrate,9 HEPE,试剂均来自Sigma)。
1.3 形态学研究生物素Biocytin标记神经元形态与结构:事先在记录电极内液中加入0.25% Biocytin(Sigma),充分混匀后正常全细胞记录神经元,保持全细胞记录20~30 min后,让电极内液中Biocytin与细胞内液相互交换并充分扩散至整个细胞,记录完成后迅速用4%多聚甲醛固定所标记的脑片置于4度冰箱中过夜,次日取出脑片置于室温恢复1 h后PBS清洗(3×5 min),片中加入500 μL/片0.3%Triton X-100,室温下孵育1.5 h,再次用PBS清洗(3×5 min),加入CY3(使用稀释比例1:200)500 μL/片室温下避光孵育4 h后,用PBS清洗(3×5 min),完毕后将脑片移至载玻片上待自然风干后加入抗荧光衰减封片剂封片,共聚焦显微镜拍片,确定所记录神经形态与结构从而联系其电生理数据。
1.4 细胞电生理特数据分析全细胞电流钳模式下向细胞内注入步阶电流激发其电反应。注入超极化电流记录其阈下反应,注入去极化电流记录其阈上动作电位(Action potentialAP)反应。分析阈上动作电位反应,选取阈强度(注入去极化电流所引起细胞第一次发放动作电位时的电流强度)下的动作电位进行分析。动作电位主要分析的指标:动作电位发放率(Discharge rate),阈值(Threshold PotentialTP),动作电位半峰宽(AP Half-PeakWidth)。动作电位发放率定义为峰值电位与静息膜电位间的电位差。阈值定义为膜电压变化速率大于或等于50 V/s的膜电位点。半峰宽的计算:半峰宽=AP下降支半峰时间-AP上下降支半峰时间(半峰时间为半峰电位处的记录时间),其中半峰电位=(峰值电位+阈值电位)/2。分析细胞阈下反应,选取-30 pA段分析细胞时间常数(τ值),输入阻抗值(Rm)和膜电容(Cm)。细胞膜时间常数是根据Levenberg-Marquardt算法选取小的超级化电流刺激(-30 pA)下通过单指数函数拟合而得的膜充放电时间。mEPSCs的分析通过专用分析软件MiniAnalysis分析自发放,mEPSCs的筛选模板参数设定是参照已有相关研究的同类神经元mEPSCs的均值[15-16],检测限设定在噪声标准差的2.5~4倍。
1.5 统计学处理各年龄组提取的数据经Excel 2003编排后录入Origin 8.0中初步进行分析和统计并成原始图,后经导入CorelDraw 12.0中进一步精细处理成图。分析比较了发育过程中视网膜神经节细胞的细胞形态,电生理发放,突触传入特性。
实验数据以均数±标准差表示,统计分析采用SPSS13.0软件,多组间比较采用单因素方差分析,组间两两比较采用Post hoc Fisher检验,P < 0.05则差异有统计学意义。
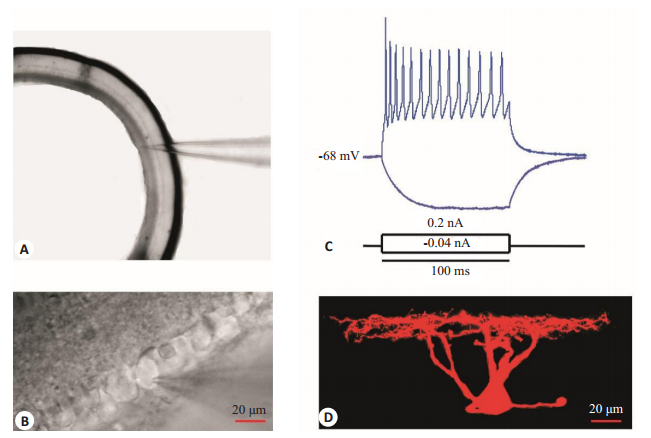
2 结果 2.1 RGC形态特性在视网膜中主要有6种不同的细胞,视锥、视杆细胞、双极细胞、水平细胞、无长突细胞和节细胞。细胞的大小及位置是鉴别这几种细胞的重要指标之一。300 μm视网膜琼脂片冠状切片,节细胞位于视网膜的最内侧,呈有序的并行排列,光镜下识别节细胞的部位(图 1A~B)后选取节细胞进行全细胞记录。玻璃电极与节细胞形成全细胞模式后,在电流钳模式下,我们通过HEKA放大器向胞体内注入100 ms的阶梯电流,观察动作电位的发放情况。我们发现该记录细胞的静息膜电位在-68 mv,阈刺激为0.04 nA,这一连串反应是注入电流为0.20 nA时所出现的(图 1C)。形态学研究也是鉴别节细胞的重要指标之一。电极内加入神经生物素Biocytin标记节细胞可以看到节细胞胞体及其往外延伸的树突(图 1D)。
|
图 1 RGC的记录及其形态图 Figure 1 Electrophysiological recording and identity of RGC. A: A coronal slice of the RGCs (Original magnification: ×4) showing the recorded ganglion layer in the innermost part of the retina; B: Typical RGCs for whole-cell recording (×40). The RGC layer is neatly arranged with large cell bodies (about 20 μm); C: A sketch map of action potential with a 100 ms stimulation interval in current clamp. The action potential threshold current of this RGCs is 0.04 nA, and the graph shows the action potential recorded at an injection current of 0.2 nA; D: Morphology of a RGC with bio-cytin staining, highlighting dendrites and axons that extend outward. |
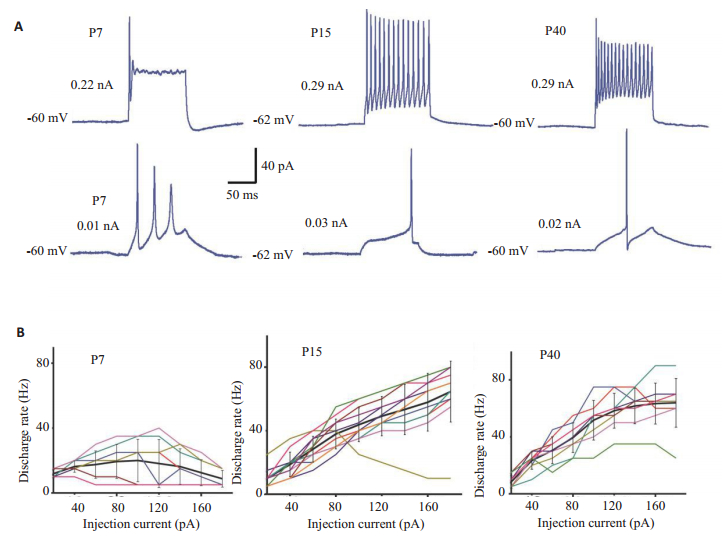
采用全细胞膜片钳记录视神经节细胞,共记录到86个节细胞。为了探究发育过程中视网膜神经节细胞基本的电生理特性,分别记录P7、P15及P40大鼠RGC的动作电位发放数以及发放率。比较3个不同年龄段RGC的动作电位发放时,可以发现P7组的SD大鼠动作电位发放模式呈现出:在阈刺激强度下,出现多个发放,在达到一定强度电流刺激后,变成单个发放,并迅速出现适应,不能爆发出新的动作电位。P15组和P21组的大鼠在阈刺激强度下呈现出单个发放,随着步阶电流的逐渐增大,发放数逐渐增大(图 2A)。因此我们分别将单个年龄段的多个细胞所记录到的随着注入电流的增大与发放率的关系作图,不同颜色的线分别代表不同细胞,黑色的粗线是单个年龄段所有细胞的平均线,并在平均线上分别计算了标准差,发现P7和P15的大鼠发放率随着注入电流增加有着明显不同,P7组和P40组同样有着明显的差异,但是P15组的大鼠和P40组的大鼠比较时并无明显差别(图 2B)。
|
图 2 发育过程中RGC注入电流与发放率的关系 Figure 2 Relationship between the injection current and the discharge rates of rat RGCs during postnatal development. A: Action potentials recorded from the RGCs at 3 different ages; B: Frequency of the action potentials. |
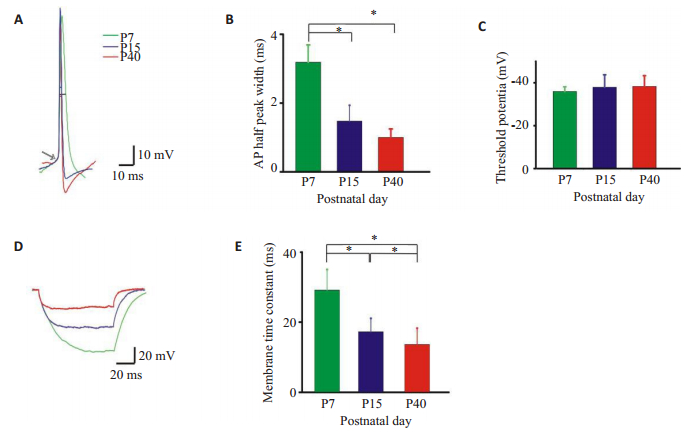
我们对所记录的动作电位进行了详细的分析,比较3个不同年龄段记录到的动作电位的半峰宽,反应示例发现P7组的动作电位半峰宽要明显宽于P15和P40组(图 3A),统计分析3个不同年龄段的半峰宽差异发现符合这一规律(图 3B)。P7组动作电位半峰宽要大于P15组(3.19±0.50, 1.47±0.46, Fisher test, P < 0.05),同样也大于P40组(3.19±0.50, 1.00±0.25, Fisher test, P < 0.05),同时比较P15组和P40组大鼠的动作电位半峰宽发现并无统计学差异(1.47 ± 0.46, 1.00 ± 0.25, Fisher test, P > 0.05),这说明P15是RGC主动膜特性变化的关键期。
|
图 3 发育过程中RGC的膜特性 Figure 3 Changes in the membrane properties of the RGCs during postnatal development. A: Single action potentials recorded from RGCs of rats at 3 different postnatal ages; B-C: Actional potential half-peak width and the threshold potential; D-E: Membrane time constant after injecting a current of -30 pA. *P < 0.05 (n=3). |
随后分析了各个年龄段记录到的动作电位的阈值发现并没有明显的变化(图 3A箭头处),通过对多个不同年龄段细胞的阈值进行统计分析显示(图 3C),3个不同年龄段阈值变化无统计学差异(-35.96±2.16, - 37.94±5.77, -38.32±5.00, One-wayANOVA, P > 0.05)。
进一步研究膜的被动特性,我们分析了视神经节细胞膜电容和电阻之间的关系。电流钳模式下,通过注入一个-30 pA的超极化电流,记录膜反应,分析膜电阻,膜电容和膜时间常数,我们发现P7组的时间常数和P15及P40组有显著性差异,并随着年龄的增大,差异越来越明显(图 3D),对它们进行统计分析(图 3E),发现年龄越大,细胞膜的时间常数越小,并随着年龄的增大,越来越小(29.15±5.88, 17.23±3.85, 13.61±4.66, One-wayANOVA, P < 0.05)。
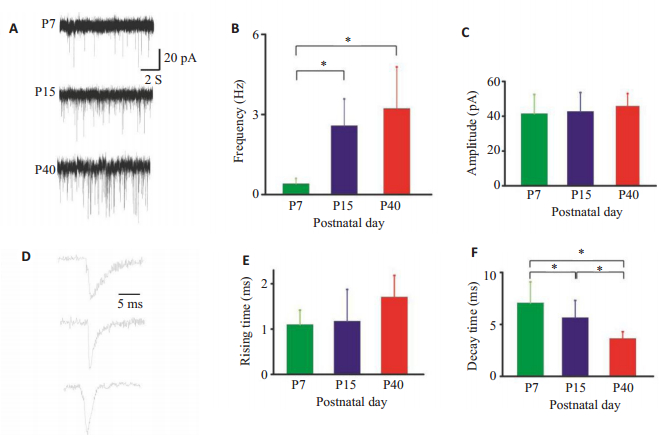
2.3 发育过程中RGC的突触稳定性的变化我们进一步从突触角度研究RGC的电生理特性。突触稳定性从微小兴奋性突触后电流(mEPSC)的幅度、频率、上升时间和下降时间等方面来分析。我们分别记录各个年龄段的微小兴奋性突触后电流,每个细胞记录10分钟。从反应示例可以看出,随着大鼠年龄的增大,其mEPSC的频率逐渐增大(图 4A),各年龄组之间进行统计分析得出(图 4B),P7组和P15组比较时mEPSC的频率明显增大(0.40±0.21, 2.58±1.43, Fisher test, P < 0.05),P7和P40组mEPSC的频率也明显增大(0.40±0.21, 3.22±2.09, Fisher test, P < 0.05),但是比较P15组和P40组mEPSC的频率时并无统计学差异(2.58±1.43, 3.22±2.09, Fisher test, P > 0.05)。随后分别统计三个不同年龄段的大鼠mEPSC的幅度(41.45± 11.03, 42.72±10.88, 45.77±7.24, One-way ANOVA, P > 0.05)发现并无统计学差异(图 4C)。说明RGC的突触在单位时间内释放囊泡的个数在P15有明显增加,而递质释放量在发育期间并无改变。
|
图 4 发育过程中RGCs的突触前的变化 Figure 4 Presynaptic changes of the RGCs during postnatal development. A and D: Three original chart recordings of mEPSCs of the RGCs from rats at P7, P15 and P40. The frequency (B), amplitude (C), rising time (E) and decay time (F) were analyzed. *P < 0.05 (n=3). |
为了进一步研究突触上受体的开放与关闭,分析比较了各组之间的mEPSC上升时间和下降时间,发现3个不同年龄段mEPSC的上升时间(1.10±0.32, 1.17± 0.70, 1.71±0.48, One-way ANOVA, P > 0.05)并无统计学差异(图 4E),但是比较下降时间时,P7组和P15组的mEPSC下降时间明显减小(7.06 ± 2.03, 5.65 ± 1.65, Fisher test, P < 0.05),并随着年龄段的增大逐渐减小(5.65±1.65, 3.64±0.66, Fisher test, P < 0.05),并对各组之间做了统计分析(7.06±2.03, 5.65±1.65, 3.64±0.66, One-way ANOVA, P < 0.05)(图 4F),说明RGC突触上受体的开放时间在发育过程中并无改变,而关闭时间随着年龄的增加逐渐变快。
3 讨论在这项研究中,我们从主动膜特性,被动膜特性和突触稳定性系统的阐述了视神经节细胞在发育过程中的电生理变化。结果显示,不同年龄段RGC的放电模式有显著的改变,这与以往的文献报道的结果相似[17-18],我们的结果进一步从膜固有特性其他方面证明了出生后15 d是电生理变化的关键期。
现有的研究显示生后早期的大鼠随着发育过程中年龄的增加,视神经节细胞膜的兴奋性增加,导致动作电位发生改变,年龄越小的细胞呈现出单个发放,随着年龄的增加,开始表现出一系列重复的发放数,年龄越大发放数越多[19-20]。年龄小的细胞记录到的类型以单峰型居多,随着年龄增加,慢慢转化为瞬变型和持续性,达到一定年龄之后很少能出现单峰型,主要以持续性为主[21-23],单峰型RGC的静息膜电位、输入阻抗较瞬变型和持续型高,动作电位的阈值高,幅度低,半峰宽大。幼稚神经元具有高输入阻抗高静息膜电位,而成熟型神经元相对较低,年龄较小的节细胞的电生理特性不成熟,在发育过程中处于一种前期状态。在本研究中,我们发现了视网膜神经节细胞的阈上动作电位波形发生了显著的改变,动作电位半峰宽变小,动作电位幅度基本不变,提示了节细胞膜上的蛋白分布密度升高所致。此外,分析阈下膜特性时,节细胞的时间常数随着年龄增加逐渐减小,膜时间常数又由膜电导和膜电容所决定[24-26],通常和细胞大小以及细胞膜上蛋白质的电导有关,视网膜神经节细胞的形态学发育与年龄无关,所以两者主要是由膜上的蛋白质所主导,同样提示膜上蛋白密度的升高,从而提高了RGC的兴奋性。
现有研究表明正常SD大鼠睁眼年龄在11~13 d左右,睁眼之前细胞形态就已经发育成熟,但在突触的数量上,视觉发育过程中生后16 d至关重要。有研究比较了黑暗环境下和正常饲养环境下对常规突触发育及生理功能的影响,结果发现突触的形状与生长并没有受到影响,但是可能影响了突触的数量,并在16 d的时候达到恒定水平[27-28]。我们发现在出生后15 d之前突触前产生的mEPSC的频率明显增大,但是在出生后15 d之后变化并无统计学差异,这与现有文献报道的突触形成在16 d达到恒定水平结论相似。此外,我们的研究还发现反映突触后膜上受体关闭的时间随着发育过程逐渐减小,这也很好的提示了突触后膜上蛋白密度的增加所致。
总之,本研究通过全细胞膜片钳技术的方法发现视神经节细胞发育过程中膜特性和突触稳定性的具体变化特点,了解这种电生理特性改变机制有助于进一步理解RGC在视觉信息中发挥的作用。
| [1] |
Reese BE. Development of the retina and optic pathway[J].
Vision Res, 2011, 51(7): 613-32.
DOI: 10.1016/j.visres.2010.07.010. |
| [2] |
Ammer JJ, Grothe B, Felmy F. Late postnatal development of intrinsic and synaptic properties promotes fast and precise signaling in the dorsal nucleus of the lateral lemniscus[J].
J Neurophysiol, 2012, 107(4): 1172-85.
DOI: 10.1152/jn.00585.2011. |
| [3] |
Qu J, Myhr KL. The development of intrinsic excitability in mouse retinal ganglion cells[J].
Dev Neurobiol, 2008, 68(9): 1196-212.
DOI: 10.1002/dneu.v68:9. |
| [4] |
Berntson AK, Walmsley B. Characterization of a potassium-based leak conductance in the medial nucleus of the trapezoid body[J].
Hear Res, 2008, 244(1/2): 98-106.
|
| [5] |
Franzen DL, Gleiss SA, Berger C, et al. Development and modulation of intrinsic membrane properties control the temporal precision of auditory brain stem neurons[J].
J Neurophysiol, 2015, 113(2): 524-36.
DOI: 10.1152/jn.00601.2014. |
| [6] |
Wong RC, Cloherty SL, Ibbotson MR, et al. Intrinsic physiological properties of rat retinal ganglion cells with a comparative analysis[J].
J Neurophysiol, 2012, 108(7): 2008-23.
DOI: 10.1152/jn.01091.2011. |
| [7] |
Liu J, Backx PH. Patch-clamp technique in ESC-derived cardiomyocytes[J].
Methods Mol Biol, 2014, 1181: 203-14.
DOI: 10.1007/978-1-4939-1047-2. |
| [8] |
Gandini MA, Sandoval A, Felix R. Patch-clamp recording of voltagesensitive Ca2+ channels[J].
Cold Spring Harb Protoc, 2014(4): 325-9.
|
| [9] |
Yassin L, Pecka M, Kajopoulos J, et al. Differences in synaptic and intrinsic properties result in topographic heterogeneity of temporal processing of neurons within the inferior colliculus[J].
Hear Res, 2016, 341: 79-90.
DOI: 10.1016/j.heares.2016.08.005. |
| [10] |
Yang C, Mckenna JT, Brown RE. Intrinsic membrane properties and cholinergic modulation of mouse basal forebrain glutamatergic neurons in vitro[J].
Neuroscience, 2017, 352: 249-61.
DOI: 10.1016/j.neuroscience.2017.04.002. |
| [11] |
Zhang J, Yang Y, Li H, et al. Amplitude/frequency of spontaneous mEPSC correlates to the degree of long-term depression in the CA1 region of the hippocampal slice[J].
Brain Res, 2005, 1050(1/2): 110-7.
|
| [12] |
Kreinest M, Müller B, Winkelhoff J, et al. Miniature EPSCs in the lateral superior olive before hearing onset: regional and cell-typespecific differences and heterogeneous neuromodulatory effects of ATP[J].
Brain Res, 2009, 1295: 21-36.
DOI: 10.1016/j.brainres.2009.07.083. |
| [13] |
Park HY, Kim JH, Park CK. Alterations of the synapse of the inner retinal layers after chronic intraocular pressure elevation in glaucoma animal model[J].
Mol Brain, 2014, 7: 53.
DOI: 10.1186/s13041-014-0053-2. |
| [14] |
Agostinone J, Di Polo A. Retinal ganglion cell dendrite pathology and synapse loss: Implications for glaucoma[J].
Prog Brain Res, 2015, 220: 199-216.
DOI: 10.1016/bs.pbr.2015.04.012. |
| [15] |
Ankolekar SM, Sikdar SK. Early postnatal exposure to Lithium in vitro induces changes in AMPAR mEPSCs and vesicular recycling at hippocampal glutamatergic synapses[J].
J Biosci, 2015, 40(2): 339-54.
DOI: 10.1007/s12038-015-9527-3. |
| [16] |
Hendricson AW, Sibbald JR, Morrisett RA. Ethanol alters the frequency, amplitude, and decay kinetics of Sr2+-supported, asynchronous NMDAR mEPSCs in rat hippocampal slices[J].
J Neurophysiol, 2004, 91(6): 2568-77.
DOI: 10.1152/jn.00997.2003. |
| [17] |
Marcelin B, Liu Z, Chen Y, et al. Dorsoventral differences in intrinsic properties in developing CA1 pyramidal cells[J].
J Neurosci, 2012, 32(11): 3736-47.
DOI: 10.1523/JNEUROSCI.5870-11.2012. |
| [18] |
Hu C, Hill DD, Wong KY. Intrinsic physiological properties of the five types of mouse ganglion-cell photoreceptors[J].
J Neurophysiol, 2013, 109(7): 1876-89.
DOI: 10.1152/jn.00579.2012. |
| [19] |
Maravall M, Stern EA, Svoboda K. Development of intrinsic properties and excitability of layer 2/3 pyramidal neurons during a critical period for sensory maps in rat barrel cortex[J].
J Neurophysiol, 2004, 92(1): 144-56.
DOI: 10.1152/jn.00598.2003. |
| [20] |
Pan G, Yang JM, Hu XY, et al. Postnatal development of the electrophysiological properties of somatostatin interneurons in the anterior cingulate cortex of mice[J].
Sci Rep, 2016, 6: 28137.
DOI: 10.1038/srep28137. |
| [21] |
Felix RA, Vonderschen K, Berrebi AS, et al. Development of on-off spiking in superior paraolivary nucleus neurons of the mouse[J].
J Neurophysiol, 2013, 109(11): 2691-704.
DOI: 10.1152/jn.01041.2012. |
| [22] |
Li J, Baccei ML. Developmental regulation of membrane excitability in rat spinal lamina Ⅰ projection neurons[J].
J Neurophysiol, 2012, 107(10): 2604-14.
DOI: 10.1152/jn.00899.2011. |
| [23] |
Eugène D, Idoux E, Beraneck M, et al. Intrinsic membrane properties of central vestibular neurons in rodents[J].
Exp Brain Res, 2011, 210(3/4): 423-36.
|
| [24] |
Kaphzan H, Buffington SA, Jung JI, et al. Alterations in intrinsic membrane properties and the axon initial segment in a mouse model of Angelman syndrome[J].
J Neurosci, 2011, 31(48): 17637-48.
DOI: 10.1523/JNEUROSCI.4162-11.2011. |
| [25] |
Lavialle-Defaix C, Jacob V, Monsempès C, et al. Firing and intrinsic properties of antennal lobe neurons in the Noctuid moth Agrotis ipsilon[J].
Biosystems, 2015, 136: 46-58.
DOI: 10.1016/j.biosystems.2015.06.005. |
| [26] |
Kaczorowski CC, Disterhoft J, Spruston N. Stability and plasticity of intrinsic membrane properties in hippocampal CA1 pyramidal neurons: effects of internal anions[J].
J Physiol, 2007, 578(Pt 3): 799-818.
|
| [27] |
Lee EJ, Merwine DK, Padilla M, et al. Choline acetyltransferase-immunoreactive neurons in the retina of normal and dark-reared turtle[J].
J Comp Neurol, 2007, 503(6): 768-78.
|
| [28] |
Akimov NP, Rentería RC. Dark rearing alters the normal development of spatiotemporal response properties but not of contrast detection threshold in mouse retinal ganglion cells[J].
Dev Neurobiol, 2014, 74(7): 692-706.
DOI: 10.1002/dneu.v74.7. |
 2018, Vol. 38
2018, Vol. 38

