维持性透析(MD)患者骨折事件发生率远高于正常人群[1],且发生后可致残致死,影响MD患者的生存率及生活质量。骨折可由创伤和骨骼疾病所致,骨质疏松是重要原因之一。慢性肾脏病所致骨质疏松的发病机制较为复杂,包括了转运、矿化和骨量异常。目前并无确切有效且使用方便的指标可预测MD患者的骨折风险。碱性磷酸酶(ALP)是一种骨形成的标志物,研究提示,在骨质疏松发病机制中,碱性磷酸酶具有重要作用[2]。中华医学会肾脏病分会专家共识推荐定期监测血ALP水平以协助诊断和评估透析患者骨质疏松。既往研究结果表明,中国男性骨质疏松骨折患者的血骨源性ALP较正常人群显著增高[3]。有报道证实,血骨源性ALP水平可预测绝经期妇女的椎骨骨折风险[4]。且有学者发现慢性肾脏病男性患者的血骨源性ALP水平远高于正常男性人群[5]。也有回顾性分析提示,肾移植后10年内发生非椎骨骨折的患者,其移植后第一年的血ALP水平显著高于非骨折者[6]。但在MD患者中血ALP水平与骨折事件的关系未明。本研究主要通过分析MD患者基线血清ALP水平与2年内骨折事件发生率之间的关系,了解血清ALP水平对MD患者骨折事件的预测价值。
1 资料和方法 1.1 研究对象本研究纳入2013年8月~2016年5月的我院慢性肾衰竭MD患者,所有研究对象均已维持性透析3月以上,剔除急性感染期、恶性肿瘤、心脑血管事件急性期及肝功能不正常患者,剔除随诊期间内行甲状旁腺切除术的患者。血透患者每周透析2~3次,腹透患者每天换液8000~10 000 mL。排除2年随访过程中无发生骨折的死亡患者及失访患者。最后共有139例患者纳入研究,其中包括有107例血液透析患和32例腹膜透析患者,其中包含男性92例,女性47例,所有患者中位年龄为53(19~83)岁,中位透析龄为12(3~240)月。患者原发病构成为:慢性肾小球肾炎65例,糖尿病肾病31例,良性肾小动脉硬化17例,梗阻性肾病12例,多囊肾6例,慢性尿酸性肾病3例,狼疮性肾炎2例,肾病综合征、肾淀粉样变、造影剂肾病各1例。
1.2 研究方法以所有纳入研究的患者血ALP值中位数把患者分为低血ALP值组(A组)及高血ALP值组(B组)两组。所有患者均检查基线血ALP、血磷、血钙、血完整甲状旁腺激素激素(iPTH)水平,基线骨密度(BMD)水平。所有患者按指南要求随访2年。记录2年间患者发生的所有部位骨折事件。
1.3 血液标本检测所有患者检查于纳入研究时即检查血ALP、血磷、血钙、iPTH水平。所有研究对象均采集清晨空腹静脉检测血ALP,腹透患者采集清晨空腹静脉血检测血钙、磷及iPTH,血透患者采集透析前静脉血检测血钙、血磷及iPTH。血钙、磷及ALP均使用日立7600全自动生化分析仪检测,血iPTH采用化学发光法检测,均于我院检验科完成。
1.4 骨密度检测及骨质疏松的诊断骨密度测定采用双能X线吸收法,以GE LUNAR Prodigy双能X线骨密度仪检查腰椎及右侧股骨颈骨密度。诊断骨质疏松按WHO推荐的推荐标准,骨密度值低于同性别、同种族健康成人的骨峰值不足1个标准差属正常;降低1~2.5个标准差之间诊断为骨量低下(或骨量减少);降低程度大于和等于2.5个标准差诊断为骨质疏松。符合骨质疏松诊断标准者同时伴有骨折时为严重骨质疏松。
1.5 骨折的诊断骨折的诊断按照《外科学》中的定义进行,即骨的完整性和连续性中断。骨折事件的记录均以2年随诊期间新发的,以有影像学支持的诊断为准(包括有症状及无症状性的骨折)。
1.6 统计学分析用IBM SPSS Statistics 19统计软件分析数据。对正态分布资料采用均数±标准差表示,非正态分布资料以中位数(最小值-最大值)表示。以t检验及χ2检验了解A、B两组患者的基线资料状况,以双变量相关分析了解ALP与骨密度的关系,以χ2检验比较A、B两组患者结束研究时的骨质疏松发生率及骨折发生率,以Logistic回归分析骨折发生的危险因素,最后以ROC曲线分析血ALP水平及其它基线指标对骨折的预测价值。检验水准α=0.05。
2 结果 2.1 患者的基线资料所有患者ALP为132.55±167.68 U/L(与本研究年龄、性别匹配的正常成年人100人ALP为92.50± 29.34 U/L),本研究患者血ALP平均水平明显高于正常人群对照组(t:2.816,P=0.006),结果有统计学意义。所有患者血钙为2.28±0.25 mmol/L,血磷值为2.06±0.73 mmol/L,iPTH平均为56.48±70.42 pmol/L,腰椎骨密度平均为1.020±0.188 g/cm2,诊断为腰椎骨质疏松22例(15.8%),股骨颈骨密度为0.758±0.158 g/cm2,诊断为股骨颈骨质疏松12例(8.6%)。血ALP值分别与腰椎(r=-0.203, P=0.006)及股骨(r=-0.196, P=0.021)骨密度均负相关(表 1)。
| 表 1 患者的基线资料 Table 1 Baseline demographic and clinical data of the patients |
随访2年内共发生骨折事件21例(15.1%),其中肋骨骨折5例(23.8%),胸椎骨折4例(19.0%),股骨、骨折各3例(14.3%),耻骨骨折2例(9.5%),其余腰椎、锁骨、掌骨、跟骨、趾骨骨折各1例(4.8%),且其中1人多发骨折(4.8%)。骨折事件的发生中有8人有明确外伤史(38.1%),包括上述的股骨、胫骨骨折各3例,锁骨、肋骨及根骨骨折各1例(其中1人多发骨折)。其中A组发生骨折2例,B组发生骨折19例,以χ2检验比较A、B两组患者的骨折发生率,结果提示B组患者骨折发生率显著高于A组(χ2:15.925,P < 0.001)。纳入性别、年龄、透析龄、透析方式、血ALP、钙、磷、iPTH、腰椎骨密度、股骨骨密度等因素,对骨折进行Logistic回归分析,血ALP水平是骨折发生的独立危险因素,差异具有统计学意义(OR:1.010, P=0.001,95%CI:1.004-1.016)。
2.3 基线血ALP、iPTH水平、骨密度值对骨折预测的ROC曲线分析基线血ALP、iPTH、腰椎及股骨骨密度值对骨折预测的ROC曲线分析,结果均有统计学意义,其曲线下面积分别为0.900、0.768、0.351及0.361(若把非骨折(不发生骨折)定为阳性值,腰椎及股骨颈密度对非骨折预测的ROC曲线下面积0.649及0.639)。其中血ALP水平对骨折预测的ROC曲线下面积最大,iPTH次之。观察ROC的移动诊断界点表,提示敏感性和特异性同时达到最高值时ALP的诊断界点为134.5U/L,其时对骨折预测的敏感度85.7%,特异度为90.6%;iPTH的诊断界点为39.9,其时对骨折预测的敏感度71.4%,特异度为67.5%(图 1,表 2)。
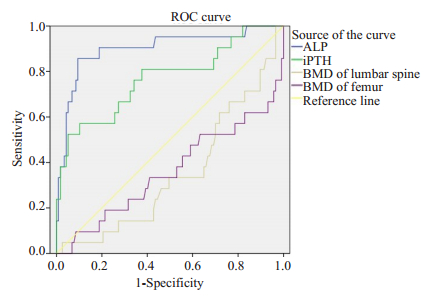
|
图 1 各基线数值对骨折预测的ROC曲线 Figure 1 ROC curve of ALP, iPTH, lumbar spine mineral density and femoral mineral density for predicting fractures. |
| 表 2 各基线数值对骨折预测的ROC曲线分析 Table 2 Receiver-operating characteristic (ROC) curves of the potential risk factor at baseline for predicting fractures |
ALP广泛存在于人体多个脏器及器官,其中包括了肝、肾、骨等。肝脏及成骨细胞是血清中ALP的主要来源,两者约各占50%,分别称为肝源性ALP和骨源性ALP[7]。本研究证明,MD患者血ALP较正常人群对照组明显升高,但其与MD患者骨质疏松、骨折的关系尚待研究。
骨源性ALP是成骨细胞的表型标志物之一,它是成骨细胞分泌的糖蛋白,表达于成骨细胞膜上[8]。正常骨代谢包括破骨和成骨两个过程,血骨源性ALP水平代表总体骨代谢的水平[9]。突变致ALP基因缺失的低磷酸酶血症患者可出现功能性佝偻病或骨软化症[10]。动物实验表明,敲除ALP基因的小鼠基质囊泡周围的生长板和骨出现钙化受损[11],且这种小鼠成骨细胞可正常分化但不能在体外开始矿化[12]。以上研究均表明缺乏ALP可导致骨矿化受损,另外,尚有以下研究结果支持ALP参与了骨矿化。既往研究提示,当ALP的活性升高,矿化即被启动,有机物质中的磷酸被ALP分解,从而增加组织局部无机磷酸的浓度,促进矿化[13]。也有学者报道,高水平ALP与高的骨转运相关[14]。ALP参与骨矿化,与骨质疏松更有着密切关系。普通人群骨质疏松症患者和女性骨质疏松患者的血骨源性ALP与股骨颈和Ward's三角区的骨密度负相关[15]。在血透患者中,也有报道提示血ALP水平与全身总骨密度负相关[16]。我们课题组在另一横断面研究的结果中提示了血ALP对MD患者骨质疏松具有良好的预测价值[17]。本研究也表明基线数值ALP与腰椎及股骨骨密度均负相关。综合本研究与既往研究结果,MD患者血ALP的升高可能与骨质疏松的发生密切相关,并且本研究进一步证实了在MD患者中血ALP的升高与WHO推荐常用于骨质疏松诊断的部位:股骨及腰椎的骨密度均负相关。
在日本,血透患者男、女性髋部骨折的发生率分别是正常人群的6.2及4.9倍[1]。且DOPPS研究数据提示,血透患者髋部骨折发生的平均年龄远低于正常人群,而发生骨折后患者的1年死亡率是没发生骨折透析患者的2.7倍[18]。本研究结果提示,MD患者2年内骨折发生率高达15.1%,骨折可发生于各种类型骨骼。而且骨折除了有明确外伤史所致的骨折外,也有相当部分无明确外伤史的病理性骨折。
高分辨外周计算机断层扫描被证实与慢性肾脏病患者骨活检参数之间存在一致性,特别是在皮质间,为慢性肾脏病患者骨折风险预测提供了新的方法[19]。但其价格昂贵,也未能在临床上得到广泛应用,尤其难在发展中国家推广。
股骨颈骨密度是预测男性和女性髋部骨折的有力预测因子[20]。国内也有资料显示,对中国绝经期妇女,髋骨骨密度是髋骨骨折的独立危险因素[21]。但因为骨密度未能判断慢性肾脏病的病人的骨组织学形态,所以骨密度对该类患者的临床价值尚有争议[22]。本研究发现基线腰椎及股骨颈骨密度值对MD患者2年不发生骨折预测的ROC曲线下面积分别为0.649及0.639,其预测效果欠佳。在慢性肾脏病骨代谢近期评估中,PTH使用较为广泛,也被指南推荐使用。据目前研究可知,PTH对终末期肾脏病患者骨折风险的预测是个类似“U”型的曲线,低于或高于NKF/K-DOQI目标值时患者骨折风险都会升高[23]。但该指标也有一定局限性,研究表明,血iPTH浓度在100~1000 ng/L范围内时,其和骨组织活检中的骨转运程度不一致[24-25]。但大部分MD患者的血iPTH浓度却在此范围内。本研究发现基线血iPTH水平对MD患者2年内骨折事件预测的ROC曲线下面积为0.768,有一定预测价值。血ALP作为一项生物学指标,对普通人群骨折的预测价值已得到证实[3-4]。对慢性肾脏病病人,也有日本研究提示,血透患者血ALP水平与1年内的髋部骨折发生率独立相关[26]。本研究总结了MD患者2年内各个部位骨折的发生情况,经过前瞻性研究,结果提示血ALP水平是MD患者2年骨折发生的独立危险因素,血基线ALP水平对MD患者2年骨折预测的ROC曲线下面积为0.9,表明该指标有较高的预测价值。且本研究以ROC曲线分析,比较了基线骨密度值、血iPTH及ALP水平对MD患者2年内骨折的预测价值,发现血ALP对MD患者2年内骨折预测的ROC曲线下面积最大,表明其预测价值最大。如上所述,骨密度未能判断慢性肾脏病患者的骨组织学形态,但血骨源性ALP却被报道可区分其骨活检中的低转运及非低转运形态[27-29]。而且有学者总结了一系列研究慢性肾脏病患者血骨源性ALP、PTH水平及骨组织关系的文献,发现血骨源性ALP与骨活检中骨形成率之间的相关性比PTH更强,且其对高、低骨转运的诊断准确性比PTH高[28]。且又人发现在维持性血液透析患者中,血骨源性ALP的浓度变化比血iPTH小,所以更支持使用骨源性ALP评估维持性透析患者骨代谢[30]。另外,本研究结果提示血ALP基线水平对MD患者2年骨折预测的敏感度及特异度高达85.7%及90.6%。且血ALP的检测方便、价格便宜,值得临床上推广。
| [1] |
Wakasugi M, Kazama JJ, Taniguchi M, et al. Increased risk of hip fracture among Japanese hemodialysis patients[J].
J Bone Miner Metab, 2013, 31(3): 315-21.
DOI: 10.1007/s00774-012-0411-z. |
| [2] |
Chen L, Jiang W, Huang J, et al. Insulin-like growth factor 2(IGF-2) potentiates BMP-9-induced osteogenic differentiation and bone formation[J].
J Bone Miner Res, 2010, 25(11): 2447-59.
DOI: 10.1002/jbmr.133. |
| [3] |
Cao Y, Liu X, Xu H. Utility of serum tartrate-resistant acid phosphatase isoform 5b, bone alkaline phosphatase and osteocalcin in osteoporotic fractures in Chinese patients[J].
Clin Lab, 2012, 58(7/8): 845-50.
|
| [4] |
Tamaki J, Iki M, Kadowaki E, et al. Biochemical markers for bone turnover predict risk of vertebral fractures in postmenopausal women over 10 years: the japanese population-based osteoporosis (JPOS) cohort study[J].
Osteoporos Int, 2013, 24(3): 887-97.
DOI: 10.1007/s00198-012-2106-7. |
| [5] |
Davina JJ, Priyadarssini M, Rajappa MA, et al. Assessment of bone turnover markers to predict mineral and bone disorder in men with pre-dialysis non-diabetic chronic kidney disease[J].
Clin Chim Acta, 2017, 469(8): 195-200.
|
| [6] |
Jerman A, Lindic J, Skoberne A, et al. Prevalence and risk factors for nonvertebral bone fractures in kidney transplant recipients-a singlecenter retrospective analysis[J].
Clin Nephrol, 2017, 88(1): S101-8.
|
| [7] |
Magnusson P, Degerblad M, Saaf M, et al. Different responses of bone alkaline phosphatase isoforms during recombinant insulin- like growth factor-Ⅰ (IGF-Ⅰ) and during growth hormone therapy in adults with growth hormone deficiency[J].
J Bone Miner Res, 1997, 12(2): 210-20.
DOI: 10.1359/jbmr.1997.12.2.210. |
| [8] |
Hooper NM. Glycosyl-phosphatidylinositol anchored membrane enzymes[J].
Clin Chim Acta, 1997, 266(1): 3-12.
DOI: 10.1016/S0009-8981(97)00161-7. |
| [9] |
Phan TC, Xu J, Zheng MH. Interaction between osteoblast and osteoclast: impact in bone disease[J].
Histol Histopathol, 2004, 19(4): 1325-44.
|
| [10] |
Whyte MP. Physiological role of alkaline phosphatase explored in hypophosphatasia[J].
Ann NYAcad Sci, 2010, 1192(7): 190-200.
|
| [11] |
Anderson HC, Sipe JB, Hessle L, et al. Impaired calcification around matrix vesicles of growth plate and bone in alkaline phosphatasedeficient mice[J].
Am J Pathol, 2004, 164(3): 841-7.
DOI: 10.1016/S0002-9440(10)63172-0. |
| [12] |
Wennberg C, Hessle L, Lundberg P, et al. Functional characterization of osteoblasts and osteoclasts from alkaline phosphatase knockout mice[J].
J Bone Miner Res, 2000, 15(10): 1879-88.
DOI: 10.1359/jbmr.2000.15.10.1879. |
| [13] |
Owen TA, Aronow M, Shalhoub V, et al. Progressive development of the rat osteoblast phenotype in vitro: reciprocal relationships in expression of genes associated with osteoblast proliferation and differentiation during formation of the bone extracellular matrix[J].
J Cell Physiol, 1990, 143(3): 420-30.
DOI: 10.1002/(ISSN)1097-4652. |
| [14] |
Magnusson P, Sharp CA, Magnusson M, et al. Effect of chronic renal failure on bone turnover and bone alkaline phosphatase isoforms[J].
Kidney Int, 2001, 60(1): 257-65.
DOI: 10.1046/j.1523-1755.2001.00794.x. |
| [15] |
Zhao DF, Wang JS, Liu Y, et al. Expressions and clinical significance of serum bone Gla-protein, bone alkaline phosphatase and Cterminal telopeptide of type Ⅰ collagen in bone metabolism of patients with osteoporosis[J].
Pak J Med Sci, 2015, 31(1): 91-4.
|
| [16] |
Park JC, Kovesdy CP, Duong U, et al. Association of serum alkaline phosphatase and bone mineral density in maintenance hemodialysis patients[J].
Hemodial Int, 2010, 14(2): 182-92.
DOI: 10.1111/hdi.2010.14.issue-2. |
| [17] |
潘健怡. 碱性磷酸酶对透析患者血管钙化和骨质疏松的评估价值[J].
广州医药, 2018, 49(3): 10-4.
DOI: 10.3969/j.issn.1000-8535.2018.03.003. |
| [18] |
Tentori F, Mccullough K, Kilpatrick RD, et al. High rates of death and hospitalization follow bone fracture among hemodialysis patients[J].
Kidney Int, 2014, 85(1): 166-73.
DOI: 10.1038/ki.2013.279. |
| [19] |
Marques ID, Araujo MJ, Graciolli FG, et al. Biopsy vs. peripheral computed tomography to assess bone disease in CKD patients on dialysis: differences and similarities[J].
Osteoporos Int, 2017, 28(5): 1675-83.
DOI: 10.1007/s00198-017-3956-9. |
| [20] |
Johnell O, Kanis JA, Oden A, et al. Predictive value of BMD for hip and other fractures[J].
J Bone Miner Res, 2005, 20(7): 1185-94.
DOI: 10.1359/JBMR.050304. |
| [21] |
Fan JX, Li N, Gong XF, et al. Serum 25-hydroxyvitamin D, bone turnover markers and bone mineral density in postmenopausal women with hip fractures[J].
Clin Chim Acta, 2018, 477(7): 135-40.
|
| [22] |
Ott SM. Review article: Bone density in patients with chronic kidney disease stages 4-5[J].
Nephrology (Carlton), 2009, 14(4): 395-403.
DOI: 10.1111/nep.2009.14.issue-4. |
| [23] |
Iimori S, Mori Y, Akita W, et al. Diagnostic usefulness of bone mineral density and biochemical markers of bone turnover in predicting fracture in CKD stage 5D patients--a single-center cohort study[J].
Nephrol Dial Transplant, 2012, 27(1): 345-51.
DOI: 10.1093/ndt/gfr317. |
| [24] |
Moe SM, Chertow GM, Coburn JW, et al. Achieving NKF-K/DOQI bone metabolism and disease treatment goals with cinacalcet HCl[J].
Kidney Int, 2005, 67(2): 760-71.
DOI: 10.1111/j.1523-1755.2005.67139.x. |
| [25] |
Gal-Moscovici A, Popovtzer MM. New worldwide trends in presentation of renal osteodystrophy and its relationship to parathyroid hormone levels[J].
Clin Nephrol, 2005, 63(4): 284-9.
DOI: 10.5414/CNP63284. |
| [26] |
Maruyama Y, Taniguchi M, Kazama JJ, et al. A higher serum alkaline phosphatase is associated with the incidence of hip fracture and mortality among patients receiving hemodialysis in Japan[J].
Nephrol Dial Transplant, 2014, 29(8): 1532-8.
DOI: 10.1093/ndt/gfu055. |
| [27] |
Haarhaus M, Monier-Faugere MC, Magnusson P, et al. Bone alkaline phosphatase isoforms in hemodialysis patients with low versus Non- Low bone turnover: a diagnostic test study[J].
Am J Kidney Dis, 2015, 66(1): 99-105.
DOI: 10.1053/j.ajkd.2015.02.323. |
| [28] |
Sardiwal S, Magnusson P, Goldsmith DA, et al.
Bone alkaline phosphatase in CKD-mineral bone disorder[M]. Am J Kidney Dis, 2013: 810-22.
|
| [29] |
Sprague SM, Bellorin-Font E, Jorgetti VA, et al. Diagnostic accuracy of bone turnover markers and bone histology in patients with CKD treated by dialysis[J].
Am J Kidney Dis, 2016, 67(4): 559-66.
DOI: 10.1053/j.ajkd.2015.06.023. |
| [30] |
Sardiwal S, Gardham C, Coleman AE, et al. Bone-specific alkaline phosphatase concentrations are less variable than those of parathyroid hormone in stable hemodialysis patients[J].
Kidney Int, 2012, 82(1): 100-5.
DOI: 10.1038/ki.2012.77. |
 2018, Vol. 38
2018, Vol. 38

