2. 蚌埠医学院人体解剖学教研室,安徽 蚌埠 233030;
3. 芜湖市繁昌县中医医院妇产科,安徽 芜湖 241200;
4. 中国科学院上海生命科学研究院,上海 200233;
5. 蚌埠医学院第一附属医院妇产科,安徽 蚌埠 233000
2. Department of Human Anatomy, Bengbu Medical College, Bengbu 233030, China;
3. Department of Obstetrics and Gynecology, Wuhu Fanchang Hospital of Traditional Chinese Medicine, Wuhu 241200, China;
4. Shanghai Institute of life Science, Chinese Academy of Sciences, Shanghai 200233, China;
5. Department of Obstetrics and Gynecology, First Affiliated Hospital of Bengbu Medical College, Bengbu 233000, China
间充质干细胞(MSCs)是具有不断自我更新和多向分化潜能的基质细胞[1-2]。在特定的诱导条件下,这些细胞能够分化为成骨细胞、软骨细胞、脂肪细胞等,因而在细胞再生医学上具有重要的临床意义[3-4]。然而调控间充质干细胞命运(细胞增殖、分化、凋亡)的分子机制尚不明确[5]。miRNAs是机体内源性长度为20~25 nt的单链RNA分子,通过碱基互补配对与靶基因结合来调控其表达[6]。近些年的研究表明,miRNAs参与调控机体多种生理过程,其中包括细胞增殖、分化与凋亡[7-9]。研究表明miR-346通过调控Wnt/β-catenin通路在间充质干细胞成骨分化中起着重要作用[10];在细胞中的研究发现,miR-27a在成骨细胞hFOB中通过与靶基因sFRP1的结合调控细胞增殖、凋亡与分化过程[11]。
miR-144-3p参与多种癌细胞的增殖分化过程,属于公认的抑癌因子,其能够抑制肝癌细胞[12]、肺癌细胞[13]以及恶性胶质瘤细胞的增殖[14-16];康等通过基因芯片技术检测到miR-144-3p在间充质干细胞成骨分化中表达降低,表明miR-144-3p可能参与间充质干细胞分化过程中[17]。然而关于miR-144-3p是如何参与调控间充质干细胞分化,以及其靶基因的研究未见报道。为此,我们通过在体外诱导大鼠骨髓间充质干细胞的成骨分化,来研究miR-144-3p的生理功能和作用机制,现将结果报道如下:
1 材料和方法 1.1 试剂和仪器DMEM培养液、胎牛血清购自美国Gbico,0.25%胰酶购自美国Invitrogen,ALP活性检测试剂盒购自南京建成生物工程有限公司,CO2细胞培养箱(德国,Heraeus),OLYMPUS倒置显微系统(TH4-200,日本),地塞米松、β-甘油磷酸钠、维生素C均购自美国Sigma,Western Blotting ECL化学发光检测试剂盒购自美国Bio-Rad,罗氏LightCycler480荧光定量PCR仪,smad4与β- Actin抗体均购自Abcam,TaqMan® MicroRNA Reverse Transcription kit试剂盒购自美国应用生物系统公司(ABI)。
1.2 实验细胞株与复苏实验过程中采用的大鼠骨髓间充质干细胞是Wistar大鼠骨髓间充质干细胞,购自中国科学院上海细胞库。由液氮罐中迅速取出冻存的细胞,至于37 ℃水浴锅解冻,然后接种于一次性细胞培养瓶(25 cm2)中,加入新鲜DMEM培养液5 mL,放入5% CO2培养箱内37 ℃培养,每2 d换液1次。当贴壁细胞融合度达到90%左右时,再进行传代(用0.25%的胰酶消化),对细胞进行计数后按1×105/mL浓度接种继续培养,用传至第3~5代的细胞进行诱导分化实验。
1.3 成骨诱导分化当细胞生长密度在80%时,弃掉旧的培养液,用PBS清洗2遍,加入细胞成骨分化诱导培养液,放入37℃ CO2培养箱培养,细胞成骨分化诱导过程中,每3 d更换1次新鲜的成骨诱导培养液,整个成骨诱导过程持续3周时间,显微镜下观察细胞的生长状况以及形态变化。
1.4 ALP活性检测按照ALP活性检测试剂盒说明书,在空白管、标准管、测试管中分别加入50 µL ddH2O,0.1 mg/mL标准应用液和待测蛋白,另外各管中均加入0.5 mL缓冲液和基质液,混匀后37 ℃水浴20 min,然后每管中加入1.5 mL显色液,置于酶标仪上检测A530 nm波长下各管吸光度值,代入标准曲线公式计算ALP活性。
1.5 细胞的转染本试验采用Life technologies的Lipofectamine 2000进行转染。转染过程如下:在进行转染12~24 h前,取1瓶生长状况良好且细胞生长密度在80%左右的细胞,用胰蛋白酶消化后,加入适量的细胞生长培养液,用吸管将细胞完全吹散并形成均匀的细胞悬液,向24孔板中每孔加入500 µL的细胞悬液,轻轻晃动培养板,摇匀后置于37 ℃,5% CO2细胞培养箱中培养12~24 h。转染时,细胞培养板中的细胞生长密度应达到80%以上。取miR-144-3p mimic、miR-144-3p inhibitor以及miR-NC转染质粒加入到50 µL OPTI-MEM溶液中,取1.5 µL Lipofectamine 2000同样加入50 µL OPTI-MEM溶液,室温静止5 min;混匀上述溶液,室温静置20 min。用无菌吸管吸去接种在24孔板中的旧的细胞培养液,用PBS清洗细胞两次,加入450 µL新鲜的细胞培养液;往24孔板中每个孔加入等量的混合液,混合均匀后,放入37 ℃,5% CO2细胞培养箱培养48 h;培养48 h后收集细胞,提取总RNA以及总蛋白,用于qRT-PCR定量和Western blot检测;转染48 h后继续对细胞进行成骨诱导。
1.6 qRT-PCR以及Western blot检测 1.6.1 qRT-PCR检测RNA水平的表达按照ABI的TaqMan® MicroRNA Reverse Transcription kit试剂盒操作说明书,对抽提的RNA进行体外反转录实验,得到cDNA产物;反应条件为:16 ℃,孵育30 min,42 ℃孵育30 min,85 ℃加热5 min,4 ℃保存。以得到的cDNA为模版,进行荧光定量PCR,采用TaqMan® Universal PCR Master Mix 20 µL反应体系,在罗氏LightCycler480仪器上操作,以U6作为表达检测的内参,∆CT表示miR- 144-3p的相对表达,其中∆CT=CTU6-CTmiR-144-3p,Runx2的相对表达量为∆ CT=CTβ-actin-CT Runx2,Smad4的相对表达量为∆CT=CTβ-actin-CT OCN,反应条件为:95 ℃,预变性10 min;95 ℃ 15 s,60 ℃ 30 s,70 ℃ 30 s进行40个循环的扩增,引物信息见表 1。
| 表 1 各引物序列信息 Table 1 Sequence of primers used for qRT-PCR |
分别取各转染组等量细胞,加入10×的蛋白变性缓冲液,100 ℃变性5 min,将变性之后的蛋白液加入12.5% SDS-PAGE胶,90 V恒压电泳100 min,至溴酚兰跑出变性胶即可终止电泳,然后进行后续的转膜操作;取SDS-PAGE胶置于硝酸纤维素膜上,进行恒流转移,转膜完成后,采用3% BSA进行4 ℃封闭过夜,封闭完成后,先采用PBS缓冲液对硝酸纤维素膜进行洗涤,按1:500浓度加入smad4单克隆抗体,室温孵育45 min,然后采用PBS缓冲液对硝酸纤维素膜进行洗涤;开始二抗的孵育,按照1:1000加入HRP标记的二抗,室温孵育30 min,然后用BS缓冲液洗涤硝酸纤维素膜,之后向膜上加入ECL化学发光剂进行化学发光,采用Kodak X进行曝光3 min左右,对硝酸纤维素膜进行成像。对成像之后的胶片,采用密度扫描仪对各个条带的吸光度值进行定量,以β-actin作为内参照,使用其灰度值差值,来表示smad4的相对表达量。
1.7 碱性磷酸酶染色以及茜素红染色 1.7.1 碱性磷酸酶染色弃去6孔板中的细胞培养液,采用PBS清洗细胞3次,然后加入1.5 mL固定液,室温静置30 s;弃去固定液,采用PBS清洗细胞2次,然后加入1.5 mLALP染色液,室温避光保存15 min;弃去染色液,加入蒸馏水清洗细胞3次,自然风干,观察细胞染色结果。
1.7.2 茜素红染色弃去细胞培养液,采用PBS清洗细胞3次,然后加入4%的多聚甲醛固定细胞,室温静置30 min;弃去多聚甲醛,采用PBS清洗细胞2次,加入2%的茜素红染色液,室温染色15 min;弃去染色液,加入蒸馏水清洗细胞3次,观察细胞染色结果。
1.8 靶基因预测miRNA靶基因的预测运用国际公认的模式物种靶基因预测数据库TargetScan、PicTar和miRanda对miRNA进行靶基因的预测,并取三者预测结果的交集作为靶基因,以提高预测结果的准确性和可靠性。
1.9 统计分析数据采用SPSS21.0统计软件进行分析,其中计量资料采用均数±标准差表示,两组间比较采用t检验进行统计分析,多组间比较则采用单因素的方差分析,P < 0.05认为差异有统计学意义。
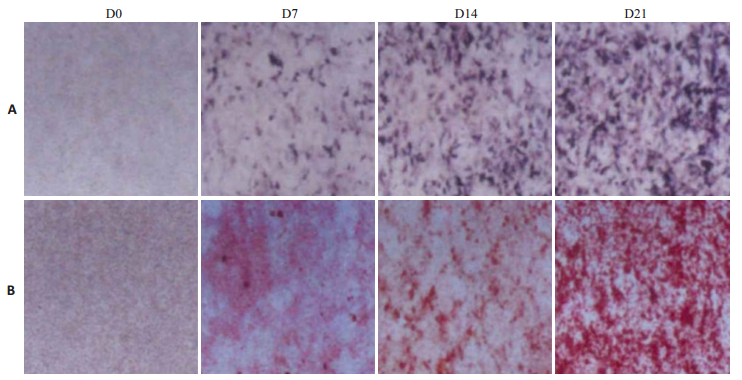
2 结果 2.1 miR-144-3p在成骨诱导过程中的表达变化在体外对大鼠骨髓间充质干细胞进行成骨分化的诱导,在第0、7、14、21天时分别收集细胞,进行qRT-PCR的检测发现,随着间充质干细胞诱导成骨时间的延长,与成骨相关基因的表达水平逐渐升高,在第21天达到最高水平,不同时期的表达水平相互比较,差异有统计学意义(P < 0.05);而miR-144-3p的表达水平则逐渐下降,在第21天达到最低水平,不同时期的表达水平相互比较,差异有统计学意义(P < 0.05,表 2);碱性磷酸酶染色以及茜素红染色结果表明,随着诱导成骨时间的延长,细胞中碱性磷酸酶染色以及茜素红染色逐渐加深(图 1)。
| 表 2 成骨分化过程中基因的表达变化 Table 2 Expression of the marker genes of osteogenic differentiation and miR-144-3p in rat BMSCs during induced differentiation (n=6) |
|
图 1 诱导成骨分化不同时期细胞染色结果 Figure 1 Rat BMSCs in different stages of osteogenic differentiation (Original magnification: ×100). A: Alkaline phosphatase staining; B: Alizarin red staining. |
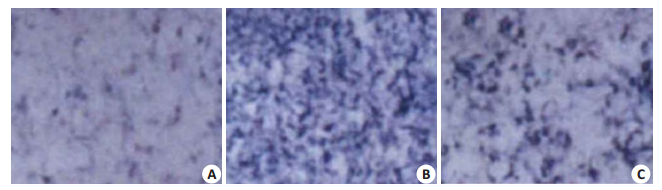
对转染后各组细胞中miR-144-3p的表达进行qRTPCR检测发现,转染miR-144-3p mimic组,miR-144-3p表达相比于转染前显著升高(P < 0.05),而miR-144-3p inhibitor组相比于转染前表达水平显著降低,差异有统计学意义(P < 0.05);阴性对照miR-NC组的细胞,在转染前后miR-144-3p的表达水平无显著变化(P > 0.05)。成骨诱导分化21 d后,对3组细胞中miR-144-3P的表达进行定量分析发现,miR-144-3p inhibitor组中其表达水平最低,miR-144-3p mimic组表达水平最高,相比于阴性对照组差异有统计学意义(P < 0.05);同时还对诱导成骨分化21 d后的各组细胞,进行了ALP活性测定,其中miR-144-3p inhibitor组细胞ALP活性最高,而miR-144-3p mimic组细胞ALP活性最低,相比于阴性对照miR-NC组差异有统计学意义(P < 0.05,表 3,图 2)。
| 表 3 各组细胞转染前后miR-144-3P表达的变化 Table 3 Comparison of miR-144-3P expression and ALP activity in rat BMSCs with different transfection protocols (n=6) |
|
图 2 各组碱性磷酸酶染色结果 Figure 2 Results of alkaline phosphatase staining of rat BMSCs with different transfection protocols (× 100). A: Cells transfected with miR-144-3p mimic; B: Cells transfected with miR-144-3p inhibitor; C: Cells transfected with miR-NC. |
通过定量PCR检测诱导分化21 d后各组细胞中,Runx2以及OCN基因的相对表达发现,miR-144-3p mimic组Runx2以及OCN的相对表达量最低,而miR-144-3p inhibitor组Runx2以及OCN的相对表达量则最高,相比于miR-NC对照组差异有统计学意义(P < 0.05,表 4)。
| 表 4 各组细胞中Runx2以及OCN的相对表达量 Table 4 Expression of Runx2 and OCN in rat BMSCs with different transfection protocols (n=6) |
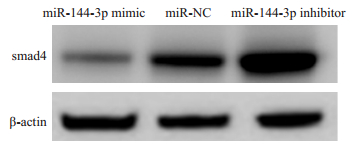
运用多种靶基因预测数据库TargetScan、microRNA.org和miRanda对miRNA进行靶基因的预测分析发现,smad4基因的3'非编码区存在多个miR-144-3p潜在结合位点,表明其可能是miR-144-3p的靶基因。通过不同方法检测smad4的表达发现,在RNA水平上3组的相对表达量相当,差异无统计学意义(P > 0.05,表 5);进一步通过Western blotting在蛋白水平上检测smad4的表达发现,其中miR-144-3p inhibitor组smad4的表达水平最高,而miR-144-3p mimic组smad4蛋白的表达水平最低,相比于miR-NC组差异均有统计学意义(P < 0.05,表 5,图 3)。
| 表 5 各组细胞中smad4表达变化 Table 5 Expression of smad4 in different groups (n=6) |
|
图 3 Western blotting检测各组中smad4的表达 Figure 3 Detection of the expression of smad4 by Western blotting. |
miRNA是一类具有基因调控功能的内源性非编码小分子RNA,其长度在18~25 nt,通过与其靶基因非编码区的碱基配对结合,抑制靶基因的表达和翻译过程,参与个体的发育,细胞的增殖,凋亡与分化[18-20]。研究证实miRNA可调控至少有30%的人类蛋白编码基因的表达,发挥着比蛋白编码基因更重要的作用[21-22]。骨的生成受机体的严密调控,贯穿于胚胎骨组织开始形成到骨骼完全发育成熟以及修复和改建的始终[21]。BMSCs属于成体干细胞,来源于脏胎发育早期的中胚层化及外胚层,具有自我更新和多向分化能力[22]。经诱导可分化为多种组织细胞如成骨细胞、成脂肪细胞以及成软骨细胞等[23]。近年来,大量研究表明miRNA与BMSCs的成骨分化有密切的关系[15-17]。miRNA可通过不完全互补配对识别多个与成骨相关的mRNA,直接调控该类别mRNA表达从而参与机体的成骨分化过程[24]。国外学者曾报道,在小鼠ST2成骨细胞分化中,miR-125b的表达显著下降,而通过下调miR-125b,能够促进BMP4诱导的T2成骨细胞分化进程[25];在BMSCs中miR-218与Wnt通路相互作用,正调控在BMSCs的成骨分化过程[23]。
本研究通过在体外诱导大鼠骨髓间充质干细胞的分化过程,研究miR-144-3p的生理功能和作用机制发现,在诱导分化的过程中,miR-144-3p的表达水平逐渐下降,成骨细胞相关基因的表达逐渐升高;通过细胞转染实验,抑制细胞内源miR-144-3p的表达发现,细胞ALP活性显著升高,成骨细胞相关基因的表达也出现明显高表达,相比于阴性对照组差异有统计学意义(P < 0.05);当骨髓间充质干细胞中miR-144-3p的表达升高后,细胞ALP活性显著下降,成骨细胞相关基因的表达也出现下调,相比于阴性对照组差异有统计学意义(P < 0.05);表明在骨髓间充质干细胞中,miR-144-3p参与细胞成骨分化的过程中,高表达的miR-144-3p能够抑制大鼠骨髓间充质干细胞向成骨细胞的分化过程。进一步对miR-144-3p的靶基因进行预测发现,smad4的3'非编码区存在着与其结合的位点,通过实验进一步验证发现,提高或抑制细胞中miR-144-3p的表达,均不会影响smad4在RNA水平的转录,差异无统计学意义(P > 0.05),而通过Western blotting在蛋白水平对smad4检测发现,当提高细胞内源miR-144-3p的表达时,smad4蛋白的表达水平显著降低,而抑制内源miR-144-3p的表达时,smad4蛋白的表达水平显著升高,表明miR-144-3p可能与smad4 RNA的3'非编码区结合,通过转录后水平调控smad4蛋白的表达。smad4是TGF-β信号通路下游一个重要的转录调控因子并且参与TGF-β信号转导过程,BMP2/smad4在细胞成骨分化过程中具有重要作用,暗示smad4可能是细胞成骨分化过程中的一个关键信号蛋白[26];在BMP-4诱导成骨分化过程中,抑制smad4表达会抑制成骨分化[27];而在原代成骨细胞中敲除smad4基因的表达,同样也会抑制成骨分化的进程[26];我们的研究中发现,当提高细胞内源miR-144-3p的表达时,smad4蛋白的表达水平显著降低,而间充质干细胞成骨分化过程也被抑制,表明miR-144-3p是通过转录后修饰对smad4的表达水平进行调控,从而干扰成骨分化过程。
综上所述,在大鼠骨髓间充质干细胞成骨分化过程中,miR-144-3p通过碱基互补配对结合smad4 mRNA的3'非编码区,参与其转录后水平的调控,从而下调smad4蛋白的表达,抑制间充质干细胞成骨分化。至于miR-144-3p是否还与其他基因结合,是否会参与分化过程中信号的传导等,还需要进一步的实验研究。
| [1] |
师彬, 杨武斌, 王平. 骨髓间充质干细胞诱导分化成骨细胞的研究现状[J].
中国实验方剂学杂志, 2014, 20(19): 228-31.
|
| [2] |
雷栓虎, 岳海源, 汪静, 等. 骨髓间充质干细胞诱导分化成骨方法的研究与进展[J].
中国组织工程研究, 2013, 17(6): 1101-6.
|
| [3] |
周鑫, 赵佳佳, 陈莉莉. 调节骨髓间充质干细胞成骨成脂分化的因素[J].
中国组织工程研究, 2017, 21(17): 2759-65.
DOI: 10.3969/j.issn.2095-4344.2017.17.022. |
| [4] |
胡伟涛, 赵建江, 孙翔, 等. 人骨髓间充质干细胞成骨分化早期相关的长链非编码RNA的初步研究[J].
中山大学学报:医学科学版, 2016, 37(3): 384-9.
|
| [5] |
赵培庆, 王连庆, 李涛. 间充质干细胞成骨分化过程中长链非编码RNA调控作用研究进展[J].
中国医药导报, 2015(18): 35-8.
|
| [6] |
邹翰林, 郭永飞, 刘岩. 骨髓间充质干细胞成骨分化中的微小RNA及Wnt通路[J].
中国组织工程研究, 2013, 17(10): 1896-900.
DOI: 10.3969/j.issn.2095-4344.2013.10.029. |
| [7] |
Seok H, Ham J, Jang ES, et al. Micro RNA target recognition: insights from transcriptome-wide non-canonical interactions[J].
Mol Cells, 2016, 39(5): 375-81.
DOI: 10.14348/molcells.2016.0013. |
| [8] |
Ha M, Kim VN. Regulation of microRNA biogenesis[J].
Nat Rev Mol Cell Biol, 2014, 15(8): 509-24.
DOI: 10.1038/nrm3838. |
| [9] |
de Nigris F. Epigenetic regulators: Polycomb-miRNA circuits in cancer[J].
Biochim Biophys Acta, 2016, 1859(5): 697-704.
DOI: 10.1016/j.bbagrm.2016.03.005. |
| [10] |
Wang Q, Cai J, Cai XH, et al. miR-346 regulates osteogenic differentiation of human bone marrow-derived mesenchymal stem cells by targeting the Wnt/β-catenin pathway[J].
PLoS One, 2013, 8(9): e72266.
DOI: 10.1371/journal.pone.0072266. |
| [11] |
Guo D, Li Q, Lv Q, et al. MiR-27a targets sFRP1 in hFOB cells to regulate proliferation, apoptosis and differentiation[J].
PLoS One, 2014, 9(3): e91354.
DOI: 10.1371/journal.pone.0091354. |
| [12] |
Cao T, Li H, Hu Y, et al. miR-144 suppresses the proliferation and metastasis of hepatocellular carcinoma by targeting E2F3[J].
Tumour Biol, 2014, 35(11): 10759-64.
DOI: 10.1007/s13277-014-2017-7. |
| [13] |
Zhao M, Huang J, Gui K, et al. The downregulation of miR-144 is associated with the growth and invasion of osteosarcoma cells through the regulation of TAGLN expression[J].
Int J Mol Med, 2014, 34(6): 1565-72.
DOI: 10.3892/ijmm.2014.1963. |
| [14] |
Chen S, Li P, Li J, et al. MiR-144 inhibits proliferation and induces apoptosis and autophagy in lung cancer cells by targeting TIGAR[J].
Cell Physiol Biochem, 2015, 35(3): 997-1007.
DOI: 10.1159/000369755. |
| [15] |
Cai H, Xue Y, Wang P, et al. The long noncoding RNA TUG1 regulates blood-tumor barrier permeability by targeting miR-144[J].
Oncotarget, 2015, 6(23): 19759-79.
|
| [16] |
Lan F, Yu H, Hu M, et al. miR-144-3p exerts anti-tumor effects in glioblastoma by targeting c-Met[J].
J Neurochem, 2015, 135(2): 274-86.
DOI: 10.1111/jnc.13272. |
| [17] |
康夏, 康菲, 杨波, 等. miRNA-144靶向调节钙粘蛋白11对间充质干细胞成骨分化的抑制效应[J].
第三军医大学学报, 2013, 35(10): 922-6.
|
| [18] |
周林林, 郭乐, 汤建中, 等. miR-144通过靶向Atg4a调控卡介苗和雷帕霉素诱导的RAW264.7细胞自噬[J].
细胞与分子免疫学杂志, 2015, 31(2): 163-7.
|
| [19] |
Wang Y, Zhang XW, Li H, et al. The role of miRNA-29 family in cancer[J].
Eur J Cell Biol, 2013, 92(3): 123-8.
DOI: 10.1016/j.ejcb.2012.11.004. |
| [20] |
张倍源. 补肾活血方调控microRNA-210促进BMSCs成骨分化的研究[J].
中国骨质疏松杂志, 2014, 20(4): 396-9.
|
| [21] |
齐磊. miR-34b对骨髓间充质干细胞成骨分化的影响及相关机制[J].
临床与病理杂志, 2016, 36(7): 898-904.
|
| [22] |
Liu H, Sun Q, Wan CY, et al. MicroRNA-338-3p regulates osteogenic differentiation of mouse bone marrow stromal stem cells by targeting Runx2 and Fgfr2[J].
J Cell Physiol, 2014, 229(10): 1494-502.
DOI: 10.1002/jcp.v229.10. |
| [23] |
Hassan MQ, Maeda Y, Taipaleenmaki H, et al. miR-218 directs a Wnt signaling circuit to promote differentiation of osteoblasts and osteomimicry of metastatic cancer cells[J].
J Biol Chem, 2012, 287(50): 42084-92.
DOI: 10.1074/jbc.M112.377515. |
| [24] |
代光明, 任磊, 陈虹, 等. 下调骨细胞TGF-β/Smad4信号可抑制小鼠BMSCs成骨及破骨分化[J].
基础医学与临床, 2017, 37(6): 786-91.
DOI: 10.3969/j.issn.1001-6325.2017.06.009. |
| [25] |
Hirata-Tsuchiya S, Fukushima H, Katagiri T, et al. Inhibition of BMP2-induced bone formation by the p65 subunit of NF-κB via an interaction with Smad4[J].
Mol Endocrinol, 2014, 28(9): 1460-70.
DOI: 10.1210/me.2014-1094. |
| [26] |
Liang W, Lin M, Li X, et al. Icariin promotes bone formation via the BMP-2/Smad4 signal transduction pathway in the hFOB 1.19 human osteoblastic cell line[J].
Int J Mol Med, 2012, 30(4): 889-95.
DOI: 10.3892/ijmm.2012.1079. |
| [27] |
Salazar VS, Zarkadis N, Huang L, et al. Embryonic ablation of osteoblast Smad4 interrupts matrix synthesis in response to canonical Wnt signaling and causes an osteogenesis-imperfecta-like phenotype[J].
J Cell Sci, 2013, 126(Pt 21): 4974-84.
|
 2018, Vol. 38
2018, Vol. 38

