2. 佛山市南海区人民医院普外一科,广东 佛山 528000
2. First Department of General Surgery, Nanhai People's Hospital, Foshan 528000, China
半乳糖凝集素-3(Gal-3)是一种多功能半乳糖蛋白,表达于胃、乳腺、前列腺等正常组织细胞中,参与包括细胞生长、增殖和凋亡、纤维化形成、细胞黏附及肿瘤浸润与转移等病理、生理过程[1]。骨髓间充质干细胞(BMSCs)是来源于中胚层的成体干细胞,具有自我复制功能和分化潜能,能够释放多种祖细胞,再分化为各种功能性的细胞,如肝细胞、骨细胞、脂肪细胞及内胚层来源的细胞等[2],还能参与肝脏的修复、细胞更新、功能重建等过程[3]。由于目前干细胞分化的机制尚未明确,临床应用也远未达到预期效果,阐明干细胞分化的机理以及高效地诱导BMSCs向肝样细胞分化,是目前研究的方向,也是其应用于临床肝脏疾病治疗的关键。吴增城等[4]利用HGF与Gal-3在体外与BMSCs联合培养,经诱导后的干细胞能够分泌肝细胞的特异性产物如AFP、ALB等,表明Gal-3是一个有能力促进大鼠骨髓间充质干细胞向肝细胞分化的因子。但是Gal-3是否能单独诱导BMSCs肝样分化,以及其诱导分化的效率、机制目前尚不明确。本研究通过单独利用GAL-3与BMSCs共培养以进一步验证Gal-3对BMSCs诱导分化的作用,并在此过程中运用基因芯片技术,研究其中所涉及的信号通路及机制。
1 材料和方法 1.1 材料SD大鼠骨髓间充质干细胞:由SD大鼠(中山大学动物实验中心)原代细胞分离。大鼠肝细胞BRL3A(广州铭善上);Murine HGF、Human Galectin-3(Peprotech);大鼠CK-18抗体、大鼠AFP抗体、Anti-YAP1抗体(Abcam);抗大鼠CD29 APC、抗大鼠CD44H PE、抗大鼠CD90 FITC、抗大鼠CD45 APC(eBioscience);抗大鼠CD34 FITC(Bioss);RNA提取剂Trizol(Invitrogen);RNeasy MinElute纯化试剂盒(QIAGEN);间充质干细胞基因芯片Mesenchymal Stem Cell PCR Array(QIAGEN)。XMU-MP-1(MedChemExpress,MST1/2抑制剂)。ABI7500荧光PCR仪(ABI);凝胶成像系统(上海天能);核酸蛋白测定仪(Eppendorf)。
1.2 方法 1.2.1 大鼠股骨骨髓间充质干细胞的提取、分离与传代培养采用颈椎脱臼的方式处死SD大鼠,移入超净台。取腹正中线切口,暴露股骨,将股骨两端剪断,用注射器吸取低糖培养液多次冲洗骨髓腔,并冲出骨髓,制备为单细胞悬液。接种在培养瓶中,把细胞放入37 ℃、5% CO2饱和湿度的培养箱中培养,采用差异贴壁法培养,每3 d更换培养液,将不贴壁的细胞祛除。按照1:3传代,重复上述步骤。
1.2.2 细胞表面抗原流式鉴定BMSCs细胞计数,调整细胞浓度为1×106/100 μL。空白对照管,同型对照管加入1 μL mouse IgG1-FITC一抗,室温避光孵育;检测管加入各1 μL检测抗体,室温避光孵育。加入500 μL PBS离心管洗涤1次。补0.2 mL PBS重悬细胞。检测CD29、CD44、CD90、CD34和CD45等细胞表面抗原,鉴定是否符合干细胞特性。
1.2.3 实验分组A组:SD大鼠BMSCs;B组:SD大鼠BMSCs+0.5 µg/mL Gal-3;C组:SD大鼠BMSCs+ 20ng/mLHGF;D组:SD大鼠BMSCs+0.5µg/mLGal-3+ 20 ng/mLHGF;E组:大鼠肝细胞。
1.2.4 细胞形态学观察A、B、C、D组在开始诱导后的7、14、21、28 d 4个时间点,用显微镜观察细胞变化,并作糖原染色(PAS)观察。E组直接行镜下观察及糖原染色观察。用Imagej软件对糖原染色的结果进行数据分析。
1.2.5 实时定量PCR在7、14、21、28 d 4个时间点收集细胞利用Q-PCR检测AFP、CK-18及ALB。E组直接检测AFP、CK-18及ALB。用Trizol溶液提取总RNA作为模板,反转录合成cDNA,内参片段β-actin-150 bp,目的片段:AFP-130 bp;CK18-150 bp;ALB-120 bp。引物序列:AFP-F1:5'GGACTGGCCGACATTTACAT;AFPR1:5'CCCTCAGAAAGCTGGTGATG;CK18-F1:5'GGAATCAGAGCTGGCACAAA;CK18-R1:5'GCGT CGTTGAGACTGAAATC;ALB-F1:5'TCTATGCCCC AGAACTCCTT;ALB-R1:5'CTTTCTCTTTCACGGC ATCA;β-actin-R:5'GAACCGCTCATTGCCGATAG。反应条件为:50 ℃条件下2 min;95 ℃条件下2 min;95 ℃条件下15 s,最后在60 ℃时32s后读板,40循环。
1.2.6 Western blot检测A、B、C、D组在7、14、21、28 d 4个时间点收集细胞行Western blot检测AFP、CK-18及ALB。E组直接行Westernblot检测AFP、CK-18及ALB。用RIPA裂解细胞,提取细胞蛋白质,测定蛋白含量,行SDS-PAGE电泳。将PVDF膜分别加入稀释好的一抗及二抗,化学发光显影后用凝胶图象处理系统分析。
1.2.7 基因芯片检测取B组细胞,在诱导后0、14、28 d利用PCR芯片进行检测。每50~100 mg组织样品,加入TRIZOL试剂匀浆,将RNA沉淀、清洗,再重新溶解。用DNaseⅠ消化RNA样品,去除其中可能含有的基因组DNA,再用RNeasy MinElute纯化试剂盒进行RNA纯化。测定RNA的浓度和纯度后,用SuperScript.ⅢReverse Transcriptase行RNA逆转录,合成cDNA。将混合液加入到间充质干细胞基因芯片(Mesenchymal Stem Cell PCRArray,德国QIAGEN)对应的每个孔中,进行实时定量PCR反应。分别将14 d、28 d的基因表达与0 d的基因表达进行对比,以2-ΔCt计算差异倍数进行数据分析。
1.2.8 Hippo信号通路的研究将BMSCs分组进行诱导,分组如下:Ⅰ组:SD大鼠BMSCs;Ⅱ组:SD大鼠BMSCs+ 0.5 µg/mL Gal-3;Ⅲ组:SD大鼠BMSCs+0.5 µg/mL Gal-3+5 μg/mL XMU-MP-1(Hippo信号通路MST1/2抑制剂);Ⅳ组:大鼠肝细胞。Ⅰ、Ⅱ、Ⅲ组在诱导28天后Western blot检测YAP、P-YAP、ALB、AFP、CK-18,Ⅳ组大鼠肝细胞直接行Western blot检测。
1.3 统计学方法以上数据计量资料以均数±标准差表示,多样本间均数比较采用方差分析,并进行两两对比。所有数据经SPSS20.0统计软件进行分析,P < 0.05认为差异显著,具有统计学意义。
2 结果 2.1 大鼠骨髓间充质干细胞的鉴定SD大鼠股骨骨髓分离出的细胞培养24 h后,在倒置显微镜下观测细胞形态可见大部分细胞贴壁,逐渐增殖,形状呈卵圆形、长梭形或多角型生长,以梭形占较大多数。取第4代培养的细胞利用流式细胞技术检测,结果见骨髓间充质干细胞表面分子CD29、CD44和CD90表达均高于95%;而造血系干细胞标记分子CD34和CD45表达低于5%。符合骨髓间充质干细胞特性(图 1)。
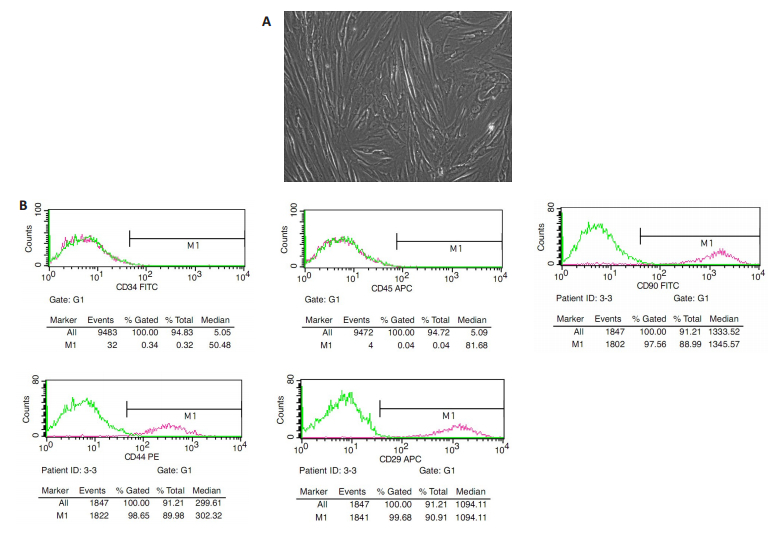
|
图 1 SD大鼠骨髓间充质干细胞的鉴定 Figure 1 Identification of bone marrow mesenchymal stem cells (BMSCs) from SD rats. A: Morphology of the BMSCs (Original magnification: ×100); B: Immunophenotype of the BMSCs detected using flow cytometry. |
A组细胞形态均一,呈梭形、长条状,呈集落、旋涡状生长,有一定的方向性,细胞数量增多。B、C、D组7 d时,细胞开始贴壁生长,形态从原来的长梭形,开始变短、变圆,部分细胞呈短梭形;培养14~21 d后,部分细胞逐渐变成纺锤、卵圆形或多边形,逐渐出现聚集生长状况;培养至28 d时,各组细胞数量逐渐变多,形态越发与肝细胞相似,大多细胞呈类圆形、立方形,呈铺路石样改变,形成岛状连接成片。其中以D组28 d时细胞形态变化最为明显,与肝细胞相对比相似度最高(图 2A)。取各组各时间点细胞进行糖原染色鉴定,结果可见肝细胞明显染色,B、C、D组随时间推移染色率(IOD/Area)逐渐增多。28 d时A组无明显染色,D组染色率最高,且与B、C组有明显差异(P < 0.05),B、C组间无明显差异(P > 0.05,图 2B、C)。
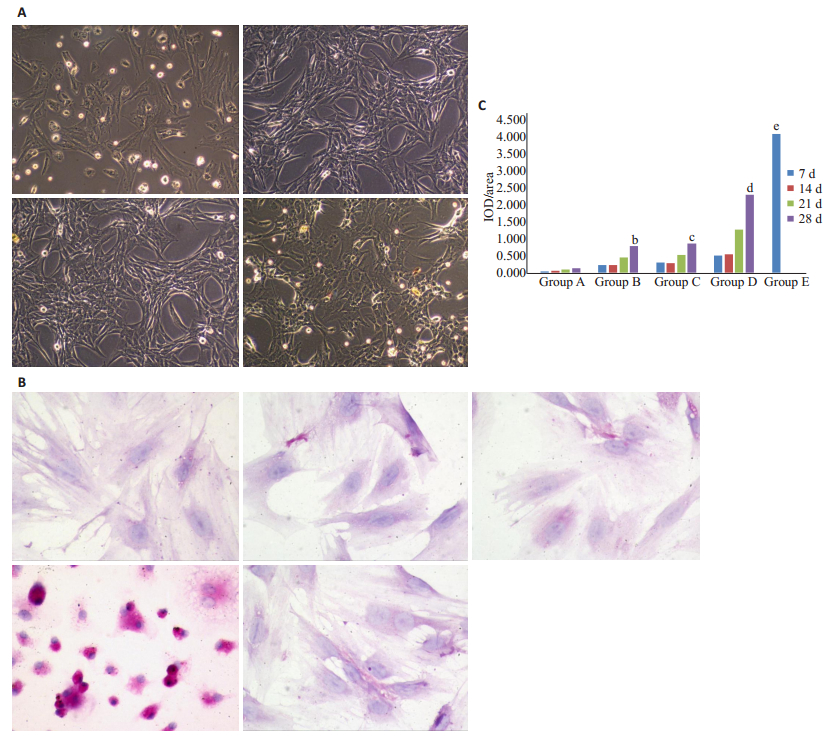
|
图 2 诱导后骨髓间充质干细胞向肝细胞形态转化 Figure 2 Morphological transformation of BMSCs into hepatocytes after induction. A: Morphology of rat BMSCs at 28 days (Original magnification: × 100); B: PAS staining of rat BMSCs at 28 days (× 400); C: Comparison of PAS staining IOD/area among the groups at different time points. b vs d, c vs d, d vs e, P < 0.05. |
取相对定量的方法检测目的基因的表达变化,按照2-ΔΔCT法对数据进行统计分析。7 d时,A组AFP表达显著低于其余各组(均有P < 0.001),B组显著低于C组和D组(均有P < 0.05)。14 d时,B组CK-18显著高于C组(P=0.003)。21 d时,A组各指标表达依然最低,B组AFP显著低于C组(P= 0.010),B组ALB与C组差异不显著。28 d时,A组AFP、ALB、CK-18表达显著低于其余各组(AFP、ALB: P < 0.001, CK-18: P < 0.01),B组与C组无显著差别,但显著低于D组(AFP: P=0.011, CK-18、ALB: P < 0.01)。28 d时B、C、D组的ALB、CK-18与E组的基因表达接近,但仍有差异(均有P < 0.05,图 3A)。诱导过程中,B、C、D组的CK18与AFP升幅各有先后,随着时间延长,各指标变化趋势基本一致,且28 d时B组与C组各指标较接近(均有P < 0.05),说明Gal-3的最终诱导效率接近HGF。
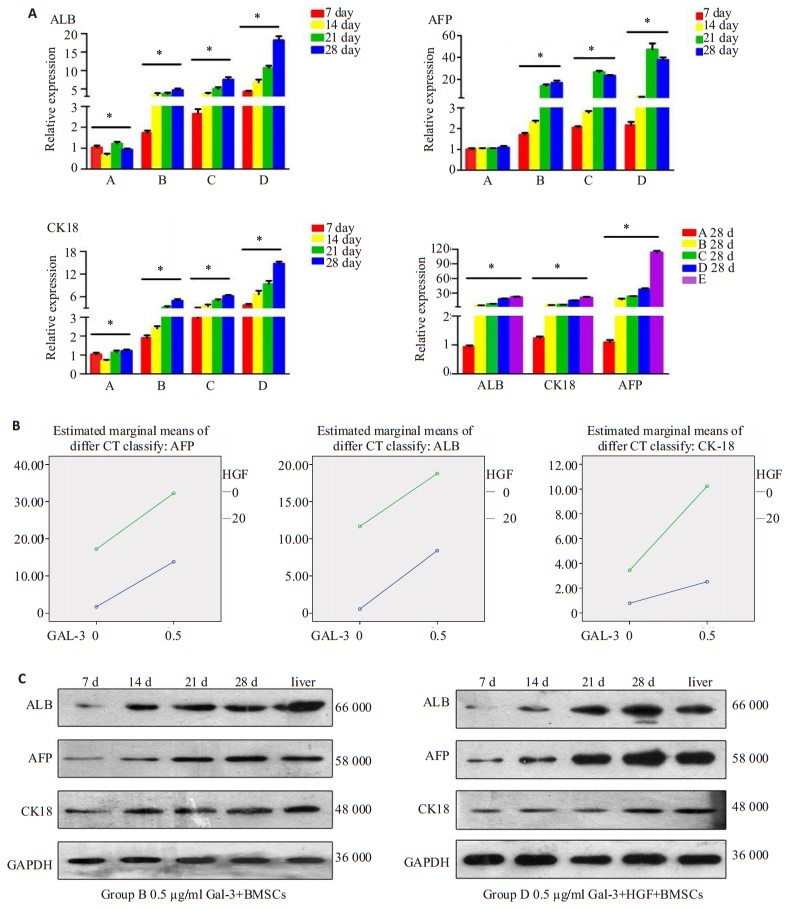
|
图 3 诱导后细胞ALB、CK-18及AFP表达 Figure 3 Expression of ALB, AFP and CK-18 in rat BMSCs after induction. A: Q-PCR for detecting expressions of ALB, CK18 and AFP mRNAs (*P < 0.05); B: Factorial design of ALB, AFP and CK-18 mRNAs expression; C: Western blotting of rat BMSCs induced with 0.5 µg/mL Gal-3 alone and in combination with HGF. |
将AFP、ALB的mRNA表达采用析因设计方差分析,单独效应采用独立t检验,提示Gal-3与HGF不存在交互效应(AFP:F=0.236, P=0.640;ALB:F=50.639, P= 0.000),Gal-3及HGF对BMSCs的诱导效率互相不受影响,Gal-3+HGF的诱导效果为Gal-3与HGF的叠加。CK-18的mRNA的析因设计方差分析则提示存在交互效应(F=50.639, P=0.000),Gal-3与HGF的诱导效率具有协同效应(图 3B)。
2.3.2 Western blot检测蛋白表达结果取各组不同时间点细胞,提取蛋白并对AFP、ALB以及CK-18蛋白含量进行测定。A组与E组肝细胞对比,几乎不表达AFP、ALB及CK-18。B、C、D组的AFP、ALB及CK-18蛋白表达随时间延长,逐渐增加。ALB及CK-18到28d时的表达与肝细胞相近。各组细胞的蛋白表达与基因表达的趋势保持一致(图 3C)。
2.4 基因芯片检测结果PCR Array可在96孔板上同时对相关的84个基因进行实时荧光定量PCR反应,对表达量变化进行检测(其余为对照样本孔)。将诱导组在14 d及28 d与0 d作对比,以2-ΔCt计算差异倍数均 > 1作为筛选条件。发现上调基因27个,下调基因62个。
通过数据库检索,可见上调基因GO注释主要集中在为系统开发和胞外区;下调基因GO注释主要集中在多细胞生物过程的正调控,细胞外空隙和囊泡。通过通路富集分析,上调基因涉及的通路有:RAS signaling pathway,PI3K-Akt signaling pathway,TGF-beta signaling pathway,Hippo signaling pathway。下调基因涉及的通路有:RAP1 signaling pathway;PI3K-Akt signaling pathway;JAK-ATAT sign-aling pathway;TNF signaling pathway;RAS signaling pathway;IL-17 signaling pathway;TGF-beta signaling pathway;HIF-1 signaling pathway。同时有上调及下调基因涉及的通路有:MAPK signaling pathway;Rap1 signaling pathway;Cytokine-cytokine receptor interac-tion;PI3K-Akt signaling pathway;TGF-beta signaling pathway;Focal adhesion;TNF signaling pathway。TGF-β信号通路涉及上调的基因有TGF-β、BMP;下调的基因有TNFα、Smad4。PI3K-Akt信号通路涉及上调的基因有ITGA、ITGB、RTK、FAK;下调的基因有GF、ECM、Cytokine。Hippo信号通路涉及上调的基因有TGF-β、BMPs、Wnt3a、F-actin。
2.5 Hippo信号通路的研究为验证Gal-3诱导BMSCs分化是否有Hippo信号通路的参与,在各组诱导28 d后行Western blot检测其效应蛋白YAP、P-YAP。结果可见Ⅱ组、Ⅲ组YAP表达大于Ⅰ组(P < 0.05),Ⅲ组YAP表达最高,肝细胞组(Ⅳ组)表达最低。P-YAP表达则与YAP相反,Ⅰ组及Ⅳ组表达较高,Ⅲ组最低(P < 0.05,图 4A)。Hippo信号通路的效应蛋白出现明显变化,说明诱导过程中有Hippo信号通路的调节。
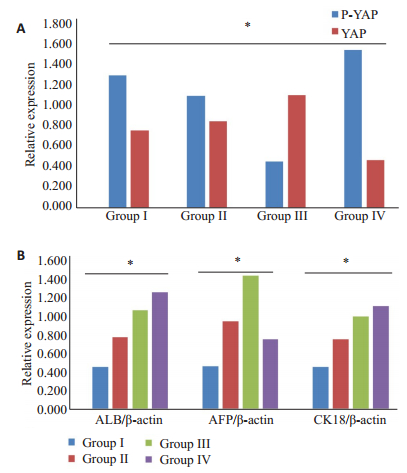
|
图 4 关于Hippo信号通路的Westren blot检测 Figure 4 Westren blotting of Hippo signaling pathway. A: Western blotting of YAP/P-YAP (*P < 0.05); B: Western blotting of ALB, AFP and CK-18 (*P < 0.05). |
诱导后的ALB、CK-18及AFP表达,Ⅰ组最低,Ⅲ组大于Ⅱ组(P < 0.05),Ⅲ组的ALB及CK-18的表达与Ⅳ组接近(P < 0.05)(图 4B)。可见加入Hippo信号通路抑制剂XMU-MP-1后BMSCs的诱导效率较单独应用Gal-3高。
3 讨论Gal-3是一种半乳糖结合蛋白,参与包括细胞生长、增殖、凋亡、分化、炎症反应及新生血管形成和肿瘤浸润与转移等生理过程[5]。在氯化碳(CC1)肝损伤小鼠在肝组织修复过程中,可发现血清Gal-3表达上调[6]。本课题组的前期实验中,利用iTRAQ技术[7]对比肝衰竭大鼠与正常大鼠的肝脏进行了蛋白质组学及生物信息学分析,发现其有显著表达差异,提示Gal-3与肝细胞的损伤修复及再生关系密切。
目前诱导BMSCs分化为肝样细胞的方案可以有:添加特定的细胞因子;运用损伤的肝脏或肝损伤相应血清;利用特殊的细胞外环境;基因修饰;中药诱导等[8]。本研究单独应用Gal-3、HGF以及联合Gal-3、HGF对BMSCs进行诱导培养,以研究其诱导效果。首先进行大鼠骨髓间充质干细胞的分离、培养及鉴定[9],分离纯化的细胞符合骨髓间充质干细胞特性。经过28 d的培养,Gal-3组(B组)能诱导干细胞表达了肝细胞特异性表面抗原ALB、AFP、CK18[10],而且ALB、CK-18的mRNA表达与肝细胞接近。由于分离肝细胞是新生鼠,故原代分离肝细胞(E组)高表达AFP[11]。通过蛋白印迹从蛋白质水平上也验证了对应蛋白的表达。诱导后细胞的形态逐渐趋向于肝细胞形态[12]。糖原染色阳性表明其一定程度上具备合成糖原的能力[13]。可见Gal-3能够单独诱导骨髓间充质干细胞向肝样细胞分化。
Gal-3与细胞的增值及分化相关,其不仅能促进神经干细胞向神经元细胞增殖分化[14],还能刺激骨髓间充质干细胞向血管内皮细胞的分化[15]。Hsieh WC等[16]发现Galectin-3在慢性肝损伤或肝细胞增殖受损后可调节肝祖细胞的扩张,并可再生肝实质。从糖原染色以及Q-PCR的统计结果可得出,Gal-3诱导骨髓干细胞转化成肝细胞的效率接近HGF。Q-PCR析因分析结果提示Gal-3与HGF联合诱导的效率有叠加,并有部分的协同效应,这为我们更高效地诱导BMSCs分化提供依据。由于实验时间的限制,远期诱导效果预计与目前实验结果相似,而且相关检测指标会与肝细胞更接近。
为了进一步探究Gal-3诱导骨髓干细胞分化的机制,利用基因芯片技术检测出在此过程中上调基因27个,下调基因62个。通过这些表达有变化的基因,通过通路富集分析筛选出可能涉及的通路如下:(1)TGF-β信号通路:涉及上调的基因有TGF-β、BMP;下调的基因有TNFα,Smad4。TGF-β主要与肝纤维化有关[17],在疾病发展的不同阶段发挥不同作用,肝损伤的初期能够增加肝脏损伤,然后介导肝星状细胞的活化及修复;在肝细胞的增值和修复过程中又发挥抑制作用[18]。TGF-β也参与细胞增值分化的调节,当TGF-β1诱导HSCs中Smad2/3和Smad4的表达下调,可以抑制肝星状细胞的激活[19];(2)PI3K-Akt信号通路:涉及上调的基因有ITGA,ITGB,RTK,FAK;下调的基因有GF,ECM,Cytokine。PI3K-Akt与MAPK是两条促进肝星状细胞增值致肝纤维化、抑制凋亡的通路[20-21],被激活的Akt会使大量下游底物磷酸化,通过调控mTOR信号转导通路促进细胞生长与蛋白质合成。HGF也可以通过PI3K/AKT途径转导干细胞的抗凋亡作用[22];(3)Hippo信号通路:涉及上调的基因有TGF-β,BMPs,Wnt3a,F-actin。这些基因中,BMPs除BMP-1外均属于TGF-β超家族,F-actin是Hippo信号的上游调节剂之一,它能够激活YAP并增加其下游CCN生长因子[23-24]。Hippo信号通路转录效应因子TAZ/YAP的激活或抑制对间充质干细胞命运决定具有关键性调控作用,过度表达的YAP使诱导多能干细胞(iPS)重编程效率提高2倍,YAP可和多种转录因子结合调节干细胞[25]。Hippo通路为负调节通路,在Gal-3对BMSCs的诱导过程中,YAP的表达较空白对照组(Ⅰ组)增多,P-YAP表达减少;加入Hippo通路核心组分MST1/2的抑制剂XMU-MP-1后,更加促进了YAP的表达,相应的P-YAP的表达更少。而此时的ALB、AFP及CK-18的表达较单独应用Gal-3(Ⅱ组)更高,说明Hippo通路确实参与BMSCs诱导的调节,抑制Hippo通路可促进BMSCs向肝样细胞分化,使诱导效率提高。因此,上述TGF-β、PI3K-Akt以及Hippo信号通路都与细胞增值分化相关,考虑均参与BMSCs分化为肝细胞的调节。TGF-β、Wnt以及Notch、G蛋白偶联受体信号通路与Hippo信号通路间还存在频繁的对话[26],Gal-3可激活Wnt/β-catenin通路[27],且有研究发现Akt被能和Smad分子结合调节TGF-β信号传导[28]。
综上所述,本研究发现Gal-3能够单独诱导骨髓间充质干细胞向肝样细胞分化,诱导效果与HGF相当,Gal-3与HGF联合诱导的效率有叠加,并有部分的协同效应。TGF-β、PI3K-Akt及Hippo等信号通路参与此过程的调节,抑制Hippo通路可提高诱导效率。
| [1] |
Li LC, Li J, Gao J. Functions of galectin-3 and its role in fibrotic diseases[J].
J Pharmacol Exp Ther, 2014, 351(2): 336-43.
DOI: 10.1124/jpet.114.218370. |
| [2] |
Kim EJ, Kim N, Cho SG. The potential use of mesenchymal stem cells in hematopoietic stem cell transplantation[J].
Exp Mol Med, 2013, 45(1): e2.
DOI: 10.1038/emm.2013.2. |
| [3] |
Stock P, Brückner S, Winkler S, et al. Human bone marrow mesenchymal stem cell-derived hepatocytes improve the mouse liver after acute acetaminophen intoxication by preventing progress of injury[J].
Int J Mol Sci, 2014, 15(4): 7004-28.
DOI: 10.3390/ijms15047004. |
| [4] |
吴增城, 康利民, 李阳, 等. 半乳糖凝集素-3联合HGF诱导大鼠骨髓间充质干细胞分化为肝样细胞[J].
重庆医学, 2016, 45(15): 2043-7.
DOI: 10.3969/j.issn.1671-8348.2016.15.005. |
| [5] |
Krześlak A, Lipińska A. Galectin-3 as a multifunctional protein[J].
Cell Mol Biol Lett, 2004, 9(2): 305-28.
|
| [6] |
Yamazaki K, Kawai A, Kawaguchi M, et al. Simultaneous induction of galectin-3 phosphorylated on tyrosine residue, p21(WAF1/Cip1/ Sdi1), and the proliferating cell nuclear antigen at a distinctive period of repair of hepatocytes injured by CCl4[J].
Biochem Biophys Res Commun, 2001, 280(4): 1077-84.
DOI: 10.1006/bbrc.2000.4193. |
| [7] |
Zieske LR. A perspective on the use of iTRAQ reagent technology for protein complex and profiling studies[J].
J Exp Bot, 2006, 57(7): 1501-8.
DOI: 10.1093/jxb/erj168. |
| [8] |
谢树才, 张剑权, 蒋锡丽, 等. 骨髓间充质干细胞诱导分化为肝细胞的方法及机制研究与进展[J].
中国组织工程研究, 2016, 20(50): 7586-93.
DOI: 10.3969/j.issn.2095-4344.2016.50.020. |
| [9] |
向俊西, 郑幸龙, 祝旭龙, 等. 骨髓间充质干细胞体外培养及肝向分化方案的优化[J].
南方医科大学学报, 2015, 35(8): 1090-6.
|
| [10] |
Fiegel HC, Lioznov MV, Cortes-Dericks L, et al. Liver-specific gene expression in cultured human hematopoietic stem cells[J].
Stem Cells, 2003, 21(1): 98-104.
|
| [11] |
王琳, 徐建波, 田元, 等. 一种分离新生小鼠肝细胞的简单方法[J].
中国优生与遗传杂志, 2007, 15(1): 10-2.
DOI: 10.3969/j.issn.1006-9534.2007.01.004. |
| [12] |
Wang PP, Wang JH, Yan ZP, et al. Expression of hepatocyte-like phenotypes in bone marrow stromal cells after HGF induction[J].
Biochem Biophys Res Commun, 2004, 320(3): 712-6.
DOI: 10.1016/j.bbrc.2004.05.213. |
| [13] |
Hong SH, Gang EJ, Jeong JA, et al. In vitro differentiation of human umbilical cord blood-derived mesenchymal stem cells into hepatocyte-like cells[J].
Biochem Biophys Res Commun, 2005, 330(4): 1153-61.
DOI: 10.1016/j.bbrc.2005.03.086. |
| [14] |
Kanemura Y, Mori H, Kobayashi S, et al. Evaluation of in vitro proliferative activity of human fetal neural stem/progenitor cells using indirect measurements of viable cells based on cellular metabolic activity[J].
J Neurosci Res, 2002, 69(6): 869-79.
|
| [15] |
Yan YP, Lang BT, Vemuganti R, et al. Galectin-3 mediates postischemic tissue remodeling[J].
Brain Res, 2009, 1288: 116-24.
DOI: 10.1016/j.brainres.2009.06.073. |
| [16] |
Hsieh WC, Mackinnon AC, Lu WY, et al. Galectin-3 regulates hepatic progenitor cell expansion during liver injury[J].
Gut, 2015, 64(2): 312-21.
DOI: 10.1136/gutjnl-2013-306290. |
| [17] |
苏冬娜, 吴诗品. Smad7基因质粒转染骨髓间充质干细胞在体外对肝星状细胞TGF-β1信号传导的影响[J].
中国免疫学杂志, 2016, 32(10): 1441-5.
DOI: 10.3969/j.issn.1000-484X.2016.10.007. |
| [18] |
赵卫华, 王燕红, 丛敏. TGF-β1/Smads信号通路在肝脏纤维化中的作用研究进展[J].
肝脏, 2016, 21(10): 877-9.
DOI: 10.3969/j.issn.1008-1704.2016.10.022. |
| [19] |
Sun XE, Zhang XQ, Liu MM. Effect of bone marrow mesenchymal stem cells on the TGF-β1/Smad signaling pathway of hepatic stellate[J].
Genet Mol Res, 2015, 14(3): 8744-54.
DOI: 10.4238/2015.July.31.23. |
| [20] |
Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets[J].
J Cell Mol Med, 2006, 10(1): 76-99.
DOI: 10.1111/jcmm.2006.10.issue-1. |
| [21] |
Qiang H, Lin Y, Zhang X, et al. Differential expression genes analyzed by cDNA array in the regulation of rat hepatic fibrogenesis[J].
Liver Int, 2006, 26(9): 1126-37.
DOI: 10.1111/liv.2006.26.issue-9. |
| [22] |
姚鹏, 杨晓明, 胡大荣. PI3K/AKT途径在HGF介导肝干细胞抗凋亡调控中的作用[J].
中华微生物学和免疫学杂志, 2005, 25(2): 89-93.
DOI: 10.3760/j:issn:0254-5101.2005.02.002. |
| [23] |
Reddy P, Deguchi M, Cheng Y, et al. Correction: actin cytoskeleton regulates hippo signaling[J].
PLoS One, 2013, 8(9): e73763.
DOI: 10.1371/journal.pone.0073763. |
| [24] |
Mana-Capelli S, Paramasivam M, Dutta S, et al. Angiomotins Link Factin architecture to Hippo pathway signaling[J].
Mol Biol Cell, 2014, 25(10): 1676-85.
DOI: 10.1091/mbc.e13-11-0701. |
| [25] |
Lian I, Kim J, Okazawa H, et al. The role of YAP transcription coactivator in regulating stem cell self-renewal and differentiation[J].
Genes Dev, 2010, 24(11): 1106-18.
DOI: 10.1101/gad.1903310. |
| [26] |
Regué L, Mou F, Avruch J. G protein-coupled receptors engage the mammalian Hippo pathway through F-actin: F-Actin, assembled in response to Galpha12/13 induced RhoA-GTP, promotes dephosphorylation and activation of the YAP oncogene[J].
Bioessays, 2013, 35(5): 430-5.
DOI: 10.1002/bies.201200163. |
| [27] |
Song S, Mazurek N, Liu C, et al. Galectin-3 mediates nuclear betacatenin accumulation and Wnt signaling in human colon cancer cells by regulation of glycogen synthase kinase-3beta activity[J].
Cancer Res, 2009, 69(4): 1343-9.
DOI: 10.1158/0008-5472.CAN-08-4153. |
| [28] |
Yu JS, Ramasamy TS, Murphy N, et al. PI3K/mTORC2 regulates TGF-β/Activin signalling by modulating Smad2/3 activity via linker phosphorylation[J].
Nat Commun, 2015, 6: 7212.
DOI: 10.1038/ncomms8212. |
 2018, Vol. 38
2018, Vol. 38

