术后认知功能障碍(POCD)是老年人术后常见的一种神经并发症,多种因素可以影响其发生和发展。目前大量研究显示年龄、手术以及麻醉等与POCD的发生与发展相关[1-2]。老年人体质虚弱,因此对手术抵抗力较差,从而增加了术后POCD的患病率和病死率[3]。右美托咪定(DEX)是一种新型的α2肾上腺受体激动剂[4],它具有剂量依赖性的镇静镇痛以及催眠作用,同时还有抗交感、抑制应激反应、稳定血流动力学以及减少麻醉剂用量的作用,且无呼吸抑制[5]。DEX可减轻炎症反应并且具有神经保护作用,从而改善老年人术后认知功能障碍[6]。沉默信息调节因子1(SIRT1)是NAD+依赖的去乙酰化酶,其大量表达于海马神经元内。SIRT1可以抑制NF-κB从而减轻炎症反应和氧化应激,老龄大鼠POCD的发生与SIRT1信号通路所介导的炎症反应有关[7]。但DEX减轻POCD是否与SIRT1信号通路有关未见文献报道。因此,本试验拟探究SIRT1信号通路在DEX减轻老龄大鼠POCD中的作用,为临床上治疗POCD提供理论和实验依据。
1 材料和方法 1.1 动物分组SPF级健康雄性SD大鼠(南昌大学动物科学部提供)72只,18~20月龄,体质量500~700 g,维持饲养环境室温25 ℃左右,术前12 h禁食,自由饮水。参照文献[8-9]采用随机数字表法将所有大鼠分为4组。生理盐水对照组(Control组):未经处理的正常老龄大鼠;术后认知功能障碍组(POCD组):手术处理建立的POCD模型大鼠;右美托咪定组(DEX组):术前DEX预处理的POCD模型大鼠;SIRT1抑制剂组(EX527组):术前DEX和EX527预处理的POCD模型大鼠,18只/组。本实验所有操作都获得了南昌大学第二附属医院伦理委员会许可。
1.2 主要试剂右美托咪定(批号:H20163388,辰欣药业股份有限公司,山东),EX527(批号:APN13021-5-21,Abcam,上海),XR-XM101 Morris水迷宫(上海欣软信息科技有限公司),ELISA试剂盒(TNF-α,批号:AK0017DEC27004;IL-6,批号:AK0017DEC27003,Elabscience,武汉),组织蛋白提取液(批号:BB18011,上海贝博生物公司),BCA蛋白浓度测定试剂盒(批号:P0012,碧云天生物技术研究所),一抗(SIRT1,批号:GR195021-12,Abcam,上海;NF-κB,批号:GR200963- 8,Abcam,上海;β-actin,批号:#K10601,北京全式金生物技术有限公司),二抗(山羊抗兔,批号:#J30821,北京全式金生物技术有限公司;山羊抗鼠,批号:#J10710,北京全式金生物技术有限公司)。
1.3 动物处理方法参照文献[10]建立大鼠POCD模型。根据不同的实验分组分别进行处理,DEX组和EX527组术前30 min腹腔注射DEX 25 μg/kg。Control组和POCD组术前30 min腹腔注射等量的生理盐水。给药结束后30 min,Control组、POCD组、DEX组和EX527组经腹腔注射戊巴比妥钠40 mg/kg。其中POCD组、DEX组以及EX527组大鼠麻醉成功后消毒铺巾,于上腹部正中部位切开进腹行剖腹探查术,维持手术时间30 min。术中维持大鼠的体温恒定并严格按照无菌要求操作。术毕纱布止血并用碘伏对切口消毒,腹腔注射青霉素预防感染,逐层缝合切口,用无菌敷料贴及胶布固定,待大鼠苏醒后放回笼内单独饲养。Control组不做任何处理。EX527组术前5 min经尾静脉注射SIRT1抑制剂EX527 1 μg/kg。
1.4 认知功能的检测采用XR-XM101 Morris水迷宫对大鼠进行行为学测试。参照文献[11-13]进行水迷宫试验。实验前用加热器保持水温在25 ℃左右。术前3 d开始,每天上午同一时间段让大鼠在水迷宫中自由游泳5 min以适应环境,剔除有明显运动障碍的大鼠。于术后1 d(T1)、3 d(T2)和5 d(T3)时每组随机取6只大鼠行定位航行试验。分别从四个象限的池壁中点将大鼠面向池壁放入水中,记录大鼠在120 s内从入水到登上平台所需时间测定逃避潜伏期。如果大鼠在120 s内没有登上平台,则由实验者引导其登上平台休息30 s,此时记录逃避潜伏期为120 s,4个象限的平均值即为该大鼠的逃避潜伏期。在定位航行试验结束之后将平台撤离行空间探索试验,将大鼠由4个象限的原入水点面向池壁放入水中,记录各个象限120 s内大鼠穿越原来平台所在位置的次数。测试时应保持周围环境安静,排除周围物品、声音和光线等对试验结果的影响。
1.5 海马组织中TNF-α、IL-6表达水平测定T1、T2、T3时水迷宫试验结束之后,随机选取的各组大鼠腹腔注射3%戊巴比妥钠45 mg/kg进行麻醉,提尾断头处死大鼠,置于冰上开颅并分离左侧脑部海马组织。用预冷的PBS冲洗组织,去除残留血液,称重后将组织剪碎,按1:9的重量体积比将剪碎的组织和对应体积的PBS(加入适量蛋白酶抑制剂)加入玻璃匀浆器中,在冰上充分研磨。将匀浆液离心(5000 r/min)20 min,取上清液分装于-20 ℃冰箱保存备用。采用ELISA法检测海马组织TNF-α、IL-6水平,按试剂盒说明书步骤进行操作。
1.6 海马神经元中SIRT1和NF-κB表达水平检测分离T1、T2、T3时各组大鼠的右侧海马组织,将组织样本用剪刀剪碎,加入组织蛋白提取液和蛋白酶抑制剂进行冰上裂解,将海马组织匀浆,离心,按试剂盒说明书步骤提取组织蛋白,采用BCA法进行蛋白定量,并于- 20 ℃冰箱保存。采用Western blot法检测海马神经元SIRT1和NF-κB表达。取蛋白样品50 μg上样,进行12% SDS-PAGE凝胶电泳,转至PVDF膜,室温脱脂牛奶封闭1 h,加入一抗4 ℃孵育过夜,TBST洗膜3次,加入辣根过氧化酶标记的二抗室温孵育1 h,TBST洗膜3次,DAB避光显色3 min,采用Image J软件系统对目标条带的灰度值进行分析,以SIRT1,NF-κB与内参β-actin灰度值比较,其比值代表SIRT1和NF-κB的表达水平。
1.7 统计学分析采用SPSS 22.0软件进行分析,正态分布的计量资料以均数±标准差表示,多组间数据比较采用单因素方差分析,组间两两比较采用LSD法检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠认知功能的比较与Control组相比,POCD组和EX527组T1~T3时逃避潜伏期延长,DEX组T1~T2时逃避潜伏期延长,POCD组、DEX组和EX527组穿越平台次数减少(P < 0.05);与POCD组相比,DEX组T1~T3时逃避潜伏期缩短,穿越平台次数增加(P < 0.05),EX527组与POCD组相比上述指标差异无统计学意义(P > 0.05);与DEX组相比,EX527组T1~T3时逃避潜伏期延长,穿越平台次数减少(P < 0.05,表 1)。
| 表 1 术后各组大鼠不同时间段逃避潜伏期和穿越平台次数的比较 Table 1 Comparison of the mean escape latency and frequency of crossing the platform in each group at different time points after the operation (n=6, Mean±SD) |
与Control组相比,POCD组和EX527组T1~T3时TNF-α和IL-6质量浓度显著升高,DEX组T1~T2时TNF-α和IL-6质量浓度显著升高(P < 0.05);与POCD组相比,DEX组T1~T3时TNF-α和IL-6质量浓度均明显降低(P < 0.05),EX527组与POCD组相比上述指标差异无统计学意义(P > 0.05);与DEX组相比,EX527组T1~T3时TNF-α和IL-6质量浓度均显著升高(P < 0.05,表 2)。
| 表 2 术后各组大鼠不同时间段海马组织中TNF-α和IL-6表达水平的比较 Table 2 Comparison of the levels of TNF-α and IL-6 in the hippocampus of the rats at different time points after the operation (n=6, Mean±SD) |
与Control组相比,POCD组、DEX组和EX527组海马神经元SIRT1表达水平降低,NF-κB表达水平升高(P < 0.05);与POCD组相比,DEX组海马神经元SIRT1表达水平升高,NF-κB表达水平降低(P < 0.05),EX527组与POCD组相比上述指标差异无统计学意义(P > 0.05);与DEX组相比,EX527组海马神经元SIRT1表达水平降低,NF-κB表达水平升高(P < 0.05,图 1)。
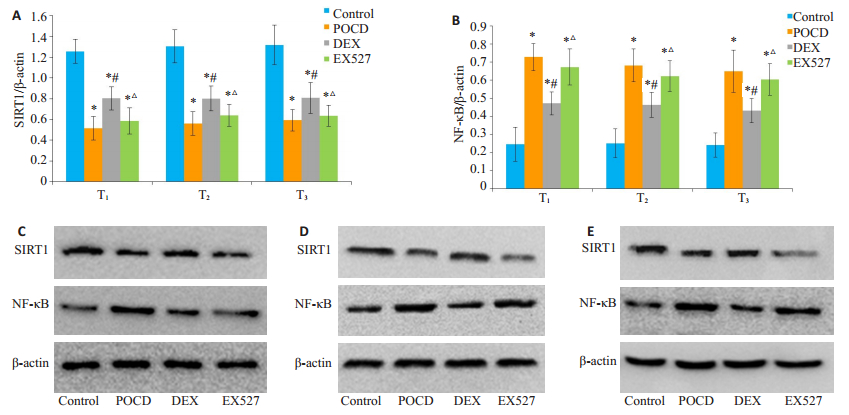
|
图 1 术后各组大鼠不同时间段海马神经元SIRT1和NF-κB表达情况的比较 Figure 1 Comparison of SIRT1 and NF-κB expressions in the hippocampal neurons of the rats at different time points after the operation. A: SIRT1 relative expression at time T1, T2, T3, F(T1)=48.574, P(T1) < 0.001, F(T2)=42.252, P(T2) < 0.001, F(T3)=33.396, P(T3) < 0.001, compared with group Control, *P < 0.05; compared with group POCD, #P < 0.05; compared with group DEX, ΔP < 0.05; B: NF-κB relative expression at time T1, T2, T3, F(T1)=40.317, P(T1) < 0.001, F(T2)=33.667, P(T2) < 0.001, F(T3)=27.269, P(T3) < 0.001, compared with group Control, *P < 0.05; compared with group POCD, #P < 0.05; compared with group DEX, ΔP < 0.05; C: Western blot analysis of SIRT1 and NF-κB at time T1; D: Western blot analysis of SIRT1 and NF-κB at time T2; E: Western blot analysis of SIRT1 and NF-κB at time T3. n=6, data was shown as Mean±SD. |
Morris水迷宫试验是一种用于研究实验动物相关脑区学习记忆机制的研究手段,在评价空间学习记忆功能、老年痴呆以及海马功能的研究中被广泛认可[14]。其中定位航行实验记录逃避潜伏期可用于检测大鼠空间学习记忆能力;空间探索实验中记录穿越平台次数可用于检测大鼠获取空间信息的记忆保持能力[15]。本试验参照文献[10]介绍的方法建立大鼠POCD模型,结果显示与Control组相比,POCD组逃避潜伏期延长,穿越平台次数减少,说明手术麻醉等刺激使老龄大鼠出现认知功能障碍,老龄大鼠POCD模型建立成功。EX527是一种有效的、选择性的SIRT1特异性抑制剂[16],可以有效的抑制SIRT1去乙酰化酶活性。本实验给药剂量及给药时间点参照文献[9]选择术前5 min时静脉注射EX527 1 μg/kg进行处理。
DEX对老龄人呼吸、循环、免疫以及神经系统等多器官保护方面有独特的优势[17-18]。DEX可以抑制炎症以及应激反应,维持围术期血流动力学稳定和减少术中麻醉药物的用量,并且对呼吸系统的影响较小,可以改善术后认知功能,降低POCD的发生率[6]。本试验参照文献[19]选择术前30 min腹腔注射DEX 25 μg/kg。结果显示与POCD组相比,DEX组大鼠逃避潜伏期缩短,穿越平台次数增加,表明DEX可以改善老龄大鼠术后认知功能。
NF-κB属于Rel转录因子蛋白家族,是一种早期重要的核转录因子,不需要新翻译出的蛋白对NF-κB的激活进行调控[20]。NF-κB是SIRT1的下游作用靶点之一,当细胞受到刺激时,NF-κB信号通路可在第一时间对外界刺激做出反应,NF-κB可从细胞质进入细胞核启动相关炎症基因的转录过程。NF-κB对早期免疫反应以及炎症反应各阶段的分子进行调控[21],使促炎因子大量释放,包括TNF-α、IL-6。NF-κB还可以参与神经系统的炎症反应,并且还可以增加缺血性脑卒中神经元的损害[22-23],导致神经元β淀粉样蛋白毒性反应,并因此对认知功能造成影响。本研究结果显示与Control组相比,POCD组和EX527组海马神经元NF-κB表达水平上调;与POCD组相比,DEX组海马神经元NF-κB表达水平降低,表明手术刺激可以导致老龄大鼠围术期中枢神经系统炎症反应,并且DEX可以减轻中枢神经系统炎症反应。
SIRT1属于sirtuin家族成员中发现最早以及研究最多的成员,是NAD+依赖的去乙酰化酶,在哺乳动物下丘脑及海马神经元内表达丰富[24],SIRT1可以通过去乙酰化作用影响下游分子,调节NF-κB活性,对细胞代谢、分化、衰老、凋亡、心肌再灌注损伤、能量代谢、转录与调节以及细胞信号转导等多种生物学功能进行密切调控[25-27]。SIRT1/NF-κB信号通路是介导慢性脑缺血炎性反应的重要信号通路,当机体处于应激状态时会诱导SIRT1活性上调,对通路下游的信号分子产生作用,减少细胞的衰老和凋亡。SIRT1激动剂可以促进RelA/ p65亚基上第310个赖氨酸的去乙酰化作用和抑制NF- κB信号转导,降低TNF-α等基因表达,抑制炎症反应和氧化应激,可以减轻POCD的发生和发展[28-30]。本研究结果显示,术前腹腔注射DEX可通过增加海马神经元SIRT1表达,抑制NF-κB表达,从而减轻POCD。当从静脉注射SIRT1抑制剂EX527后,大鼠的逃避潜伏期延长,穿越平台次数减少,海马神经元SIRT1表达降低,NF-κB表达增加,提示SIRT1抑制剂EX527可以阻断DEX减轻POCD的作用,表明DEX可能是通过激活了SIRT1信号通路降低了老龄大鼠POCD的发生。
综上所述,DEX可以减轻老龄大鼠POCD,推测其机制可能与SIRT1信号通路有关。本研究为防治老龄人POCD提供了新的思路。
| [1] |
Kotekar N, Kuruvilla CS, Murthy V. Post-operative cognitive dysfunction in the elderly: a prospective clinical study[J].
Indian J Anaesth, 2014, 58(3): 263-8.
DOI: 10.4103/0019-5049.135034. |
| [2] |
Silbert B, Evered L, Scott DA. Cognitive decline in the elderly: is anaesthesia implicated?[J].
Best Pract Res Clin Anaesthesiol, 2011, 25(3): 379-93.
DOI: 10.1016/j.bpa.2011.05.001. |
| [3] |
Sciard D, Cattano D, Hussain M, et al. Perioperative management of proximal hip fractures in the elderly: the surgeon and the anesthesiologist[J].
Minerva Anestesiol, 2011, 77(7): 715-22.
|
| [4] |
Mahmoud M, Mason KP. Dexmedetomidine: review, update, and future considerations of paediatric perioperative and periprocedural applications and limitations[J].
Br JAnaesth, 2015, 115(2): 171-82.
DOI: 10.1093/bja/aev226. |
| [5] |
Turan G, Ozgultekin A, Turan C, et al. Advantageous effects of dexmedetomidine on haemodynamic and recovery responses during extubation for intracranial surgery[J].
Eur J Anaesthesiol, 2008, 25(10): 816-20.
DOI: 10.1017/S0265021508004201. |
| [6] |
Yamanaka D, Kawano T, Nishigaki A, et al. Preventive effects of dexmedetomidine on the development of cognitive dysfunction following systemic inflammation in aged rats[J].
J Anesth, 2017, 31(1): 25-35.
DOI: 10.1007/s00540-016-2264-4. |
| [7] |
Oomen CA, Farkas E, Roman V, et al. Resveratrol preserves cerebrovascular density and cognitive function in aging mice[J].
Front Aging Neurosci, 2009, 13(1): 4.
|
| [8] |
苟毅, 余天雾, 黄中荣, 等. 白藜芦醇对大鼠肝缺血再灌注损伤的保护作用及其与Sirt1-p53通路的关系[J].
第三军医大学学报, 2017(13): 1366-70.
|
| [9] |
胡衍辉, 陈勇, 梁应平, 等. SIRT1信号通路在星状神经节阻滞减轻老龄大鼠术后认知功能障碍中的作用[J].
中华麻醉学杂志, 2017, 37(1): 54-7.
DOI: 10.3760/cma.j.issn.0254-1416.2017.01.012. |
| [10] |
陈勇, 孙静, 杜晓红, 等. 星状神经节阻滞对老龄大鼠术后认知功能的影响[J].
中华麻醉学杂志, 2013, 33(1): 37-9.
DOI: 10.3760/cma.j.issn.0254-1416.2013.01.008. |
| [11] |
Ding Y, Shi C, Chen L, et al. Effects of andrographolide on postoperative cognitive dysfunction and the association with NF-κB/MAPK pathway[J].
Oncol Lett, 2017, 14(6): 7367-73.
|
| [12] |
Feng PP, Deng P, Liu LH, et al. Electroacupuncture alleviates postoperative cognitive dysfunction in aged rats by inhibiting hippocampal neuroinflammation activated via microglia/TLRs pathway[J].
Evid Based Complement Alternat Med, 2017, 25(3): 6421260.
|
| [13] |
Li W, Chai Q, Zhang H, et al. High doses of minocycline May induce delayed activation of microglia in aged rats and thus cannot prevent postoperative cognitive dysfunction[J].
J Int Med Res, 2018, 46(4): 1404-13.
DOI: 10.1177/0300060517754032. |
| [14] |
Benoit JD, Rakic P, Frick KM. Prenatal stress induces spatial memory deficits and epigenetic changes in the hippocampus indicative of heterochromatin formation and reduced gene expression[J].
Behav Brain Res, 2015, 281(8): 1-8.
|
| [15] |
Anderson EM, Moenk MD, Barbaro L, et al. Effects of pretraining and water temperature on female rats' performance in the Morris water maze[J].
Physiol Behav, 2013, 122(3): 216-21.
|
| [16] |
Huhtiniemi T, Salo HS, Suuronen T, et al. Structure-based design of pseudopeptidic inhibitors for SIRT1 and SIRT2[J].
J Med Chem, 2011, 54(19): 6456-68.
DOI: 10.1021/jm200590k. |
| [17] |
Keating GM. Dexmedetomidine: a review of its use for sedation in the intensive care setting[J].
Drugs, 2015, 75(10): 1119-30.
DOI: 10.1007/s40265-015-0419-5. |
| [18] |
Di Cesare Mannelli L, Micheli L, Crocetti L, et al. α2 adrenoceptor: a target for neuropathic pain treatment[J].
Mini Rev Med Chem, 2017, 17(2): 95-107.
|
| [19] |
鲍冲, 金哲, 柯剑娟, 等. 右美托咪定对单肺通气大鼠术后早期空间记忆功能的影响[J].
贵州医科大学学报, 2016, 41(8): 891-5.
|
| [20] |
Hoesel B, Schmid JA. The complexity of NF-kappa B signaling in inflammation and Cancer[J].
Mol Cancer, 2013, 12(2): 86.
|
| [21] |
Chen ZJ. Ubiquitination in signaling to and activation of IKK[J].
Immunol Rev, 2012, 246(1): 95-106.
DOI: 10.1111/j.1600-065X.2012.01108.x. |
| [22] |
van den Berg R, Haenen GR, van den Berg H, et al. Transcription factor NF-kappaB as a potential biomarker for oxidative stress[J].
Br J Nutr, 2001, 24(9): S121-7.
|
| [23] |
Cho SH, Chen JA, Sayed F, et al. SIRT1 deficiency in microglia contributes to cognitive decline in aging and neurodegeneration via epigenetic regulation of IL-1β[J].
J Neurosci, 2015, 35(2): 807-18.
DOI: 10.1523/JNEUROSCI.2939-14.2015. |
| [24] |
Ogawa T, Wakai C, Saito T, et al. Distribution of the longevity gene product, SIRT1, in developing mouse organs[J].
Congenit Anom (Kyoto), 2011, 51(2): 70-9.
DOI: 10.1111/j.1741-4520.2010.00304.x. |
| [25] |
Zocchi L, Sassone-Corsi P. SIRT1-mediated deacetylation of MeCP2 contributes to BDNF expression[J].
Epigenetics, 2012, 7(7): 695-700.
DOI: 10.4161/epi.20733. |
| [26] |
Liu L, Wang P, Liu X, et al. Exogenous NAD(+) supplementation protects H9c2 cardiac myoblasts against hypoxia/reoxygenation injury via Sirt1-p53 pathway[J].
Fundam Clin Pharmacol, 2014, 28(2): 180-9.
DOI: 10.1111/fcp.2014.28.issue-2. |
| [27] |
Zhu X, Liu Q, Wang M, et al. Activation of Sirt1 by resveratrol inhibits TNF-α induced inflammation in fibroblasts[J].
PLoS One, 2011, 6(11): e27081.
DOI: 10.1371/journal.pone.0027081. |
| [28] |
Yang H, Zhang W, Pan H, et al. SIRT1 activators suppress inflammatory responses through promotion of p65 deacetylation and inhibition of NF-κB activity[J].
PLoS One, 2012, 7(9): e46364.
DOI: 10.1371/journal.pone.0046364. |
| [29] |
Yeung F, Hoberg JE, Ramsey CS, et al. Modulation of NF-kappaB dependent transcription and cell survival by the SIRT1 deacetylase[J].
EMBO J, 2004, 23(12): 2369-80.
DOI: 10.1038/sj.emboj.7600244. |
| [30] |
Knobloch J, Wahl C, Feldmann M, et al. Resveratrol attenuates the release of inflammatory cytokines from human bronchial smooth muscle cells exposed to lipoteichoic acid in chronic obstructive pulmonary disease[J].
Basic Clin Pharmacol Toxicol, 2014, 114(2): 202-9.
DOI: 10.1111/bcpt.12129. |
 2018, Vol. 38
2018, Vol. 38

