2. 西安交通大学医学部生理学与病理生理学系,陕西 西安 710061
2. Department of Physiology and Pathophysiology, Xi'an Jiaotong University College of Medicine, Xi'an 710061, China
许多病人在经历过心绞痛后会引发胸痛后遗症而发展成顽固性心绞痛,这种长期发作的疼痛给患者带来剧烈的身体痛苦和严重的精神负担[1-2]。由于心脏痛觉模型复制困难,目前人们对其中枢调控机制了解甚少。2001年,Jou等[3-4]发现心包内注射化学性刺激物通过兴奋心交感传入神经诱发大鼠心脏伤害性感受,表现为心脏-躯体运动反射,该反射以背斜方肌肌电(EMG)为观测指标。在此模型基础上,本实验室对心脏痛觉的中枢调控进行了探索[5-7]。
内吗啡肽(EM)是近年发现的、具有明确镇痛作用的一种内源性阿片肽[8-10]。中脑导水管周围灰质(PAG)是中枢内源性镇痛系统的关键结构,处于承上启下的重要地位。其中,PAG的腹外侧区(VLPAG)是“纯粹”的镇痛区,对痛觉有高度选择性抑制[11-13],然而,以往的研究主要集中在躯体痛,对于内脏痛的研究甚少。本研究拟通过VLPAG微注射EM1及μ阿片受体阻断剂,观察大鼠心包内注射BK诱发的背斜方肌EMG活动及脊髓背角c-Fos阳性表达的变化,探讨EM1参与VLPAG对大鼠心脏伤害性感受的下行性调控作用及其受体机制。
1 材料和方法 1.1 实验药品和实验仪器戊巴比妥钠、BK、EM1(Sigma),μ阿片受体拮抗剂CTOP(Chemicon)。药物均溶解于生理盐水中,配制成所需浓度。BK:1/50 μg/mL;戊巴比妥钠:5/20 mg/mL;EM1:8/16/32 nmol/0.5 μL;CTOP:100 ng/0.5 μL。兔抗大鼠c-Fos多克隆抗体(AB7963,Abcam);ABC Kit免疫组化试剂盒(PK-6101,Vector)。
BL-420A生物信号采集与分析系统及压力换能器(泰盟生物);小动物呼吸机(DW3000-B型,正华生物);大鼠脑立体定位仪(SN-2N,Narishige);蠕动泵(BT100- 2J,兰格恒流泵)。
1.2 实验动物分组及模型建立 1.2.1 实验动物分组实验选用60只雄性SD大鼠,体质量280~300 g,由西安交通大学医学院实验动物中心提供。动物随机分为肌电组和c-Fos两组,每组30只。两组再随机各分为5小组:0.9%NaCl组、BK组、BK+EM1组、BK+CTOP组、BK+CTOP+EM1组,每组均为6只,其中BK+EM1组VLPAG内微注射EM1(8/ 16/32 nmol/0.5 μL),根据以往研究以及前期预实验选择EM1的注射剂量[14-15],其余各组EM1的微注射剂量均为32 nmol/0.5 μL。实验根据IASP规则进行并得到本校动物管理与使用委员会许可。
1.2.2 实验动物基本手术SD大鼠给予2%戊巴比妥钠腹腔麻醉(45~55 mg/kg)。人工呼吸(呼吸频率:60~70/min,潮气量:5.0~6.0 mL),左侧颈静脉插管用于补液及维持麻醉[0.05%戊巴比妥钠,15 mg(/kg·h)],为了保证一个稳定而合适的麻醉状态,右侧颈总动脉插管维持平均动脉压处于90~100 mmHg。直肠温度计监测体温,通过温控仪维持大鼠体温在(37.0±0.5)℃。
1.2.3 心包插管术与给药方法切断大鼠左侧第1到第3肋软骨,暴露胸腺。沿胸腺中线分离胸腺2片小叶,暴露心包膜。用玻璃探针尖端在心包膜上开一小孔,将一内径0.051 cm、外径0.094 cm、长12~14 cm远端有数个小洞的硅胶软管经此孔插入心包约2 cm,依次缝合各层胸壁组织,以固定心包插管。每次通过心包插管向心包内注射BK 0.2 mL,记录EMG活动60 s后回抽,0.2 mL无菌生理盐水冲洗心包并回抽,连续5次,同一只大鼠,心包注射BK每次间隔40 min。
1.3 背斜方肌EMG的记录暴露左侧背斜方肌,同芯电极以30°的角度插入背斜方肌约1.5~1.7 mm,通过BL-420A生物信号采集与分析系统记录EMG活动,每次BK诱发EMG活动总放电单位数(TMUD)通过BL-420A分析软件直接统计得出。由于不同大鼠BK诱发的TMUD有所不同,为了消除个体之间的差异,每只大鼠首次心包内注射BK所诱发的TMUD被标化为100%,作为基础对照;其后续EMG的TMUD均以首次TMUD为分母进行标化,得出百分数,即EMG的变化率。
1.4 VLPAG内微量注射将动物头部固定于大鼠脑立体定位仪上,行开颅术。根据Paxions and Watson [16]图谱,在中脑下丘处钻孔开颅,将一根外径0.45 mm的钢制导管植入大鼠脑干VLPAG区上方2 mm(前囟后7.5~8.7 mm,脑表面下4~ 4.5 mm,中线向右旁开0.5 mm)。这根导管用来引导微量注射器进入VLPAG,以便给予EM1与CTOP的微量注射。微量注射使用0.5 μL微量注射器(Hamilton,Reno,Nevada,USA),注射速度为0.5 μL/min。实验结束后,VLPAG内同一注射位点行2%膀胺天蓝微量注射(0.5 μL)以标记药物在脑干的注射位点,只统计注射位点在VLPAG内的数据。
1.5 c-Fos免疫组织化学染色c-Fos各组大鼠实施基本手术4 h后(整个过程用0.05%戊巴比妥钠维持基础麻醉),经相应处理,心包内一次性注射BK 0.2 mL(50 μg/mL),保留不回抽,2 h后行左心室升主动脉插管灌注固定。先用0.01 mol/L PBS(PH7.4)150 mL快速灌流,继之以含30%饱和苦味酸和4%多聚甲醛的0.1 mol/L PB(PH7.4)200 mL固定溶液快速灌注,然后再以同样的固定液250 mL缓慢滴注,持续l.5~2 h。灌注完毕后取T3~T5脊髓,置于上述新鲜固定液中后固定4 h(4 ℃)。继之将上述组织转入含30%蔗糖的0.1 mol/LPB溶液中(4 ℃)沉底后,冰冻切片,片厚30 μm。T3~T5脊髓按照切片顺序隔3取1,分2组收集于含0.01 mol/L的PBS的洗片盒中备用。免疫组织化学ABC法兔抗鼠c-Fos抗体的工作浓度为1: 1000。对照实验用PBS代替一抗,其余步骤相同。用Olympus光学显微镜(BX51)照相,用软件SPOT对切片进行图像采集,用Imag-Pro-Plus软件计数。
肌电组大鼠灌注方法同上,取大鼠脑,后固定沉底后,冰冻切片,片厚30 μm。进一步在显微镜下确定VLPAG药物注射的位点。
1.6 统计学分析应用sigmaplot 12软件进行统计学分析及作图。各处理因素干预大鼠心包内BK诱发EMG的变化率及脊髓背角c-Fos的表达以均数±标准差表示,组间比较采用One-way ANOVA并LSD检验进行分析,两组间比较采用t检验,P < 0.05为差异有统计学意义。
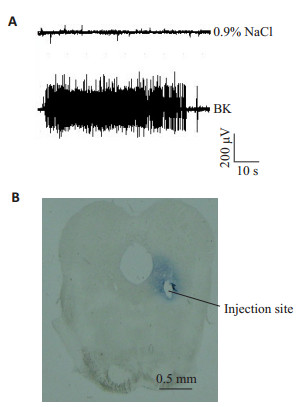
2 结果 2.1 心包内注射BK诱发大鼠心脏-躯体运动反射大鼠心包内注射0.2 mL 0.9%NaCl,未诱发心脏-躯体运动反射,背斜方肌无EMG活动;而心包内注射0.2 mL BK诱发了心脏-躯体运动反射,背斜方肌EMG活动为3343±69.77个(图 1A)。
|
图 1 大鼠心包内注射生理盐水与BK后背斜方肌EMG活动 Figure 1 EMG activities of the rats induced by intrapericardial injection of 0.9% NaCl and bradykinin (BK; A) and Pontamine Sky Blue staining of a brain section showing the microinjection site (B). |
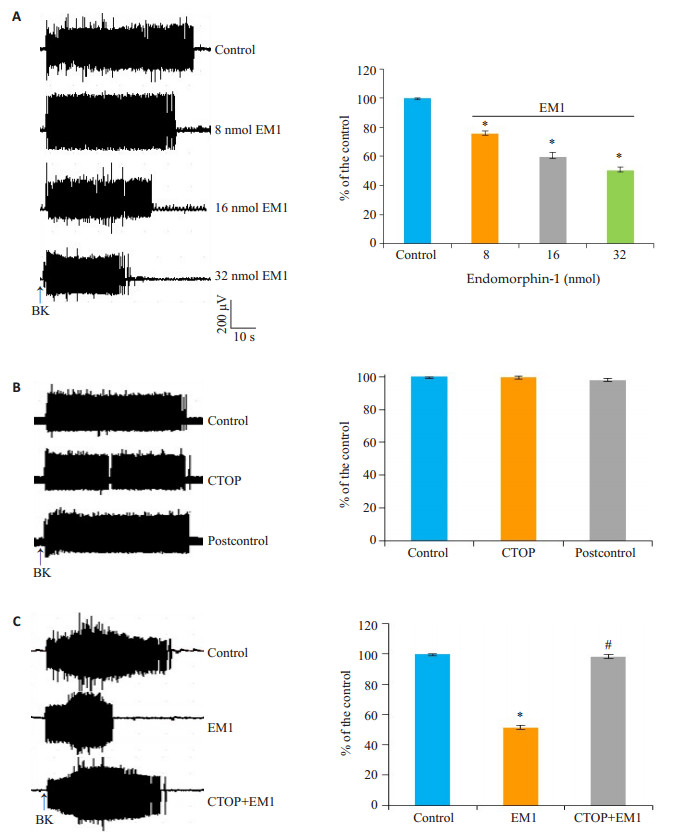
VLPAG微量注射药物的1例实例图(图 1B),蓝色区域为注射0.5 μL膀胺天蓝的扩散范围。VLPAG内EM1(8/16/32 nmol/0.5 μL)微量注射10 min后,剂量依赖性地抑制了心包内BK诱发的心脏-躯体运动反射,EMG活动下降(P < 0.05)(图 2A);VLPAG内微注射CTOP(100 ng/0.5 μL)10 min后,对心包内BK诱发的心脏-躯体运动反射无影响(P > 0.05)(图 2B);VLPAG内CTOP(100 ng/0.5 μL)微量注射10 min后,翻转了EM1(32 nmol/0.5 μL)对心包内BK诱发的心脏-躯体运动反射的抑制作用(P < 0.05,图 2C)。
|
图 2 VLPAG微注射药物对心包内BK诱发EMG活动的影响 Figure 2 Effects of microinjection of endomorphin-1 (EM1) and CTOP into the VLPAG on EMG activities evoked by intrapericardial BK injection. A: VLPAG EM1 microinjection and quantitative analysis; B: CTOP microinjection and quantitative analysis; C: CTOP and EM1 microinjection and quantitative analysis. *P < 0.05 vs control; #P < 0.05 vs EM1. |
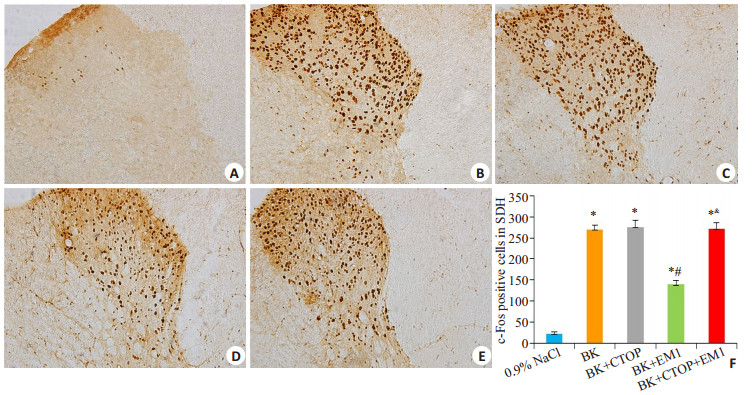
大鼠心包内注射0.2 mL 0.9%NaCl,T3~T5脊髓背角Ⅰ~Ⅴ层仅有少量c-Fos的阳性表达,且左右背角c-Fos表达无显著性差异(图 3A、F);心包内注射0.2 mLBK,T3~T5脊髓背角c-Fos的表达明显高于0.9%NaCl组(P < 0.05,图 3B、F);VLPAG微量注射CTOP后,心包内BK诱发的c-Fos阳性表达与BK组相比,无显著性差异(P > 0.05,图 3C、F);VLPAG微量注射EM1(32 nmol/0.5 μL)后,心包内BK诱发的c-Fos阳性表达与BK组相比,显著减少(P < 0.05,图 3D、F);VLPAG微量注射CTOP翻转了EM1对心包内BK诱发的c-Fos阳性表达(P < 0.05,图 3E、F)。
|
图 3 各组大鼠脊髓背角c-Fos的表达 Figure 3 Expressions of c-Fos in the spinal dorsal horn (SDH) of rats receiving intrapericardial 0.9% NaCl injection (A), intrapericardial bradykinin injection (B), intra-VLPAG CTOP microinjection with intrapericardial BK injection (C), intra-VLPAG EM1 microinjection with intrapericardial BK injection (D), and intra-VLPAG CTOP and EM1 microinjection with intrapericardial BK injection (E) with quantitative analysis (F) (Original magnification: ×100). *P < 0.05 vs 0.9%NaCl; #P < 0.05 vs BK; & P < 0.05 vs BK+EM1. |
PAG是疼痛信息汇聚、调控和引发镇痛效应的中心区域,阿片肽及其受体在PAG镇痛效应的实现中发挥重要作用[17-19]。1997年Zadina等[8]发现了对μ阿片受体具有高选择性的内源性配体EM,随后的研究表明EM1纤维及其终末广泛地分布于中枢神经系统,在VLPAG内尤为密集[20-21],电刺激或化学激活PAG对躯体痛能产生显著的镇痛效应[13, 17, 22]。我们前期的研究表明电刺激PAG对心脏伤害性感受产生下行性抑制调控作用[23]。然而,EM1激活VLPAG对内脏伤害性信息尤其是心脏伤害性信息的下行性调控研究比较少。本研究在心包内注射BK诱发心脏伤害性感受模型的基础上,VLPAG微注射EM1对心脏伤害性信息的下行调控作用及其机制做了探讨。电生理实验结果表明VLPAG微注射EM1剂量依赖性地抑制了心包内BK诱发的背斜方肌EMG活动,提示EM1激活了VLPAG下行痛抑制系统,从而对心脏-躯体运动反射产生抑制作用。众所周知,阿片类物质的作用是通过μ、δ和κ阿片受体介导而实现的[17, 24]。研究已证实EM对μ阿片受体的亲和力是δ,κ阿片受体的1000倍以上[19]。本实验中,当VLPAG微注射μ阿片受体特异性拮抗剂CTOP后,完全翻转了EM1对心包内BK诱发背斜方肌EMG活动的抑制作用,提示在VLPAG内,EM1通过激活μ阿片受体对心脏-躯体运动反射产生下行性抑制调控作用。
c-Fos是原癌基因中的即刻早期基因产物。在神经科学研究中,探索伤害性感受神经通路最常用的方法之一,就是观察c-Fos在中枢神经系统的空间表达状况[25-27]。现已明确缺血损伤的心肌组织释放包括BK在内的多种致痛物质,可激活伴随心交感神经的感觉传入末梢,传入纤维经星状神经节投射至胸段脊髓背角,从而激活脊髓背角痛反应神经元[28],因此,观察大鼠脊髓背角痛反应神经元c-Fos的表达,有助于分析VLPAG对心脏伤害性感受传入的下行性调控作用。形态学实验结果表明VLPAG微注射EM1显著抑制了心包内BK诱发的T3~T5脊髓背角c-Fos阳性表达,且这种抑制作用被VLPAG预先微注射CTOP完全翻转,提示VLPAG微注射EM1通过激活μ阿片受体对心包内BK诱发的脊髓背角c-Fos阳性表达发挥下行性抑制调控作用。这个结果与VLPAG微注射EM1对心包内BK诱发的EMG活动抑制调控作用一致。
本研究通过电生理学及形态学两个方面表明VLPAG微注射EM1对心脏伤害性感受发挥下行性抑制调控作用,且这种抑制作用通过激活μ阿片受体实现,至于EM1激活μ阿片受体后再通过何种机制对心脏伤害性感受发挥下行性抑制调控作用有待下一步研究。
| [1] |
Levine PR, Mascette AM. Musculoskeleta chest pain in patients with" angina" :a prospective study[J].
South Med J, 1989, 82(5): 580-5.
|
| [2] |
Foreman RD, Garrett KM, Blair RW. Mechanisms of cardiac pain[J].
Compr Physiol, 2015, 5(2): 929-60.
|
| [3] |
Jou CJ, Farber JP, Qin C, et al. Intrapericardial algogenic chemicals evoke cardiac-somatic motor reflexes in rats[J].
Auton Neurosci, 2001, 94(1/2): 52-61.
|
| [4] |
Jou CJ, Farber JP, Qin C, et al. Afferent pathways for cardiac-somatic motor reflexes in rats[J].
Am J Physiol Regul Integr Comp Physiol, 2001, 281(6): R2096-102.
DOI: 10.1152/ajpregu.2001.281.6.R2096. |
| [5] |
韩曼, 刘晓华, 杜剑青. 脊髓5-羟色胺受体参与延髓外侧网状核对大鼠心脏伤害性感受的下行性抑制调控[J].
南方医科大学学报, 2017, 37(9): 1190-4.
|
| [6] |
韩曼, 刘晓华, 杜剑青. 脊髓NK1受体与非NMDA受体对大鼠心脏-躯体运动反射的调节作用[J].
南方医科大学学报, 2014, 34(12): 1728-32.
|
| [7] |
Han M, Liu XH, Sun N, et al. Lateral reticular necleus modulates the cardiosomatic reflex evoked by intrapericardial capsaicin in the rat[J].
Eur J Neurosci, 2013, 37(9): 1511-8.
DOI: 10.1111/ejn.2013.37.issue-9. |
| [8] |
Zadina JE, Hackler L, Ge LJ, et al. A potent and selective endogenous agonist for the μ-opiate receptor[J].
Nature, 1997, 386: 499-502.
DOI: 10.1038/386499a0. |
| [9] |
Tseng LF. The antinociceptive properties of endomorphin-1 and endomorphin-2 in the mouse[J].
Jpn J Pharmacol, 2002, 89(3): 216-20.
DOI: 10.1254/jjp.89.216. |
| [10] |
Leng DN, FengYP, Li YQ. Endomorphin-1 is more potent than endomorphin-2 in inhibition of synaptic transmission in substantiagelatinosa of adult rat spinal cord[J].
Int J Neurosci, 2005, 115: 1515-26.
DOI: 10.1080/00207450590957827. |
| [11] |
Beitz AJ. The midbrain periaqueductal gray in the rat. I. Nuclear volume, cell number, density, orientation, and regional subdivisions[J].
J Comp Neurol, 1985, 237(4): 445-59.
DOI: 10.1002/(ISSN)1096-9861. |
| [12] |
Behbehani MM. Functional characteristics of the midbrain periaqueductal gray[J].
Prog Neurobiol, 1995, 46(6): 575-605.
DOI: 10.1016/0301-0082(95)00009-K. |
| [13] |
Millan MJ. Descending control of pain[J].
Prog Neurobiol, 2002, 66(6): 355-474.
DOI: 10.1016/S0301-0082(02)00009-6. |
| [14] |
Chen T, Li J, Feng B, et al. Mechanism underlying the analgesic effect exerted by endomorphin-1 in the rat ventrolateral periaqueductal gray[J].
Mol Neurobiol, 2016, 53(3): 2036-53.
DOI: 10.1007/s12035-015-9159-5. |
| [15] |
Wu YJ, Zhao XY, Gan YA, et al. Original endomorphin-1 analogues exhibit good analgesic effects[J].
Bioorg Med Chem Lett, 2017, 27(7): 1557-60.
DOI: 10.1016/j.bmcl.2017.02.034. |
| [16] |
Paxinos G, Watson C.
The rat brain in stereotaxic coordinates[M]. San Diego, CA: Academic Press, 1998.
|
| [17] |
韩济生.
神经科学[M]. 3版. 北京: 北京大学医学出版社, 2009: 657-9.
|
| [18] |
Samineni VK, Grajales-Reyes JG, Copits BA, et al. Divergent modulation of nociception by glutamatergic and GABAergic neuronal subpopulations in the periaqueductal gray[J].
eNeuro, 2017, 4(2): 0116-29.
|
| [19] |
Zadina JE, Martin-Schild S, Gerall AA. Endomorphins:novel endogenous μ-opiate receptor agonists in regions of high μ-opiate receptor density[J].
Ann NYAcadSci, 1999, 897: 136-44.
DOI: 10.1111/j.1749-6632.1999.tb07885.x. |
| [20] |
Chen T, Hui R, Wang XL, et al. Origins of endomorphin-immunoreactive fibers and terminals in different columns of the periaqueductal gray in the rat[J].
J Comp Neurol, 2008, 509(1): 72-87.
DOI: 10.1002/(ISSN)1096-9861. |
| [21] |
富歆. 内源性阿片样肽-内吗啡肽的研究进展[J].
国外医学药学分册, 2003, 30(6): 339-44.
|
| [22] |
Wang N, Zhang T, Su YL, et al. Differential modulation of electrical stimulation of periaqueductal gray and thalamus on nociceptive behaviors of rats[J].
Sheng Li Xue Bao, 2016, 68(2): 115-25.
|
| [23] |
韩曼, 刘晓华, 杜剑青. 电刺激中脑导水管周围灰质对大鼠心脏伤害性感受的下行性抑制调控[J].
山西医科大学学报, 2018, 49(2): 107-11.
|
| [24] |
Bodnar RJ. Endogenous opiates and behavior:2012[J].
Peptides, 2013, 50: 55-95.
DOI: 10.1016/j.peptides.2013.10.001. |
| [25] |
Harris JA. Using c-fos as a neural marker of pain[J].
Brain Res Bull, 1998, 45(1): 1-8.
DOI: 10.1016/S0361-9230(97)00277-3. |
| [26] |
李莉, 余剑波, 刘志学.针刺镇痛与c-fos基因的研究临床麻醉学杂志[J]. 2011, 27(10): 1030-2.
http://kns.cnki.net/KCMS/detail/detail.aspx?filename=LCMZ201110045&dbname=CJFD&dbcode=CJFQ
|
| [27] |
Tae HJ, Park SM, Cho JH, et al. Differential activation of c-Fos in the paraventricular nuclei of the hypothalamus and thalamus following myocardial infarction in rats[J].
Mol Med Rep, 2016, 14(4): 3503-8.
DOI: 10.3892/mmr.2016.5731. |
| [28] |
Pan HL, Chen SR. Myocardial ischemia recruits mechanically insensitive cardiac sympathetic afferents in Cats[J].
J Neurophysiol, 2002, 87(2): 660-8.
DOI: 10.1152/jn.00506.2001. |
 2018, Vol. 38
2018, Vol. 38

