2. 南方医科大学中西医结合医院科教科临床研究中 心,广东 广州 510315
2. Clinical Research Center, Integrated Hospital of Traditional Chinese Medicine, Southern Medical University, Guangzhou 510315, China
咪唑并杂环类化合物具有广泛的生物活性,如抗炎、抗癌、抗菌和抗病毒等[1-2]。近年来,这类化合物的抗癌活性研究在国内外均有报道,以咪唑并吡啶类的相关研究最多。以咪唑并[1, 2-a]吡啶为母体的一系列化合物具有香叶酰香叶基转移酶(RGGT)抑制活性[3]。通过分子对接发现母体6位引入取代基可增强与RGGT的亲和力,在细胞水平上表现为抗增殖活性提高。其中,活性最好的化合物对Hela癌细胞的最低有效剂量仅为10 μmol/L。AKT抑制剂ARQ 092[4]的母体为3-(3-苯基-3H-咪唑并[4, 5-b]吡啶-2-基)吡啶-2-胺;基于咪唑并[4, 5-b]吡啶的化合物[5]具有PAK4酶抑制活性。这些报道暗示了咪唑并吡啶衍生物可能通过影响与癌症发生相关的分子发挥抗癌作用。此外,咪唑并吡啶衍生物对肺癌[6]、乳腺癌[7]、前列腺癌[8]、黑素瘤[9]及卵巢癌[10]等恶性肿瘤均表现出较强的抑制活性,还有部分衍生物具有广谱抗癌活性[11-13]。除咪唑并吡啶类外,咪唑并吡嗪[14-16]、咪唑并哒嗪[17-19]、咪唑并吡唑[20]、咪唑并噻唑或噻二唑[21-23]等化合物也显示出较好的应用前景。这些化合物结构复杂,作用机制各异,或诱导细胞凋亡[24],或损伤DNA [25],或抑制与癌症发生相关的蛋白如VEGFR2 [19]。使用传统的方法合成咪唑并杂环化合物需要经历几步反应。在此,本课题组通过新型的卤环化反应一步合成以咪唑并杂环为母体的化合物。目标化合物共计12个,其中有3个结构新颖的化合物(4a、4b和4c)。这些化合物的母体为咪唑并喹啉、咪唑并萘啶等等,在抗癌领域没有报道。本课题组致力于研发安全、有效、价格低廉的抗乳腺癌药物,因此将在此评价它们的抗乳腺癌活性。
1 材料和方法 1.1 仪器和试剂1H-NMR和13C-NMR用Bruker Avance drx 400 MHz型核磁共振仪测定;MS采用Waters ZQ4000质谱仪测试;薄层层析硅胶板(TLC)采用GF 254(青岛海洋化工厂);柱层析硅胶粉采用200-300目(青岛海洋化工厂);层析柱采用磨口砂芯(北京欣维尔);紫外灯(波长254 nm)显色。试剂均为市售化学纯或分析纯产品,除特别说明外,不经处理直接使用。
人乳腺癌细胞sk-br-3和犬肾细胞MDCK(一骏生物);细胞培养基和澳洲胎牛血清(Thermo Fisher Scientific);医用DMSO(Sigma-Aldrich);酶标仪、移液枪和CO2培养箱(Thermo Scientific);流式细胞仪(BD Biosciences);Annexin V-FITC/PI Kit凋亡检测试剂盒(四柏正);雌性BALB/c裸鼠(赛柏诺生物)。
1.2 化合物1a、1b、1c、1d、1e的合成(图 1)[26]
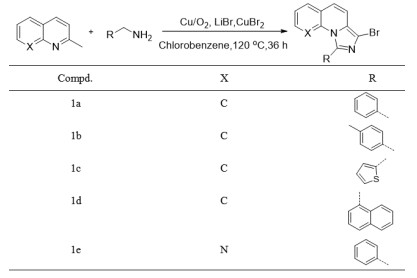
|
图 1 化合物1a、1b、1c、1d和1e的合成 Figure 1 Synthesis of compounds 1a, 1b, 1c, 1d and 1e. |
在25 mL的圆底烧瓶中加入反应物2-甲基喹啉36 mg(0.25 mmol),再加入苄胺54 mg(0.5 mmol),溴化锂130 mg(1.5 mmol),溴化铜11 mg(0.05 mmol)和氯苯1.5 mL。在120 ℃下回流反应36 h。冷却至室温,用氯仿提纯产物,5% Na2CO3溶液洗涤,无水硫酸钠干燥,然后真空下除去溶剂以浓缩。最后,残余物通过硅胶(石油醚:乙酸乙酯=2: 1)上的制备型TLC纯化,得到淡黄色固体72.4 mg,产率90%。Mp 163-164 ℃;1H NMR(400 MHz, CDCl3)δ 7.67-7.59(m, 3H),7.56-7.46(m, 4H), 7.33(t, J=7.5 Hz, 1H),7.29(d, J=9.4 Hz, 1H),7.19(t, J=7.8 Hz, 1H),7.08(d, J=9.4 Hz, 1H);13C NMR(101 MHz, CDCl3)δ 141.6,132.7,132.2,129.7,129.7,128.9,128.9,127.9,127.7,125.7,125.6,122.4,117.3,116.1,109.3;IR(KBr)3061,2954,2924,2852,1622,1604,1452,1393,1360,793,754,700,559 cm-1;HRMS(ESI)calcd for C17H11BrN2Na [M+Na]+344.9998;found 344.9996。
1.2.2 3-溴-1(-对甲苯基)咪唑并[1, 5-a]喹啉(1b)的合成在25 mL的圆底烧瓶中加入反应物2-甲基喹啉36 mg(0.25 mmol),再加入4-甲基苄胺61 mg(0.5 mmol),溴化锂130 mg(1.5 mmol),溴化铜11 mg(0.05 mmol)和氯苯1.5 mL。在120 ℃下回流反应36 h。冷却至室温,用氯仿提纯产物,5% Na2CO3溶液洗涤,无水硫酸钠干燥,然后真空下除去溶剂以浓缩。最后,残余物通过硅胶(石油醚:乙酸乙酯=2: 1)上的制备型TLC纯化,得到淡黄色固体71.4 mg,产率85%。Mp 167-168 ℃;1H NMR(400 MHz, CDCl3)δ 7.61(dd, J=7.8, 1.1 Hz, 1H),7.56-7.48(m, 3H),7.35-7.29(m, 3H),7.27(d, J = 9.4 Hz, 1H),7.22-7.16(m, 1H),7.06(d, J=9.4 Hz, 1H),2.46(s, 3H);13C NMR(101 MHz, CDCl3)δ 141.8,139.8,132.3,129.7,129.6,129.5,128.9,127.8,127.7,125.7,122.2,117.3,116.0,109.1,21.6;IR(KBr)3024,2953,2921,2856,1606,1552,1526,1475,1451,1359,793,754,722,558 cm-1;HRMS(ESI)calcd for C18H13BrN2Na[M+ Na]+ 359.0154;found 359.0149.
1.2.3 3-溴-1(-噻吩-2-基)咪唑并[1, 5-a]喹啉(1c)的合成在25 mL的圆底烧瓶中加入反应物2-甲基喹啉36 mg(0.25 mmol),再加入2-噻吩甲胺57 mg(0.5 mmol),溴化锂130 mg(1.5 mmol),溴化铜11 mg(0.05 mmol)和氯苯1.5 mL。在120 ℃下回流反应36 h。冷却至室温,用氯仿提纯产物,5% Na2CO3溶液洗涤,无水硫酸钠干燥,然后真空下除去溶剂以浓缩。最后,残余物通过硅胶(石油醚:乙酸乙酯=2 : 1)上的制备型TLC纯化,得到淡黄色固体66.4 mg,产率81%。Mp 156-157 ℃;1H NMR(400 MHz, CDCl3)δ 7.65(d, J=7.7 Hz, 1H),7.59(d, J= 6.8 Hz, 2H),7.40-7.33(m, 2H),7.28(dd, J=12.7, 6.2 Hz, 2H),7.23-7.18(m, 1H),7.11(d, J=9.4 Hz, 1H);13C NMR(101 MHz, CDCl3)δ 134.3,132.9,132.2,130.1,129.0,128.8,128.6,128.1,127.5,126.0,125.6,122.9,116.9,115.8,109.4;IR(KBr)3068,2954,2924,2852,1620,1473,1447,1361,1251,794,751,741,706,672,555 cm-1;HRMS(ESI)calcd for C15H9BrN2NaS [M + Na]+ 350.9562;found 350.9568.
1.2.4 3-溴-1(-萘-1-基)咪唑并[1, 5-a]喹啉(1 d)的合成在25 mL的圆底烧瓶中加入反应物2-甲基喹啉36 mg(0.25 mmol),再加入1-甲基萘71 mg(0.5 mmol),溴化锂130 mg(1.5 mmol),溴化铜11 mg(0.05 mmol)和氯苯1.5 mL。在120 ℃、回流反应36 h。冷却至室温,用氯仿提纯产物,5% Na2CO3溶液洗涤,无水硫酸钠干燥,然后真空下除去溶剂以浓缩。最后,残余物通过硅胶(石油醚:乙酸乙酯=2: 1)上的制备型TLC纯化,得到淡黄色固体84.6 mg,产率91%。Mp 185-186 ℃;1H NMR(400 MHz, CDCl3)δ 8.06(d, J=8.2 Hz, 1H),7.95(d, J= 8.2 Hz, 1H),7.71(d, J=6.9 Hz, 1H),7.61(t, J=8.5 Hz, 2H),7.49(t, J=7.2 Hz, 1H),7.42-7.28(m, 3H),7.22(t, J= 7.2 Hz, 1H),7.13(d, J=9.5 Hz, 1H),6.99-6.84(m, 2H);13C NMR(101 MHz, CDCl3)δ 139.7,133.7,132.4,132.1,130.5,130.4,129.1,128.8,128.5,128.1,127.8,127.4,126.6,125.6,125.6,125.5,125.4,122.5,116.9,116.0,109.2;IR(KBr)3053,2954,2924,2853,1607,1473,1448,1360,1247,798,777,752,741,561,527 cm-1;HRMS(ESI)calcd for C21H13BrN2Na [M+Na]+ 395.0154;found 395.0158。
1.2.5 7-溴-9-苯基咪唑并[1, 5-a][1, 8]萘啶(1e)的合成在25 mL的圆底烧瓶中加入反应物2-甲基-[1, 8]-萘啶36 mg(0.25 mmol),再加入苄胺54 mg(0.5 mmol),溴化锂130 mg(1.5 mmol),溴化铜11 mg(0.05 mmol)和氯苯1.5 mL。在120 ℃、回流反应36 h。冷却至室温,用氯仿提纯产物,5% Na2CO3溶液洗涤,无水硫酸钠干燥,然后真空下除去溶剂以浓缩。最后,残余物通过硅胶(石油醚:乙酸乙酯=2: 1)上的制备型TLC纯化,得到淡黄色固体60.5 mg,产率75%。Mp 183-184 ℃;1H NMR(400 MHz, CDCl3)δ 8.24(d, J=4.5 Hz, 1H),7.91(d, J= 7.8 Hz, 1H),7.80-7.70(m, 2H),7.48-7.38(m, 3H),7.35- 7.26(m, 2H),6.98(d, J=9.3 Hz, 1H);13C NMR(101 MHz, CDCl3)δ 146.6,143.9,143.1,136.3,132.5,130.4,128.8,128.7,127.27,122.0,120.3,120.2,117.4,110.6;IR(KBr)3055,2954,2922,2853,1617,1593,1422,1366,814,761,699,675,590 cm-1;MS(EI, m/z)323 [M] +;HRMS(ESI)calcd for C16H11BrN3 [M + H]+324.0131;found 324.0132。
1.3 化合物2a、2b的合成(图 2)[26]
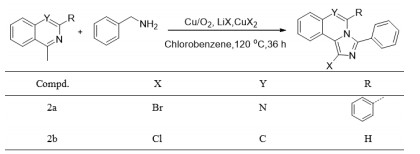
|
图 2 化合物2a和2b的合成 Figure 2 Synthesis of compounds 2a and 2b. |
在25 mL的圆底烧瓶中加入4-甲基-2-苯基喹唑啉55 mg(0.25 mmol),再加入苄胺54 mg(0.5 mmol),溴化锂130 mg(1.5 mmol),溴化铜11 mg(0.05 mmol)和氯苯1.5 mL。在120 ℃、回流反应36 h。冷却至室温,用氯仿提纯产物,5% Na2CO3溶液洗涤,无水硫酸钠干燥,然后真空下除去溶剂以浓缩。最后,混合物通过硅胶(石油醚:乙酸乙酯=4: 1)上的制备型TLC纯化,得到黄色固体44.9 mg,产率45%。Mp 229-230 ℃;1H NMR(400 MHz, CDCl3)δ 8.86(d, J=7.4 Hz, 1H),7.89(d, J=7.4 Hz, 1H),7.67-7.52(m, 2H),7.30(d, J=7.7 Hz, 2H),7.22-6.97(m, 8H);13C NMR(101 MHz, CDCl3)δ 145.6,141.8,138.5,133.4,130.5,130.1,129.2,128.8,128.7,128.5,128.4,128.2,127.8,127.5,125.6,121.7,118.9,109.0;IR(KBr)3052,2954,2922,2852,1605,1566,1532,1462,1329,1234,949,753,695,541 cm-1;HRMS(ESI)calcd for C22H15BrN3 [M+H]+ 400.0444;found 400.0449。
1.3.2 1-氯-3-苯基咪唑并[5, 1-a]异喹啉(2b)的合成在25 mL的圆底烧瓶中加入1-甲基异喹啉36 mg(0.25 mmol),再加入苄胺54 mg(0.5 mmol),氯化锂64 mg(1.5 mmol),氯化铜7 mg(0.05 mmol)和氯苯1.5 mL。在120 ℃、回流反应36 h。冷却至室温,用氯仿提纯产物,5% Na2CO3溶液洗涤,无水硫酸钠干燥,然后真空下除去溶剂以浓缩。最后,混合物通过硅胶(石油醚:乙酸乙酯=4: 1)上的制备型TLC纯化,得到白色固体48.6 mg,产率70%。Mp 161-162 ℃;1H NMR(400 MHz, CDCl3)δ 8.62(d, J=8.0 Hz, 1H),7.86(d, J=7.6 Hz, 1H),7.72(d, J=7.6 Hz, 2H),7.56-7.34(m, 6H),6.71(d, J= 7.6 Hz, 1H);13C NMR(101 MHz, CDCl3)δ 138.4,129.4,129.0,129.0,128.5,128.5,127.3,127.1,126.9,124.6,122.7,122.3,122.2,120.2,114.9;IR(KBr)3066,3027,2919,2849,1602,1553,1477,1453,1364,977,790,737,691,596 cm-1;HRMS(ESI)calcd for C17H11ClN2Na [M+Na]+ 301.0503;found 301.0511。
1.4 1-苯基-3(-苯基乙炔基)咪唑并[1, 5-a]喹啉(3a)的合成(图 3)
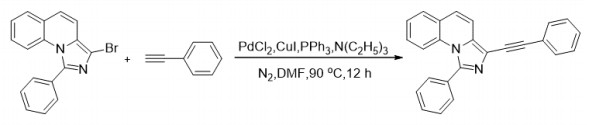
|
图 3 化合物3a的合成 Figure 3 Synthesis of compound 3a. |
氮气氛下,将3-溴-1-苯基咪唑并[1, 5-a]喹啉(1a)345 mg(1 mmol)、乙炔苯128 mg(1.25 mmol)、PdCl2 9 mg(0.05 mmol)、CuI 38 mg(0.2 mmol)、PPh3 10 mol %、N(C2H5)3 304 mg(3 mmol)和DMF 1.5 mL依次放入Schlenk管。然后关闭Schlenk管,并将所得混合物在90 ℃下搅拌12 h。冷却至室温后,混合物用氯仿萃取,用5% Na2CO3洗涤,用硫酸钠干燥,并在真空中除去溶剂以浓缩。最后,将残余物通过硅胶上的制备型TLC(石油醚:乙酸乙酯:二氯甲烷=4: 2: 1)纯化得到棕色固体223.6 mg,产率65%。Mp 186-187 ℃;1H NMR(400 MHz, CDCl3)δ 7.71-7.57(m, 5H),7.57-7.44(m, 5H),7.40-7.25(m, 4H),7.22-7.10(m, 2H);13C NMR(101 MHz, CDCl3)δ 142.4,133.3,133.1,132.4,131.4,129.7,129.7,128.8,128.4,128.1,127.9,125.8,125.6,123.5,123.2,117.4,116.9,116.7,93.1,82.5;IR(KBr)3056,2924,2209,1599,1556,1445,1359,1111,798,753,705,690,611 cm-1;HRMS(ESI)calcd for C25H17N2 [M+H]+ 345.1386;found 345.1395。
1.5 N,N-二苯基-4(- 1-苯基咪唑并[1, 5-a]喹啉-3-基)苯胺(3b)的合成(图 4)氮气氛下,将3-溴-1-苯基咪唑并[1, 5-a]喹啉(1a)345 mg(1 mmol)、4-硼酸三苯胺347 mg(1.2 mmol)、Pd2(dba)3(5 mol %)、P(t-Bu)3(10 mol %)、KOH(2 mmol)和DMF(1.5 mL)依次放入Schlenk管。然后关闭Schlenk管,并将所得混合物在100 ℃下搅拌10 h。冷却至室温后,混合物用氯仿萃取2次,用5%Na2CO3洗涤,用硫酸钠干燥,并在真空中除去溶剂以浓缩。最后,将残余物通过硅胶上的制备型TLC(石油醚:乙酸乙酯:二氯甲烷=4:2:1)纯化得到黄色固体379.8 mg,产率78%。Mp 231- 232 ℃;1H NMR(400 MHz, CDCl3)δ 7.82(d, J=8.6 Hz, 2H),7.77-7.71(m, 2H)7.69(d, J=9.5 Hz, 1H),7.64(d, J=7.7 Hz, 1H),7.61-7.53(m, 3H),7.50(d, J=8.5 Hz, 1H),7.37-7.26(m, 5H),7.25-7.14(m, 7H),7.06(dd, J=17.0, 8.5 Hz, 3H);13C NMR(101 MHz, CDCl3)δ 147.8,146.9,142.0,133.6,132.5,129.8,129.5,129.3,129.0,128.9,128.5,128.4,127.5,126.1,125.9,125.3,124.3,124.3,122.8,122.6,121.8,117.6,117.6;IR(KBr)3057,3027,2923,2853,1589,1489,1315,1276,751,696 cm-1;HRMS(ESI)calcd for C35H26N3 [M+H] + 488.2121;found 488.2137。
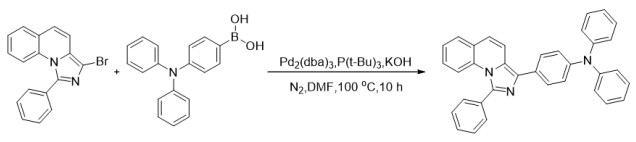
|
图 4 化合物3b的合成 Figure 4 Synthesis of compound 3b. |
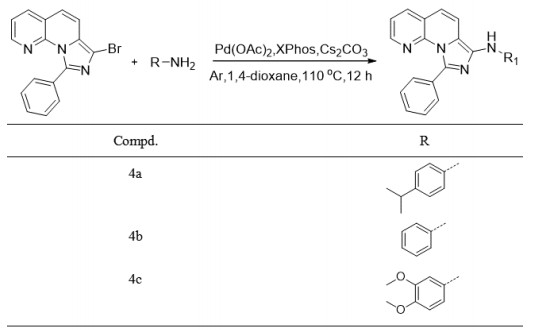
|
图 5 化合物4a、4b和4c的合成 Figure 5 Synthesis of compound 4a, 4b and 4c. |
萘啶(1e)469 mg(1.4 mmol)、4-异丙基苯胺135 mg(1 mmol)、Pd(OAc)2 22 mg(0.1 mmol)、XPhos和Cs2CO3 163 mg(0.5 mmol)溶于1, 4-二氧六环,用氩气保护并在110 ℃加热12 h。冷却至室温后,反应混合物用乙酸乙酯萃取,用盐水洗涤。收集有机相并且在真空中除去溶剂。使用环己烷-丙酮作为洗脱液的硅胶色谱法纯化粗产物,得到黄色固体291 mg,产率53%。Mp 193-194 ℃;1H NMR(500 MHz, DMSO)δ 8.39(s, 1H),8.17(dd, J=4.6, 1.6 Hz, 1H),8.09(dd, J=7.8, 1.6 Hz, 1H),7.75-7.69(m, 2H),7.57(d, J=9.3 Hz, 1H),7.44-7.38(m, 4H),7.28(d, J=8.5 Hz, 2H),7.05(d, J=8.5 Hz, 2H),6.88(d, J=9.3 Hz, 1H),2.82-2.72(m, 1H),1.15(d, J=6.9 Hz, 6H);13C NMR(126 MHz, DMSO)δ 145.86,144.08,142.80,138.92,138.74,137.02,136.56,133.91,130.44,128.53,127.54,126.93,122.51,121.56,118.65,117.48,115.46,33.12,24.67;EI(+)-ESI-MS m/z,calcd for C25H22N4 [M+H]+ 379.19,found 379.20。
1.6.2 N,9-二苯基咪唑并[1, 5-a][1, 8]萘啶-7-胺(4b)的合成把7-溴-9-苯基咪唑并[1, 5-a][1, 8]萘啶(1e)469 mg(1.4 mmol)、苯胺93 mg(1 mmol)、Pd(OAc)2 22 mg(0.1 mmol)、XPhos和Cs2CO3 163 mg(0.5 mmol)溶于1, 4-二氧六环,用氩气保护并在110 ℃加热12 h。冷却至室温后,反应混合物用乙酸乙酯萃取,用盐水洗涤。收集有机相并且在真空中除去溶剂。使用环己烷-丙酮作为洗脱液的硅胶色谱法纯化粗产物,得到棕色固体402 mg,产率67%。Mp 184-185 ℃;1H NMR(500 MHz, DMSO)δ 8.52(s, 1H),8.17(dd, J=4.6, 1.7 Hz, 1H),8.10(dd, J=7.8, 1.7 Hz, 1H),7.74-7.70(m, 2H),7.58(d, J=9.3 Hz, 1H),7.45-7.39(m, 4H),7.36(d, J=7.7 Hz, 2H),7.19-7.15(m, 2H),6.91(d, J=9.4 Hz, 1H),6.72(t, J= 7.3 Hz, 1H);13C NMR(126 MHz, DMSO)δ 145.96,145.03,144.05,139.00,136.57(d, J=14.5 Hz),133.90,130.46,129.24,128.56,127.55,122.53,121.46,118.63(d, J=23.0 Hz),118.54-118.26(m),117.89,115.84,115.24;EI(+)-ESI-MS m/z,calcd for C22H16N4 [M+H]+ 337.15,found 337.10。
1.6.3 N-(3, 4-二甲氧基苯基)-9-苯基咪唑并[1, 5-a][1, 8]萘啶-7-胺(4c)的合成把7-溴-9-苯基咪唑并[1, 5-a] [1, 8]萘啶(1e)469 mg(1.4 mmol)、3, 4-二甲氧基苯胺153 mg(1 mmol)、Pd(OAc)2 22 mg(0.1 mmol)、XPhos和Cs2CO3 163 mg(0.5 mmol)溶于1, 4-二氧六环,用氩气保护并在110 ℃加热12 h。冷却至室温后,反应混合物用乙酸乙酯萃取,用盐水洗涤。收集有机相并且在真空中除去溶剂。使用环己烷-丙酮作为洗脱液的硅胶色谱法纯化粗产物,得到棕色固体358 mg,产率59%。Mp 209-210 ℃;1H NMR(500 MHz, DMSO)δ 8.34(s, 1H),8.16(dd, J=4.6, 1.7 Hz, 1H),8.08(dd, J=7.8, 1.7 Hz, 1H),7.73(dd, J=7.7, 1.8 Hz, 2H),7.57(d, J=9.3 Hz, 1H),7.44- 7.39(m, 4H),7.13(d, J=2.5 Hz, 1H),6.95(dd, J= 8.7, 2.5 Hz, 1H),6.86(d, J=9.4 Hz, 1H),6.81(d, J=8.7 Hz, 1H),6.62(d, J=8.4 Hz, 1H),6.25(d, J=2.5 Hz, 1H),6.05(dd, J=8.4, 2.5 Hz, 1H),4.64(s, 1H),3.72(s, 3H),3.66(d, J=6.5 Hz, 6H),3.59(s, 3H);13C NMR(126 MHz, DMSO)δ 150.29,149.77,145.78,144.09,143.90,142.26,140.46,139.16,138.83,137.51,136.50,133.88,130.38,128.51,127.53,122.53,121.64,118.66,116.88,115.14,114.11,106.90,105.50,101.61,100.39,57.18,56.77,55.66(d, J=19.1 Hz);EI(+)-ESI-MS m/z,calcd for C24H20N4O2 [M+H]+ 397.17,found 397.16。
1.7 化合物的体外细胞实验将1a-1e、2a、2b、3a、3b及4a-4c使用医用DMSO分别配制成浓度为10 mmol/L的溶液,备用。实验中使用的DMEM培养基采用90% DMEM基本培养基加10%胎牛血清配制得到。
化合物对乳腺癌细胞的抗增殖活性与对MDCK细胞的毒性均采用MTT法测定。实验组化合物抑制率(%)= {([N-C)(-E-C)]/(N-C)} ×100%,阳性对照组化合物抑制率(%)= {([N-C)(-P-C)]/(N-C)}×100%,其中E代表实验组的吸光度值,P代表阳性对照组的吸光度值,N代表阴性对照组的吸光度值,C代表调零组的吸光度值。用化合物的半数抑制浓度(IC50)作为化合物对乳腺癌细胞抗增殖活性的指标,半数细胞死亡浓度(CC50)作为化合物对细胞毒性的指标。IC50与CC50均通过Calccusyn软件计算得到。
顺铂在临床上以注射的方式给药,静脉注射18~ 24 h后,在肾内积蓄最多,产生严重肾毒性[27]。根据已报道文献[28-31],本文采用MDCK细胞(考克斯班尼犬肾脏上皮细胞)比较目标化合物与顺铂的肾毒性。
采用Annexin V-FITC/PI双染色法对化合物作用后的sk-br-3细胞染色,使用流式细胞仪检测细胞凋亡情况,以研究化合物的作用机制。
1.7.1 初步筛选具有体外抗乳腺癌活性的化合物取对数生长期的sk-br-3细胞,以3000/孔的密度接种于96孔板,放置于培养箱中培养24 h。用DMEM将10 mmol/L的药物溶液稀释为25 μmol/L。96孔板每孔加入相应的25 μmol/L药物溶液100 μL,同时设置阴性对照组、阳性对照组(顺铂)及不含细胞的调零组,放置于培养箱中培养48 h,加入MTT,继续培养4 h,使用酶标仪在490 nm处测定吸光度(A490 nm),并计算抑制率。
1.7.2 化合物的体外抗乳腺癌活性测定取对数生长期的sk-br-3细胞,以3000/孔的密度接种于96孔板,放置于培养箱中培养24 h。用DMEM将10 mmol/L的药物溶液等比稀释为6个浓度梯度。96孔板每孔加入相应的药物溶液100 μL,同时设置阴性对照组、阳性对照组(顺铂)及不含细胞的调零组,放置于培养箱中培养48 h,加入MTT,继续培养4 h,使用酶标仪在490 nm处测定吸光度值,并计算抑制率与IC50。重复实验4次,舍去每个化合物IC50的最大值与最小值,取剩余3个数据作统计学分析。
1.7.3 化合物的肾毒性测定取对数生长期的MDCK细胞,以3000 /孔的密度接种于96孔板,放置于培养箱中培养24 h。用DMEM将10 mmol/L的药物溶液等比稀释为6个浓度梯度。96孔板每孔加入相应的药物溶液100 μL,同时设置阴性对照组、阳性对照组(顺铂)及不含细胞的调零组,放置于培养箱中培养48 h,加入MTT,继续培养4 h,使用酶标仪在490 nm处测定吸光度值,并计算抑制率与CC50。重复实验4次,舍去每个化合物CC50的最大值与最小值,取剩余3个数据作统计学分析。
1.7.4 Annexin V-FITC/PI双染色检测2a对sk-br-3细胞的凋亡诱导作用取对数生长期的sk-br-3细胞,以106/孔的密度接种于6孔板,放置于培养箱中培养24 h。用DMEM将10 mmol/L的2a等比稀释为4个浓度梯度。6孔板每孔加入相应的药物溶液2 mL,同时设置单染色对照组、空白对照组和阳性对照组(使用浓度与2a相同的顺铂溶液作对照),放置于培养箱中培养。在6孔板加药培养48 h后,用PBS清洗细胞并保留清洗液。用不含EDTA的胰蛋白酶消化细胞后与清洗液合并,离心,弃上清液。用冷冻的PBS 2 mL洗涤细胞2次,离心,弃上清液。加入500 μLAnnexin V-Fitc结合液重悬细胞,使细胞浓度约为106/mL。取100 μL细胞悬液加入到新的EP管,加AnnexinV-Fitc结合物5 μL,再加PI溶液5 μL。室温下避光培养15 min。加入Annexin V-Fitc结合液400 μL,1 h内检测。流式细胞仪激发波长为488 nm,发射波长为530 nm,Annexin V-Fitc的绿色荧光通过FITC(FL1)通道检测;PI的红色荧光通过FL2通道检测[32]。
1.8 2a的体内抗癌活性对六周龄的雌性BALB/c裸鼠皮下注射约5×106个sk-br-3细胞。裸鼠肿瘤平均体积达到100~300 mm3时,利用SPSS产生随机数字将裸鼠随机分为治疗组与对照组,每组6只。治疗组腹腔注射2a的生理盐水溶液,剂量:10 mg/(kg·d);对照组腹腔注射等量生理盐水,持续14 d。每天观察小鼠的基本情况(精神状态、大小便情况,皮肤变化如皮疹、活动情况)。实验结束时处死小鼠,取出肿瘤测量长短径,对比大小[33],采用此公式计算体积[34]:肿瘤体积=0.52×长径×短径2。
1.9 数据分析实验数据采用SPSS分析。结果以均数±标准差表示。组间比较采用独立样本t检验,P < 0.05表示差异有统计学意义。
2 结果 2.1 化合物的抗增殖活性与肾毒性化合物的体外抗乳腺癌活性初步筛选结果见表 1。结果表明,化合物2a、4a、4b和4c在25 μmol/L对人乳腺癌细胞株sk-br-3有一定的抑制活性。其中,2a的活性最好,高达77.12%,接近阳性药物顺铂(抑制率为82.23%)。
| 表 1 化合物在25 μmol/L下对sk-br-3的抑制活性 Table 1 Inhibitory effects of the synthesized compounds (25 μmol/L) against sk-br-3 cells |
化合物对sk-br-3细胞抗乳腺癌活性非常接近阳性药物顺铂,肾毒性略小于顺铂。化合物4a和4c对乳腺癌细胞的也有一定的抑制活性且肾毒性小,可以用于结构改造以获得活性更好的化合物(表 2)。
| 表 2 化合物的体外抗癌活性与肾毒性 Table 2 Anti-tumor activity and nephrotoxicity of the synthesized compounds in vitro (Mean±SEM, n=3) |
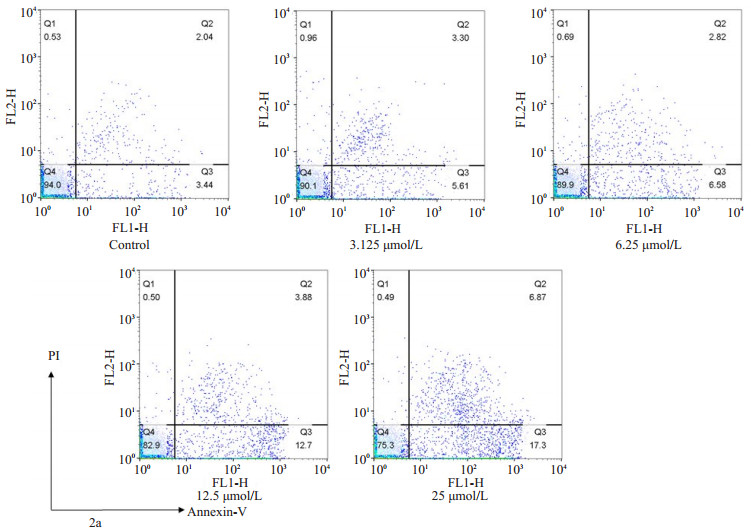
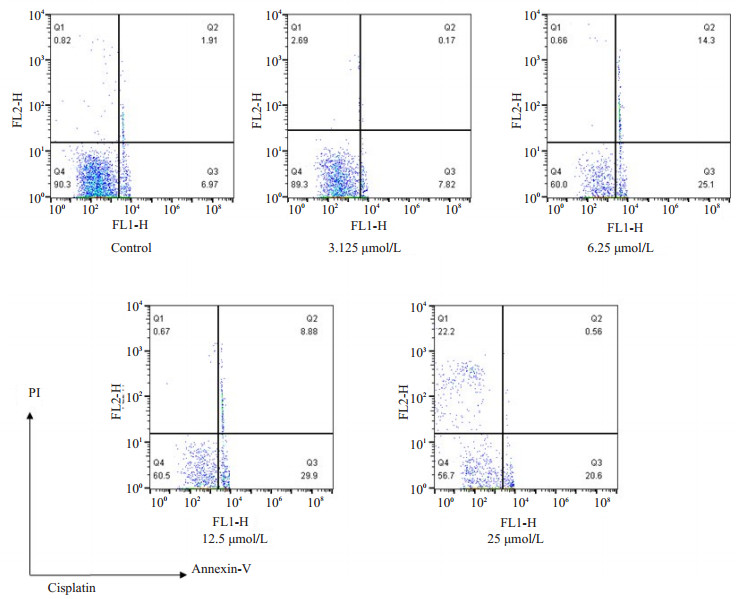
2a对细胞的凋亡诱导作用不如顺铂强;但和顺铂相同,细胞经2a处理48 h后,凋亡早期细胞的比例随着化合物浓度提高而上升(图 6~7)。
|
图 6 2a对sk-br-3细胞的凋亡诱导作用 Figure 6 Apoptosis-inducing effects of compound 2a in sk-br-3 cell line. |
|
图 7 顺铂对sk-br-3细胞的凋亡诱导作用 Figure 7 Apoptosis-inducing effects of cisplatin in sk-br-3 cell line. |
连续给药14 d后,对照组裸鼠肿瘤平均体积为1261.63 ± 159.58 mm3,给药组裸鼠肿瘤平均体积为870.62±92.47 mm3,说明2a在10 mg·kg-1·day-1的剂量下对小鼠体内的肿瘤生长显示出一定的抑制效应。对两组裸鼠肿瘤平均体积进行独立样本T检验,0.1 > P= 0.06 > 0.05。虽然不能说明两组裸鼠肿瘤平均体积存在显著性差异,但P接近0.05,提示可能存在较大差别,未小于0.05可能由于样本量太少,未达到统计学差异。此外,在用药期间没有观察到严重不良反应的发生。
3 讨论综上所述,本课题组通过新型的卤环化反应一步合成以咪唑并杂环为母体的化合物并进行活性筛选和机制研究。初步筛选出4个活性化合物2a、4a、4b和4c并测定IC50。其中2a活性最好,IC50值是9.77±2.32 μmol/L,接近阳性对照药物顺铂(IC50=8.96±2.35 μmol/L),且肾毒性略小于顺铂(2a的CC50为10.79±0.87 μmol/L,顺铂的CC50为8.45±0.68 μmol/L)。综合考虑,选取2a用于进一步研究。通过初步的机制研究,发现2a以浓度依赖的方式诱导乳腺癌细胞sk-br-3发生凋亡从而发挥抗癌效应。此外,体内抗癌活性研究发现,2a在10 mg/(kg·day)的剂量下对小鼠体内的肿瘤生长有一定的抑制作用。
| [1] |
Krause M, Foks H, Gobis K. Pharmacological potential and synthetic approaches of imidazo[4, 5-b] pyridine and imidazo[4, 5-c] pyridine derivatives[J].
Molecules, 2017, 22(3): 399.
DOI: 10.3390/molecules22030399. |
| [2] |
Marie Kirwen E, Batra T, Karthikeyan C, et al. 2, 3-Diaryl-3Himidazo[4, 5-b] pyridine derivatives as potential anticancer and antiinflam-matory agents[J].
Acta Pharm Sin B, 2017, 7(1): 73-9.
DOI: 10.1016/j.apsb.2016.05.003. |
| [3] |
Kaźmierczak A, Kusy D, Niinivehmas SP, et al. Identification of the privileged position in the imidazo[1, 2-a] pyridine ring of phosphonocarboxylates for development of Rab geranylgeranyl transferase (RGGT) inhibitors[J].
J Med Chem, 2017, 60(21): 8781-800.
DOI: 10.1021/acs.jmedchem.7b00811. |
| [4] |
Lapierre JM, Eathiraj S, Vensel D, et al. Discovery of 3-(3-(4-(1- Aminocyclobutyl) phenyl)-5-phenyl-3h-imidazo[4, 5-b] pyridin-2- yl) pyridin-2-amine (ARQ 092):an orally bioavailable, selective, and potent allosteric AKT inhibitor[J].
J Med Chem, 2016, 59(13): 6455-69.
DOI: 10.1021/acs.jmedchem.6b00619. |
| [5] |
Park JK, Kim S, Han YJ, et al. The discovery and the structural basis of an imidazo[4, 5-b] pyridine-based p21-activated kinase 4 inhibitor[J].
Bioorg Med Chem Lett, 2016, 26(11): 2580-3.
DOI: 10.1016/j.bmcl.2016.04.037. |
| [6] |
Liu TC, Peng X, Ma YC, et al. Discovery of a new series of imidazo [1, 2-a] pyridine compounds as selective c-Met inhibitors[J].
Acta Pharmacol Sin, 2016, 37(5): 698-707.
DOI: 10.1038/aps.2016.11. |
| [7] |
Rassokhina IV, Volkova YA, Kozlov AS, et al. Synthesis and antiproliferative activity evaluation of steroidal imidazo[1, 2-a] pyridines[J].
Steroids, 2016, 113: 29-37.
DOI: 10.1016/j.steroids.2016.06.001. |
| [8] |
Ramya PVS, Guntuku L, Angapelly S, et al. Synthesis and biological evaluation of curcumin inspired imidazo[1, 2-a] pyridine analogues as tubulin polymerization inhibitors[J].
Eur J Med Chem, 2018, 143: 216-31.
|
| [9] |
Garamvölgyi R, Dobos J, Sipos A, et al. Design and synthesis of new imidazo[1, 2-a] pyridine and imidazo[1, 2-a] pyrazine derivatives with antiproliferative activity against melanoma cells[J].
Eur J Med Chem, 2016, 108: 623-43.
DOI: 10.1016/j.ejmech.2015.12.001. |
| [10] |
Han W, Menezes DL, Xu Y, et al. Discovery of imidazo[1, 2-a]- pyridine inhibitors of pan-PI3 kinases that are efficacious in a mouse xenograft model[J].
Bioorg Med Chem Lett, 2016, 26(3): 742-6.
DOI: 10.1016/j.bmcl.2016.01.003. |
| [11] |
Mani GS, Shaik SP, Tangella Y, et al. {[}1, 2-a] pyridines via sp(3) C-H functionalization of azaarenes and evaluation of anticancer activity[J].
Org Biomol Chem, 2017, 15(32): 6780-91.
DOI: 10.1039/C7OB01384A. |
| [12] |
Goel R, Luxami V, Paul K. Imidazo [1, 2-a] pyridines:promising drug candidate for antitumor therapy[J].
Curr Top Med Chem, 2016, 16(30): 3590-616.
DOI: 10.2174/1568026616666160414122644. |
| [13] |
Choi JY, Iacobazzi RM, Perrone M, et al. Synthesis and evaluation of tricarbonyl (99m)Tc-Labeled 2-(4-Chloro) phenyl-imidazo[1, 2-a] pyridine analogs as novel SPECT imaging radiotracer for TSPORich cancer[J].
Int J Mol Sci, 2016, 17(7): 1085.
DOI: 10.3390/ijms17071085. |
| [14] |
Yu T, Zhang Y, Kerekes AD, et al. Discovery of a highly potent orally bioavailable imidazo-[1, 2-a] pyrazine Aurora inhibitor[J].
Bioorg Med Chem Lett, 2018, 28(8): 1397-403.
DOI: 10.1016/j.bmcl.2018.02.037. |
| [15] |
Bazin MA, Rousseau B, Marhadour S, et al. Discovery of novel (imidazo[1, 2-a] pyrazin-6-yl) ureas as antiproliferative agents targeting P53 in non-small cell lung cancer cell lines[J].
Anticancer Res, 2016, 36(4): 1621-30.
|
| [16] |
Zhao F, Zhang J, Zhang L, et al. Discovery and optimization of a series of imidazo[4, 5-b] pyrazine derivatives as highly potent and exquisitely selective inhibitors of the mesenchymal-epithelial transition factor (c-Met) protein kinase[J].
Bioorg Med Chem, 2016, 24(18): 4281-90.
DOI: 10.1016/j.bmc.2016.07.019. |
| [17] |
Mao B, Gao S, Weng Y, et al. Design, synthesis, and biological evaluation of imidazo[1, 2-b] pyridazine derivatives as mTOR inhibitors[J].
Eur J Med Chem, 2017, 129: 135-50.
DOI: 10.1016/j.ejmech.2017.02.015. |
| [18] |
翁怡然, 高善云, 杨振军, 等. 咪唑-[1, 2-b]哒嗪类mTOR抑制剂的合成及抗肿瘤活性研究[J].
中国药物化学杂志, 2013, 23(6): 435-43.
|
| [19] |
戴雪娥, 赵钟祥, 吴建军, 等. 咪唑并[1, 2-b]哒嗪类VEGFR2激酶抑制剂的分子设计[J].
计算机与应用化学, 2016, 33(1): 69-74.
|
| [20] |
Grosse S, Mathieu V, Pillard C, et al. New imidazo[1, 2-b] pyrazoles as anticancer agents:synthesis, biological evaluation and structure activity relationship analysis[J].
Eur J Med Chem, 2014, 84(18): 718-30.
|
| [21] |
Matysiak J, Niewiadomy A. QSAR models of antiproliferative activity of imidazo[2, 1-b][1, 3, 4] thiadiazoles in various cancer cell lines[J].
Mol Divers, 2017, 21(1): 211-8.
DOI: 10.1007/s11030-016-9705-8. |
| [22] |
Baig MF, Nayak VL, Budaganaboyina P, et al. Synthesis and biological evaluation of imidazo[2, 1-b] thiazole-benzimidazole conjugates as microtubule-targeting agents[J].
Bioorg Chem, 2018, 77: 515-26.
DOI: 10.1016/j.bioorg.2018.02.005. |
| [23] |
Noolvi MN, Patel HM, Singh N, et al. Synthesis and anticancer evaluation of novel 2-cyclopropylimidazo[2, 1-b][1, 3, 4]-thiadiazole derivatives[J].
Eur J Med Chem, 2011, 46(9): 4411-8.
DOI: 10.1016/j.ejmech.2011.07.012. |
| [24] |
Kamal A, Ramakrishna G, Raju P, et al. Synthesis and anticancer activity of oxindole derived imidazo[1, 5-a] pyrazines[J].
Eur J Med Chem, 2011, 46(6): 2427-35.
DOI: 10.1016/j.ejmech.2011.03.027. |
| [25] |
Liu J, Chen M, Wang Y, et al. Synthesis and the interaction of 2-(1Hpyrazol-4-yl)-1H-imidazo[4, 5-f][1, 10] phenanthrolines with telomeric DNA as lung cancer inhibitors[J].
Eur J Med Chem, 2017, 133: 36-49.
DOI: 10.1016/j.ejmech.2017.03.030. |
| [26] |
Tan Z, Zhao H, Zhou C, et al. Aerobic Copper-Catalyzed halocyclization of methyl N-Heteroaromatics with aliphatic amines:access to functionalized imidazo-fused N-heterocycles[J].
J Org Chem, 2016, 81(20): 9939-46.
DOI: 10.1021/acs.joc.6b02117. |
| [27] |
Sharma SK, Goyal N. Protective effect of heliotropium eichwaldi against cisplatin-induced nephrotoxicity in mice[J].
Zhong Xi Yi Jie He Xue Bao, 2012, 10(5): 555-60.
|
| [28] |
Xu B, Chu F, Zhang Y, et al. A series of new ligustrazine-triterpenes derivatives as anti-tumor agents:design, synthesis, and biological evaluation[J].
Int J Mol Sci, 2015, 16(9): 21035-55.
DOI: 10.3390/ijms160921035. |
| [29] |
Chu F, Xu X, Li G, et al. Amino acid derivatives of ligustrazineoleanolic acid as new cytotoxic agents[J].
Molecules, 2014, 19(11): 18215-31.
DOI: 10.3390/molecules191118215. |
| [30] |
Xu B, Yan WQ, Xu X, et al. Combination of amino acid/dipeptide with ligustrazine-betulinic acid as antitumor agents[J].
Eur J Med Chem, 2017, 130: 26-38.
DOI: 10.1016/j.ejmech.2017.02.036. |
| [31] |
王鹏龙, 徐昕, 李国梁, 等. 新型川芎嗪衍生物的合成及其抗癌活性研究[J].
西北药学杂志, 2014, 29(1): 58-64.
DOI: 10.3969/j.issn.1004-2407.2014.01.019. |
| [32] |
Liu AD, Xu H, Gao YN, et al. (Arg)9-SH2 superbinder:a novel promising anticancer therapy to melanoma by blocking phosphotyrosine signaling[J].
J Exp Clin Cancer Res, 2018, 37(1): 138.
DOI: 10.1186/s13046-018-0812-5. |
| [33] |
赵期康, 吴颖, 莫雪丽, 等. MDA-MB-468和SK-BR-3乳腺癌细胞建立裸鼠皮下种植瘤的生物学功能[J].
中华实验外科杂志, 2015, 32(9): 2146-9.
DOI: 10.3760/cma.j.issn.1001-9030.2015.09.037. |
| [34] |
Jiang F, Qiu Q, Khanna A, et al. Aldehyde dehydrogenase 1 is a tumor stem cell-associated marker in lung cancer[J].
Mol Cancer Res, 2009, 7(3): 330-8.
DOI: 10.1158/1541-7786.MCR-08-0393. |
 2018, Vol. 38
2018, Vol. 38

