肝细胞肝癌(HCC)的高复发率和死亡率与肝癌细胞的转移侵袭密切相关,丰富的血液供给为肝癌细胞的转移侵袭提供了可能。血管生成拟态(VM)是一种区别于经典的肿瘤血管生成途径,不依赖血管内皮细胞的肿瘤微循环模式。目前在食管癌、卵巢癌、胆囊癌、肝癌等中证实存在VM,且存在VM的肿瘤细胞恶性程度高、侵袭能力强,易发生转移[1-5]。VM理论为恶性肿瘤血供方式提供了新的思路,也成为恶性肿瘤转移侵袭机制的研究热点。
Rho/ROCK信号通路与恶性肿瘤细胞的增殖、粘附、迁移等多种生物学行为有关,该信号通路的活化促进了肝癌细胞的转移和侵袭[6-8]。目前对于Rho/ROCK信号通路与肿瘤VM形成相关性的研究较少,已有的结果提示通过抑制该通路信号分子RhoA、ROCK的表达能够抑制肿瘤VM的形成[9-11]。血管上皮钙黏素(VEcadherin)和磷酯酰肌醇3激酶(PI3K)目前被认为是VM形成的关键通路蛋白,有研究证实通过Rho/ROCK通路的活化,能够促进VE-cadherin、PI3K的表达[12]。
鳖甲煎丸出自《金匮要略》,具有益气养血、活血化瘀、解毒散结之效,目前广泛应用于肝癌、肝硬化和肝纤维化等疾病的治疗[13-15]。我们前期的研究表明鳖甲煎丸能够有效抑制肝癌HepG2细胞的转移侵袭[16-18],但其作用机制尚不明确。本研究首次以三维培养的肝癌HepG2细胞为模型,运用血清药理学方法,观察鳖甲煎丸对肝癌细胞VM形成的作用,以及鳖甲煎丸对Rho/ROCK信号通路和VE-cadherin、PI3K表达的影响,探讨鳖甲煎丸对肝癌HepG2细胞VM形成的影响及其分子机制。
1 材料和方法 1.1 药物鳖甲煎丸,产自国药集团中联药业有限公司(50 g/瓶),国药准字Z42020772。
1.2 动物及细胞株雄性SD大鼠(6周龄)40只,平均体质量250 g,由南方医科大学实验动物中心提供,动物许可证编号为SCXK(粤)2011-0015。肝癌细胞系(HepG2):由南方医科大学药学院抗病毒中心提供。
1.3 试剂及仪器DMEM高糖培养液、PBS缓冲液系Hyclone产品;胎牛血清、青链霉素混合液(双抗)、0.25%胰蛋白酶购自GIBCO;Y-27632购于MedChemExpress;兔抗人ROCK1单克隆抗体、兔抗人RhoA单克隆抗体购自Abcam;I型胶原蛋白、10% SDS、Tris碱、Tween 20购自Sigma;二甲基亚砜(DMSO)系MP原装;SYBR® Premix Ex Taq™(Tli RNaseH Plus),Reverse Transcriptase M-MLV (RNase H)购于TAKARA;ELISA Kit购于Andygene。
1.4 实验方法 1.4.1 药物血清制备将大鼠随机分组为鳖甲煎丸高(H组)、中(M组)、低剂量组(L组)及生理盐水阴性对照组(N组),10只/组。以成人(60 kg)临床剂量换算得大鼠(250 g/只)的药物剂量为1.1 g/kg(设为M组)。H和L组分别为M组的2倍和0.5倍,用生理盐水配置为混悬液,按8 mL/kg灌胃给药。N组按等体积的生理盐水处理。大鼠灌胃2次/d,灌胃4 d后大鼠用3% 1.0 mL/kg异戊巴比妥钠溶液麻醉,腹主动脉采血,4 ℃静置4 h,3000 r/min离心20 min,分离血清,56 ℃水浴中灭活30 min,0.22 μm微孔膜过滤,-80 ℃冷藏备用。
1.4.2 细胞基质胶Matrigel三维培养于37 ℃、5% CO2及饱和湿度条件下将HepG2细胞培养在高糖DMEM培养基内(含10%胎牛血清、5%双抗),隔天换液。待细胞密度长至80%时,用不含血清的高糖DMEM培养基换液进行饥饿处理,继续培养24 h,制备细胞悬液并在显微镜下计算细胞密度。另取24孔培养板,每孔加入25 μL的Matrigel原液,37 ℃培养箱内温育60 min,待胶凝固后,再向每孔添加1 mL密度为8×105/mL的细胞悬液。
1.4.3 药物血清干预待细胞密度长至80 %时,用不含血清的高糖DMEM培养基换液进行饥饿处理,继续培养24 h后,分别加入鳖甲煎丸高(H)、中(M)、低剂量(L),阴性对照(N)药物血清以及含Y-27632(50 μmol/L)的对照血清(P)[19],设置分组为:H组、M组、L组、N组、P组。
1.4.4 VM拍摄和测量以上各组细胞在37 ℃、5% CO2条件下培养24 h后,在40倍光镜下观察并用Kodak Image Station 2000 MM成像系统拍摄记录各组VM管道形成情况,测量照片中血管样结构的长度(认为长度>200 μm为血管样结构),并计算每张照片的总长度[20]。实验重复3次,计算平均值。
1.4.5 Western blotting检测各组RhoA、ROCK1表达将各实验组回收的细胞裂解、提取总蛋白,待样品总蛋白定量后,将样品与5×的上样缓冲液4: 1混合,100 ℃煮沸5 min变性,按每孔总蛋白30 μg进行10% SDSPAGE凝胶电泳(80 V 20 min,120 V 100 min),将蛋白转至PVDF膜(300 mA 80 min),使用5 %脱脂牛奶室温封闭1 h,封闭后的PVDF膜在一抗中孵育过夜(4 ℃),TBST洗涤3次,随后用辣根过氧化物酶(HRP)标记的二抗孵育2 h,TBST洗涤3次,ECL发光试剂盒在曝光仪中进行曝光,以内参GAPDH为对照,实验重复3次。采用Image J软件进行灰度分析。
1.4.6 ELISA法检测各组细胞培养上清中VEcadherin、PI3K的表达水平收集细胞培养上清液,采用ELISA试剂盒检测各组VE-cadherin、PI3K的表达,每例样本均设3个复孔,求其均值,所有标本均为同批检测,均值为最终浓度。
1.4.7 统计学分析各组VM管道形成情况采用Image J软件采集灰度分析数据,应用SPSS 13.0软件进行统计学分析。实验数据采用独立样本t检验、单因素方差分析评价,P < 0.05为差异有统计学意义。
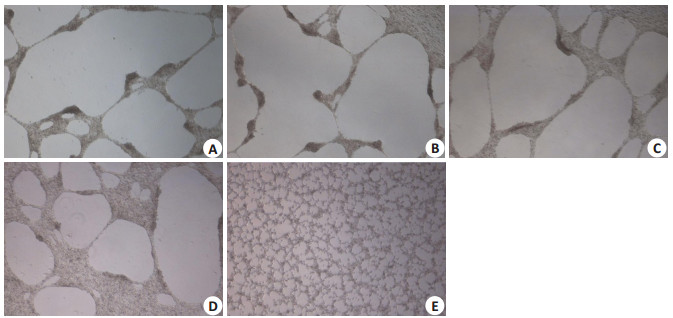
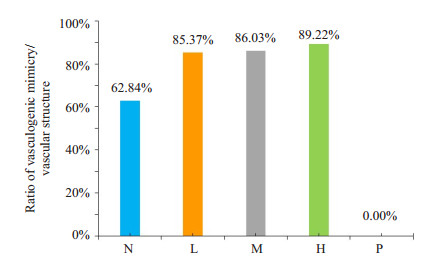
2 结果 2.1 鳖甲煎丸对肝癌HepG2细胞VM形成的影响在相同培养条件下,将肝癌细胞三维培养24 h后在40倍光镜视野下随机截取20个视野,H组在VM管道数量以及血管样结构数量上要低于M、L和N组,但其在VM管道数量/血管样结构数量比值上则要高于M、L和N组。H,M和L组VM管管径远大于N组,差异具有显著性(P < 0.01)P组无明显VM管道形成(P < 0.01,图 1~2,表 1)。
|
图 1 各组三维培养细胞图 Figure 1 Three-dimensional culture of different drug groups (Original magnification: ×40). A: Normal group; B: Lowdose group; C: Middle-dose group; D: High-dose group; E: Positive-dose group. |
|
图 2 VM管道数量/血管样结构数量比值 Figure 2 Ratio of vasculogenic mimicry to vascular structure. N: Normal group; L: Low-dose group; M: Middle-dose group; H: High-dose group; P: Positive-dose group. |
| 表 1 不同药物浓度组血管样管道数量比较 Table 1 Comparison of the number of vascular-like pipes in different drug level groups |
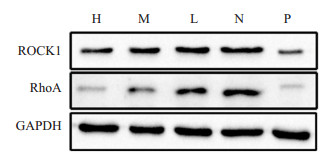
实验结果表明,和N组相比,各药物血清组对三维培养的HepG2细胞中RhoA及ROCK1的蛋白表达水平有均抑制作用(P < 0.05,图 3,表 2)。
|
图 3 鳖甲煎丸对三维培养的HepG2细胞中RhoA、ROCK1表达的影响 Figure 3 Effect of Biejiajian Pills on expression of RhoA and ROCK1 in HepG2 cells in three-dimensional culture. N: Normal group; L: Low-dose group; M: Middle-dose group; H: High-dose group; P: Positivedose group. |
| 表 2 鳖甲煎丸对三维培养的HepG2细胞中RhoA及ROCK1表达的影响 Table 2 Effect of Biejiajian Pill on expression of RhoA and ROCK1 in HepG2 cells in three-dimensional culture |
和N组相比,H、M、L、P组的VE-cadherin、PI3K表达水平均显著降低(P < 0.05),表明各组药物血清对三维培养的HepG2细胞中VE-cadherin、PI3K的表达均有抑制作用(表 3)。
| 表 3 各组PI3K、VE-cadherin的表达水平 Table 3 Expression of PI3K and VE-cadherin in different groups (n=3, Mean±SD) |
有研究发现HCC患者术后癌组织存在VM[4-5],随后的体内、外实验[21]也证实HCC中存在VM,且VM与肝癌的侵袭转移能力正相关。VM的发现有助于解释HCC高侵袭、高转移的生物学行为,更为HCC抗血管治疗提供新的理论依据和治疗靶标;但目前对于肝癌VM的研究很少,其相关机制仍需深入探讨。中医认为,肝癌转移病机复杂,累及多系统、多组织、多器官,寒热交错,虚实夹杂。鳖甲煎丸组方寒热并用,攻补兼施,具有益气养血、活血化瘀、解毒散结之效,该方已成为抗肿瘤领域中一个极具研究潜质的方药。
我们研究发现当不同剂量的鳖甲煎丸作用于三维培养的肝癌HepG2细胞之后,H组在VM管道数量以及血管样结构数量上要低于N、L、M组,但VM管径远高于其他组。这一结果提示我们鳖甲煎丸不但可以抑制VM和血管样结构的数量,而且可能通过抑制肿瘤细胞增殖,促进其凋亡的方式扩大了VM的生存空间,进而增大了VM的管径[22]。
RhoA和ROCK1作为Rho/ROCK信号通路的重要信号分子,参与了细胞骨架运动,细胞黏附及细胞周期等多个环节,已有研究证实上述分子的活化可以促进肝癌的侵袭转移[23-25]。目前关于Rho/ROCK信号通路与肿瘤VM的报道很少,在对B16小鼠黑色素瘤细胞VM生成的研究中发现RhoA起到促进的关键作用[10];对人类骨肉瘤(OS)细胞[9]和肝癌细胞的研究中发现ROCK是肿瘤细胞形成VM关键因子。Y-27632作为Rho/ ROCK信号通路的抑制剂,已被证实不仅能够抑制肝癌细胞的生长和转移,还可以抑制肝癌VM的形成[26-27]。本研究发现,50 μmol/L的Y-27632通过降低RhoA和ROCK1的表达几乎完全抑制了HepG2细胞VM的形成,说明Rho/ROCK信号通路在肝癌VM的形成过程中发挥了重要作用。不同剂量的鳖甲煎丸都能抑制RhoA和ROCK1的表达,表明鳖甲煎丸能够通过调控RhoA和ROCK1的表达,从而抑制Rho/ROCK信号通路的活化,进而抑制了肝癌细胞VM的形成。
缺氧可以促进恶性肿瘤VM的形成,这一现象在HCC患者的癌组织中也得到了证实[28]。缺氧激活缺氧诱导因子,上调VE-cadherin等的转录,诱导受体酪氨酸激酶(EphA2)重新定位到细胞膜,导致EphA2磷酸化。被激活的EphA2使局部黏着斑激酶磷酸化,从而激活细胞外信号调节激酶(ERK1/2),进而激活PI3K。PI3K能同时被VE-cadherin与EphA2激活。被激活的PI3K调控基质金属蛋白酶-1(MT1-MMP)前基因转换成MT1-MMP,从而激活MMP-2前基因。MT1-MMP和MMP-2共同促进了层黏连蛋白(LN-5γ2)链裂解成片段。细胞外微环境中增多的这两种片段最终导致VM的形成[29]。所以VE-cadherin/EphA2/PI3K/MMP信号通路目前被认为是VM形成的关键通路。有研究发现RhoA可以通过PI3K/Akt通路促进小鼠前列腺癌细胞增生[30];PPARγ通过上游调控分子RhoA/ROCK经PTEN/PI3K/Atk信号通路调控下游VEGF表达,参与胃癌的发展和转移[12];Y-27632可以抑制肝癌细胞中VEcadherin和PI3K的表达[27]。上述研究提示Rho/ROCK可能是VE-cadherin/PI3K的上游信号通路,通过调控VE-cadherin/PI3K的信号分子发挥作用。本研究也发现鳖甲煎丸能够抑制三维培养的肝癌细胞HepG2细胞中VE-cadherin、PI3K的表达,这可能与鳖甲煎丸能够抑制Rho/ROCK信号通路的活化,从而调控下游VEcadherin、PI3K的表达水平有关。
综上所述,我们首次以三维培养的肝癌HepG2细胞为研究对象,发现鳖甲煎丸可以抑制肝癌细胞VM的形成,从而达到抗肝癌转移侵袭的目的,其分子机制可能与抑制Rho/ROCK通路信号分子RhoA、ROCK1的表达,进而抑制VE-cadherin、PI3K的活化有关。这一结果为鳖甲煎丸抗肿瘤转移侵袭的机制研究提供了新的思路。
| [1] |
Tang NN, Zhu H, Zhang HJ, et al. HIF-1 alpha induces VE-cadherin expression and modulates vasculogenic mimicry in esophageal carcinoma cells[J].
World J Gastroenterol, 2014, 20(47): 17894-904.
DOI: 10.3748/wjg.v20.i47.17894. |
| [2] |
俞岚, 武世伍, 宋文庆, 等. 卵巢上皮癌中血管生成拟态和E-钙黏蛋白表达及其临床意义[J].
中国病理生理杂志, 2011, 27(11): 2120-5.
DOI: 10.3969/j.issn.1000-4718.2011.11.015. |
| [3] |
郑宇辉, 杨映红, 林秀芳. 血管生成拟态在胆囊癌表达的形态学研究及其临床意义[J].
福建医科大学学报, 2012, 46(4): 248-50, 276.
DOI: 10.3969/j.issn.1672-4194.2012.04.006. |
| [4] |
赵秀兰, 杜静, 张诗武, 等. 肝细胞肝癌中血管生成拟态的研究[J].
中华肝脏病杂志, 2006, 14(1): 41-4.
DOI: 10.3760/j.issn:1007-3418.2006.01.011. |
| [5] |
毛海波. 肝癌转移中血管生成拟态的PAS染色研究应用[J].
现代实用医学, 2015, 27(9): 1167-9.
DOI: 10.3969/j.issn.1671-0800.2015.09.027. |
| [6] |
马强, 谢淑丽, 王广义, 等. 慢病毒介导靶向P27RF-Rho基因沉默对肝癌细胞侵袭性的影响[J].
吉林大学学报, 2016, 42(2): 260-5.
|
| [7] |
任海燕, 胡汉华, 乔慧瑛, 等. 异常黑胆质肝癌移植模型大鼠Rho/Rock信号通路相关分子表达研究[J].
现代生物医学进展, 2018, 18(4): 621-6.
|
| [8] |
欧阳锡武, 陶一明, 王志明. 基质硬度对PKN3表达及肝细胞癌侵袭转移的影响[J].
中国普通外科杂志, 2016, 25(10): 1455-60.
DOI: 10.3978/j.issn.1005-6947.2016.10.015. |
| [9] |
Xia Y, Cai X, Fan J, et al. RhoA/ROCK pathway inhibition by fasudil suppresses the vasculogenic mimicry of U2OS osteosarcoma cells in vitro[J].
Anticancer Drugs, 2017, 28(5): 514-21.
DOI: 10.1097/CAD.0000000000000490. |
| [10] |
Xia Y, Cai XY, Fan JQ, et al. Rho kinase inhibitor fasudil suppresses the vasculogenic mimicry of B16 mouse melanoma cells both in vitro and in vivo[J].
Mol Cancer Ther, 2015, 14(7): 1582-90.
DOI: 10.1158/1535-7163.MCT-14-0523. |
| [11] |
Zhang JG, Zhang DD, Wu X, et al. Incarvine C suppresses proliferation and vasculogenic mimicry of hepatocellular carcinoma cells via targeting ROCK inhibition[J].
BMC Cancer, 2015, 15(15): 814.
|
| [12] |
廖山婴, 刘超, 王蓓蓓, 等. RhoA/ROCK信号通路在胃癌中的表达及其与胃癌生物学行为的关系[J].
胃肠病学和肝病学杂志, 2017, 26(3): 251-5.
|
| [13] |
铁明慧, 张颖, 王科. 鳖甲煎丸对肝癌皮下转移瘤小鼠肿瘤新生血管及微环境的影响[J].
中医杂志, 2018, 59(4): 325-8.
|
| [14] |
赵琪, 朱清静. 鳖甲煎丸降低肝纤维化指标的Meta分析[J].
湖南中医杂志, 2017, 33(8): 155-8.
|
| [15] |
王朝阳, 刘光伟. 鳖甲煎丸治疗早期肝硬化及并发症的研究进展[J].
光明中医, 2017, 32(13): 1986-8.
DOI: 10.3969/j.issn.1003-8914.2017.13.068. |
| [16] |
贺松其, 程旸, 朱云, 等. 鳖甲煎丸对肝细胞癌中Wnt/β-catenin信号通路及抑制基因DKK-1、FrpHe表达的影响[J].
南方医科大学学报, 2013, 33(1): 30-3.
DOI: 10.3969/j.issn.1673-4254.2013.01.07. |
| [17] |
孙海涛, 贺松其, 文彬, 等. 鳖甲煎丸对肝癌细胞中Wnt信号分子β- catenin、GSK-3β及靶基因CD44v6、VEGF的影响[J].
南方医科大学学报, 2014, 34(10): 1454-8.
DOI: 10.3969/j.issn.1673-4254.2014.10.11. |
| [18] |
孙海涛, 贺松其, 文彬, 等. 鳖甲煎丸对HepG2裸鼠移植瘤Wnt信号通路相关分子及靶基因的影响[J].
中国实验方剂学杂志, 2016, 22(13): 81-5.
|
| [19] |
Wang J, Liu XH, Yang ZJ, et al. The effect of ROCK-1 activity change on the adhesive and invasive ability of Y79 retinoblastoma cells[J].
BMC Cancer, 2014, 14(14): 89.
|
| [20] |
Yamamoto K, Takahashi T, Asahara T, et al. Proliferation, differentiation, and tube formation by endothelial progenitor cells in response to shear stress[J].
J Appl Physiol, 2003, 95(5): 2081-8.
DOI: 10.1152/japplphysiol.00232.2003. |
| [21] |
孟立祥, 李建生, 英卫东, 等. 肝细胞癌中血管生成拟态的三维细胞培养观察[J].
实用肝脏病杂志, 2009, 12(2): 91-4.
DOI: 10.3969/j.issn.1672-5069.2009.02.004. |
| [22] |
孙阳, 吴勃岩, 车艳新, 等. 鳖甲煎丸诱导肝癌细胞凋亡及对STAT信号通路的影响[J].
时珍国医国药, 2016, 27(4): 849-51.
|
| [23] |
Zhang YL, Li Q, Yang XM, et al. SPON2 promotes M1-like macrophage recruitment and inhibits hepatocellular carcinoma metastasis by distinct Integrin-Rho GTPase-Hippo pathways[J].
Cancer Res, 2018, 78(9): 2305-17.
DOI: 10.1158/0008-5472.CAN-17-2867. |
| [24] |
Bhullar KS, Jha A, Rupasinghe HP. Novel carbocyclic curcumin analog CUR3d modulates genes involved in multiple apoptosis pathways in human hepatocellular carcinoma cells[J].
Chem Biol Interact, 2015, 242(5): 107-22.
|
| [25] |
Zhan Y, Zheng N, Teng F, et al. MiR-199a/b-5p inhibits hepatocellular carcinoma progression by post-transcriptionally suppressing ROCK1[J].
Oncotarget, 2017, 8(40): 67169-80.
|
| [26] |
Xue F, Takahara T, Yata Y, et al. Blockade of Rho/Rho-associated coiled coil-forming kinase signaling can prevent progression of hepatocellular carcinoma in matrix metalloproteinase-dependent manner[J].
Hepatol Res, 2008, 38(8): 810-7.
DOI: 10.1111/hep.2008.38.issue-8. |
| [27] |
Zhang JG, Li XY, Wang YZ, et al. ROCK is involved in vasculogenic mimicry formation in hepatocellular carcinoma cell line[J].
PLoS One, 2014, 9(9): e107661.
DOI: 10.1371/journal.pone.0107661. |
| [28] |
Paulis YW, Soetekouw PM, Verheul HM, et al. Signalling pathways in vasculogenic mimicry[J].
Biochim Biophys Acta, 2010, 1806(1): 18-28.
|
| [29] |
姬海宁, 辛彦, 肖玉平. 血管生成拟态研究进展[J].
中华肿瘤防治杂志, 2011, 18(21): 1736-40.
|
| [30] |
Ghosh PM, Bedolla R, Mikhailova M, et al. RhoA-dependent murine prostate cancer cell proliferation and apoptosis: role of protein kinase Czeta[J].
Cancer Res, 2002, 62(9): 2630-6.
|
 2018, Vol. 38
2018, Vol. 38

