手术部位感染(SSI)是脊柱手术的常见并发症之一,常会引起神经损伤、内固定失败、脓毒血症甚至死亡等一系列并发症[1]。既往研究结果认为糖尿病、肥胖、心血管疾病、年龄等为脊柱术后感染的危险因素[2-4]。体质量指数(BMI)常作为衡量肥胖的指标进行统计分析,但Mehta等[5]提出直接分析患者的脂肪分布情况较单纯分析BMI能够更加敏感的评估患者术后感染风险,并指出腰背部手术区域的皮下脂肪组织为独立于BMI腰椎手术特有的感染危险因素。
肌肉组织中出现脂肪浸润现象为肌肉退变的晚期表现之一[6],腰部多裂肌作为最靠近椎板的肌肉,在其退变后会在靠近椎板一侧的肌肉中出现脂肪浸润现象,在既往文献中主要研究多裂肌脂肪浸润与腰腿疼痛的关系[7-10],但没有进行过其与术后感染的相关性探讨。因此,根据手术部位脂肪组织会增加术后感染风险[11],我们提出了在初次后正中入路腰椎减压椎间植骨融合内固定术中腰部多裂肌脂肪浸润也有可能增加术后感染风险这一假说,在既往研究基础上进一步讨增加术后感染的危险因素。
1 资料和方法 1.1 病例选择回顾性分析2011~2016年因腰椎退行性疾病初次行腰椎后路减压植骨融合内固定术的患者共2904例,全部患者均采用后正中入路。SSI的诊断标准[12]:临床表现为不明原因的发热、寒战、切口局部红肿热痛伴/或不伴脓性渗出等,切口分泌物、外周血或切口引流管内引流物样本可培养出细菌。如患者具有白细胞升高,红细胞沉降率及C-反应蛋白(CRP)持续升高等表现而无细菌学阳性证据,符合下列条件之一可以临床诊断为手术部位感染:(1)从深部切口引流出或穿刺抽到脓液;(2)自然裂开或由外科医师打开的切口,有脓性分泌物或有发热≥38 ℃,局部有疼痛或压痛;(3)再次手术探查、经组织病理学或影像学检查发现涉及深部切口脓肿或其他感染证据。其中急性感染时间限定在术后30 d内。
纳入标准:术后30 d内发生SSI的患者纳入实验组(43例),在2904例初次经后正中入路进行腰椎减压椎间植骨融合内固定术的患者中使用随机数法抽取术后未发生感染的患者作为对照组(334例)。入组患者术前2月内均在我院行腰椎磁共振检查,并有身高、体质量、性别、年龄、高血压史、糖尿病史、手术节段、手术时长及术中失血量等一般资料的记录。排除标准:术后30 d后出现感染症状的亚急性和慢性感染,因脊柱侧弯畸形、骨折、肿瘤及结核等病变行手术治疗,翻修手术、术前一般资料不完整,术前无本院磁共振检查的患者。
1.2 数据收集 1.2.1 一般资料查阅病历系统,收集患者的性别、年龄、身高、体质量、术前血红蛋白和白蛋白水平、高血压、糖尿病、泌尿系感染、手术节段、手术时长、术中出血量、术后引流量等一般资料。
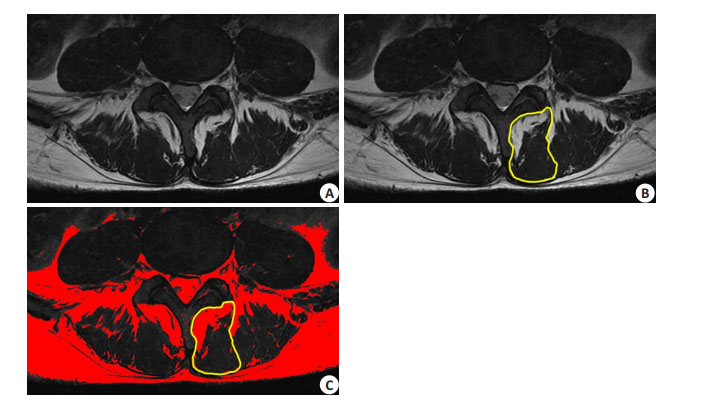
1.2.2 多裂肌脂肪浸润百分比所有患者均于术前2月内在我院行腰椎核磁共振检查(3.0T,PHILIP, Netherlands)。在磁共振T2WI手术节段中,每个椎间盘横断面有3层平扫图像,选择最中间层面图像作为研究对象(图 1A),使用Image J软件首先分别勾勒出左右两侧的多裂肌,多裂肌与椎板棘突间的脂肪组织计算入多裂肌的横截面积,而与竖脊肌间的脂肪组织则不纳入计算,从而得到多裂肌的相对横截面积(图 1B)[13]。由于在T2像上,脂肪组织的信号高于肌肉组织,因此将图像灰度值范围调整为55-255,便可以在第1次测绘多裂肌的基础上利用软件得到多裂肌中灰度值位于55-255区域的面积,即多裂肌中脂肪组织的相对横截面积(图 1C)[14]。根据此方法测量多裂肌横截面积和脂肪组织浸入多裂肌的相对横截面积[13],左右两侧分开进行多裂肌与脂肪浸润面积的测量。
| $ \begin{array}{l} {\rm{多裂肌脂肪浸润率}}\\ = \frac{{{\rm{多裂肌中脂肪组织的相对横截面积}}}}{{{\rm{同一横断面同侧多裂肌的相对横截面积}}}} \times 100\% \end{array} $ |
|
图 1 多裂肌面积及脂肪浸润面积测量方法 Figure 1 Measurement of the relative cross- sectional area of the multifidus muscle and fat infiltration. A: Choosing the most middle level of the coronal plane of the disc in the MR scan. B: Drawing the outline of the multifidus muscle and measurement of the relative cross- sectional area of the multifidus muscle; C: Calculating the gray value (55 to 255) and measurement of the relative cross-sectional area of fat infiltration in the outline of the multifidus muscle. |
|
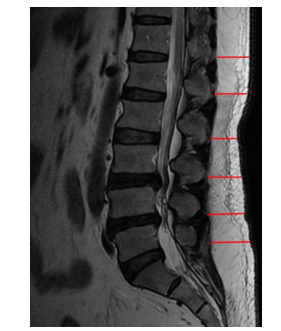
图 2 背部皮下脂肪厚度测量 Figure 2 Posterior midline subcutaneous fat measurements at T12-L5. |
在腰骶椎磁共振的矢状位T2图像上,使用南方PACS系统(广州南方宜信信息科技有限公司)测绘T12-L5棘突到背部皮肤的水平距离,以此定义为背部脂肪组织厚度[5]。
所有的测量由3名脊柱骨科医生进行测绘,多裂肌脂肪浸润百分比与背部脂肪厚度选择手术部位的数据纳入统计学分析。
1.3 统计方法所有的数据均采用SPSS 20.0进行统计分析。组间差异使用t 检验或χ2检验。使用Pearson单因素和Logistic多因素回归模型分析探讨各因素与术后手术部位感染的相关性。P < 0.05认为差异有统计学意义。
2 结果2011~2016年共有2904名患者因腰椎退行性疾病初次行后路腰椎椎管减压椎间盘髓核摘除椎间植骨融合术,发生SSI患者43例,感染率为1.48%。在感染患者中,23例患者具有手术部位分泌物细菌培养阳性结果,其中金黄色葡萄球菌8例,表皮葡萄球菌6例,耐甲氧西林金黄色葡萄球菌(MRSA)3例,腐生葡萄球菌、里昂葡萄球菌、铜绿假单胞菌、大肠埃希菌、肠球菌及头葡萄球菌各1例。
两组患者的一般资料比较中,BMI、术前白蛋白水平、术前尿路感染、糖尿病和高血压患者比例、背部脂肪厚度等指标无统计学差异(P > 0.05,表 1)。而感染组患者的年龄小于对照组、术前血红蛋白水平高于对照组且均具有统计学差异(P < 0.05)。在手术因素中,感染组在手术时长、出血量、术后引流量、拔管前1 d引流量、引流管根数及留置时间均高于对照组,但是无统计学差异(P > 0.05)。感染组中多节段手术患者的比率高于对照组(51.56% vs 27.54%),且具有统计学差异(P < 0.05)。感染组左右侧多裂肌脂肪率均高于对照组对照组(左侧:(25.77±16.58)% vs(21.40±13.78)%,P=0.057;右侧:(28.09±15.21)% vs(22.31±11.32)%,P=0.003),但只有右侧的组间差异具有统计学意义。在两组患者的一般资料比较见表 1。
| 表 1 感染组与正常组一般资料比较 Table 1 Comparison of demographic and surgical data between infection and no-infection patients |
因为没有合适的数据处理方法合并左右侧多裂肌脂肪浸润率数据,所以分别进行了两次Logistic回归分析。在右侧的多元回归分析中,双节段手术(OR=3.82,95% CI=2.03-7.18)、三节段手术(OR=7.41,95% CI= 2.64-20.83)、手术部位皮下脂肪厚度(OR=1.09,95% CI=1.04-1.14)以及多裂肌脂肪浸润(OR=1.05,95%CI= 1.03-1.07)为腰椎术后感染的独立危险因素,在左侧的多元回归分析中,双节段手术(OR=3.83,95%CI=2.00- 7.32)、三节段手术(OR=9.24,95%CI=3.13-27.32)、手术部位皮下脂肪厚度(OR=1.10,95%CI=1.05-1.15)以及多裂肌脂肪浸润(OR=1.08,95%CI=1.05-1.10)为腰椎术后感染的独立危险因素,而在两次Logistic回归分析中,男性、年龄和BMI为术后感染的保护因素。手术时长、出血量、引流管留置时间、术后引流量等指标则与术后感染无关(P > 0.05,表 2)。在线性回归分析中,左右侧多裂肌脂肪浸润率与BMI均无线性相关性。
| 表 2 腰椎融合术后切口感染相关危险因素的Logistic回归分析 Table 2 Multiple logistic regression model of previously identified risk factors of SSI and LMM fat infiltration |
后正中入路腰椎椎管减压椎间植骨融合内固定术是治疗腰椎退行性疾病的经典手术方式,而术后手术部位感染是其常见并发症之一,既往文献报道腰椎初次手术感染率为8.5%,而翻修手术感染率为12.2%[15],本研究中初次手术术后感染率为1.48%。在手术部位感染的诊断标准中,既往文献表明分泌物细菌培养结果并不是必备条件[2],本实验中也只有53%的感染患者细菌培养结果阳性,这一方面可能与感染病原体的多样化有关,另一方面取材的时间点和部位也会影响分泌物培养的阳性率。
高龄、糖尿病和肥胖等因素在既往研究中被认为是脊柱术后感染的危险因素[16-18]。但是在本实验中年龄反而是保护性因素,而糖尿病则与术后感染无相关性,这可能与患者的围手术期管理有关,Olsen等[2]提出糖尿病患者术前血糖水平 > 6.9 mmol/L、术后血糖 > 11.1 mmol/L时才会显著增加术后感染风险。因此加强患者围手术期管理能够降低患者术后感染的风险。
体质量指数(BMI)通常被用来评估肥胖,但BMI并不能反映身体质量分布情况[5],既往对于BMI是否为腰椎术后感染的危险因素也存在争议。Mehta等[19]回顾性分析456例腰椎后正中入路患者的临床资料发现BMI与术后感染的发生无显著相关性,而我们的结果显示BMI是腰椎术后感染的保护性因素。因此单纯分析BMI并不能得出肥胖为脊柱术后感染危险因素的结论。
近期的研究发现,手术部位的脂肪组织是术后感染的危险因素[1, 11, 20],脂肪组织使伤口缝合后容易形成死腔,同时脂肪组织的液化坏死也会增加感染风险[21]。我们的数据也表明手术部位的皮下脂肪厚度以及多裂肌脂肪浸润是术后感染的危险因素。皮下脂肪厚度与术后感染的关系已经有相关研究,Ankit[20]和John[11]分别提出皮下脂肪厚度为颈椎和腰椎融合术后感染的危险因素,并且均提出手术部位的皮下脂肪厚度与BMI无显著相关性。多裂肌为最靠近腰椎椎板的肌肉,在维持腰椎稳定上起到重要作用[9],多裂肌脂肪浸润为多裂肌退变后的晚期表现之一,可以在磁共振检查上清楚观察到这一现象[22],既往关于多裂肌脂肪浸润着重于研究其与腰腿疼痛的关系[10, 13, 14, 23-27]。Sion等[28]对106位志愿者进行了数据分析,发现与多裂解的横截面积相比,多裂肌中的脂肪浸润程度更能影响患者的活动功能。Andrew[29]和Teichtahl[7]等分别研究了腰腹部不同肌肉与腰部疼痛的关系,在他们的研究结果中均提出了多裂肌脂肪浸润与腰背部疼痛相关。但是多裂肌的脂肪浸润与腰椎术后手术部位感染的相关性研究较少。多裂肌作为最靠近椎板的肌肉,在后正中入路暴露过程中遭到损伤最大[30],同时肌肉中的脂肪组织也会在电刀的热作用下遭到破坏,并形成脂肪液化,这两者都有可能延缓术后肌肉与椎板间的愈合,增加死腔形成的几率从而增加术后感染风险。虽然多裂肌退变表现为脂肪浸润,但是我们通过线性回归分析并未发现BMI和多裂肌脂肪浸润有相关性,因此多裂肌脂肪浸润程度是独立于BMI腰椎特有的术后感染危险因素。既往研究表明女性较男性有更高的多裂肌脂肪浸润率[24],这有可能是女性为腰椎术后感染危险因素的原因之一。
在手术因素中,多节段手术为腰椎术后感染的危险因素,而感染组虽然在手术时长和术中出血量上均高于正常组,但是这两组数据并无统计学差异。因此手术因素中增加术后感染风险的原因主要在于手术范围,多节段的手术将造成更多的肌肉组织的损伤、延长手术切口内部的愈合时间,从而增加了切口内部死腔形成的可能性。既往也有文献提出手术节段和手术时间为术后感染的危险因素[31],但是作者也指出手术节段与手术时间密切相关且决定着手术时间[32],因此多节段手术才可能是真正增加感染风险的因素,而只需要在手术过程中注意无菌操作,单纯延长手术时间和术中出血量的增加可能并不会增加术后感染风险。本文也存在一些不足,如属于回顾性研究且样本量较小,关于术中清理多裂肌中的脂肪组织是否会降低术后感染风险则还不明确。
| [1] |
Radcliff KE, Neusner AD, Millhouse PW, et al. What is new in the diagnosis and prevention of spine surgical site infections[J].
Spine J, 2015, 15(2): 336-47.
DOI: 10.1016/j.spinee.2014.09.022. |
| [2] |
Olsen MA, Nepple JJ, Riew KD, et al. Risk factors for surgical site infection following orthopaedic spinal operations[J].
J Bone Joint Surg Am, 2008, 90(1): 62-9.
DOI: 10.2106/JBJS.F.01515. |
| [3] |
Pull Ter Gunne AF, Hosman AJ, Cohen DB, et al. A methodological systematic review on surgical site infections following spinal surgery: part 1: risk factors[J].
Spine (Phila Pa 1976), 2012, 37(24): 2017-33.
DOI: 10.1097/BRS.0b013e31825bfca8. |
| [4] |
Chaichana KL, Bydon M, Santiago-Dieppa DR, et al. Risk of infection following posterior instrumented lumbar fusion for degenerative spine disease in 817 consecutive cases Clinical article[J].
J Neurosurg Spine, 2014, 20(1): 45-52.
DOI: 10.3171/2013.10.SPINE1364. |
| [5] |
Mehta AI, Babu R, Karikari IO, et al. 2012 young investigator award winner: the distribution of body mass as a significant risk factor for lumbar spinal fusion postoperative infections[J].
Spine (Phila Pa 1976), 2012, 37(19): 1652-6.
DOI: 10.1097/BRS.0b013e318241b186. |
| [6] |
Kalichman L, Klindukhov A, Li L, et al. Indices of paraspinal muscles degeneration: reliability and association with facet joint osteoarthritis: feasibility study[J].
Clin Spine Surg, 2016, 29(9): 465-70.
DOI: 10.1097/BSD.0b013e31828be943. |
| [7] |
Teichtahl AJ, Urquhart DM, Wang YA, et al. Fat infiltration of paraspinal muscles is associated with low back pain, disability, and structural abnormalities in community-based adults[J].
Spine J, 2015, 15(7): 1593-601.
DOI: 10.1016/j.spinee.2015.03.039. |
| [8] |
Suri P, Fry AL, Gellhorn AC. Do muscle characteristics on lumbar spine magnetic resonance imaging or computed tomography predict future low back pain, physical function, or performance? a systematic review[J].
PM R, 2015, 7(12): 1269-81.
DOI: 10.1016/j.pmrj.2015.04.016. |
| [9] |
Freeman MD, Woodham MA, Woodham AW. The role of the lumbar multifidus in chronic low back pain: a review[J].
PM R, 2010, 2(2): 142-6.
DOI: 10.1016/j.pmrj.2009.11.006. |
| [10] |
Fortin M, Videman T, Gibbons LE, et al. Paraspinal muscle morphology and composition: a 15-yr longitudinal magnetic resonance imaging study[J].
Med Sci Sports Exerc, 2014, 46(5): 893-901.
DOI: 10.1249/MSS.0000000000000179. |
| [11] |
Lee JJ, Odeh KI, Holcombe SA, et al. Fat thickness as a risk factor for infection in lumbar spine surgery[J].
Orthopedics, 2016, 39(6): e1124-8.
DOI: 10.3928/01477447-20160819-05. |
| [12] |
刘家明, 邓辉林, 周扬, 等. 腰椎后路术后切口感染及椎管内血肿的危险因素分析[J].
中华骨科杂志, 2017, 37(9): 547-52.
|
| [13] |
Niemeläinen R, Briand MM, Battié MC. Substantial asymmetry in paraspinal muscle cross-sectional area in healthy adults questions its value as a marker of low back pain and pathology[J].
Spine (Phila Pa 1976), 2011, 36(25): 2152-7.
DOI: 10.1097/BRS.0b013e318204b05a. |
| [14] |
Lee JC, Cha JG, Kim Y, et al. Quantitative analysis of back muscle degeneration in the patients with the degenerative lumbar flat back using a digital image analysis: comparison with the normal controls[J].
Spine (Phila Pa 1976), 2008, 33(3): 318-25.
DOI: 10.1097/BRS.0b013e318162458f. |
| [15] |
Kurtz SM, Lau E, Ong KL, et al. Infection risk for primary and revision instrumented lumbar spine fusion in the Medicare population[J].
J Neurosurg Spine, 2012, 17(4): 342-7.
DOI: 10.3171/2012.7.SPINE12203. |
| [16] |
Schuster JM, Rechtine G, Norvell DC, et al. The influence of perioperative risk factors and therapeutic interventions on infection rates after spine surgery: a systematic review[J].
Spine (Phila Pa 1976), 2010, 35(9 Suppl): S125-37.
|
| [17] |
Schoenfeld AJ, Carey PA, Cleveland AW, et al. Patient factors, comorbidities, and surgical characteristics that increase mortality and complication risk after spinal arthrodesis: a prognostic study based on 5, 887 patients[J].
Spine J, 2013, 13(10): 1171-9.
DOI: 10.1016/j.spinee.2013.02.071. |
| [18] |
Watanabe M, Sakai D, Matsuyama D, et al. Risk factors for surgical site infection following spine surgery: efficacy of intraoperative saline irrigation[J].
J Neurosurg Spine, 2010, 12(5): 540-6.
DOI: 10.3171/2009.11.SPINE09308. |
| [19] |
Ledford CK, Ruberte Thiele RA, Appleton JS, et al. Percent body fat more associated with perioperative risks after total joint arthroplasty than body mass index[J].
J Arthroplasty, 2014, 29(9 Suppl): 150-4.
|
| [20] |
Mehta AI, Babu R, Sharma R, et al. Thickness of subcutaneous fat as a risk factor for infection in cervical spine fusion surgery[J].
J Bone Joint Surg Am, 2013, 95(4): 323-8.
DOI: 10.2106/JBJS.L.00225. |
| [21] |
Xing D, Ma JX, Ma XL, et al. A methodological, systematic review of evidence-based Independent risk factors for surgical site infections after spinal surgery[J].
Eur Spine J, 2013, 22(3): 605-15.
DOI: 10.1007/s00586-012-2514-6. |
| [22] |
Kjaer P, Bendix T, Sorensen JS, et al. Are MRI-defined fat infiltrations in the multifidus muscles associated with low back pain?[J].
BMC Med, 2007, 5: 2.
DOI: 10.1186/1741-7015-5-2. |
| [23] |
Montano-Loza AJ, Meza-Junco J, Prado CM, et al. Muscle wasting is associated with mortality in patients with cirrhosis[J].
Clin Gastroenterol Hepatol, 2012, 10(2): 166-73, 173.e1.
DOI: 10.1016/j.cgh.2011.08.028. |
| [24] |
Ekin EE, Kurtul Yıldız H, Mutlu H. Age and sex-based distribution of lumbar multifidus muscle atrophy and coexistence of disc hernia: an MRI study of 2028 patients[J].
Diagn Interv Radiol, 2016, 22(3): 273-6.
DOI: 10.5152/dir. |
| [25] |
Hebert JJ, Kjaer P, Fritz JM, et al. The relationship of lumbar multifidus muscle morphology to previous, current, and future low back pain: a 9-year population-based prospective cohort study[J].
Spine (Phila Pa 1976), 2014, 39(17): 1417-25.
DOI: 10.1097/BRS.0000000000000424. |
| [26] |
Mannion AF, Käser L, Weber E, et al. Influence of age and duration of symptoms on fibre type distribution and size of the back muscles in chronic low back pain patients[J].
Eur Spine J, 2000, 9(4): 273-81.
DOI: 10.1007/s005860000189. |
| [27] |
Parkkola R, Rytökoski U, Kormano M. Magnetic resonance imaging of the discs and trunk muscles in patients with chronic low back pain and healthy control subjects[J].
Spine (Phila Pa 1976), 1993, 18(7): 830-6.
DOI: 10.1097/00007632-199306000-00004. |
| [28] |
Sions JM, Coyle PC, Velasco TO, et al. Multifidi muscle characteristics and physical function among older adults with and without chronic low back pain[J].
Arch Phys Med Rehabil, 2017, 98(1): 51-7.
DOI: 10.1016/j.apmr.2016.07.027. |
| [29] |
Hides J, Stanton W, Mendis MD, et al. The relationship of transversus abdominis and lumbar multifidus clinical muscle tests in patients with chronic low back pain[J].
Man Ther, 2011, 16(6): 573-7.
DOI: 10.1016/j.math.2011.05.007. |
| [30] |
Fan S, Hu Z, Zhao F, et al. Multifidus muscle changes and clinical effects of one-level posterior lumbar interbody fusion: minimally invasive procedure versus conventional open approach[J].
Eur Spine J, 2010, 19(2): 316-24.
DOI: 10.1007/s00586-009-1191-6. |
| [31] |
Lewkonia P, Dipaola C, Street J. Incidence and risk of delayed surgical site infection following instrumented lumbar spine fusion[J].
J Clin Neurosci, 2016, 23: 76-80.
DOI: 10.1016/j.jocn.2015.05.039. |
| [32] |
张志平, 郭昭庆, 齐强, 等. 胸腰椎后路术后深部手术切口感染的危险因素分析[J].
中华外科杂志, 2015, 53(5): 345-8.
DOI: 10.3760/cma.j.issn.0529-5815.2015.05.006. |
 2018, Vol. 38
2018, Vol. 38

