2. 安徽省多糖药物药物工程技术研究中心//活性生物大分子研究安徽省重点实验室,安徽 芜湖 241002
2. Anhui Provincial Engineering Research Center for Polysaccharide Drugs/Anhui Provincial Key Laboratory of Active Biological Macro-molecules, Wuhu 241002, China
雷公藤甲素是从传统中药材雷公藤中提取的有效成分,是临床上广泛应用的免疫抑制剂。但长期服用后,会对人体各个系统产生较强的毒副作用,尤其对肝脏系统有很大的毒性[1-2]。目前,雷公藤甲素所致肝毒性的机理研究还不透彻,其机制可能与诱导肝细胞凋亡、氧化应激损伤、过氧化损伤导致的自噬过度、iNOS表达过量、免疫损伤、肝药酶损伤等高度相关,而氧化应激作用在雷公藤甲素诱导肝毒性中扮演了重要角色[3]。在氧化应激通路的研究中,Keap1-Nrf2/ARE信号通路是近年来机体内最重要的内源性抗氧化应激信号通路,可以调控目标蛋白HO-1、NQO1等数百个抗氧化基因的表达[4-5]。
目前,中药配伍是雷公藤减毒增效研究中的热点。甘草酸对雷公藤甲素诱导的肝损伤具有保护作用,减毒作用明显且分子机制与激活了Nrf2信号通路相关[6]。通过代谢组学研究,证实三七减轻了雷公藤甲素所致老鼠肝毒性[7]。用丹参酮参与雷公藤甲素配伍,发现其减毒作用也与Nrf2信号通路密切相关[8]。通过实验证明槲皮素除了通过Nrf2信号通路保护免疫性肝损伤外,还通过恢复了大鼠血液中TH17/Treg的平衡保护雷公藤甲素所致肝损伤[9]。此外,将雷公藤甲素配伍白芍,水飞蓟素,黄芪,天冬,白藜芦醇及灵芝,姬松茸,虫草等名贵中药材等都对雷公藤具有很好的减毒增效作用[10-11]。
当氧化损伤造成线粒体膜电位的下降和细胞内Ca2+蓄积时,莫诺苷可以减轻这一现象从而发挥抗氧化应激作用,且保护作用与其剂量有依赖的关系,导致过氧化物诱导的氧化损伤细胞凋亡率降低[12]。目前,莫诺苷的抗氧化应激作用广泛应用于脑神经损伤的保护,并具有很好的临床效果,而对于肝损伤保护的研究较少,Park等[13]研究证明莫诺苷对糖尿病模型小鼠的肝脏损伤有保护作用。还有研究表明莫诺苷可以在大鼠中诱导CYP3A的活性[14],而雷公藤甲素是CYP3A的弱抑制剂,与雷公藤甲素肝毒性密切相关。莫诺苷可以通过抗氧化应激作用来保护对乙酰氨基酚所诱导的小鼠肝损伤[15]。这些研究都表明,莫诺苷对各种原因所致肝损伤具有很好的保护作用,但其对雷公藤甲素所致肝损伤的研究尚未见报道。基于莫诺苷强大抗氧化应激作用,本实验将莫诺苷与雷公藤甲素配伍使用,观察莫诺苷对雷公藤甲素所致肝减毒增效的作用。我们利用两种中药的互补效应,对莫诺苷与雷公藤甲素进行联合用药,通过观察雷公藤甲素和莫诺苷配伍对人肝癌细胞HepG2的影响,为两药联用降低雷公藤甲素的不良反应提供新的是研究思路,具有十分重要的现实意义。
1 材料和方法 1.1 试剂与仪器雷公藤甲素,莫诺苷均购自上海源叶生物科技有限公司(纯度:HPLC≥98%);DEEM培养液、胎牛血清、0.25%胰蛋白酶、PBS等(HyClone);二甲基亚砜(DMSO)和四甲基偶氮唑盐(MTT)(Sigma);AnnexinV-FITC/PI细胞凋亡检测试剂盒(建成生物科技);β- actin单克隆抗体,山羊抗兔二抗IgGHRP(碧云天生物技术研究所);兔抗人Nrf2多克隆抗体、兔抗小鼠HO-1多克隆抗体(ABclonal);增强化学发光试剂盒(Millypore);全自动生化分析仪(7180型)(日立公司);全自动酶标仪(Bio-Tek);二氧化碳细胞培养箱(SANYO);蛋白电泳仪,转膜仪,凝胶成像仪(Bio-Rad);流式细胞仪(BD);激光共聚焦显微镜(TCS SP8)(Leica)。
1.2 实验动物及分组BALB/C小鼠,6周,雌雄各半,体质量25±2 g(皖南医学院实验动物中心提供)。小鼠随机分为4组,10只/组。按以下方式分组,灌胃给药:(1)对照组:给予生理盐水;(2)莫诺苷组:给予莫诺苷500 mg·kg-1·d-1;③雷公藤甲素组:给予雷公藤甲素500 μg·kg-1·d-1;④莫诺苷组+雷公藤甲素组:莫诺苷500 mg·kg-1·d-1+雷公藤甲素500 μg·kg-1·d-1;实验期间,小鼠常规颗粒饲养,进食和饮水自由。实验结束后,眼眶取血分离血清测定各组小鼠血液中谷丙转氨酶(ALT)、谷草转氨酶(AST)指标;随后颈椎脱臼法处死小鼠,解剖取肝脏测定质量,计算肝脏指数LI(%)=肝脏湿重(g)/体质量(g)×100%。
1.3 细胞培养人肝癌HepG2细胞株由武汉ABclonal提供。将细胞株移入DMEM培养液(含10%的胎牛血清、100 U/mL青霉素、100 U/mL链霉素)中,并将培养皿置于温度为37 ℃、5% CO2的细胞培养箱使其生长。当细胞铺满培养皿底时,以胰酶消化并传代细胞至对数生长期用于实验。
1.4 方法 1.4.1 血清学检查及肝脏指数测定眼眶取血后得到的血液样本置于冰箱内4 ℃静置30 min,再于4 ℃、3000 r/min的条件下离心15 min得血清,全自动生化分析仪检测血清中ALT、AST含量;各实验组小鼠处死后,取肝脏称量湿重,并与体质量对比,得肝脏指数。
1.4.2 MTT法检测各组药物对人肝癌HepG2细胞株的生长抑制率取消化后的人肝癌HepG2细胞,以每孔1×104细胞密度接种于96孔板。根据雷公藤甲素和莫诺苷对人肝癌HepG2细胞株预试验所得的药物半数抑制率IC50的结果,观察细胞贴壁后分别加入以下4组药物处理:阴性对照组为不含药液的细胞组;雷公藤甲素处理组,使细胞中含有终浓度为50 nmol/L的雷公藤甲素药液,并分别处理24、48、72 h;莫诺苷单药处理组,使细胞中含有终浓度为5 μmol/L的莫诺苷,并分别处理24、48、72 h;双药联合处理组,在细胞中分别加入雷公藤甲素(终浓度50 nmol/L),莫诺苷(终浓度5 μmol/L),并分别处理24、48、72 h;每组均设6个复孔,并于实验结束后均加入MTT(5 mg/mL)20 μL并继续培养4 h。然后将上清液倒掉,每孔再加入DMSO 200 μL,震荡至溶解完全,以酶标仪测定吸光度A570 nm。分别计算两种药物单独及合用在不同时间对人肝癌HepG2细胞的存活率的影响,细胞存活率(%)=(实验孔吸光度/对照孔吸光度)×100%。
1.4.3 激光共聚焦法观察莫诺苷对雷公藤甲素诱导的肝细胞凋亡的保护作用人肝癌HepG2细胞株经过4组药物处理(如1.3.1所述药物分组)后,通过细胞形态及细胞核的变化考察各组药物对人肝癌HepG2细胞凋亡的影响。收集指数生长期的人肝癌HepG2细胞,并以细胞密度接为1×106/mL接种于2块6孔板,细胞悬液2 mL/孔。4组药物给药后细胞培养24 h,其中一块6孔板直接于显微镜下观察各组细胞形态学变化;另一块6孔板收集各组细胞,PBS清洗3次,弃PBS每孔加入0.5 mL聚甲醛固定30 min。去固定液后再PBS洗2次,每孔加入2 mL Hoechst33258染色液,避光孵育30 min后于激光共聚焦显微镜下观察并记录细胞核形态学变化特点。
1.4.4 流式细胞术观察莫诺苷对雷公藤甲素诱导的肝细胞凋亡的保护作用4组药物(如1.3.1所述药物分组)分别加入以密度1×106/mL接种于6孔板内(2 mL/孔)的人肝癌HepG2细胞悬液中,放置培养箱过夜至细胞生长至对数生长期后消化清洗,并取细胞悬液于EP管中离心弃上清后加入5 μL的PI和10 μL Annexin V-FITC试剂试剂,避光处理15 min后上流式细胞仪检测分析。
1.4.5 Western blot法测定氧化应激通路相关蛋白空白组(不加药液);雷公藤甲素(DMSO溶解至终浓度50 nmol/L);莫诺苷(终浓度5 μmol/L);雷公藤甲素(DMSO溶解至终浓度50 nmol/L)+莫诺苷(终浓度5 μmol/L)联合用药处理24 h后的人肝癌HepG2细胞收获后,各组细胞分别按以下流程处理。(1)BCA法确定各组蛋白浓度:预冷的PBS清洗1遍细胞后后加入100 μL预冷裂解液,冰上裂解20 min后冷冻离心(4 ℃,12 000 r/min,30 min),弃沉淀取上清,用BCA试剂盒法测定各组上清中的蛋白质的浓度。(2)电泳分离目的蛋白:各组取200 μg蛋白质样品,根据相对分子质量大小用蛋白质电泳分离得到目的蛋白。(3)转膜转移目的蛋白:采用半干转膜法(0.8 A,24 V)将目的蛋白转移至硝酸纤维素膜上。(4)封闭目的蛋白:将含有目标蛋白的硝酸纤维膜浸入含5%脱脂奶粉的缓冲液中封闭过夜。(5)抗原抗体反应:封闭液中加入以下一抗(Nrf2,HO-1,β-actin)各2 μL,在4 ℃下过夜孵育。(6)抗原抗体反应标记:将结合了抗体的纤维素膜用缓冲液洗涤3次,15 min/次,加入标记了荧光的二抗室温下孵育1 h。(7)凝胶成像:用缓冲液洗涤4次,15 min/次,将此硝酸纤维素膜置于凝胶成像系统分析显影,并记录实验图像数据,Image J软件分析图像结果。
1.5 数据统计分析数据采用SPSS 18.0软件分析。计量资料以均数±标准差表示,多组数据的比较采用单因素方差分析,两组间比较采用t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 莫诺苷对雷公藤甲素肝损伤小鼠ALT、AST、肝脏指数的影响与对照组相比,雷公藤甲素明显导致小鼠血清中ALT、AST升高,显示出雷公藤甲素的肝毒性。莫诺苷单药组小鼠的ALT、AST无明显变化,而联合用药组的ALT、AST水平则明显低于雷公藤甲素单药组(表 1)。各组的肝脏指数也出现相似规律的变化(表 2)。
| 表 1 莫诺苷对雷公藤甲素所致肝损伤小鼠ALT、AST的影响 Table 1 Effect of monoside on ALT and AST in mice with triptolide induced liver injury (n=10, IU/L, Mean±SD) |
| 表 2 莫诺苷对雷公藤甲素所致肝损伤小鼠肝脏指数的影响 Table 2 Effect of monoside on liver index in mice with triptolide-induced liver injury (n=10, Mean±SD) |
如图 1所示,雷公藤甲素作用于人肝癌HepG2细胞后24、48、72 h,与不给药的空白组相比,3个时间段都出现了明显的细胞生长抑制现象,且细胞生长抑制率随着时间的延长而逐渐升高,具有时间依赖性;而莫诺苷作用于人肝癌HepG2细胞后,观察24、48、72 h,并未发现其对人肝癌HePg2细胞有明显的抑制作用。但是,莫诺苷与雷公藤甲素联合作用于人肝癌HePg2细胞后,在24、48、72 h的实验中,则显著提高了细胞的生长活性,逆转了雷公藤甲素单药所致的细胞抑制。
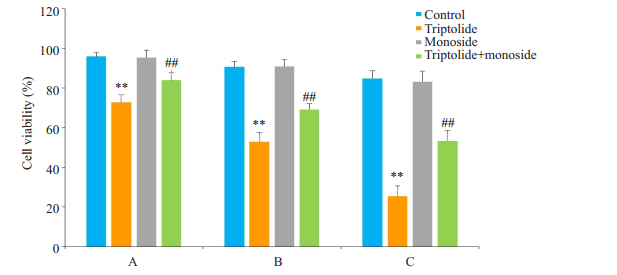
|
图 1 4组药物不同时间处理人肝癌HepG2细胞存活率 Figure 1 Comparison of the viability of HepG2 cells with different treatments. A: HepG2 cells treated with different drugs for 24 h; B: HepG2 cells treated with different drugs for 48 h; C: HepG2 cells treated with different drugs for 72 h. **P < 0.01 vs control group; ##P < 0.01 vs TP group. |
HepG2细胞自然传代至对数生长期,分别给予4组药物24 h后,空白组细胞形态完整,贴壁生长情况良好,铺满细胞皿底部。而经过雷公藤甲素单独处理的细胞组中则出现了大量漂浮的细胞,细胞形态变圆润,贴壁明显减少,仔细观察细胞内部,可见明显液泡和细胞碎片,胞内蛋白质聚集,染色体凝结,颗粒状物质增多,形成典型的细胞凋亡形态。但莫诺苷联合用药组逆转了这一现象,细胞凋亡数目显著减少,贴壁数量增多。经联合用药处理后,与雷公藤甲素组比较,联合用药组中细胞核皱缩和碎片化,细胞器液化溶解,DNA破裂,染色质浓集的现象得到了显著缓解(图 2)。
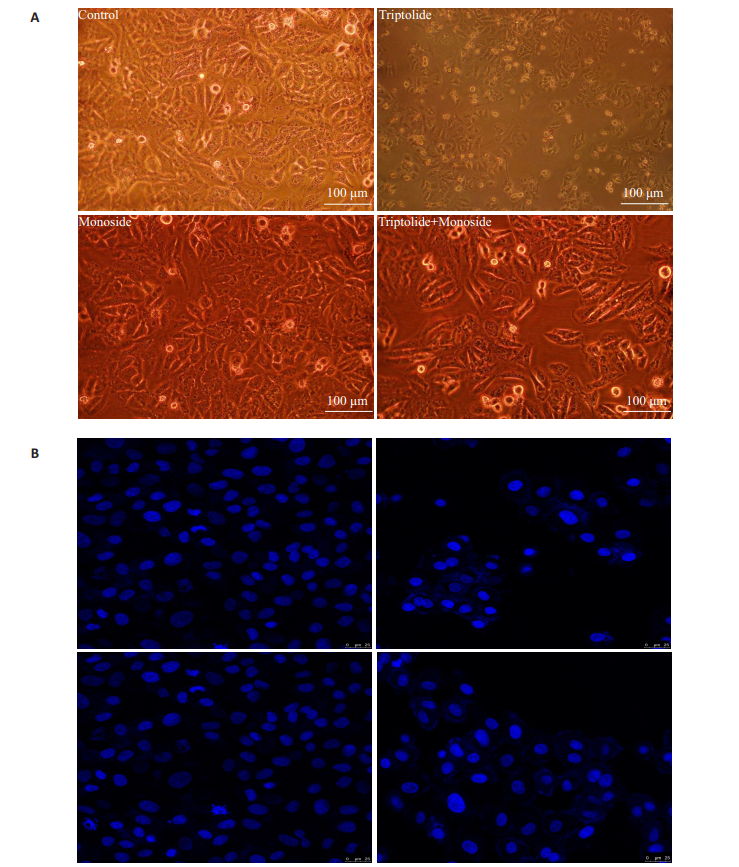
|
图 2 4组药物处理人肝癌HepG2后细胞形态变化 Figure 2 Morphological changes of HepG2 cells treated with different drugs, visualized using brightfield microscope (A, scale bar=100 μm) and fluorescence microscope after Hoechst 33258 staining (B, scale bar=25 μm). |
使用Annexin V-FITC/PI双染试剂盒处理各给药组后,通过流式细胞术检测各组细胞凋亡情况,结果如图 3所示:相比于空白对照组,雷公藤甲素可以明显诱导人肝癌HepG2细胞发生凋亡,细胞的凋亡率从空白对照组的9.05%(空白组)增加到43.10%(雷公藤甲素组)。联合使用保护剂莫诺苷以后,细胞凋亡率(22.41%)显著低于单独应用雷公藤甲素组。
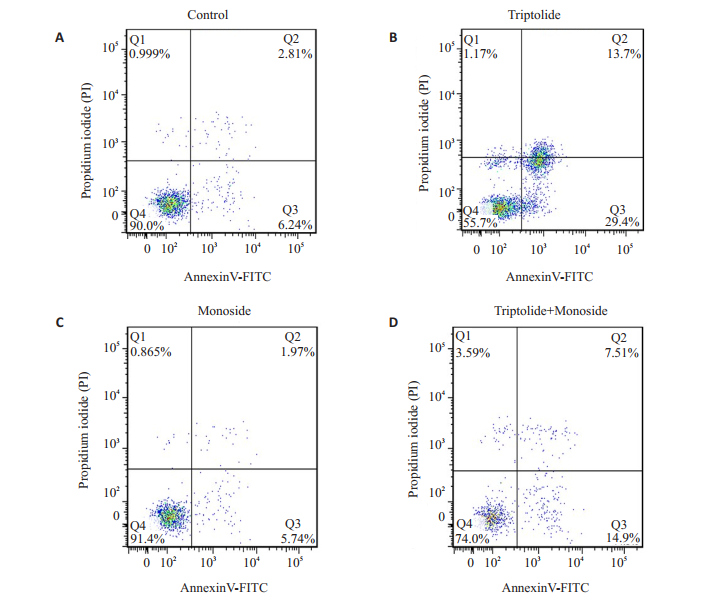
|
图 3 4组药物诱导人肝癌HepG2细胞发生凋亡 Figure 3 Aoptosis in HepG2 cells with different treatments. A: Control; B: Triptolide; C: Monoside; D: Triptolide+Monoside. |
细胞生长至对数生长期后,4组药物分别作用24 h,相比于空白组,雷公藤甲素对人肝癌HepG2细胞中表达的Nrf2与HO-1蛋白均有影响。两药单用均可显著减少Nrf2与HO-1蛋白的表达(P < 0.05,图 4)。
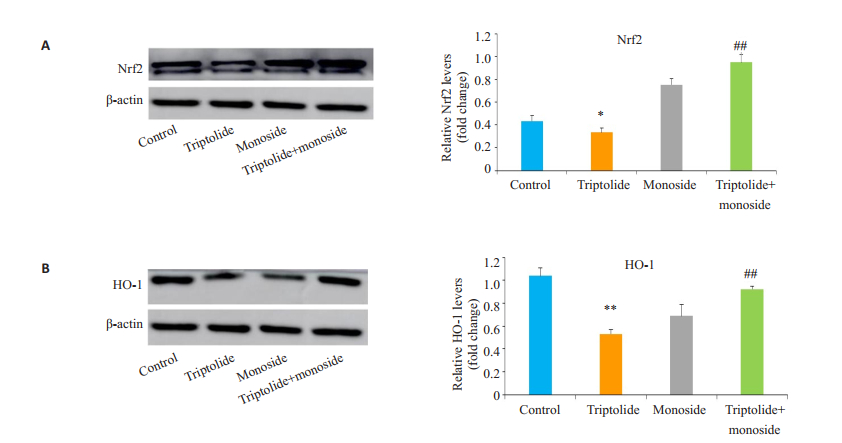
|
图 4 4组药物处理HepG2细胞后对Nrf2和HO-1蛋白表达水平的影响 Figure 4 Protein expressions of Nrf2 (A) and HO-1 (B) in HepG2 cells in different groups detected by Western blotting (n=3). *P < 0.05 vs control; **P < 0.01 vs control; ##P < 0.01 vs TP group. |
雷公藤甲素对乳腺癌,卵巢癌,肝癌,胰腺癌等多种实体瘤具有很好的抗瘤活性,是非常极具潜力的抗癌新药[16-20]。雷公藤甲素造成的肝细胞损伤机制可能与过氧化损伤以及过氧化损伤导致的自噬过度激活有关[21];用鼠肝微粒体和用三明治培养的鼠肝细胞来证实雷公藤甲素是弱的CYP3A抑制剂,此机制在雷公藤甲素诱导的肝毒性中起重要作用[22]。动物实验证实Nrf2的激动剂可以保护雷公藤甲素所致的肝毒性[23]。关键效应分子Nrf2很有可能是潜在的氧化应激所致肝损伤的治疗靶点[24-25]。
莫诺苷已被多项实验证明具有抗氧化应激作用从而发挥增强人体的肝肾功能的药效[26-27],但其在雷公藤甲素所致肝损伤的应用中还未见报道。本研究采用具有抗氧化应激活性的莫诺苷与具有肝毒性的雷公藤甲素配伍用药,从多个角度证明两药联用对人肝癌HepG2细胞的影响。与预期一致,雷公藤甲素对人肝癌HepG2细胞的生长具有非常明显的抑制效应,MTT实验和流式细胞实验都证实了雷公藤甲素可诱导人肝癌HepG2细胞凋亡,细胞形态学实验更是从直观的角度证实了凋亡的发生,而且雷公藤甲素明显降低了细胞内Nrf2、HO-1蛋白的表达,HO-1是Nrf2激活的一个下游靶蛋白,当细胞损伤和氧化应激发生后,HO-1是被激活的效应蛋白,能够催化氧化血红蛋白的分解,从而发挥抗氧化应激作用。表明雷公藤甲素刺激了细胞内氧化应激的发生,而莫诺苷提高了抗氧化应激蛋白的表达,逆转了雷公藤甲素所致的凋亡,发挥了肝脏保护作用。本研究进一步证实了Nrf2通路可以作为抗氧化应激治疗的靶点,而将莫诺苷与雷公藤甲素联合用药来减轻毒副作用,为雷公藤用药的新思路,具有广阔的应用前景。
然而,雷公藤甲素所致的肝损伤的分子机制是十分复杂的,对此,我们仍然不十分清楚。本实验仅仅是探讨莫诺苷协同雷公藤甲素减毒增效研究的开始,还需进一步大量动物实验、细胞实验进行基因敲除,抑制剂或激动剂等实验的佐证。
| [1] |
崔进, 陈晓, 苏佳灿. 雷公藤甲素药理作用研究新进展[J].
中国中药杂志, 2017, 9(14): 2655-8.
|
| [2] |
魏婕, 顾一煌, 李广林. 雷公藤甲素肝毒性作用机制研究进展[J].
山东中医杂志, 2012, 8(9): 693-5.
|
| [3] |
Pall ML, Levine S. Nrf2, a master regulator of detoxification and also antioxidant, anti-inflammatory and other cytoprotective mechanisms, is raised by health promoting factors[J].
Sheng Li Xue Bao, 2015, 67(1): 1-18.
|
| [4] |
Canning P, Sorrell FJ, Bullock AN. Structural basis of Keap1 interactions with Nrf2[J].
Free Radic Biol Med, 2015, 88(Pt B): 101-7.
|
| [5] |
Suzuki T, Yamamoto M. Stress-sensing mechanisms and the physiological roles of the Keap1-Nrf2 system during cellular stress[J].
J Biol Chem, 2017, 292(41): 16817-24.
DOI: 10.1074/jbc.R117.800169. |
| [6] |
Cao L-, Yan M, Ma YX, et al. Isoliquiritigenin protects against triptolide-induced hepatotoxicity in mice through Nrf2 activation[J].
Pharmazie, 2016, 71(7): 394-7.
|
| [7] |
Zhang B, Zhang Q, Liu M, et al. Increased involvement of Panax notoginseng in the mechanism of decreased hepatotoxicity induced by Tripterygium wilfordii in rats[J].
J Ethnopharmacol, 2016, 185(10): 243-54.
|
| [8] |
Guan CW, Jin J, Li J, et al. Tanshinone ⅡA protects against triptolide-induced liver injury via Nrf2/ARE activation[J].
Yao Xue Xue Bao, 2013, 48(9): 1397-402.
|
| [9] |
Wei CB, Tao K, Jiang R, et al. Quercetin protects mouse liver against triptolide-induced hepatic injury by restoring Th17/Treg balance through Tim-3 and TLR4-MyD88-NF-kappa B pathway[J].
Int Immunopharmacol, 2017, 53(1): 73-82.
|
| [10] |
Wang L, Huang QH, Li YX, et al. Protective effects of silymarin on triptolide-induced acute hepatotoxicity in rats[J].
Mol Med Rep, 2018, 17(1): 789-800.
|
| [11] |
Yang Y, Wang W, Xiong Z, et al. Resveratrol protects against triptolide-induced cardiotoxicity through SIRT3 signaling pathway in vivo and in vitro[J].
Pharmazie, 2016, 71(9): 514-23.
|
| [12] |
张丹丹, 闫雪生. 莫诺苷的药理药效作用研究进展[J].
山东中医药大学学报, 2015, 39(1): 95-7.
|
| [13] |
Park CH, Yamabe N, Noh JS, et al. The beneficial effects of morroniside on the inflammatory response and lipid metabolism in the liver of db/db mice[J].
Biol Pharm Bull, 2009, 32(10): 1734-40.
DOI: 10.1248/bpb.32.1734. |
| [14] |
Xiong S, Li J, Zhang W, et al. Induction of CYP3A by morroniside in rats[J].
J Pharmacol Sci, 2015, 127(4): 414-8.
DOI: 10.1016/j.jphs.2015.02.014. |
| [15] |
Lee NH, Seo CS, Lee HY, et al. Hepatoprotective and antioxidative activities of cornus officinalis against acetaminophen-induced hepatotoxicity in mice[J].
Evid Based Complement Alternat Med, 2012, 35(1): 804-924.
|
| [16] |
黄宇, 马全鑫, 凌云. 雷公藤甲素抗肿瘤药理作用的研究进展[J].
药物评价研究, 2018, 41(2): 328-33.
|
| [17] |
Hou ZY, Tong XP, Peng YB. Broad targeting of triptolide to resistance and sensitization for cancer therapy[J].
Biomed Pharmacother, 2018, 104(4): 771-80.
|
| [18] |
Zhang C, He XJ, Li L, et al. Effect of the natural product triptolide on pancreatic cancer: a systematic review of preclinical studies[J].
Front Pharmacol, 2017, 8(2): 490-6.
|
| [19] |
Hu H, Luo LP, Liu F, et al. Anti-cancer and sensibilisation effect of triptolide on human epithelial ovarian cancer[J].
J Cancer, 2016, 7(14): 2093-9.
DOI: 10.7150/jca.16178. |
| [20] |
尹亮, 王亮, 蒋维维, 等. 雷公藤甲素对人肝癌细胞株HepG2体内外作用的研究[J].
南京医科大学学报:自然科学版, 2011, 31(2): 170-4.
|
| [21] |
刘春晖, 周玲玲, 马可迅. 从自噬角度研究雷公藤甲素引起HepG2细胞肝毒性的机制[J].
中国实验方剂学杂志, 2017, 5(10): 99-103.
|
| [22] |
Shen G, Zhuang X, Xiao W, et al. Role of CYP3A in regulating hepatic clearance and hepatotoxicity of triptolide in rat liver microsomes and sandwich-cultured hepatocytes[J].
Food Chem Toxicol, 2014, 71(5): 90-6.
|
| [23] |
Yokozawa T, Park CH, Noh JS, et al. Novel action of 7-O-galloyl[J].
J Pharm Pharmacol, 2009, 61(5): 653-61.
|
| [24] |
Xu H, Shen J, Liu H, et al. Morroniside and loganin extracted from Cornus officinalis have protective effects on rat mesangial cell proliferation exposed to advanced glycation end products by preventing oxidative stress[J].
Can J Physiol Pharmacol, 2006, 84(12): 1267-73.
DOI: 10.1139/y06-075. |
| [25] |
Lee SO, Kim SY, Han SM, et al. Corni fructus scavenges hydroxy radicals and decreases oxidative stress in endothelial cells[J].
J Med Food, 2006, 9(4): 594-8.
DOI: 10.1089/jmf.2006.9.594. |
| [26] |
吕兴, 许惠琴, 刘斌, 等. 莫诺苷对晚期糖基化终末产物加重链脲佐菌素诱导糖尿病肾病保护作用及其机制[J].
中草药, 2014, 45(21): 3109-16.
DOI: 10.7501/j.issn.0253-2670.2014.21.014. |
| [27] |
雷小小, 苏艳莹, 李美云, 等. 山茱萸环烯醚萜苷中马钱苷和莫诺苷的研究进展[J].
上海中医药杂志, 2018, 52(1): 104-8.
|
 2018, Vol. 38
2018, Vol. 38

