结肠癌是消化系统最常见的恶性肿瘤之一,其发病率在全球居第3位[1]。随着生活质量的提高及饮食习惯的改变,近年来结肠癌的发病率及死亡率呈现上升趋势[2-3],据统计,其5年生存率仅约50%[4]。手术、放疗、化疗、分子靶向治疗等是目前治疗结肠癌的主要方式,而肿瘤免疫治疗有望成为新的治疗手段[5-6]。
近来研究发现,细胞因子中的白细胞介素-9(IL-9)具有强大的抗肿瘤作用[7],如IL-9可明显降低小鼠黑色素瘤的增长速度,且可减少肺转移灶数量[8, 22-23];IL-9亦可抑制小鼠鳞癌的生长[9];此外,IL-9可促进CTL细胞抗原的启动并进入肺癌组织发挥抗肿瘤作用[10]。IL-9在结肠癌患者的血浆及癌组织中低表达,且与结肠癌进展相关[11]。对于IL-9的表达与结肠癌患者的临床病理特征及生存时间之间的关系,尚未有进一步研究。本研究通过免疫组织化学SP法及实时荧光定量PCR(qRT-PCR)法检测IL-9在结肠癌组织及相应癌旁正常组织中的表达水平,探讨其与结肠癌临床病理特征及预后之间的关系。
1 资料和方法 1.1 一般资料收集2010年1月~2010年12月苏州大学附属第一医院行手术切除的92例结肠癌组织标本及相应的癌旁正常组织标本(距肿瘤边缘5 cm以上,经术后病理证实无癌组织侵犯的结肠组织),所有组织标本留存两份:其中1份予以10%甲醛溶液(福尔马林溶液)固定,石蜡包埋、切片存档;另一份-80 ℃冰箱冻存,备抽提RNA。同时收集该92例患者完整的临床资料。所有患者均无自身免疫性疾病及结核、肝炎、艾滋病等传染病史,术前均未行放、化疗、靶向治疗及免疫治疗,术后病理均确诊为结肠癌。其中男性53例,女性39例;年龄46~91岁,平均年龄70.1岁;肿瘤直径≤3 cm 17例,> 3 cm 75例;低或中分化癌69例,高分化癌23例;根据第7版美国癌症联合委员会(AJCC)/国际抗癌联盟(UICC)结直肠癌TNM分期标准:Ⅰ~Ⅱ期44例,Ⅲ~Ⅳ期48例;根据Ducks分期标准:A~B期51例,C~D期41例;有淋巴结转移45例,无淋巴结转移47例;有肝转移6例,无肝转移86例。
1.2 免疫组织化学法 1.2.1 免疫组化SP法检测IL-9的表达及分布石蜡切片,脱蜡水化,PBS洗片,柠檬酸缓冲液冲洗;3%的H2O2滴于组织切片,室温下放置灭活内源性过氧化物酶10 min,PBS再次洗片,去除PBS并滴加5% BSA 50 μL,室温孵育10 min;滴加IL-9一抗(1:200稀释)4 ℃过夜,PBS洗片;加二抗室温60 min静置,PBS再次洗片;DAB显色剂反应5 min,苏木精复染,梯度浓度乙醇脱水,中性树脂封片观察。IL-9抗体购于Abcam。
1.2.2 结果判定标准IL-9主要表达于细胞质,遂以细胞质出现淡黄色、棕黄色或棕褐色颗粒为阳性。随机观察10个200倍镜视野,按阳性细胞所占比例计分:< 5%为0分,5%~30%为1分,31%~60%为2分,> 60%为3分;按染色强度计分:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。将阳性染色细胞比例与染色强度相乘:< 2分为IL-9表达阴性(-),≥2分为IL-9表达阳性(+)。
1.3 实时荧光定量PCR法 1.3.1 Trizol法抽提结肠癌组织及癌旁组织中的总RNA加1 mL Trizol研磨组织标本至均质,转至1.5 mL无酶EP管并加入氯仿离心后,取上清液加入等体积异丙嗪,离心后弃上清液,加入75%乙醇,待酒精完全挥发后加入RNase-Free H2O2溶解RNA,适当稀释后用紫外分光光度计测定RNA A260 nm和A280 nm,判断RNA纯度,并调整样本RNA终浓度至同一水平。
1.3.2 逆转录反应使用Prime Script RT Master试剂盒,计算反应体系所需试剂剂量,加样后行逆转录反应,反应程序:37 ℃ 15 min,85 ℃ 15 s,4 ℃ 1 min,最终RNA逆转录成cDNA。
1.3.3 检测IL-9 mRNA的表达水平以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,反应程序:95 ℃ 5 min,95 ℃ 10 s,60 ℃ 30 s,共40个循环,进行PCR扩增。根据仪器自动计算所得每组标本的Ct值,计算目的基因mRNA的相对表达量2-ΔΔCt,△△Ct=实验组△Ct-对照组△Ct,△Ct=目的基因Ct值-内参Ct值。引物序列如下:IL-9: F: 5'-CTCTGTTTGGGCATTCCCTCT-3',R: 5'-GGGTATCTTGTTTGCATGGTGG-3';GAPDH F: 5'-TGTGGGCATCAATGGATTTGG-3',R:5'-ACACCATGTATTCCGGGTCAAT-3'。
1.4 随访方法随访时间为6~72月,截止至2016年12月1日。生存时间为患者手术当日至随访截止日期或至患者死亡日期;术后2年内每3月随访1次,术后2~5年每半年随访1次,术后5年以上每1年随访1次;随访通过电话、复诊等方式进行。
1.5 统计学方法应用SPSS 19.0统计软件进行分析,计数资料采用率表示,不同组间的比较采用卡方检验,正态分布的计量资料用均数±标准差表示,组间比较采用t检验,应用GraphPad Prism 7.0统计软件绘制生存曲线,并采用Kaplan-Meier及Log-rank检验进行生存分析,P < 0.05为差异具有统计学意义。
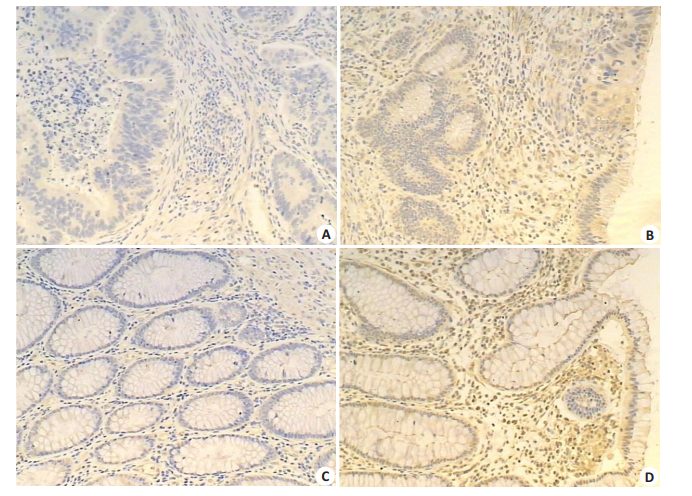
2 结果 2.1 IL-9在结肠癌组织及癌旁组织中的表达免疫组织化学染色结果显示:结肠癌组织中IL-9阴性表达58例,阳性表达34例,阳性率为37.0%(34/92);癌旁组织中IL-9阴性表达21例,阳性表达71例,阳性率为77.2%(71/92)。结肠癌组织中IL-9的阳性表达率明显低于癌旁正常组织,且差异具有统计学意义(P < 0.001,图 1、表 1)。
|
图 1 结肠癌组织和癌旁正常组织中IL-9蛋白的表达 Figure 1 Expression of IL-9 protein in colon cancer tissues and adjacent normal tissues (SP×100). A: Negative expression of IL-9 in colon cancer tissues; B: Positive expression of IL-9 in colon cancer tissues; C: Negative expression of IL-9 in adjacent normal tissues; D: Positive expression of IL-9 in adjacent normal tissues. |
| 表 1 IL-9在结肠癌组织及癌旁正常组织中的表达 Table 1 Expression of IL-9 in colon cancer tissues and adjacent normal tissues (n=92) |
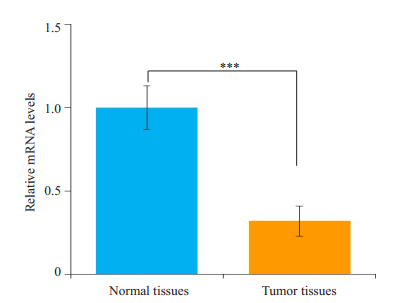
设癌旁组织IL-9 mRNA表达量均值为1。则癌旁正常组织IL-9 mRNA相对表达量(1.00±0.13)与结肠癌组织(0.32±0.09)相比,癌旁正常组织中IL-9 mRNA的表达显著高于结肠癌组织,差异具有统计学意义(P < 0.001,图 2)。
|
图 2 结肠癌组织及癌旁正常组织中IL-9 mRNA的表达 Figure 2 Relative mRNA expression levels of IL-9 in colon cancer tissues and adjacent normal tissues. ***P < 0.001. |
结肠癌组织中IL-9的表达与肿瘤TNM分期、Ducks分期和淋巴结转移有相关性,且呈负相关:结肠癌Ⅰ~Ⅱ期、Ⅲ~Ⅳ期IL-9的阳性表达率分别为50.0%、25.0%;结肠癌A~B期、C~D期IL-9的阳性表达率分别为47.1%、24.4%,结肠癌TNM分期、Ducks分期越晚,IL-9的阳性表达率越低,差异均具有统计学意义(P < 0.05);有淋巴结转移组IL-9的阳性表达率(22.2%)明显低于无淋巴结转移组(51.1%),差异具有统计学意义(P < 0.05)。结肠癌组织中IL-9的表达与性别、年龄、肿瘤大小、分化程度及肝转移等临床病理特征无明显相关性(P > 0.05,表 2)。
| 表 2 IL-9的表达与结肠癌临床病理特征的关系 Table 2 Associations between IL-9 expression and clinicopathological parameters of colon cancer patients |
随访时间为6~72月,中位数为68月,随访率93.3%。92例结肠癌患者的5年总体生存率为57.6%(53/92)。IL-9表达阴性的结肠癌患者(58例)的1、3、5年生存率分别为94.8%、74.1%、53.4%;IL-9表达阳性的结肠癌患者(34例)的1、3、5年生存率分别为100.0%、91.2%、76.5%。单因素生存分析显示,与IL-9表达阴性的结肠癌患者相比,IL-9表达阳性患者的术后生存时间更长,且差异具有统计学意义(P < 0.05,图 2)。
3 讨论白细胞介素在抗肿瘤免疫应答中的作用日益受到关注[12-13]。IL-9主要来源于活化的Th9细胞,嗜酸性粒细胞、中性粒细胞及肥大细胞等也可分泌产生,而肿瘤实质细胞不能表达IL-9;IL-9受体由2条链构成,分别为α链(IL-9Rα)和γ链(IL-9Rγ);IL-9与其受体结合后,可激发JAK1、JAK3交叉磷酸化,从而激活STAT1、STAT3、STAT5形成同源及异源二聚体,进入细胞核内启动相关基因转录表达,发挥相应的生物学作用[14-17]。IL-9的效应细胞为肥大细胞、T细胞亚群、抗原提呈细胞及树突状细胞等[18],这就决定了IL-9作用的多样性。IL-9具有促进炎症反应及自身免疫性疾病,抗寄生虫及抗结核等作用[19-20],近年的研究发现IL-9具有抗肿瘤免疫作用[21]。
本研究发现,在结肠癌组织中IL-9蛋白及mRNA的表达均明显高于癌旁正常组织。近来关于IL-9的抗肿瘤作用日益受到关注。IL-9可抑制小鼠皮下黑色素瘤的生长速度及获得较长生存时间[22];Lu等[10, 23]建立小鼠肺黑色素瘤模型发现IL-9可抑制小鼠肺转移灶数量;通过IL-9激发树突状细胞(DC)的功能来提高肿瘤特异性细胞毒T淋巴细胞(CTL)的抗肿瘤免疫[24];IL-9可抑制小鼠鳞状上皮细胞癌[9];建立Th9抗原特异性疫苗发现IL-9可抑制肿瘤细胞的种植以及扩散[25]。本研究探讨了IL-9在结肠癌和癌旁组织的表达以及IL-9在结肠癌组织的表达与患者临床病理特征的关系,研究结果与上述结论一致,说明IL-9在恶性肿瘤中可能发挥了抗肿瘤免疫作用。其原因可能为肠道是人体重要的免疫屏障,结肠组织中存在数量及种类较多的免疫细胞,这些细胞分泌了较多的细胞因子,而肿瘤组织微环境中以肿瘤细胞为主,且免疫效应细胞处于免疫抑制状态,浸润的免疫细胞较少,因此分泌细胞因子IL-9较少。
本研究还发现IL-9在结肠癌组织中的表达与TNM分期密切相关,分期越晚IL-9的阳性表达率越低,这与Huang等[11]研究发现Ⅲ~Ⅳ期结肠癌组织中IL-9的表达低于Ⅰ~Ⅱ期的结果一致,但该研究尚未对IL-9与其他临床病理特征及预后的关系作进一步研究。通过研究我们发现IL-9在结肠癌组织中的表达与Ducks分期、淋巴结转移呈负相关:Ducks分期越晚IL-9的阳性表达率越低,有淋巴结转移组的IL-9的阳性表达率明显低于无淋巴结转移组;IL-9的表达与性别、年龄、肿瘤大小、分化程度及肝转移等临床病理特征无明显相关性,提示结肠癌肿瘤微环境中高表达IL-9可能在抑制结肠癌的进展中发挥了重要作用。除此之外,通过生存分析我们还发现IL-9表达阳性的结肠癌患者的术后生存时间明显比IL-9表达阴性的患者长,提示IL-9的表达水平可评估结肠癌患者的预后情况。以上结果提示:IL-9可能具有较强的抗肿瘤作用;对结肠癌细胞有较强免疫反应的个体,可能通过在肿瘤微环境中聚集相应的抗肿瘤免疫细胞,分泌IL-9产生抗肿瘤免疫作用,抑制肿瘤细胞的局部侵犯和远处转移,所以预后较好。
关于IL-9激发抗肿瘤免疫反应的机制,已有一些研究进行了探索。在小鼠黑色素瘤中IL-9通过上调抗增值分子p21和凋亡分子TRAIL促进黑色素瘤细胞的凋亡[26];IL-9作用于效应细胞肥大细胞,激发固有免疫反应,发挥抗肿瘤作用[22, 25, 27];IL-9通过诱导肺癌组织CCL20-CCR6依赖的DCs细胞进入引流淋巴结,激活CTL细胞后引入肿瘤组织发挥抗肿瘤作用,同时刺激CD8+细胞介导的抗肿瘤免疫[10, 23];在小鼠鳞癌中金黄色葡萄球菌肠毒素B增加CD4+细胞信号转导及IL-9转录因子STAT5、HDAC1、PU.1的表达,促进IL-9产生,从而抑制鳞癌细胞生长[9]。SIRT1对诱导IL-9分泌具有重要作用,其上游抑制信号为TAK1,SIRT1缺陷可活化和诱导下游信号mTOR-HIF1 α,促进IL-9的分泌从而抑制肿瘤进展[8, 28];GITR可通过转录因子STAT6和组蛋白乙酰化酶P300促进IL-9分泌[29];通过DCs表达的OX40及NF-κB信号通路可调节IL-9的产生[30]。但目前对于IL-9的抗肿瘤作用机制尚未完全阐明。
综上所述,IL-9可能具有抗肿瘤免疫作用,与结肠癌的进展密切相关。因本研究为单中心研究,有待于大样本多中心研究证实;同时,IL-9在结肠癌微环境中的抗肿瘤免疫机制尚需细胞免疫学、分子生物学实验及动物实验进一步探讨,从而为结肠癌的临床免疫治疗提供新的理论基础。
| [1] |
蔡国响, 戴卫星, 蔡三军. 结直肠癌多学科综合治疗的现状与未来[J].
中华胃肠外科杂志, 2016, 19(6): 607-11.
DOI: 10.3760/cma.j.issn.1671-0274.2016.06.002. |
| [2] |
Chow CJ, Al-Refaie WB, Abraham A, et al. Does patient rurality predict quality colon cancer care? A population-based study[J].
Dis Colon Rectum, 2015, 58(4): 415-22.
DOI: 10.1097/DCR.0000000000000173. |
| [3] |
宋文, 彭曼, 段世玉, 等. MIER3在结直肠癌中的表达及其相关蛋白的生物信息学分析[J].
南方医科大学学报, 2017, 37(8): 1040-6.
DOI: 10.3969/j.issn.1673-4254.2017.08.07. |
| [4] |
Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J].
Int J Cancer, 2015, 136(5): E359-86.
DOI: 10.1002/ijc.29210. |
| [5] |
Couzin-Frankel J. Breakthrough of the year 2013. Cancer immunotherapy[J].
Science, 2013, 342(6165): 1432-3.
DOI: 10.1126/science.342.6165.1432. |
| [6] |
Yang YP. Cancer immunotherapy: harnessing the immune system to battle cancer[J].
J Clin Invest, 2015, 125(9): 3335-7.
DOI: 10.1172/JCI83871. |
| [7] |
Végran F, Apetoh L, Ghiringhelli F. Th9 cells: a novel CD4 T-cell subset in the immune war against cancer[J].
Cancer Res, 2015, 75(3): 475-9.
DOI: 10.1158/0008-5472.CAN-14-2748. |
| [8] |
Nakatsukasa H, Zhang D, Maruyama T, et al. The DNA-binding inhibitor Id3 regulates IL-9 production in CD4(+) T cells[J].
Nat Immunol, 2015, 16(10): 1077-84.
DOI: 10.1038/ni.3252. |
| [9] |
Miao BP, Zhang RS, Sun HJ, et al. Inhibition of squamous cancer growth in a mouse model by Staphylococcal enterotoxin B[J].
Cell Mol Immunol, 2017, 14(4): 371-9.
DOI: 10.1038/cmi.2015.88. |
| [10] |
Lu Y, Yi Q. Utilizing T9 cells as a novel therapeutic strategy for malignancies[J].
Oncoimmunology, 2013, 2(3): 23084.
DOI: 10.4161/onci.23084. |
| [11] |
Huang Y, Cao Y, Zhang S, et al. Association between low expression levels of interleukin-9 and colon cancer progression[J].
Exp Ther Med, 2015, 10(3): 942-6.
DOI: 10.3892/etm.2015.2588. |
| [12] |
Davis MR, Zhu Z, Hansen DM, et al. The role of IL-21 in immunity and cancer[J].
Cancer Lett, 2015, 358(2): 107-14.
DOI: 10.1016/j.canlet.2014.12.047. |
| [13] |
Schwartz C, O'grady K, Lavelle EC, et al. Interleukin 33: an innate alarm for adaptive responses beyond Th2 immunity-emerging roles in obesity, intestinal inflammation, and cancer[J].
Eur J Immunol, 2016, 46(5): 1091-100.
DOI: 10.1002/eji.201545780. |
| [14] |
Dardalhon V, Awasthi A, Kwon H, et al. IL-4 inhibits TGF-beta[J].
Nat Immunol, 2008, 9(12): 1347-55.
DOI: 10.1038/ni.1677. |
| [15] |
Cheng G, Yu A, Dee MJ, et al. IL-2R signaling is essential for functional maturation of regulatory T cells during thymic development[J].
J Immunol, 2013, 190(4): 1567-75.
DOI: 10.4049/jimmunol.1201218. |
| [16] |
Pan HF, Leng RX, Li XP, et al. Targeting T-helper 9 cells and interleukin-9 in autoimmune diseases[J].
Cytokine Growth Factor Rev, 2013, 24(6): 515-22.
DOI: 10.1016/j.cytogfr.2013.09.001. |
| [17] |
Ma L, Xue HB, Guan XH, et al. Possible pathogenic role of T helper type 9 cells and interleukin (IL)-9 in atopic dermatitis[J].
Clin Exp Immunol, 2014, 175(1): 25-31.
DOI: 10.1111/cei.2014.175.issue-1. |
| [18] |
Goswami R, Kaplan MH. A brief history of IL-9[J].
J Immunol, 2011, 186(6): 3283-8.
DOI: 10.4049/jimmunol.1003049. |
| [19] |
Nalleweg N, Chiriac MT, Podstawa E, et al. IL-9 and its receptor are predominantly involved in the pathogenesis of UC[J].
Gut, 2015, 64(5): 743-55.
DOI: 10.1136/gutjnl-2013-305947. |
| [20] |
Rojas-Zuleta WG, Sanchez E.. IL-9: function, sources, and detection[J].
Methods Mol Biol, 2017, 1585(8): 21-35.
|
| [21] |
许昆鹏, 赵路军. Th9细胞抗肿瘤免疫作用及机制研究进展[J].
中国肿瘤临床, 2017, 44(6): 294-8.
DOI: 10.3969/j.issn.1000-8179.2017.06.390. |
| [22] |
Purwar R, Schlapbach C, Xiao S, et al. Robust tumor immunity to melanoma mediated by interleukin-9-producing T cells[J].
Nat Med, 2012, 18(8): 1248-53.
DOI: 10.1038/nm.2856. |
| [23] |
Lu Y, Hong S, Li H, et al. Th9 cells promote antitumor immune responses in vivo[J].
J Clin Invest, 2012, 122(11): 4160-71.
DOI: 10.1172/JCI65459. |
| [24] |
Kim IK, Kim BS, Koh CH, et al. Glucocorticoid-induced tumor necrosis factor receptor-related protein co-stimulation facilitates tumor regression by inducing IL-9-producing helper T cells[J].
Nat Med, 2015, 21(9): 1010-7.
DOI: 10.1038/nm.3922. |
| [25] |
Abdul-Wahid A, Cydzik M, Prodeus A, et al. Induction of antigen[J].
Int J Cancer, 2016, 139(4): 841-53.
DOI: 10.1002/ijc.30121. |
| [26] |
Fang Y, Chen X, Bai Q, et al. IL-9 inhibits HTB-72 melanoma cell growth through upregulation of p21 and TRAIL[J].
J Surg Oncol, 2015, 111(8): 969-74.
DOI: 10.1002/jso.v111.8. |
| [27] |
Végran F, Berger H, Boidot R, et al. The transcription factor IRF1 dictates the IL-21-dependent anticancer functions of TH9 cells[J].
Nat Immunol, 2014, 15(8): 758-66.
DOI: 10.1038/ni.2925. |
| [28] |
Wang Y, Bi Y, Chen X, et al. Histone deacetylase SIRT1 negatively regulates the differentiation of interleukin-9-Producing CD4(+) T cells[J].
Immunity, 2016, 44(6): 1337-49.
DOI: 10.1016/j.immuni.2016.05.009. |
| [29] |
Xiao X, Shi X, Fan Y, et al. GITR subverts Foxp3(+) Tregs to boost Th9 immunity through regulation of histone acetylation[J].
Nat Commun, 2015, 6(12): 8266.
|
| [30] |
Zhao Y, Chu X, Chen J, et al. Dectin-1-activated dendritic cells trigger potent antitumour immunity through the induction of Th9 cells[J].
Nat Commun, 2016, 7(7): 12368.
|
 2018, Vol. 38
2018, Vol. 38

