2. 蚌埠医学院第一附属医院呼吸与危重症医学科,安徽 蚌埠 233004
2. Department of Respiratory and Critical Medicine, First Affiliated Hospital of Bengbu Medical College, Bengbu 233004, China
近年来研究表明,不同浓度的活性氧自由基(ROS)参与心肌的生理过程及病理损害[1]。需氧生物在氧化应激及酶联反应过程中产生ROS,生理状态下,适量ROS参与对正常细胞功能调节;但当ROS生成增加或内源性抗氧化酶功能失调时,ROS及其代谢产物在机体内异常聚集导致一系列损伤状态,即氧化应激[2]。氧化应激是导致心血管系统结构、功能异常的重要原因之一,多种心血管疾病伴有氧自由基的生成增加,且疾病的严重程度与氧化应激水平呈正相关。因此,减轻氧化应激对心肌损伤具有重要的保护意义。
线粒体乙醛脱氢酶2(ALDH2)是体内重要的醛类氧化酶,参与乙醇代谢,将乙醇代谢产物乙醛代谢成无害的乙酸,消除过氧化物和反应性醛,减轻乙醇及其代谢产物对细胞的氧化损伤[3]。ALDH2对多种因素导致的心肌损伤均能发挥保护作用[4-6],但关于氧自由基与ALDH2在心肌损伤中的报道存在争议。特异性激动ALDH2可对抗心肌缺血再灌注损伤中氧化应激的发生[7],但Sun等[8-9]报道ROS在小鼠心肌梗死及心衰期间并未参与ALDH2转染介导的心肌细胞保护作用。另有报道,ALDH2通过解毒4-HNE而不是减弱ROS产生来保护神经元细胞免受氧化应激[10]。是否可以直接采用氧化应激干预观察ALDH2在心肌损伤中的变化,更明确地分析两者的关系?H2O2是一种重要的氧自由基,不仅能产生高活性的羟基基团,而且能够自由穿越细胞膜在细胞内弥散,研究中常使用外源性H2O2直接诱导细胞氧化损伤。ALDH2基因过表达增加了H2O2干预胃粘膜细胞的活力,ALDH2基因敲低具有相反的作用[11]。H2O2加重心肌细胞凋亡[12],但H2O2与心肌细胞ALDH2的直接关联尚未见报道。因此,本研究为进一步明确氧化应激损伤与心肌细胞ALDH2之间的直接关联,采用一定浓度的H2O2直接干预H9C2心肌细胞,分析氧化应激和ALDH2的关系,为抗氧化损伤药物治疗心肌损伤提供理论研究基础。
1 材料和方法 1.1 材料细胞裂解液(增强型)、BCA蛋白定量试剂(碧云天)、0.25%胰酶消化液(含0.05% EDTA、GBICO),DMEM高糖培养基、胎牛血清(Hyclone),四甲基噻唑盐(MTT)、二甲基亚砜(DMSO)、Daidzin、Alda- 1(Sigma),小鼠抗大鼠GAPDH抗体和HRP标记的羊抗兔IgG抗体(武汉博士德生物),兔抗大鼠ALDH2抗体(Abcam),ALDH2活性试剂盒(Abcam),大鼠H9C2心肌细胞系(上海吉凯),30%过氧化氢溶液(国药集团)。
1.2 实验方法 1.2.1 H9C2心肌细胞培养及氧化应激损伤模型的建立H9C2心肌细胞接种于T-25无菌透气培养瓶中,37 ℃、5% CO2条件下含10%胎牛血清的DMEM高糖完全培养基培养。取细胞铺满培养瓶,80%~90%对数生长期细胞用于实验。采用含10%胎牛血清的DMEM培养基将H2O2稀释成200、400、600、800 μmol/L的工作液,分别作用于心肌细胞1、2 h,MTT比色法检测各组细胞活力。结果显示200 μmol/L H2O2干预1 h,细胞存活率接近正常组50%(表 1),故本研究中选用200 μmol/L H2O2干预心肌细胞1 h诱导其损伤。
| 表 1 不同浓度H2O2干预1 h和2 h心肌细胞活力变化 Table 1 Changes of myocardial cell viability at 1 h and 2 h after exposure to different concentrations of H2O2 (Mean±SD, n=9) |
实验干预前给予细胞无血清DMEM培养基同步化18 h处理(每组细胞数相同)。将实验设置为5组:正常对照组(NG):DMEM完全培养基;NG+ ALDH2激动剂Alda-1组(NG+Alda-1):DMEM完全培养基,加入Alda-1使得其终浓度为20 μmol/L[13];H2O2损伤组(H2O2):DMEM完全培养基稀释的200 μmol/L H2O2,干预1 h;H2O2+ALDH2激动剂Alda-1组(H2O2+ Alda-1):DMEM完全培养基稀释的200 μmol/L H2O2,加入Alda-1使得其终浓度20 μmol/L,干预1 h;H2O2+ ALDH2抑制剂Daidzin组(H2O2+Daidzin):DMEM完全培养基稀释的200 μmol/L H2O2,加入Daidzin使得其终浓度为60 μmol/L[14],干预1 h。
1.2.3 四甲基偶氮唑盐(MTT)法测定心肌细胞存活率活细胞线粒体中的琥珀酸脱氢酶可以被外源性的甲基四唑蓝(MTT)还原为蓝紫色结晶物沉积在细胞中,通过酶标仪检测A490 nm处吸光度,间接反映活细胞数量。将H9C2心肌细胞悬液接种于96孔板,104/孔,37 ℃、5% CO2培养箱中常规培养24 h后,无血清处理18 h。实验条件干预后,每孔加入5 μg/mL的MTT试剂20 μL,37 ℃培养箱孵育4 h后,弃上清,加入150 μL二甲基亚砜,室温下摇床10 min后,酶标仪测定细胞A490 nm。
1.2.4 DHE检测各组心肌细胞内ROS水平H9C2心肌细胞以3×105/mL接种于6孔板,实验干预条件处理之后每孔加入10 μmol/L的DHE溶液100 μL,37 ℃避光孵育30 min,D-Hanks液洗3遍,3 min/遍,4%的多聚甲醛固定10 min,荧光显微镜下观察,拍照。应用Image J软件进行荧光强度分析。
1.2.5 各组心肌细胞ALDH2活性及ALDH2蛋白表达测定ALDH2具有脱氢酶活性,可以吸收氢质子而使其转化为相应的酸,即乙醛+ NAD+→酸+ NADH,按照ALDH2活性测定试剂盒说明书,测定A490 nm吸光度检测各组心肌细胞ALDH2活性。选取3个不同批次心肌细胞,不同干预后提取各组细胞总蛋白。按照BCA试剂盒说明书测量蛋白浓度并计算出30 μg蛋白上样体积。取30 μg样品进行聚丙烯酰胺凝胶电泳(10%分离胶+ 5%浓缩胶),电泳结束转移至0.45 μm的PVDF膜上,室温下封闭2 h,4 ℃孵育ALDH2一抗(1:3000)过夜,TBST洗膜后孵育二抗1 h,洗膜后ECL显影液显影。用Image J软件分析各条带的灰度值,以GAPDH为内参对照,计算各蛋白条带的表达水平。
1.3 统计方法采用SPSS 16.0统计软件,计量资料以均数±标准差表示,多组间比较采用单因素方差分析,并用Newman-Keuls检验进行组间比较。P < 0.05认为差异有统计学意义。
2 结果 2.1 不同浓度H2O2培养的H9C2心肌细胞存活率MTT结果显示:与NG组相比较,不同剂量H2O2作用于心肌细胞1 h和2 h后,A490 nm值均明显下降。其中200 μmol/L的H2O2作用1 h时,细胞存活率接近正常组50%,选取200 μmol/LH2O2干预1 h作为氧化损伤模型(表 1)。
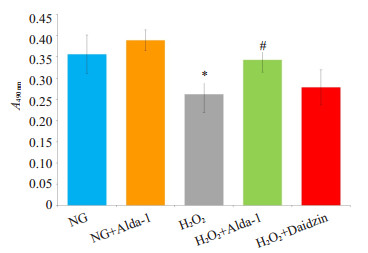
2.2 ALDH2对H2O2诱导H9C2心肌细胞损伤中细胞存活率的影响200 μmol/L的H2O2处理H9C2心肌细胞1 h后,与NG组相比,细胞存活率明显降低(P < 0.05);与H2O2损伤组相比,ALDH2特异性激动剂Alda-1明显升高细胞存活率(P < 0.05),ALDH2抑制剂Daidzin对H2O2引起的细胞存活率的降低无明显影响(P >0.05,图 1)。
|
图 1 不同组别心肌细胞损伤和细胞存活率的变化 Figure 1 Changes in cell survival rate in the cardiomyocytes after different treatments (Mean±SD, n=3). *P < 0.05 vs NG; #P < 0.05 vs H2O2 group |
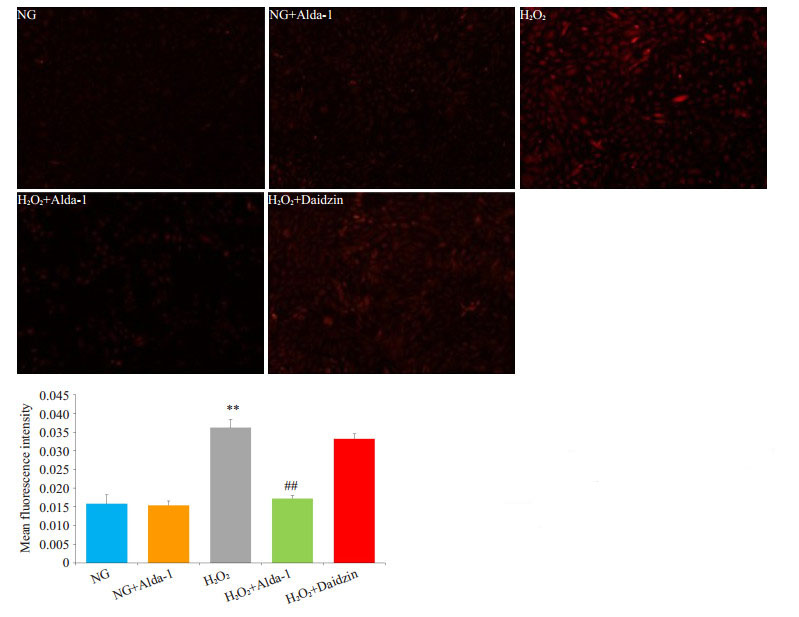
与NG组相比,DHE荧光染色显示,H2O2损伤组红色荧光强度明显增强(P < 0.01);与H2O2组相比,H2O2+ Alda-1组中细胞红色荧光强度明显减弱(P < 0.01),ROS水平降低;H2O2+Daidzin组中无明显影响(P >0.05,图 2)。
|
图 2 不同组别心肌细胞氧化应激水平的变化 Figure 2 Changes of oxidative stress in different groups. A: DHE staining of H9C2 cells in different groups (× 100); B: ROS level in H9C2 cells with different treatments (Mean±SD, n=5). **P < 0.01 vs NG; ##P < 0.01 vs H2O2 |
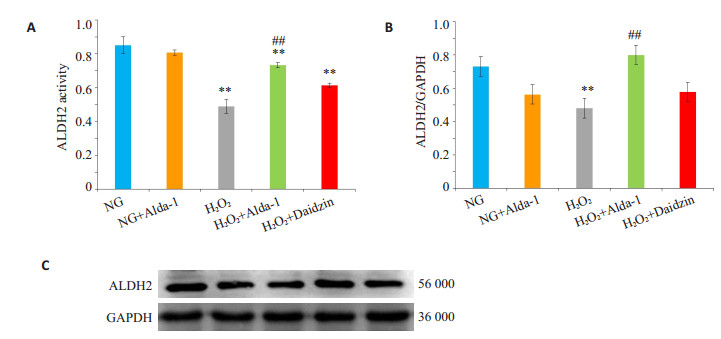
与NG组相比,H2O2损伤组心肌细胞ALDH2活性和蛋白表达降低(P < 0.01);与H2O2组相比,ALDH2激动剂Alda-1干预后ALDH2活性和蛋白表达明显升高(P < 0.01);ALDH抑制剂Daidzin干预后,与H2O2组相比,ALDH2活性和蛋白表达无明显变化(P >0.05,图 3)。
|
图 3 不同组别心肌细胞ALDH2活性和蛋白表达 Figure 3 ALDH2 activity and protein expression in different groups (Mean±SD, n=3). A: ALDH2 activity in different groups; B: ALDH2 protein levels in H9C2 cells normalized by GAPDH levels; C: Western blotting of ALDH2 and GAPDH in H9C2 cells; **P < 0.01 vs NG; ##P < 0.01 vs H2O2 |
心肌缺血及再灌注损伤过程伴随氧自由基(ROS)的大量产生和堆积,引发机体内源性氧化应激反应,加重心肌缺血损伤[15]。氧自由基是细胞氧化应激的重要产物之一,其水平的高低反应了细胞受自由基攻击受损的程度[16]。细胞内过多的ROS积累可导致DNA损伤,线粒体功能障碍,进一步加重ROS产生和细胞损伤,促进心肌重塑的发生和发展[17]。
H2O2诱导H9C2细胞氧化应激的发生[18],H2O2可以显著增加细胞的氧化应激水平,降低超氧化物歧化酶在H9C2细胞中的活性[19]。本研究为了直接观察氧自由基对心肌细胞的影响,采用H2O2直接诱导心肌细胞氧化应激损伤。有研究表明H2O2浓度(>300 μmol/L)过高,往往会导致细胞不可逆性损伤甚至死亡,低浓度H2O2则能通过激活细胞内各种信号转导机制,引起细胞损伤[20-21]。我们的研究观察到,应用不同浓度H2O2干预心肌细胞1 h均可降低细胞的存活率,结合本实验MTT结果和Bihamta等[19]的报道,我们选用200 μmol/L H2O2干预心肌细胞1 h作为损伤刺激。
糖尿病大鼠心肌损伤时ALDH2表达的高低与心肌功能损伤程度密切相关[22]。ALDH2特异性激动剂Alda-1可通过直接激活和抑制失活两种方式增加ALDH2的活性[11]。ALDH2保护作用的研究已经涵盖了全身多个重要组织器官。脑缺血再灌注损伤中,Alad-1可通过提高ALDH2活性发挥神经保护作用[23],Alda-1可通过降低毒性代谢产物有效改善心功能衰竭大鼠的心脏功能[24]。人脐静脉内皮细胞转入ALDH2基因后,可明显减少ROS的增加,细胞抗氧化损伤作用显著增强[25]。在环磷酰胺引起的急性肝毒性损伤中,ALDH2通过减少毒性醛的积累和ROS的产生减轻环磷酰胺引起的急性肝损伤[26]。这些结果均提示,ALDH2可能是组织或器官拮抗氧化应激损伤的重要保护因子。
本研究观察到,H2O2直接干预心肌细胞后引起氧化应激损伤,表现为细胞内ROS释放水平增高,细胞存活率降低;给予Alda-1后显著增强ALDH2活性,ALDH2蛋白表达增加,ROS水平降低,氧化应激程度减轻,细胞存活率明显升高。提示Alda-1可以通过提高ALDH2的活性及表达直接对抗细胞的氧化应激损伤,对H2O2干预后的心肌损伤起保护作用。
值得注意的是,正常H9C2心肌细胞给予ALDH2激动剂Alda-1干预后,并未引起ALDH2活性及表达增加。我们推测,正常细胞内ALDH2表达呈相对稳定水平,Alda-1激动并不增高ALDH2的表达,但氧化应激损伤刺激导致体内ALDH2的活性和表达降低,Alda-1可激动体内ALDH2在一定范围内表达增高从而发挥心肌保护作用。
Daidzin作为ALDH2特异性抑制剂抑制ALDH2活性。有研究报道,大鼠心肌细胞缺氧损伤时,当ALDH2被Daidzin抑制后,心肌细胞对缺氧的耐受性明显下降,可能与ALDH2活性降低后引起ROS的产生增加及MAPK通路的激活有关[27]。同时Daidzin使ALDH2失活后提高了酒精性心肌病中醛和p38MAPK磷酸化水平,加重乙醇诱导的心脏损伤[28]。本课题组既往研究发现,提高ALDH2表达可抑制高糖引起的心肌成纤维细胞的增殖,改善氧化应激,而激动ALDH2同时给予其抑制剂Daidzin对抗ALDH2的表达后,其保护作用消失[29],提示体内一定含量的ALDH2是维持心肌细胞正常功能的重要保障之一。本研究结果显示,H2O2诱导心肌细胞损伤的基础上加入Daidzin干预,与H2O2组相比,并未引起细胞活力下降和氧化损伤的进一步加重,ALDH2活性和蛋白表达未出现明显下降,推测外源性H2O2干预引起的氧化应激损伤造成细胞损伤的重要机制之一,发挥了与Daidzin相似的作用,已直接降低了ALDH2的活性及表达。
综上所述,一定浓度的H2O2引起H9C2心肌细胞ALDH2活性及表达降低,激活ALDH2通过抑制氧化应激减弱H2O2诱导的心肌细胞损伤,其相关机制还有待进一步探讨。
| [1] |
Carvajal K, El Hafidi M, Baños G. Myocardial damage due to ischemia and reperfusion in hypertriglyceridemic and hypertensive rats: participation of free radicals and Calcium overload[J].
J Hypertens, 1999, 17(11): 1607-16.
DOI: 10.1097/00004872-199917110-00015. |
| [2] |
Finkel T. Oxidant signals and oxidative stress[J].
Curr Opin Cell Biol, 2003, 15(2): 247-54.
DOI: 10.1016/S0955-0674(03)00002-4. |
| [3] |
Zhang Y, Ren J. ALDH2 in alcoholic heart diseases: molecular mechanism and clinical implications[J].
Pharmacol Ther, 2011, 132(1): 86-95.
DOI: 10.1016/j.pharmthera.2011.05.008. |
| [4] |
Koda K, Salazar- Rodriguez M, Corti F, et al. Aldehyde dehydrogenase activation prevents reperfusion arrhythmias by inhibiting local renin release from cardiac mast cells[J].
Circulation, 2010, 122(8): 771-81.
DOI: 10.1161/CIRCULATIONAHA.110.952481. |
| [5] |
Liu B, Wang J, Li M, et al. Inhibition of ALDH2 by OGlcNAcylation contributes to the hyperglycemic exacerbation of myocardial ischemia/reperfusion injury[J].
Oncotarget, 2017, 8(12): 19413-26.
|
| [6] |
Ma H, Guo R, Yu L, et al. Aldehyde dehydrogenase 2 (ALDH2) rescues myocardial ischaemia/reperfusion injury: role of autophagy paradox and toxic aldehyde[J].
Eur Heart J, 2011, 32(8): 1025-38.
DOI: 10.1093/eurheartj/ehq253. |
| [7] |
Chen CH, Budas GR, Churchill EN, et al. Activation of aldehyde dehydrogenase-2 reduces ischemic damage to the heart[J].
Science, 2008, 321(5895): 1493-5.
DOI: 10.1126/science.1158554. |
| [8] |
Sun A, Zou Y, Wang P, et al. Mitochondrial aldehyde dehydrogenase 2 plays protective roles in heart failure after myocardial infarction via suppression of the cytosolic JNK/p53 pathway in mice[J].
J Am Heart Assoc, 2014, 3(5): e000779.
DOI: 10.1161/JAHA.113.000779. |
| [9] |
Yang H, Song Z, Yang GP, et al. The ALDH2 rs671 polymorphism affects post-stroke epilepsy susceptibility and plasma 4-HNE levels[J].
PLoS One, 2014, 9(10): e109634.
DOI: 10.1371/journal.pone.0109634. |
| [10] |
Ohsawa Ikuroh, Nishimaki Kiyomi, Yasuda Chie, et al. Deficiency in a mitochondrial aldehyde dehydrogenase increases vulnerability to oxidative stress in PC12 cells[J].
J Neurochem, 2003, 84(5): 1110-7.
DOI: 10.1046/j.1471-4159.2003.01619.x. |
| [11] |
Duan Y, Gao Y, Zhang J, et al. Mitochondrial aldehyde dehydrogenase 2 protects gastric mucosa cells against DNA damage caused by oxidative stress[J].
Free Radic Biol Med, 2016, 93(8): 165-76.
|
| [12] |
Liu XR, Li T, Cao L, et al. Dexmedetomidine attenuates H2O2- induced neonatal rat cardiomyocytes apoptosis through mitochondria- and ER-medicated oxidative stress pathways[J].
Mol Med Rep, 2018, 17(5): 7258-64.
|
| [13] |
Perez-Miller S, Younus H, Vanam R, et al. Alda-1 is an agonist and chemical chaperone for the common human aldehyde dehydrogenase 2 variant[J].
Nat Struct Mol Biol, 2010, 17(2): 159-64.
DOI: 10.1038/nsmb.1737. |
| [14] |
Zhang P, Xu D, Wang S, et al. Inhibition of aldehyde dehydrogenase 2 activity enhances antimycin- induced rat cardiomyocytes apoptosis through activation of MAPK signaling pathway[J].
Biomed Pharmacother, 2011, 65(8): 590-3.
DOI: 10.1016/j.biopha.2009.12.001. |
| [15] |
Murphy E, Steenbergen C. Mechanisms underlying acute protection from cardiac ischemia-reperfusion injury[J].
Physiol Rev, 2008, 88(2): 581-609.
DOI: 10.1152/physrev.00024.2007. |
| [16] |
Larsen M, Webb G, Kennington S, et al. Mannitol in cardioplegia as an Oxygen free radical scavenger measured by malondialdehyde[J].
Perfusion, 2002, 17(1): 51-5.
DOI: 10.1191/0267659102pf528oa. |
| [17] |
Mishra P, Samanta L. Oxidative stress and heart failure in altered thyroid States[J].
ScientificWorldJournal, 2012(8): 741861.
|
| [18] |
Winstead MV, Lucas KK, Dennis EA. Group IV cytosolic phospholipase A2 mediates arachidonic acid release in H9c2 rat cardiomyocyte cells in response to hydrogen peroxide[J].
Prostaglandins Other Lipid Mediat, 2005, 78(1/4): 55-66.
|
| [19] |
Bihamta M, Hosseini A, Ghorbani A, et al. Protective effect of pomegranate seed oil against H2O2 - induced oxidative stress in cardiomyocytes[J].
Avicenna J Phytomed, 2017, 7(1): 46-53.
|
| [20] |
Goldhaber JI, Weiss JN. Oxygen free radicals and cardiac reperfusion abnormalities[J].
Hypertension, 1992, 20(1): 118-27.
DOI: 10.1161/01.HYP.20.1.118. |
| [21] |
Sabri A, Byron KL, Samarel AM, et al. Hydrogen peroxide activates mitogen- activated protein kinases and Na +- H + exchange in neonatal rat cardiac myocytes[J].
Circ Res, 1998, 82(10): 1053-62.
DOI: 10.1161/01.RES.82.10.1053. |
| [22] |
Wang HJ, Kang PF, Ye HW, et al. Effect of ALDH2 activation against myocardial ischemia/reperfusion injury in diabetic rat[J].
Zhongguo Ying Yong Sheng Li Xue Za Zhi, 2012, 28(2): 133-7.
|
| [23] |
Guo JM, Liu AJ, Zang P, et al. ALDH2 protects against stroke by clearing 4-HNE[J].
Cell Res, 2013, 23(7): 915-30.
DOI: 10.1038/cr.2013.69. |
| [24] |
Gomes KM, Campos JC, Bechara LR, et al. Aldehyde dehydrogenase 2 activation in heart failure restores mitochondrial function and improves ventricular function and remodelling[J].
Cardiovasc Res, 2014, 103(4): 498-508.
DOI: 10.1093/cvr/cvu125. |
| [25] |
Li SY, Gomelsky M, Duan J, et al. Overexpression of aldehyde dehydrogenase- 2 (ALDH2) transgene prevents acetaldehydeinduced cell injury in human umbilical vein endothelial cells: role of ERK and p38 mitogen- activated protein kinase[J].
Biol Chem, 2004, 279(12): 11244-52.
DOI: 10.1074/jbc.M308011200. |
| [26] |
Zhai X, Zhang Z, Liu W, et al. Protective effect of ALDH2 against cyclophosphamide- induced acute hepatotoxicity via attenuating oxidative stress and reactive aldehydes[J].
Biochem Biophys Res Commun, 2018, 499(1): 93-8.
DOI: 10.1016/j.bbrc.2018.03.041. |
| [27] |
徐丹令, 孙爱军, 王时俊, 等. 乙醛脱氢酶2在大鼠心肌缺氧损伤中的抗凋亡作用[J].
中国病理生理杂志, 2006, 22(4): 683-6.
DOI: 10.3321/j.issn:1000-4718.2006.04.014. |
| [28] |
Liu B, Zhang R, Wei S, et al. ALDH2 protects against alcoholic cardiomyopathy through a mechanism involving the p38MAPK/ CREB pathway and local renin- angiotensin system inhibition in cardiomyocytes[J].
Cardiol, 2018, 257(8): 150-9.
|
| [29] |
Gu X, Fang T, Kang P, et al. Effect of ALDH2 on high GlucoseInduced cardiac fibroblast oxidative stress, apoptosis, and fibrosis[J].
Oxid Med Cell Longev, 2017, 25(9): 9257967.
|
 2018, Vol. 38
2018, Vol. 38

