外泌体是指由细胞内多泡小体与细胞质膜融合并把其内含小泡分泌至细胞外的一类膜性生物小囊泡[1]。研究证实,外泌体广泛存在于血液、唾液、尿液、乳汁以及羊水等多种体液中,而且所有体外培养的细胞的培养上清中都含有外泌体[2]。外泌体可以携带宿主细胞特异或非特异性的内容物,除各类生长因子,细胞因子及脂质成分外,还含有mRNA、ncRNA、DNA等核酸物质并可将其靶向性地传递给受体细胞,因此,在细胞间信息的交流传递上,外泌体作为一种新型的途径扮演着重要的作用[3]。肿瘤细胞来源的外泌体是指来源于肿瘤细胞并向外分泌至肿瘤微环境中的外泌体,由于其包裹着肿瘤细胞所产生的特异性肿瘤调控相关的蛋白质、mRNA和ncRNA,并可将这些活性物质靶向性传递给间质细胞、内皮细胞、炎症细胞以及免疫细胞,通过影响受体细胞基因表型改变蛋白功能,达到促进肿瘤增殖、侵袭、转移以及免疫抑制等目的,以利于肿瘤的局部或远处转移[4-5]。现有的研究已经表明外泌体在肿瘤微环境调节、肿瘤细胞与正常细胞之间,以及肿瘤细胞与肿瘤细胞之间的信息交流中发挥着重要作用[6-7]。MAPK/ERK信号转导通路作为细胞内重要的促增殖及抗凋亡通路之一,通过影响下游细胞周期调节蛋白、凋亡相关蛋白等效应分子的活性,在肿瘤细胞恶性增殖方面中具有重要的作用[8]。
腺样囊性癌(ACC)作为唾液腺常见恶性肿瘤之一,其嗜神经、强侵袭并易入侵血管,造成血行转移的特性为临床治疗及预后评估带来巨大的困难[9],但是其中的具体机制尚未阐明。ACC来源的外泌体在ACC生长、侵袭及转移中的作用机制仍有待于研究。本研究主要探讨腺样囊性癌细胞株SACC-83来源的外泌体对自身分泌细胞增殖能力的影响,并分析其潜在机制,为进一步研究ACC来源的外泌体在ACC恶性生物学行为的调节作用奠定基础。
1 材料和方法 1.1 主要仪器与试剂DMEM培养基(Corning)、RPMI 1640培养基(Corning)、角质细胞培养基(KGM-Gold Keratinocyte Growth Medium)(Lonza),胎牛血清(fetal bovine serum,FBS)(Corning),双抗(青霉素100 U/mL,链霉素100 μg/mL)(Gibco),胰蛋白酶(Gibco),兔抗人CD9单克隆抗体(Abcam),兔抗人CD63单克隆抗体(Abcam),兔抗人TSG101单克隆抗体(Abcam),兔抗人ERK单克隆抗体(Abcam),兔抗人P-ERK单克隆抗体(Abcam),100 000超滤管(Millipore),Total Exosome Isolation Reagent(Invitrogen),Micro BCA Protein Assay Kit (Thermo Fisher),PKH67 Green Fluorescent Cell Linker Mini Kit (Sigma),Alexa Fluor®594 Phalloidin(molecular probe),MTT细胞增殖检测试剂盒(Thermo Fisher),共聚焦培养皿(NEST),FV10i激光扫描共聚焦显微镜(Olympus),65670贝克曼高速离心机(Beckman),Odyssey近红外成像系统(Licor)。
1.2 腺样囊性癌肿瘤细胞株SACC-83的传代培养复苏后的SACC-83细胞(该细胞株由中山大学孙逸仙纪念医院李劲松教授馈赠)用含10% FBS,100 U/mL青霉素和100 μg/mL链霉素的RPIM 1640培养基进行常规培养,待细胞生长稳定后,用无菌PBS洗涤细胞3遍,更换为无血清的KGM培养基常规培养,每72 h换液,收集培养上清用于外泌体的提取。
1.3 腺样囊性癌细胞SACC-83来源的外泌体的提取及透射电镜观察将收集的SACC-83细胞培养上清液在4 ℃下以300 g离心5 min,以去除死亡细胞,再行2000 g离心20 min,10 000 g离心30 min,以去除其他小囊泡;将离心后的上清液用100 000的超滤管进行浓缩,在得到的细胞上清浓缩液中,以2: 1比例加入Total Exosome Isolation Reagent (Invitrogen),4 ℃过夜,10 000 g离心60 min,将所得沉淀用PBS重悬,使用Micro BCA Protein Assay Kit进行定量。所得到的外泌体用2%磷钨酸负染后,滴于铜网上,置于透射电镜下观察(120 kV)。
1.4 SACC-83对自身来源的外泌体的摄取实验使用PKH67 Green Fluorescent Cell Linker Mini Kit,按照说明书对SACC-83来源的外泌体进行标记。将SACC-83以104/mL密度接种于共聚焦培养皿中,待细胞贴壁后,加入2 μg PKH67标记的外泌体。常规培养48 h后,吸弃培养液,细胞用PBS清洗2次;4%多聚甲醛固定10 min,PBS洗涤2~3次,10 min/次;1% Triton透化处理10 min,增加细胞通透性;然后PBS洗涤2~3次,10 min/次;加入1 mL1%BSA,孵育20~30 min,降低染色背景;滴加适宜浓度的Alexa Fluor®594 Phalloidin和DAPI对细胞骨架中的F-actin和细胞核进行染色;共聚焦显微镜下观察SACC-83对自身来源的外泌体的摄取情况。
1.5 MTT法检测细胞增殖能力取对数生长期的SACC-83细胞,常规胰酶消化制成单细胞悬液,以5×103/mL密度接种于96孔板中,每孔200 μL,使用RPMI 1640(含10%胎牛血清)培养基在37 ℃ 5% CO2培养箱中培养24 h;待细胞贴壁后,分别配置浓度为0、25、100 μg/mL的含外泌体的无血清RPMI 1640培养基;吸取板内培养基,PBS洗涤1次;每孔按组别分别加入配置好的含外泌体的无血清RPMI 1640培养基200 μL;以日为单位,连续7 d分别加入MTT染液(5 g/L)20 μL/孔,继续培养4 h后吸取上清,每孔加入150 μL DMSO,在振荡器上充分振荡混匀,用酶标仪检测吸光度A570 nm。每个孔至少重复3次;按所得A570 nm绘制细胞增殖曲线。
1.6 细胞划痕实验检测细胞增殖能力取对数生长期的SACC-83细胞,常规胰酶消化制成单细胞悬液,以2×104/mL密度接种于6孔板中;在37 ℃ 5% CO2培养箱中培养72 h后吸掉培养基,用1 mL灭菌一次性吸管划痕,PBS冲洗2次后加入RPMI 1640(含10%胎牛血清)培养基继续培养;实验组每孔加入含10 μg外泌体的RPMI 1640(含10%胎牛血清)培养基,对照组加入等量PBS,在同一观察位置,分别于0、12、24 h在显微镜下观察,采用ImageJ软件分析比较加入外泌体的SACC-83细胞与对照组的SACC-83细胞的划痕愈合情况。
1.7 Western blot取对数生长期的SACC-83细胞,常规胰酶消化制成单细胞悬液,以1×104/mL密度接种于6孔板中;实验组每孔加入含10 μg外泌体的RPMI 1640(含10%胎牛血清)培养基,对照组加入等量PBS,在37 ℃ 5% CO2培养箱中培养72 h;随后分别将提取所得的对照组SACC-83×3个孔(未经外泌体处理)、实验组SACC-83×3个孔(经外泌体处理)用含有蛋白酶抑制剂的RIPA裂解液裂解,提取总蛋白,用BCA法定量,每个样本以40 μg的总蛋白量进行SDS-PAGE电泳,将蛋白条带转移到硝酸纤维素膜上,5%脱脂奶粉-TBST封闭1 h之后,分别与1:1000稀释的兔抗人ERK多克隆抗体、兔抗人P-ERK多克隆抗体及兔抗人GAPDH多克隆抗体4 ℃孵育过夜。TBST洗涤3次,5 min/次。1: 15000稀释IRDye® 680RD羊抗兔荧光二抗室温避光孵育1 h,TBST洗涤3次,5 min/次。Odyssey近红外成像系统扫描成像。同理,将提取的SACC-83来源的外泌体用蛋白裂解液裂解后提取总蛋白并检测CD9、CD63及TSG101外泌体特异性蛋白。以上每个实验重复3次,并通过ImageJ软件进行蛋白条带灰度值分析。
1.8 统计学分析实验数据采用SPSS 19.0统计软件进行相关数据分析,两组间数据比较采用独立样本t检验,P < 0.05为差异有统计学意义。
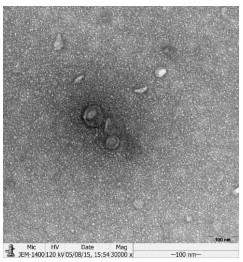
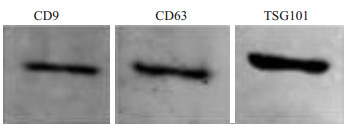
2 结果 2.1 外泌体的鉴定在透射电镜下,可以观察到从SACC-83培养上清中提取的微囊泡直径在30~100 nm之间(图 1),呈典型的“杯口状”结构,符合文献报道的外泌体的直径范围及形态特点。Western blot结果显示,该微囊泡表达外泌体标记物蛋白CD9,CD63和TSG101(图 2)。
|
图 1 透射电镜下观察到的来源于腺样囊性癌细胞株SACC-83的外泌体 Figure 1 A representative electron microscopic image of exosomes derived from SACC-83 cells. Scale bar=100 nm. |
|
图 2 Western blot鉴定外泌体标记物蛋白CD9、CD63和TSG101 Figure 2 Western blot analysis of exosomal markers CD9, CD63 and TSG101. |
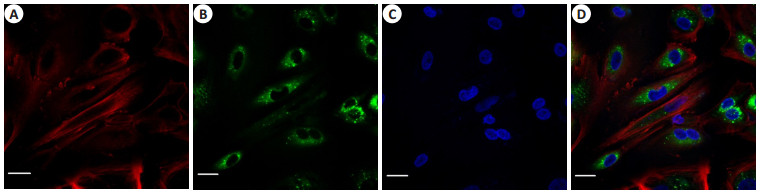
SACC-83来源的外泌体作用于自身72 h后,在激光扫描共聚焦显微镜下可观察到:被PKH67标记的,呈现绿色荧光的外泌体主要位于SACC-83的胞浆内,且主要分布在核周;而且几乎所有的细胞内都可观察到绿色荧光(图 3)。
|
图 3 共聚焦显微镜下观察SACC-83对自身来源的TDE的摄取 Figure 3 Confocal microscopy showing the uptake of PKH67-labeled (green) exosomes by SACC-83 cells after co-culture for 48 h (Original magnification: × 120). A: Alex Fluro594 phalloidin-labeled F-actin (red fluorescence); B: PKH67-labeled exosomes (green fluorescence); C: DAPI-labeled cell nuclei (blue fluorescence); D: Merge; Scale bar=50 nm. |
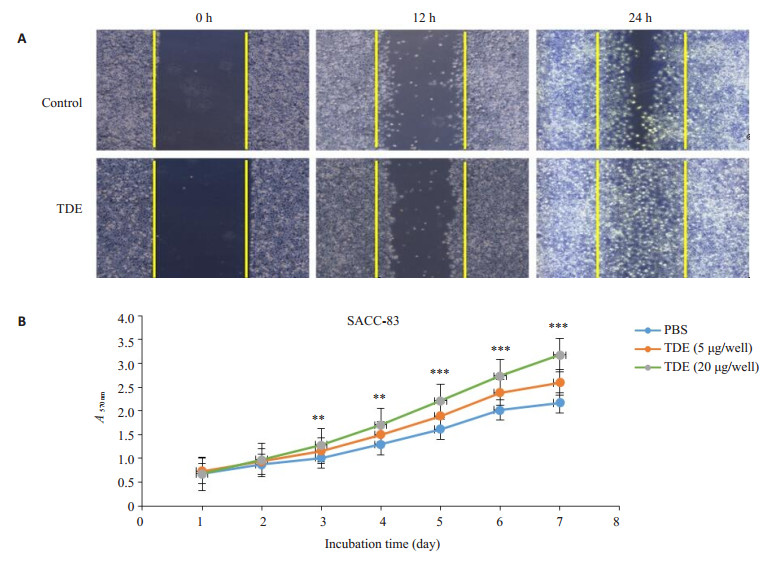
我们采用细胞划痕实验研究了SACC-83来源的外泌体对SACC-83细胞增殖迁移行为的影响,通过细胞划痕实验我们发现,外泌体处理的SACC-83细胞的迁移增殖能力明显高于对照组的SACC-83细胞(图 4A)。另外,经自身来源的外泌体作用72 h之后,采用MTT检测SACC-83细胞的增殖能力的变化情况,结果显示:随着时间推移对照组SACC-83的A570 nm较5 μg组及20 μg组显著降低。而在实验组的两组阳性分组中,20 μg组较5 μg组的A570 nm更高(P < 0.05,图 4B)。
|
图 4 SACC-83来源的外泌体促进自身肿瘤细胞的增殖能力 Figure 4 SACC-83-derived exosomes significantly promote proliferation of SACC-83 cells. A: Resuts of wound healing assay showing significantly enhanced migration ability of SACC-83 cells co-cultured with the exsomes; B: MTT assay showing significantly enhanced proliferation of SACC-83 cells co-cultured with different concentrations of exsomes. **P < 0.01, ***P < 0.001 vs PBS. |
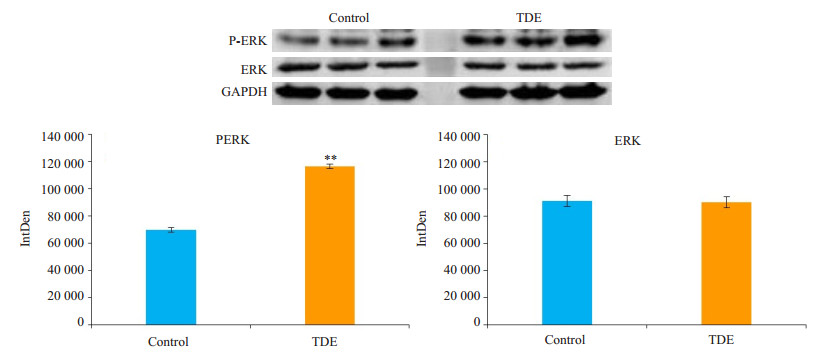
经自身来源的外泌体作用72 h之后,Western blot检测SACC-83细胞中ERK/P-ERK蛋白表达情况。外泌体作用之后,SACC-83中P-ERK的表达明显增高,而ERK的表达未见明显变化。采用Image J软件行蛋白条带灰度值测定后使用SPSS19.0统计软件比较两组数据发现,P-ERK实验组较对照组蛋白条带灰度值明显增加且具差异有统计学意义(P < 0.01),而ERK实验组与对照组蛋白条带灰度值差异无统计学意义(P > 0.05,图 5)。
|
图 5 SACC-83来源的外泌体诱导SACC-83中ERK活性增强 Figure 5 Expression of ERK and P-ERK in SACC-83 cell co-cultured with the exsomes detected by Western blotting. **P < 0.01. |
外泌体中除了包含脂质、蛋白质等物质之外,还携带有mRNA、ncRNA以及DNA等核酸物质,并且可以将其靶向性地传递给受体细胞,分别从转录前、转录后、蛋白的翻译等各个层面上对细胞生命代谢进行调控[10]。外泌体中的内容物不是随机进入囊泡,而是经过母体细胞精密调节、高度选择后的结果,并且携带有其来源母体细胞的特性[11-12]。外泌体能够将促进其生长、侵袭和转移的转录因子、细胞因子、生长因子等蛋白质以及mRNA和ncRNA传递给间质细胞、内皮细胞、炎症细胞和免疫细胞等受体细胞,在肿瘤微环境调节、肿瘤细胞与正常细胞之间,以及肿瘤细胞与肿瘤细胞之间的信息交流中发挥重要作用[13]。
目前常用的外泌体提取方法包括超速离心法、蔗糖浓度梯度离心法、免疫磁珠法、EXO试剂盒提取法等[14-15]。本研究中首先通过超速梯度离心法获取足量的外泌体样本。随后采用试剂盒提取法,于所获得的粗样本中特异性地提取实验所需的外泌体。这样的方法既缩短了离心时间又减少了提取试剂的使用量,所获得的微囊泡无论是量还是质都取得了良好的效果,经透射电镜观察和Western blot鉴定特异性蛋白证实为外泌体。
细胞的增殖与凋亡维持着体内组织器官的生长代谢平衡,对于肿瘤而言,肿瘤细胞毫无约束的生长,细胞凋亡作用的减弱往往是肿瘤快速发展的重要原因[16]。外泌体具有促进肿瘤细胞凋亡的作用。胰腺癌细胞株来源的外泌体可以通过线粒体途径促进正常细胞的凋亡[17]。另外,这种胰腺癌来源外泌体的抗细胞增殖作用的发生是由于降低了hes-1水平,以及激活PTEN和GSK-3b的功能而实现的[18]。还有研究发现小鼠乳腺癌模型中,正常乳腺细胞来源的外泌体可以导致肿瘤组织的坏死[19]。越来越多的研究将焦点放在了外泌体促进肿瘤及肿瘤微环境中细胞增殖能力的探讨上[20-22]。本研究为了明确SACC-83来源的外泌体对自身肿瘤细胞增殖能力的影响,首先将PKH67绿色荧光标记的外泌体与SACC-83共培养,通过荧光共聚焦显微镜观察发现SACC- 83可以摄取自身来源的外泌体,这表明了SACC-83为自身来源外泌体的靶细胞,也意味着腺样囊性癌肿瘤细胞可通过外泌体途径将促瘤因子传递给自身,改变自身基因表型,从而影响生物学功能。随后本研究通过MTT细胞增殖实验证实了经SACC-83来源的外泌体作用后,SACC-83的增殖能力明显增强;这提示了在腺样囊性癌肿瘤细胞恶性增殖的过程中,肿瘤细胞分泌的外泌体在其中扮演着“促进因子”的角色。因此结合本研究结果及文献报道可以发现,除了自分泌、旁分泌等机制之外,外泌体途径又为肿瘤的恶性生物学行为提供了新的研究视角。
为了深入研究外泌体促肿瘤细胞恶性增殖的潜在机制,本研究将焦点置于MAPK/ERK信号转导通路。MAPK/ERK信号转导通路是细胞内重要的促增殖及抗凋亡通路之一。研究证实,磷酸化激活的细胞外信号调节激酶(P-ERK)可以通过诱导细胞周期蛋白D1的表达,促进细胞周期G1期向S期的转换,加速细胞分裂增殖,从而导致肿瘤细胞增殖能力的增强[23];另一方面,PERK可以直接抑制细胞凋亡终末效应器caspase-3的活性,阻断各种刺激诱导的细胞凋亡过程;或通过活化抑凋亡分子如细胞凋亡蛋白抑制剂IAPs间接抑制caspase-3的活性,从而抑制肿瘤细胞的凋亡,促进肿瘤的进一步进展[24]。目前,MAPK/ERK信号通路在人类肝细胞癌、胰腺癌、胶质瘤、非小细胞肺癌等恶性肿瘤中被证实具有促进肿瘤细胞增殖,抑制细胞凋亡的作用[25-28]。有研究表明,口腔鳞状细胞癌细胞及涎腺腺样囊性癌细胞等恶性肿瘤分泌的外泌体能够被自身肿瘤细胞摄取[29],并且还可通过激活PI3K/Akt,MAPK/ERK以及JNK-1/2信号转导通路来促进肿瘤细胞的增殖、迁移以及侵袭能力[30]。胃癌SGC7901细胞来源的外泌体可以通过激活其分泌细胞中的MAPK/ERK信号转导通路来促进肿瘤细胞的增殖能力[8]。以上实验结果提示我们,经肿瘤细胞分泌的外泌体途径导致MAPK/ERK信号通路的激活在肿瘤细胞的恶性增殖中具有重要的作用;为此我们在证实了SACC-83来源的外泌体可以促进自身肿瘤细胞的增殖后,进一步推断外泌体的这种促恶性增殖作用中存在着MAPK/ERK信号通路的参与。Western blot结果证实经自身来源的外泌体作用后,SACC-83内P-ERK蛋白的表达量显著增高,且蛋白条带灰度值分析实验组较对照组显著增高且差异具有统计学意义(P < 0.05);而ERK蛋白的表达未见明显变化,蛋白条带灰度值分析实验组与对照组间差异无统计学意义(P > 0.05)。这提示SACC-83来源的外泌体不仅具有促进自身肿瘤细胞增殖的能力,同时可以上调P-ERK的表达量,而ERK的活化导致的MAPK/ERK信号转导通路的激活可能是外泌体促腺样囊性癌增殖能力的潜在机制之一。但是外泌体诱导SACC-83内ERK活化的具体机制尚不明了,是通过miRNA基因调控亦或是其他转录因子的调控尚未可知,有待于进一步地深入研究。
| [1] |
Colombo M, Raposo G, Théry C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles[J].
Annu Rev Cell Dev Biol, 2014, 30(3): 255-89.
|
| [2] |
Salido-Guadarrama I, Romero-Cordoba S, Peralta-Zaragoza O, et al. MicroRNAs transported by exosomes in body fluids as mediators of intercellular communication in cancer[J].
Onco Targets Ther, 2014, 7(3): 1327-38.
|
| [3] |
Zhang J, Li S, Li L, et al. Exosome and exosomal microRNA: trafficking, sorting, and function[J].
Genomics Proteomics Bioinformatics, 2015, 13(1): 17-24.
DOI: 10.1016/j.gpb.2015.02.001. |
| [4] |
Milane L, Singh A, Mattheolabakis G, et al. Exosome mediated communication within the tumor microenvironment[J].
J Control Release, 2015, 219(12): 278-94.
|
| [5] |
Webber J, Yeung V, Clayton A. Extracellular vesicles as modulators of the cancer microenvironment[J].
Semin Cell Dev Biol, 2015, 40(6): 27-34.
|
| [6] |
Qu JL, Qu XJ, Zhao MF, et al. Gastric Cancer exosomes promote tumour cell proliferation through PI3K/Akt and MAPK/ERK activation[J].
Dig Liver Dis, 2009, 41(12): 875-80.
DOI: 10.1016/j.dld.2009.04.006. |
| [7] |
Martins VR, Dias MS, Hainaut P. Tumor-cell-derived microvesicles as carriers of molecular information in cancer[J].
Curr Opin Oncol, 2013, 25(1): 66-75.
DOI: 10.1097/CCO.0b013e32835b7c81. |
| [8] |
Tkach M, Théry C. Communication by extracellular vesicles: where we are and where we need to go[J].
Cell, 2016, 164(6): 1226-32.
DOI: 10.1016/j.cell.2016.01.043. |
| [9] |
Khan AJ, Digiovanna MP, Ross DA, et al. Adenoid cystic carcinoma: a retrospective clinical review[J].
Int J Cancer, 2001, 96(3): 149-58.
DOI: 10.1002/(ISSN)1097-0215. |
| [10] |
Sun CK, Man K, Ng KT, et al. Proline-rich tyrosine kinase 2 (Pyk2) promotes proliferation and invasiveness of hepatocellular carcinoma cells through c-Src/ERK activation[J].
Carcinogenesis, 2008, 29(11): 2096-105.
DOI: 10.1093/carcin/bgn203. |
| [11] |
Keller S, Sanderson MP, Stoeck A, et al. Exosomes: from biogenesis and secretion to biological function[J].
Immunol Lett, 2006, 107(2): 102-8.
DOI: 10.1016/j.imlet.2006.09.005. |
| [12] |
Skog J, Würdinger T, van Rijn S, et al. Glioblastoma microvesicles transport RNA and proteins that promote tumour growth and provide diagnostic biomarkers[J].
Nat Cell Biol, 2008, 10(12): 1470-6.
DOI: 10.1038/ncb1800. |
| [13] |
Valadi H, Ekström K, Bossios A, et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells[J].
Nat Cell Biol, 2007, 9(6): 654-9.
DOI: 10.1038/ncb1596. |
| [14] |
Pigati L, Yaddanapudi SC, Iyengar R, et al. Selective release of microRNA species from normal and malignant mammary epithelial cells[J].
PLoS One, 2010, 5(10): e13515.
DOI: 10.1371/journal.pone.0013515. |
| [15] |
宋梦阳, 杨小军, 侯晋, 等. 人正常唾液腺上皮细胞摄取腺样囊性癌细胞来源的外泌体的实验研究[J].
中国口腔颌面外科杂志, 2016, 14(2): 106-10.
|
| [16] |
Théry C, Amigorena S, Raposo G, et al. Isolation and characterization of exosomes from cell culture supernatants and biological fluids[J].
Curr Protoc Cell Biol, 2006, Chapter(3): Unit 3.22.
|
| [17] |
Rahman MA, Barger JF, Lovat F, et al. Lung Cancer exosomes as drivers of epithelial mesenchymal transition[J].
Oncotarget, 2016, 7(34): 54852-66.
|
| [18] |
Oeste CL, Pinar M, Schink KO, et al. An isoprenylation and palmitoylation motif promotes intraluminal vesicle delivery of proteins in cells from distant species[J].
PLoS One, 2014, 9(9): e107190.
DOI: 10.1371/journal.pone.0107190. |
| [19] |
Bryant RJ, Pawlowski T, Catto JW, et al. Changes in circulating microRNA levels associated with prostate cancer[J].
Br J Cancer, 2012, 106(4): 768-74.
DOI: 10.1038/bjc.2011.595. |
| [20] |
Yang JK, Yang JP, Tong J, et al. Exosomal miR-221 targets DNM3 to induce tumor progression and temozolomide resistance in glioma[J].
J Neurooncol, 2017, 131(2): 255-65.
DOI: 10.1007/s11060-016-2308-5. |
| [21] |
Richards KE, Zeleniak AE, Fishel ML, et al. Cancer-associated fibroblast exosomes regulate survival and proliferation of pancreatic cancer cells[J].
Oncogene, 2017, 36(13): 1770-8.
DOI: 10.1038/onc.2016.353. |
| [22] |
Chambard JC, Lefloch R, Pouysségur J, et al. ERK implication in cell cycle regulation[J].
Biochim Biophys Acta, 2007, 1773(8): 1299-310.
DOI: 10.1016/j.bbamcr.2006.11.010. |
| [23] |
Mccubrey JA, Steelman LS, Chappell WH, et al. Roles of the Raf/ MEK/ERK pathway in cell growth, malignant transformation and drug resistance[J].
Biochim Biophys Acta, 2007, 1773(8): 1263-84.
DOI: 10.1016/j.bbamcr.2006.10.001. |
| [24] |
Lugini L, Valtieri M, Federici C, et al. Exosomes from human colorectal cancer induce a tumor-like behavior in colonic mesenchymal stromal cells[J].
Oncotarget, 2016, 7(31): 50086-98.
|
| [25] |
Dai R, Chen R, Li H. Cross-talk between PI3K/Akt and MEK/ERK pathways mediates endoplasmic reticulum stress-induced cell cycle progression and cell death in human hepatocellular carcinoma cells[J].
Int J Oncol, 2009, 34(6): 1749-57.
|
| [26] |
Zhang T, Li Y, Zhu Z, et al. MEK inhibition potentiates the activity of Hsp90 inhibitor 17-AAG against pancreatic cancer cells[J].
Mol Pharm, 2010, 7(5): 1576-84.
DOI: 10.1021/mp900321a. |
| [27] |
Glassmann A, Reichmann K, Scheffler B, et al. Pharmacological targeting of the constitutively activated MEK/MAPK-dependent signaling pathway in glioma cells inhibits cell proliferation and migration[J].
Int J Oncol, 2011, 39(6): 1567-75.
|
| [28] |
Zou ZQ, Zhang LN, Wang F, et al. The novel dual PI3K/mTOR inhibitor GDC-0941 synergizes with the MEK inhibitor U0126 in non-small cell lung cancer cells[J].
Mol Med Rep, 2012, 5(2): 503-8.
|
| [29] |
Hou J, Wang F, Liu X, et al. Tumor-derived exosomes enhance invasion and metastasis of salivary adenoid cystic carcinoma cells[J].
J Oral Pathol Med, 2018, 47(2): 144-51.
DOI: 10.1111/jop.2018.47.issue-2. |
| [30] |
Sento S, Sasabe E, Yamamoto T. Application of a persistent heparin treatment inhibits the malignant potential of oral squamous carcinoma cells induced by tumor cell-derived exosomes[J].
PLoS One, 2016, 11(2): e0148454.
DOI: 10.1371/journal.pone.0148454. |
 2018, Vol. 38
2018, Vol. 38

