2. 嘉应学院医学院临床微生物学与免疫学实验室,广东 梅州 514015
2. Clinical Microbiology and Immunology Laboratory, Medical College, Jiaying University, Meizhou 514015, China
DNA双链断裂(DSBs)是一种严重致死的DNA损伤类型,因此DNA损伤修复是生命科学中的一个重大课题。细胞内的代谢产物以及细胞外的毒性因子的刺激都会造成DNA损伤,通常情况下,DNA损伤通过细胞内的修复系统加以修复,以维护细胞基因组DNA的遗传稳定性[1-2],但当DNA损伤不能及时或准确地修复,就会导致基因突变、引起细胞死亡或肿瘤的发生。DNA损伤修复系统功能增强会使肿瘤细胞对化疗药产生拮抗,导致化疗失败[3]。放化疗抵抗是结直肠癌等癌症治疗失败、肿瘤复发的主要原因[4-5]。顺铂耐药的机制涉及多个方面,如DNA损伤修复、表观遗传、药物代谢及药物诱导凋亡等机制[6-10],但其确切耐药机制仍不完全清楚。
Folkma[11]提出血管生成对肿瘤的发生、发展、转移起重要作用,最早提出通过抑制新生血管的形成从而达到治疗肿瘤的概念。抗血管生成疗法是通过限制肿瘤获得氧供应和营养物质而使肿瘤“饿死”,从而抑制肿瘤生长和转移的能力[11],抗血管生成成为肿瘤治疗的新靶点。AGGF1是2004年新被发现的具有促组织血管生成能力的因子,AGGF1编码的蛋白质有两个功能结构域:G-patch结构域和FHA结构域[12]。近几年研究表明,AGGF1与多种肿瘤的发生发展密切相关,研究大多侧重AGGF1的促血管生成能力[13-15]。研究表明包含FHA结构域的蛋白在细胞周期检验点调控和DNA损伤修复过程中起重要作用[16]。目前,国内外尚未见其与结直肠癌细胞DNA损伤修复及放化疗关系的相关报道。
本研究利用顺铂处理HCT116细胞建立DNA损伤模型,检测AGGF1在DNA损伤反应中的表达情况,研究结直肠癌细胞DNA损伤修复及化疗敏感性的变化;并检测DNA损伤修复关键蛋白NBS1磷酸化水平,初步探讨AGGF1在结直肠癌细胞DNA损伤修复中的作用机制。
1 材料和方法 1.1 材料 1.1.1 细胞系结直肠癌HCT116细胞系购于中国典型培养物保藏中心(中国,武汉)。
1.1.2 主要试剂抗人组蛋白H2AX兔源多克隆抗体(Proteintech),磷酸化组蛋白H2AX(γH2AX, Cell Signaling Technology),AGGF1抗体(三鹰生物),NBS1、pNBS1抗体(Cell Signaling Technology),顺铂(DDP)、Hochest 33342(Sigma Aldrich),增殖试剂盒CellTiter 96® AQueous One Solution Cell Proliferation Assay(a)(Millipore),RPMI 1640培养基、胎牛血清(GIBCO),细胞转染试剂Lipofectamine™2000、Opti-MEM无血清培养基(Invitrogen)。
1.2 方法 1.2.1 细胞培养与siRNA转染结直肠癌细胞HCT116用DMEM培养基加10%胎牛血清培养,培养在37 ℃含5% CO2的细胞培养箱中。细胞以3×105/孔的密度接种于6孔板。当细胞生长密度达到50%~60%时,用脂质体Lipofectamine 2000(Gibco)分别转染siAGGF1与siNC(siNegative Control)(广州锐博),具体操作按试剂说明书进行。
1.2.2 Western blot实验检测蛋白表达6孔板中的细胞每孔加200 μL细胞裂解液(P0013,碧云天生物),裂解后用细胞刮将细胞收集,离心弃沉淀,上清加loading buffer煮样;制备SDS-PAGE凝胶,按照每孔40 μg的总蛋白量上样,电泳分离蛋白后转印至PVDF膜上,用5% BSA封闭液室温缓慢摇动2 h或者4 ℃过夜;弃去封闭液,TBST溶液洗3次,每次10 min,AGGF1抗体按照1:2000比例稀释,室温孵育2 h或4 ℃过夜,TBST溶液洗膜3次,每次10 min,加入二抗,室温下孵育2 h,TBST洗膜后用ECL solution显影液显色,Chemi Doc XRS(Bio-Rad)检测信号,Quantity One(Bio-Rad)软件分析结果。
1.2.3 细胞增殖检测检测顺铂对细胞增殖的影响,转染前取生长状况良好的细胞,0.25%胰酶消化后,细胞计数,以5000个细胞每孔的密度铺到96孔板上,37 ℃,5% CO2的细胞培养箱中培养24 h后转染,转染48 h后进行损伤处理,2组细胞分别进行空白处理及不同剂量(0、25、50、100、150、200、400 nmol/L)的顺铂药物刺激处理,参照Tayyaba Afsar[17]每组处理设置3个复孔,待对照孔细胞长满后,弃去培养基,每孔加20 μL CellTiter 96® AQueous One Solution Reagent(Promega),继续培养1~ 4 h,490 nm读取吸光度值,进行3次独立重复试验。
1.2.4 免疫荧光及共聚焦显微镜观察将适当密度的细胞铺在特定的chamber中,药物处理细胞后,在不同修复时间用10%甲醛室温固定细胞10 min,固定后用PBS洗3次,每次10 min。0.5% Triton X-100室温透化5 min,PBS洗3次。封闭血清封闭30min,去除非染色质结合的蛋白质,10%血清室温封闭1 h,PBS洗3次。一抗4 ℃作用过夜,PBS洗3次,每次10 min。二抗室温避光孵育1 h,PBS洗3次。激光共聚焦显微镜拍照观察。
1.2.5 免疫组化染色选取嘉应学院附属医院病理科确诊的70例患者石蜡包埋组织样本。将70例结直肠癌组织及癌旁组织样本按照6 μm厚度连续切片3张,低温烤干后,采用辣根-过氧化酶连接法对组织进行免疫组化实验检测,运用DAB二氨基联苯胺显色试剂盒显色(购于北京中杉金桥)。染色后采用双盲法阅片,组织细胞中出现明显的棕黄色为阳性。
1.2.6 统计学分析所有试验数据至少重复3次,3次试验的平均值±标准差得出结果。所有数据用GraphPad Prism软件分析后作图,Student's t-test来比较不同试验组中的差异显著性分析。计数资料采用χ2检验分析。P < 0.05表示差异有统计学意义。
2 结果 2.1 AGGF1在顺铂处理的细胞中表达下调用100 nmol/L顺铂处理HCT116细胞4 h,建立诱导DNA损伤模型。Western blot检测结果显示,与对照组相比,AGGF1在诱导损伤的细胞中表达下调(图 1A上,下为相对定量结果)。并且随着诱导时间的增加,AGGF1逐渐下调(图 1),提示AGGF1可能在顺铂诱导的DNA损伤反应过程中发挥重要作用。
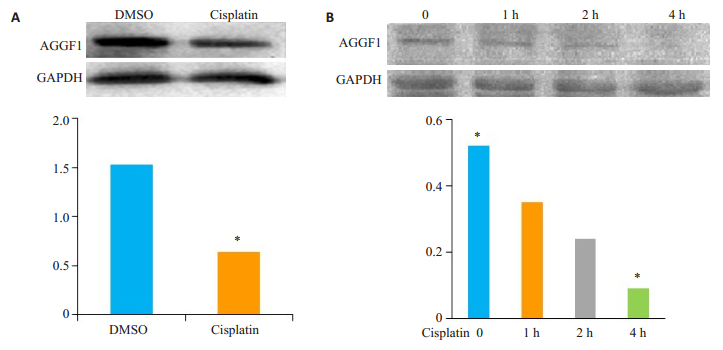
|
图 1 Western blot检测顺铂处理的结直肠癌细胞AGGF1蛋白表达情况 Figure 1 Western blot analysis of AGGF1 expression in HCT116 cells in response to Cisplatin treatment. A: AGGF1 protein expression was downregulated after treated with Cisplatin; B: HCT116 cells treated with Cisplatin for 0, 1, 2 or 4 h. *P < 0.05. |
Western blot实验结果显示,DNA损伤分子标记物γH2AX蛋白在处理的HCT116细胞组中表达水平显著高于对照组,细胞内磷酸化NBS1表达受到抑制(图 2)。
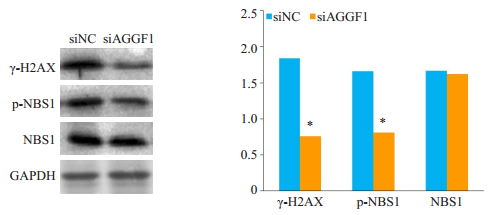
|
图 2 Western blot检测siAGGF1对γH2AX和NBS1蛋白表达的影响 Figure 2 Western blot analysis showing suppressed phosphorylation of γH2AX and NBS1 in HCT116 cells transfected with siAGGF1 for 48 h. *P < 0.05 vs siNC. |
细胞增殖实验结果显示,干扰AGGF1后HCT116细胞对顺铂的药物敏感性显著高于对照组,差异有统计学意义(*P < 0.05,**P < 0.01,图 3)。
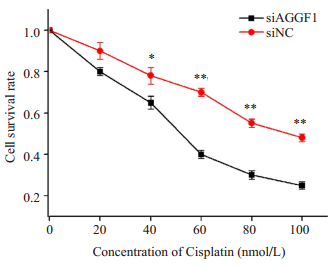
|
图 3 抑制AGGF1对结直肠癌细胞HCT116化疗敏感性的影响 Figure 3 Down-regulation of AGGF1 increased the chemosensitivity of HCT116 cells. *P < 0.05, **P < 0.01 vs siNC. |
免疫荧光检测检测AGGF1和γH2AX灶点的结果(图 4)显示,AGGF1与γH2AX共定位在核内。
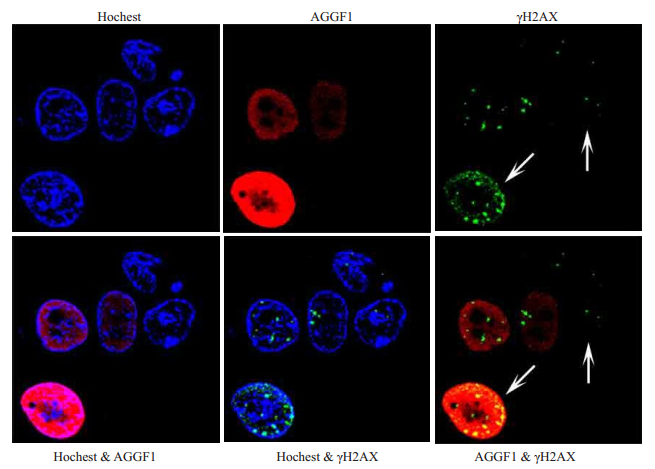
|
图 4 AGGF1募集到DNA损伤位点 Figure 4 Immunofluorescence staining of AGGF1 and γH2AX expressions in HCT116 cells treated with Cisplatin for 4 h. Hochest 33342 was used for nuclear staining. Arrow means recruitment of phosphorylated γH2AX and AGGF1. |
AGGF1蛋白在70例结直肠癌样本组织中表达高于癌旁正常组织,具有统计学差异(图 5,表 1)。AGGF1在结直肠癌组织中主要定位于细胞质。
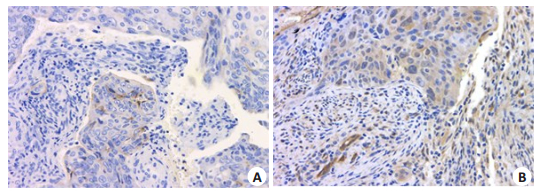
|
图 5 AGGF1在结直肠癌组织及癌旁组织中的免疫组化染色结果 Figure 5 Immunohistochemical staining of AGGF1 in human colon cancer tissues (Original magnification: ×200). A: Paired adjacent tissue; B: Colon cancer tissue. |
| 表 1 AGGF1在结直肠癌组织和癌旁正常组织中的表达 Table 1 Expression of AGGF1 in colon cancer tissues and adjacent tissues (n=70) |
DNA损伤发生后,高等真核生物细胞已进化出一整套精密的DNA损伤应答机制,能够及时检测和修复损伤的DNA,维持基因组的稳定性[1-2]。H2AX是参与DNA损伤应答较早期的蛋白,可在DNA发生损伤后被迅速募集到损伤位点,其139位丝氨酸被ATM/ATR等激酶磷酸化为γH2AX[18-19]。因此γH2AX是检测细胞DSBs的敏感而有效的指标[20-22]。本研究主要对AGGF1在DNA损伤发生后被快速地募集至损伤位点这一有趣的现象进行了研究,接下来我们将在其它结直肠癌细胞中进一步加以验证,以期为DSB同源重组修复提供重要线索。为深入研究AGGF1促进DNA损伤修复的分子机制提供基础。同时,我们发现AGGF1在结直肠癌中高表达,可能与肿瘤的恶性表型呈正相关,需要收集更多样本进行分析与检测,因此本研究结论能够为结直肠癌的筛查和基因治疗等方面提供科学依据。AGGF1基因首先是在对先天性静脉畸形骨肥大综合征的分子遗传学中发现的,是首个被克隆的KTS致病基因[12]。已证实AGGF1表达异常是KTS发生的重要原因。体外原核表达纯化的AGGF1蛋白表现出和血管内皮生长因子一样的功能,能够强烈促进血管新生[12]。一直以来对AGGF1的研究大多集中在促血管新生和心血管系统方面[14, 23-24]。近年来,其在肿瘤中的作用研究也逐渐增多[15, 25-26]。关于AGGF1参与DNA的损伤修复目前尚无报道。本研究在以顺铂作为DNA损伤剂的作用下发现DNA损伤应答的生物学效应发生了显著改变,下调AGGF1表达后能显著抑制DNA损伤修复相关蛋白NBS1的磷酸化活性,由此我们认为,AGGF1可能通过促进NBS1的磷酸化,进而促进结直肠癌细胞DNA的损伤修复能力。然而,AGGF1参与DNA损伤修复的具体机制和AGGF1在其它结直肠癌细胞中是否也存在相同的作用?需要进一步深入研究。
肿瘤耐药是由多因素多因子参与的,任何一种机制都不可能完全解释肿瘤耐药现象的发生。Tang[27]报道DNA损伤修复功能异常是顺铂耐药的主要机制之一。本研究结果进一步证实了AGGF1可能通过调节DNA损伤修复影响肿瘤细胞对化疗药物的敏感性。提示通过检测AGGF1的表达水平可以预测结直肠癌患者对化疗的疗效反应和作为干预结直肠癌化疗抵抗的重要靶点。靶向AGGF1并联合化疗这一新的策略为常规化疗不敏感的结直肠癌患者提供了新的方向。同时,蛋白质印迹结果显示,干扰AGGF1能显著抑制DNA修复关键蛋白NBS1的磷酸化表达。NBS1是激活DNA损伤修复信号传导的关键因子,在维持基因组的稳定和DNA损伤修复过程中起着重要的作用[28]。因此我们认为,AGGF1可能通过促进NBS1蛋白的磷酸化,进而促进结直肠癌细胞DNA的损伤修复能力。
综上所述,本研究首次揭示了血管生成因子AGGF1的另一功能,即在顺铂诱导的DNA损伤模型中通过调控NBS1的表达促进结直肠癌细胞的DNA损伤修复,最终影响癌细胞对顺铂类药物的敏感性。
| [1] |
Rouse J, Jackson SP. Interfaces between the detection, signaling, and repair of DNA damage[J].
Science, 2002, 297(5581): 547-51.
DOI: 10.1126/science.1074740. |
| [2] |
Bakkenist CJ, Kastan MB. DNA damage activates ATM through intermolecular autophosphorylation and dimer dissociation[J].
Nature, 2003, 421(6922): 499-506.
DOI: 10.1038/nature01368. |
| [3] |
Simon GR, Sharma S, Cantor A, et al. ERCC1 expression is a predictor of survival in resected patients with non-small cell lung cancer[J].
Chest, 2005, 127(3): 978-83.
DOI: 10.1378/chest.127.3.978. |
| [4] |
Jackson SP, Bartek J. The DNA-damage response in human biology and disease[J].
Nature, 2009, 461: 1071-8.
DOI: 10.1038/nature08467. |
| [5] |
Zhou BB, Elledge SJ. The DNA damage response: putting checkpoints in perspective[J].
Nature, 2000, 408(6811): 433-9.
DOI: 10.1038/35044005. |
| [6] |
Siddik ZH. Cisplatin: mode of cytotoxic action and molecular basis of resistance[J].
Oncogene, 2003, 22(47): 7265-79.
DOI: 10.1038/sj.onc.1206933. |
| [7] |
Fan XS, Cao FY, Li KZ. Silencing MSH3 expression enhances cisplatin sensitivity of human tongue cancer cells[J].
Nan Fang Yi Ke Da Xue Xue Bao, 2016, 36(8): 1080-4.
|
| [8] |
Roberti A, La Sala D, Cinti C. Multiple genetic and epigenetic interacting mechanisms' contribute to clonally selection of drugresistant tumors: Current views and new therapeutic prospective[J].
J Cell Physiol, 2006, 207(3): 571-81.
DOI: 10.1002/(ISSN)1097-4652. |
| [9] |
Iwasa Y, Nowak MA, Michor F. Evolution of resistance during clonal expansion[J].
Genetics, 2006, 172: 2557-66.
|
| [10] |
Yu W, Jin C, Lou X, et al. Global analysis of DNA methylation by Methyl-Capture sequencing reveals epigenetic control of cisplatin resistance in ovarian cancer cell[J].
PLoS One, 2011, 6(12): e29450.
DOI: 10.1371/journal.pone.0029450. |
| [11] |
Folkman J. Angiogenesis in cancer, vascular, rheumatoid and other disease[J].
Nat Med, 1995, 1(1): 27-31.
DOI: 10.1038/nm0195-27. |
| [12] |
Tian XL, Kadaba R, You S, et al. Identification of an angiogenic factor that when mutated causes susceptibility to Klippel-Trenaunay syndrome[J].
Nature, 2004, 427(6975): 640-5.
DOI: 10.1038/nature02320. |
| [13] |
Smolka MB, Chen SH, Maddox PS, et al. An FHA domain-mediated protein interaction network of Rad53 reveals its role in polarized cell growth[J].
J Cell Biol, 2006, 175(5): 743-53.
DOI: 10.1083/jcb.200605081. |
| [14] |
Chen D, Li L, Tu X, et al. Functional characterization of Klippel Trenaunay syndrome gene AGGF1 identifies a novel angiogenic signaling pathway for specification of vein differentiation and angiogenesis during embryogenesis[J].
Hum Mol Genet, 2013, 22(5): 963-76.
DOI: 10.1093/hmg/dds501. |
| [15] |
Lu QL, Yao YF, Hu ZK, et al. Angiogenic factor AGGF1 activates autophagy with an essential role in therapeutic angiogenesis for heart disease[J].
PLoS Biol, 2016, 14(8): e1002529.
DOI: 10.1371/journal.pbio.1002529. |
| [16] |
Wang W, Li GY, Zhu JY, et al. Overexpression of AGGF1 is correlated with angiogenesis and poor prognosis of hepatocellular carcinoma[J].
Med Oncol, 2015, 32(4): 131.
DOI: 10.1007/s12032-015-0574-2. |
| [17] |
Afsar T, Razak S, Khan MR, et al. Acacia hydaspica ethyl acetate extract protects against cisplatin-induced DNA damage, oxidative stress and testicular injuries in adult male rats[J].
BMC Cancer, 2017, 17(1): 883.
DOI: 10.1186/s12885-017-3898-9. |
| [18] |
Löbrich M, Shibata A, Beucher A, et al. gammaH2AX foci analysis for monitoring DNA double-strand break repair: strengths, limitations and optimization[J].
Cell Cycle, 2010, 9(4): 662-9.
DOI: 10.4161/cc.9.4.10764. |
| [19] |
Meyer B, Voss KO, Tobias F, et al. Clustered DNA damage induces pan-nuclear H2AX phosphorylation mediated by ATM and DNA-PK[J].
NucleicAcids Res, 2013, 41(12): 6109-18.
DOI: 10.1093/nar/gkt304. |
| [20] |
Goodarzi AA, Jeggo PA. Irradiation induced foci (IRIF) as a biomarker for radiosensitivity[J].
Mutat Res, 2012, 736(1/2): 39-47.
|
| [21] |
Mariotti LG, Pirovano G, Savage KI, et al. Use of the gamma-H2AX assay to investigate DNA repair dynamics following multiple radiation exposures[J].
PLoS One, 2013, 8(11): e79541.
DOI: 10.1371/journal.pone.0079541. |
| [22] |
Mah LJ, El-Osta A, Karagiannis TC. Gamma H2AX: a sensitive molecular marker of DNA damage and repair[J].
Leukemia, 2010, 24(4): 679-86.
DOI: 10.1038/leu.2010.6. |
| [23] |
Hu FY, Wu C, Li Y, et al. AGGF1 is a novel anti-inflammatory factor associated with TNF-alpha-induced endothelial activation[J].
Cell Signal, 2013, 25(8): 1645-53.
DOI: 10.1016/j.cellsig.2013.04.007. |
| [24] |
Li L, Chen D, Li J, et al. Aggf1 acts at the top of the genetic regulatory hierarchy in specification of hemangioblasts in zebrafish[J].
Blood, 2014, 123(4): 501-8.
DOI: 10.1182/blood-2013-07-514612. |
| [25] |
Xu Y, Zhou M, Wang JJ, et al. Role of microRNA-27a in downregulation of angiogenic factor AGGF1 under hypoxia associated with high-grade bladder urothelial carcinoma[J].
Biochim Biophy Acta, 2014, 1842(5): 712-25.
DOI: 10.1016/j.bbadis.2014.01.007. |
| [26] |
Yao HH, Wang BJ, Wu Y, et al. High expression of angiogenic factor with G-Patch and FHA domain1 (AGGF1) predicts poor prognosis in gastric cancer[J].
Med Sci Monit, 2017, 23: 1286-94.
DOI: 10.12659/MSM.903248. |
| [27] |
Tang CL, Yang HP, Zhou XD. Advances of DNA damage repair and cisplatin resistance mechanisms in lung cancer[J].
Chin J Lung Cancer, 2011, 14: 12.
|
| [28] |
Williams RS, Dodson GE, Limbo O, et al. Nbs1 flexibly tethers Ctp1 and Mre11-Rad50 to coordinate DNA Double-Strand break processing and repair[J].
Cell, 2009, 139(1): 87-99.
DOI: 10.1016/j.cell.2009.07.033. |
 2018, Vol. 38
2018, Vol. 38

