2. 浙江中医药大学 中医药科学院,浙江 杭州 310053;
3. 宁波市第二医院乳腺外科,浙江 宁波 315010
2. Academy of Chinese Medical Sciences, Zhejiang Chinese Medical University, Hangzhou 310053, China;
3. Department of Breast Surgery, Ningbo Second Hospital, Ningbo 315010, China
我国乳腺癌发病率逐年升高,2015年我国新增乳腺癌女性超过26万人,占女性癌症15%[1]。肿瘤机体的粒系血象异常与HSC分化异常有关[2-3]。造血干细胞分化理论认为,HSC分化异常致其不能定向分化为嗜碱性粒细胞(BASO)、EO和NEUT等血液系统及免疫系统中的各类成熟细胞[3],继而出现血象异常、免疫紊乱。然而,引起乳腺癌机体HSC分化异常的具体机制尚不明确。有研究显示,肿瘤分泌的TGF-β作为重要的细胞因子,对正常机体的HSC的增殖、分化有不同程度的影响[4]。基于此,我们推测,TGF-β通过影响乳腺癌机体HSC的分化导致外周血象粒系分布异常。本课题组前期发现乳腺癌小鼠存在明显的粒系细胞分布异常[5]。因此,本研究从TGF-β对肿瘤机体的HSC分化是否存在矛盾转化作用的角度探讨临床乳腺癌患者出现粒系血象异常的原因,有望为乳腺癌血象异常的治疗提供新的有价值的理论依据或思路。
1 资料和方法 1.1 纳入标准收集2013年1月至2016年6月宁波市第二人民医院乳腺外科52例乳腺癌女性(29~77岁,中位年龄53.5岁)和体检中心47例健康女性(29~73岁,中位年龄53岁)进行病例-对照研究。入选标准:首次确诊为乳腺癌,病理报告证实为浸润性导管乳腺癌,未行手术、放化疗及其他药物治疗,2月内未行其他手术,无创伤、烧伤,无急性或慢性炎症,无血液系统疾病、甲亢、类风湿、糖尿病等自身免疫性疾病及类固醇药物治疗史,具备完整临床资料(现病史、家族史、个人史、体格检查等)和相应检查资料。
1.2 排除标准血液学资料缺失、合并其他严重疾病或感染、妊娠期妇女,有固醇药物治疗史、近期有手术、放化疗经历或有多发肿瘤者。所有患者统一在早晨8:00~8:30采集外周静脉血,统一采用EDTA抗凝。科室专家对陈某的病理资料讨论分析后一致认为其处于Ⅱ级与Ⅲ级之间,Ⅰ级患者仅1位,无统计学意义,排除此2位患者后,共对50位患者进行组织学分级的分析讨论。所有研究对象均自愿签署知情同意书,本研究经宁波第二人民医院伦理委员会审核批准。
1.3 分析方法病理类型采用WHO分类标准,临床病理分期采用UICC与AJCC共同制定的TNM分期标准。临床分期为ⅠA(n=15)、ⅡA(n=11)、ⅡB(n=15)、ⅢA(n=6)、ⅢC(n=5),组织学分级参考《新编常见恶性肿瘤诊治规范:乳腺癌分册》。血常规测试采用LH750血细胞分析仪,采用影像学技术判断有否转移,超声技术测量肿瘤大小。比较两人群粒系细胞的分布差异,分析其与多个临床病理特征的关系。
1.4 体外实验材料雌性BALB/C鼠,体质量18~22 g,许可证号码:SCXK(沪)2013-0016,购自上海西普尔必凯实验动物有限公司,SPF级饲养。4T1小鼠乳腺癌细胞由美国芝加哥大学何通川教授惠赠。RPMI 1640和DMEM培养液(吉诺生物医药技术)。TGF-β1(Sigma,批号:9090140813)。MethoCultTM人造血干细胞甲基纤维素培养基(stemcell,批号:15c62234)。Gr-1 PE、Ms CD11b FITC(BD)。
1.5 体外实验方法 1.5.1 4T1乳腺癌荷瘤小鼠造模采用含10%FBS的DMEM培养基(添加NaHCO3 1.5g/L,青霉素1×105 U·L-1、链霉素100 mg·L-1),在5% CO2、饱和湿度的37 ℃细胞培养箱内培养4T1细胞,每2~3 d传代1次。将对数生长的4T1细胞消化后用台盼蓝计数,确保细胞存活率在98%以上,用4 ℃无菌PBS缓冲液调整到所需浓度。选取健康BALB/C小鼠,异氟烷麻醉小鼠后,于右侧倒数第2对乳腺脂肪垫皮下接种4T1细胞悬液,每只注射100 μL细胞悬液(浓度为1×107/mL),制备4T1乳腺癌荷瘤模型。
1.5.2 荷瘤小鼠脾脏细胞克隆形成能力检测正常鼠和造模4 w的荷瘤鼠眼眶采血,分别制备正常血清(NS)和模型血清(MS)。颈椎脱臼处死小鼠,无菌取脾脏,用2% FBS的1640分别制备正常细胞悬液(N)和模型细胞悬液(M),细胞浓度均为4×105/mL。取12.5 μL有核细胞悬液和12.5 μL正常小鼠血清、荷瘤小鼠血清、TGF-β1(1 ng/mL)、对照组培养液至250 μL甲基纤维素培养基中,每皿终细胞数为5×104。设置N、N+NS、N+TGF-β、N+MS、M、M+MS、M+TGF-β、M+NS8个组别,3复孔,放于37 ℃的5% CO2细胞培养箱。10 d后显微镜下计数CFU-GM、BFU-E、CFU-M形成数。
1.5.3 流式细胞仪检测不同祖细胞比例70%酒精固定上述细胞,PBS清洗后,用1%的BSA 4℃封闭。用anti-mouse CD11b-FITC和anti-mouse Gr-1-PE抗体联合处理细胞。4 ℃避光孵育30 min,PBS洗1次,200目筛网过滤,流式细胞仪检测Gr-1+CD11b+的细胞比例。
1.6 统计采用SPSS19.0统计软件分析,计量资料采用均数±标准差表示,进行正态性检验,多组间进行单因素ANOVA分析,若方差齐性,则用LSD检验,若不满足方差齐性,则行Tamhane检验,P < 0.05为差异有统计学意义。
2 结果 2.1 不同临床分期乳腺癌患者的血细胞分布特征血常规结果如表 1所示,EO计数及分类在ⅡA、ⅡB、ⅢA和ⅢC期明显降低(P < 0.05)。ⅡB期血象异常最为显著:WBC计数、NEUT计数、Total GC计数、GC比例、NLR显著升高(P < 0.05),EO计数及分类明显降低(P < 0.05),是乳腺癌进展中的关键和转折阶段。
| 表 1 不同临床分期乳腺癌患者的血液学参数 Table 1 Hematological parameters of breast cancer patients in different clinical stages (Mean±SD) |
| 表 2 不同临床病理特征的血象比较 Table 2 Comparison of white blood cell profile in breast cancer patients with different clinicopathological characteristics (Mean±SD) |
肿块面积>1 cm2或肿瘤发生转移时,NEUT计数、GC比例、NLR显著升高(P < 0.05),EO计数及分类显著降低(P < 0.05)。肿块面积≤1 cm2时,乳腺癌患者血象与正常人无明显差异。未出现淋巴转移的患者GC比例显著升高(P < 0.05),EO计数及分类显著降低(P < 0.05)。组织学Ⅱ级和Ⅲ级患者均表现出GC比例显著升高(P < 0.05),EO计数及分类显著降低(P < 0.05)。
2.3 体外不同诱导方式对脾脏造血干细胞克隆形成能力的影响与正常小鼠相比,荷瘤小鼠脾脏HSC有更强的克隆形成能力。TGF-β1能明显促进荷瘤小鼠脾脏HSC的克隆形成能力,促进CFU-GM集落的生成,但对正常小鼠具有反作用。如图 1A所示,M组CFU-GM集落数(71.67± 7.93)显著多于N组(3.33±2.87),M+TGF-β组(102.67± 6.60)多于N + TGF-β组(0.33 ± 0.47),M + TGF-β组(102.67±6.60)显著多于M组(71.67±7.93)(P均 < 0.01)。
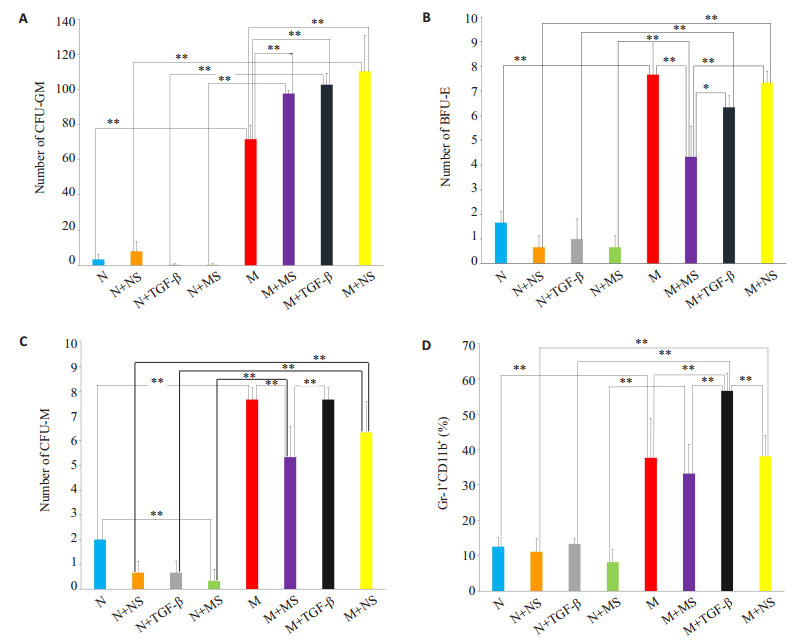
|
图 1 不同诱导因子作用下,小鼠脾脏HSC体外克隆形成集落数(A~C)及Gr-1+CD11b+粒系细胞比例(D) Figure 1 Effects of different inducing factors on the number of spleen colonies (A, B, and C) and the proportion of Gr-1+ CD11b+ cells (D). *P < 0.05, **P < 0.01. |
与正常小鼠相比,荷瘤小鼠脾脏HSC有更强的粒系分化能力,TGF-β1能诱导荷瘤小鼠脾脏HSC向粒系分化,但对正常小鼠作用相反。流式结果如图 1D、图 2所示:M组Gr-1+CD11b+粒系细胞比例(37.69±11.01)显著高于N组(12.57±2.44),M+TGF-β组(56.62±4.97)高于N+TGF-β组(13.32±1.48),M+TGF-β组(56.62±4.97)显著高于M组(37.69±11.01)(P均 < 0.01)。
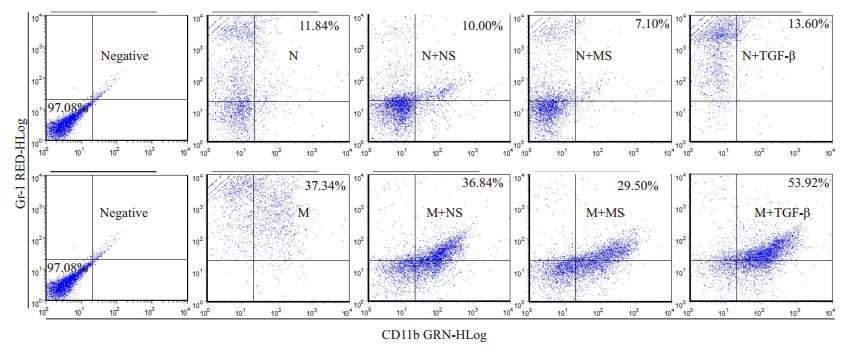
|
图 2 不同诱导因子作用下,小鼠脾脏HSC分化为Gr-1+CD11b+粒系细胞的比例 Figure 2 Effects of different inducing factors on the proportion of Gr-1+CD11b+ cells differentiated from HSCs. |
本研究结果显示,乳腺癌患者WBC计数、NEUT计数、Total GC计数、GC比例、NLR显著升高,而最明显的是EO计数及分类明显降低,存在严重的外周血粒系血象异常。不同临床分期的患者中,ⅡB期的血象异常最明显,是乳腺癌进展的关键和转折阶段。研究表明,NEUT通过激发肿瘤相关炎症反应、抑制淋巴细胞活性等调节机体免疫系统,促进肿瘤逃逸和转移[6-7]。另有研究表明,NLR从整体上反映炎症对肿瘤的促进作用,是乳腺癌的独立预后因素[8-9]。而EO是潜在的抗肿瘤免疫效应细胞,与气道肿瘤等的发生有关[10]。EO通过募集CD8+T细胞,诱导Treg细胞有效消耗,抑制肿瘤生长[11-12]。以上报道,与本研究结果基本一致。
粒细胞分布异常源于荷瘤机体HSC的分化异常。HSC为一类具有自我更新和潜在的造血重建功能的细胞,HSC的分化异常引起免疫紊乱、血象异常,促进肿瘤发展,肿瘤又反过来诱导造血调控关键基因异常表达,干扰造血干细胞分化,造成免疫失衡,加速自身的发生与转移[13-15]。本研究的体外实验表明,荷瘤小鼠脾脏HSC的克隆形成能力强于正常小鼠,粒系分化能力也明显强于正常小鼠。这提示乳腺癌机体外周血粒系血象紊乱是由HSC增殖、粒系分化异常导致的。
TGF-β是一类多功能的生物学细胞分子,参与调节细胞增殖、分化,与肿瘤的进展密切相关[16]。大多数人类乳腺癌标本中均能检测到TGF-β特异性mRNA[17],乳腺癌组织内的TGF-β水平明显高于正常乳房组织[18],乳腺癌患者血清中的TGF-β1的水平也明显高于正常人,且随着肿瘤的进展而升高[19]。但TGF-β在肿瘤的发生发展中表现为复杂的双重作用。TGF-β在正常机体及肿瘤的早期阶段,诱导细胞周期停滞和细胞凋亡;随着肿瘤的进展,肿瘤细胞对TGF-β介导的生长抑制具有抗性[20-21],TGF-β能诱导血清肠源性内毒素的产生和相关蛋白的表达等,成为乳腺癌侵袭和转移的主要上游调控因子[22-25]。TGF-β对肿瘤的双重作用可能与TGF-β对造血系统的双向调节作用有关。
研究表明,TGF-β能抑制HSC和各系定向祖细胞生长,在造血中发挥负向调控作用;然而在特定的条件下,TGF-β又能刺激祖细胞的生长[26-27]。本研究的HSC集落形成实验表明:TGF-β1能明显促进荷瘤小鼠脾脏HSC的克隆形成能力,促进粒细胞-单核细胞集落CFUGM的生成,诱导其向粒系分化,但对正常小鼠具有反作用。TGF-β1对HSC增殖、粒系分化的矛盾转化效应导致了TGF-β在乳腺癌进展中的矛盾转换调节作用。此外,研究还发现,荷瘤小鼠脾脏HSC具有更强的克隆形成能力,与细胞培养微环境无关,这可能是荷瘤小鼠脾脏HSC胞内发生了DNA突变或激活了复制程序。
综上所述,乳腺癌机体的血象及免疫系统的异常状态极有可能与乳腺癌细胞分泌的TGF-β等各种生长因子诱导造血干细胞分化失衡有关,而这种分化失衡又反过来促进了乳腺癌的进展。我们推测,通过调控肿瘤相关造血干细胞的分化失衡状态或许能起到较好的肿瘤辅助治疗效果。
| [1] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J].
CACancer J Clin, 2016, 66(2): 115-32.
DOI: 10.3322/caac.21338. |
| [2] |
李斌, 吴岩. 造血干细胞研究进展[J].
内蒙古医学院学报, 2006, 28(6): 592-5.
|
| [3] |
张岩. 造血干细胞生物学--研究与展望[J].
生命科学, 2009, 21(5): 679-89.
|
| [4] |
Pierelli L, Marone M, Bonanno G, et al. Modulation of bcl-2 and p27 in human primitive proliferating hematopoietic progenitors by autocrine TGF-beta1 is a cell cycle-independent effect and influences their hematopoietic potential[J].
Blood, 2000, 95(10): 3001-9.
|
| [5] |
Wang C, Chen YG, Gao JL, et al. Low local blood perfusion, high white blood cell and high platelet count are associated with primary tumor growth and lung metastasis in a 4T1 mouse breast cancer metastasis model[J].
Oncol Lett, 2015, 10(2): 754-60.
DOI: 10.3892/ol.2015.3304. |
| [6] |
Wculek SK, Malanchi I. Neutrophils support lung colonization of metastasis-initiating breast cancer cells[J].
Nature, 2015, 528(7582): 413.
DOI: 10.1038/nature16140. |
| [7] |
Di Carlo E, Comes A, Orengo AM, et al. IL-21 induces tumor rejection by specific CTL and IFN-gamma-dependent CXC chemokines in syngeneic mice[J].
J Immunol, 2004, 172(3): 1540-7.
DOI: 10.4049/jimmunol.172.3.1540. |
| [8] |
Koh CH, Bhoo-Pathy N, Ng KL, et al. Utility of pre-treatment neutrophil-lymphocyte ratio and platelet-lymphocyte ratio as prognostic factors in breast cancer[J].
Br J Cancer, 2015, 113(1): 150-8.
DOI: 10.1038/bjc.2015.183. |
| [9] |
Chen J, Deng Q, Pan Y, et al. Prognostic value of neutrophil-tolymphocyte ratio in breast cancer[J].
FEBS Open Bio, 2015, 5: 502-7.
DOI: 10.1016/j.fob.2015.05.003. |
| [10] |
Domagała-Kulawik J, Guzman J, Costabel U. Immune cells in bronchoalveolar lavage in peripheral lung cancer-- analysis of 140 cases[J].
Respiration, 2003, 70(1): 43-8.
DOI: 10.1159/000068414. |
| [11] |
Klug F, Prakash H, Huber PE, et al. Low-Dose irradiation programs macrophage differentiation to an iNOS(+)/M1 phenotype that orchestrates effective T cell immunotherapy[J].
Cancer Cell, 2013, 24(5): 589-602.
DOI: 10.1016/j.ccr.2013.09.014. |
| [12] |
Li XR, Kostareli E, Suffner J, et al. Efficient Treg depletion induces Tcell infiltration and rejection of large tumors[J].
Eur J Immunol, 2010, 40(12): 3325-35.
DOI: 10.1002/eji.201041093. |
| [13] |
Foroutan T, Farhadi A, Abroun S, et al. Adipose derived stem cells affect miR-145 and p53 expressions of Co-Cultured hematopoietic stem cells[J].
Cell J, 2018, 19(4): 654-9.
|
| [14] |
Biechonski S, Olender L, Zipin-Roitman A, et al. Attenuated DNA damage responses and increased apoptosis characterize human hematopoietic stem cells exposed to irradiation[J].
Sci Rep, 2018, 8(1): 6071.
DOI: 10.1038/s41598-018-24440-w. |
| [15] |
Li XL, Xue Y, Yang YJ, et al. Hematopoietic stem cells: cancer involvement and myeloid leukemia[J].
Eur Rev Med Pharmacol Sci, 2015, 19(10): 1829-36.
|
| [16] |
徐蕾, 白中红, 许软成, 等. Her-2、EGFR、PS-2、ER在乳腺癌中的表达及其临床意义[J].
南方医科大学学报, 2006, 26(2): 231-3.
|
| [17] |
Tan AR, Alexe G, Reiss M. Transforming growth factor- beta signaling: emerging stem cell target in metastatic breast cancer[J].
Breast Cancer Res Treat, 2009, 115(3): 453-95.
DOI: 10.1007/s10549-008-0184-1. |
| [18] |
Travers MT, Barrett-Lee PJ, Berger U, et al. Growth factor expression in normal, benign, and malignant breast tissue[J].
Br Med J (Clin Res Ed), 1988, 296(6637): 1621-4.
DOI: 10.1136/bmj.296.6637.1621. |
| [19] |
鲁海文, 张超, 雷建灵. 乳腺癌患者血清中TGF的表达及意义[J].
疾病监测与控制, 2016, 10(4): 277-8.
|
| [20] |
Sritananuwat P, Sueangoen N, Thummarati P, et al. Blocking ERK1/2 signaling impairs TGF-β1 tumor promoting function but enhances its tumor suppressing role in intrahepatic cholangiocarcinoma cells[J].
Cancer Cell Int, 2017, 17: 85.
DOI: 10.1186/s12935-017-0454-2. |
| [21] |
Connolly EC, Freimuth J, Akhurst RJ. Complexities of TGF-β targeted cancer therapy[J].
Int J Biol Sci, 2012, 8(7): 964-78.
DOI: 10.7150/ijbs.4564. |
| [22] |
Principe DR, Doll JA, Bauer J, et al. TGF-β: duality of function between tumor prevention and carcinogenesis[J].
J Natl Cancer Inst, 2014, 106(2): djt369.
DOI: 10.1093/jnci/djt369. |
| [23] |
Xu J, Acharya S, Sahin O, et al. 14-3-3ζ turns TGF-β's function from tumor suppressor to metastasis promoter in breast cancer by contextual changes of Smad partners from p53 to Gli2[J].
Cancer Cell, 2015, 27(2): 177-92.
DOI: 10.1016/j.ccell.2014.11.025. |
| [24] |
刘丽华, 代勤, 闵志刚, 等. 转化生长因子β1通过ERK/MAPK信号转导通路促进脑胶质瘤细胞侵袭[J].
南方医科大学学报, 2013, 33(12): 1744-7.
DOI: 10.3969/j.issn.1673-4254.2013.12.07. |
| [25] |
Sundqvist A, Morikawa M, Ren J, et al. JUNB governs a feedforward network of TGFβ signaling that aggravates breast cancer invasion[J].
NucleicAcids Res, 2018, 46(3): 1180-95.
DOI: 10.1093/nar/gkx1190. |
| [26] |
毕晓, 徐勇, 涂植光. 转化生长因子β在造血中的作用和应用[J].
国际检验医学杂志, 2006, 27(8): 716-8.
|
| [27] |
Gong Y, Zhao M, Yang W, et al. Megakaryocyte-derived excessive transforming growth factor β1 inhibits proliferation of normal hematopoietic stem cells in acute myeloid leukemia[J].
Exp Hematol, 2018, 60: 40-46.
DOI: 10.1016/j.exphem.2017.12.010. |
 2018, Vol. 38
2018, Vol. 38

