2. 蚌埠医学院 临床医学一系,安徽 蚌埠 233030
2. Department of Pathology, Department of Clinical Medicine, Bengbu 233000, China
子宫颈癌是严重威胁女性健康的疾病, 其发病率和死亡率较高。常见的组织学类型包括鳞状细胞癌和腺癌,其中80%~85%是子宫颈鳞状细胞癌。因此,对于子宫颈鳞状细胞癌发病机制的探讨,一直是人们关注的热点问题。P63基因是P53的同源基因,参与细胞周期与细胞凋亡的调节,有ΔNp63和TAP63两个亚型,表达在上皮组织的基底层细胞和起源细胞中,具有调控上皮细胞分化和组织发育的作用。同时,目前的研究发现,P63与肿瘤的侵袭和转移也有一定的关系。ΔNp63和TAP63又分别有α、β、γ 3个次亚型[1]。在子宫颈组织中以△Np63α表达为主。DPC4/Smad4是一种与细胞的增殖和生长有关的转录因子,该基因的突变和失活将对细胞的增殖和生长产生一定的影响[2]。P21基因是DPC4/Smad4的下游基因,是具有广泛抑制激酶活性的细胞周期抑制蛋白,对周期蛋白依赖激酶(CDK)和周期蛋白复合物起抑制作用[3-5]。DPC4的失活,导致其下游基因表达受阻,对细胞周期的抑制作用丧失,细胞表现出较强的增殖能力。综上所述,△Np63α、DPC4/Smad4和P21均是与细胞的增殖和生长有关的因子,那么三者在肿瘤细胞的增殖和生长中的作用机制以及三者的表达情况与肿瘤侵袭、转移及生存预后的关系成为我们关注的问题。三者在子宫颈鳞状细胞癌的细胞增殖、生长中的作用机制,是本次研究的重点内容。本研究通过免疫组化ElivisionTM Plus法检测100例子宫颈鳞状细胞癌、40例子宫颈上皮内瘤变(CIN)及40例正常子宫颈鳞状上皮中DPC4/Smad4、P21和△Np63α的表达情况,分析三者表达的临床意义以及与子宫颈鳞状细胞癌侵袭、转移和生存预后的关系。为进一步探讨子宫颈鳞状细胞癌的发病机制及相应的基因治疗提供相关理论依据。
1 材料和方法 1.1 标本来源收集蚌埠医学院第一附属医院2010年1月~2010年12月根据NCCN指南接受规范手术,术前未接受同步放化疗的子宫颈鳞状细胞癌存档石蜡包埋组织标本100例,子宫颈上皮内瘤变(CIN)的组织40例。所有病例均有完整的临床病理资料及随访资料。同时,以同一时期因子宫平滑肌瘤行单纯性全子宫切除患者的正常宫颈组织40例作为对照组。所有入选病例均进行了伦理学审查,符合伦理学要求。入选子宫颈癌病例随访至患者死亡或截止2016年12月,随访时间为6~60月,其中5例失联。100例子宫颈癌中,年龄22~84岁;内生浸润型70例,外生菜花型30例;< 肌层1/2,12例,>肌层1/ 2,88例;高分化55例,中分化34例,低分化11例;无淋巴结转移47例,有淋巴结转移53例。所有病例临床分期均由两名高年资妇科医师按照FIGO2009版分期标准进行分期:Ⅰa期15例,Ⅰb期68例,Ⅱa期17例。
1.2 抗体与试剂鼠抗人△ Np63α单克隆(克隆号4A4)、DPC4/ Smad4单克隆(克隆号QBEnd/101)和P21单克隆(克隆号SX118)抗体(Santa Cruz Biotechnology),ElivisonTM Plus试剂盒和DAB显色试剂盒(迈新)。
1.3 免疫组织化学ElivisonTM Plus法检测石蜡包埋组织以4 μm厚连续切片后烤干,常规脱蜡至水洗。免疫组化染色操作步骤按试剂盒说明书进行。采用已知阳性片作对照,以PBS液代替一抗作空白对照。
1.4 结果判定△Np63α和P21以细胞核出现黄色或棕黄色颗粒为阳性;DPC4/Smad4以细胞浆和(或)细胞膜出现黄色或棕黄色颗粒为阳性。免疫组化结果采取阳性细胞数和染色强度二次计分法:每例标本随机计数10个高倍视野(×400),计数每个高倍视野中阳性细胞所占百分比并计分。阴性计为0分,阳性细胞为 < 10% 1分,11%~ 50% 2分,51%~75% 3分,>75% 4分。同时,按染色强度计分。无色0分,淡黄色1分,棕黄色2分,棕褐色3分。将二者积分的乘积作为判断表达结果,积分≤1为阴性,>1为阳性。免疫组化结果由两位高年资病理医生采用独立双盲法判定。
1.5 统计分析采用SPSS19.0统计软件进行数据分析。采用χ2检验、t检验、Spearman等级相关,以及log-rank检验进行数据分析,采用Kaplan-Meier法进行生存分析。其中P21、DPC4/Smad4和△Np63α在子宫颈癌组织和正常子宫颈组织的表达与各临床病理因素的相关性分析采用χ2、Spearman等级相关以及t检验;P21、DPC4/Smad4和△Np63α阳性组与阴性组生存分析用Kaplan-Meier法,组间比较采用log-rank检验;P < 0.05为差异有统计学意义。
2 结果 2.1 △ Np63α、DPC4/Smad4、P21在正常宫颈组织、CIN、宫颈鳞状细胞癌组织中的表达△Np63α、P21主要定位于细胞核,DPC4/Smad4主要定位于细胞浆和细胞膜。△Np63α和DPC4/Smad4在正常宫颈组织中的阳性表达率显著高于其在CIN和子宫颈鳞状细胞癌中表达,差异均有显著性(P < 0.01);而P21在CIN和子宫颈鳞状细胞癌中的阳性表达率显著高于正常宫颈组织,差异有显著性(P < 0.01,表 1、图 1~3)。
| 表 1 △Np63α、DPC4/Smad4、P21在各组中的表达情况 Table 1 Expression of ΔNp63α, DPC4/Smad4 and P21 in different tissues |
|
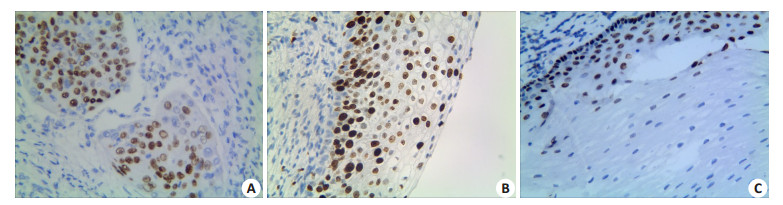
图 1 △Np63α在子宫颈鳞状细胞癌、宫颈上皮内瘤变及正常子宫颈组织中的表达 Figure 1 Expression of ΔNp63α in cervical squamous cell carcinoma (A), cervical intraepithelial neoplasia (B) and normal cervical tissues (C) (ElivisonTM staining, original magnification: ×400). |
|
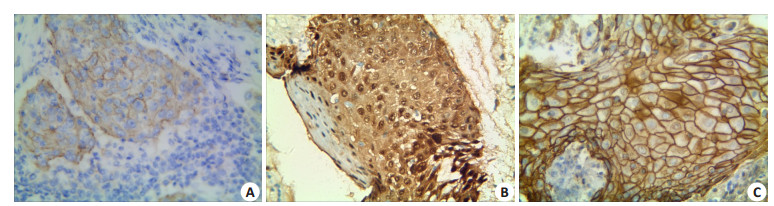
图 2 DPC4/Smad4在子宫颈鳞状细胞癌,子宫颈上皮内瘤变及正常子宫颈组织中的表达及对照组中的表达 Figure 2 Expression of DPC4/Smad4 in cervical squamous cell carcinoma (A), cervical intraepithelial neoplasia (B) and normal cervical tissues (C) (ElivisionTM staining, ×400). |
|
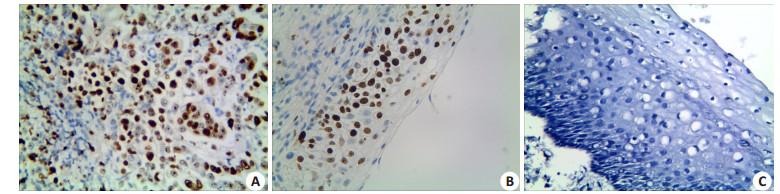
图 3 21在子宫颈鳞状细胞癌,宫颈上皮内瘤变及正常子宫颈组织中的表达 Figure 3 Expression of P21 in cervical squamous cell carcinoma (A), cervical intraepithelial neoplasia (B) and normal cervical tissues (C) (ElivisionTM staining, ×400). |
在子宫颈鳞状细胞癌中△Np63α、DPC4/Smad4和P21的表达与患者的年龄、肿瘤的大体类型、浸润深度无关(P>0.05),而与肿瘤的分化程度,临床分期,以及淋巴结转移有关,差异有显著性(P < 0.01,表 2)。
| 表 2 △Np63α、DPC4/Smad4和P21的表达与各临床病理因素的关系 Table 2 Correlation of the expressions of DPC4/Smad4 and ΔNp63α with the clinicopathological characteristics of patients with cervical squamous cell carcinoma |
Spearman等级相关分析显示:△Np63α与DPC4/ Smad4的表达呈正相关(r=0.581,P < 0.001),DPC4/ Smad4与P21的表达成负相关(r=-0.449,P < 0.001);△Np63α与P21的表达成负相关(r=-0.254,P < 0.05,表 3)。
| 表 3 △Np63α和DPC4/Smad4及P21表达的相关性分析 Table 3 Correlations ofΔNp63α, DPC4/Smad4, and P21 expressions in cervical squamous cell carcinoma |
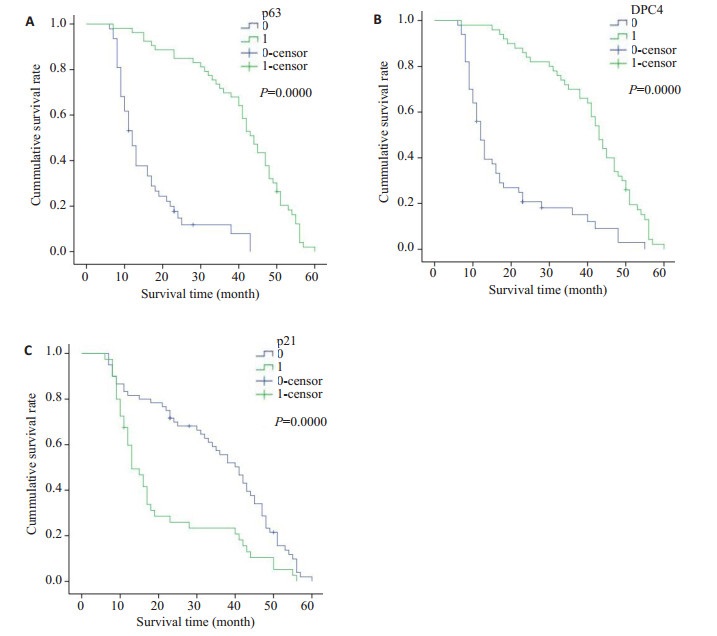
子宫颈鳞状细胞癌的5年生存率为52%(52/ 100)。其中,△Np63α阳性表达组(83.0%,44/53)显著高于△Np63α阴性表达组(12.8%,6/47),差异有显著性(P < 0.001,图 4A);DPC4/Smad4阳性表达组的86%(43/ 50)显著高于DPC4/Smad4阴性表达组的18.0%(9/50),差异有显著性(P < 0.001,图 4B)。P21阳性表达组的22.0%(11/50)显著低于P21阴性表达组的82.0%(41/ 50),差异有显著性(P < 0.05,图 4C)。
|
图 4 DPC4/Smad4, △Np63α和P21阳性组与阴性组患者生存曲线(log-rank检验) Figure 4 Kaplan-Meier survival analysis of patients with cervical squamous cell carcinoma with different statuses of DPC4/Smad4, ΔNp63α and P21 positivity (log-rank test). A: Survival curves of patients positive and negative for ΔNp63α (P < 0.001); B: Survival curves of patients positive and negative for DPC4/Smad4 (P < 0.001); C: Survival curves of patients positive and negative for P21 (P < 0.001). |
P63基因位于3q27.29,是P53基因家族成员之一,与上皮细胞的分化调控关系密切。该基因主要有ΔNP63和TAP63两个亚型,其中ΔNP63包括ΔNP63α、ΔNP63β和ΔNP63γ三个亚型;TAP63包括TAP63α、TAP63β和TAP63γ三个亚型。研究发现,ΔNP63α是尿路上皮肿瘤、头颈部鳞癌、胰腺癌的主要表达亚型[6-8]。周颖等[9]的研究证实,ΔNP63α也是子宫颈上皮及子宫颈鳞状细胞癌的主要表达亚型。ΔNP63α是诱导基底细胞分化的重要调控基因之一,而基底细胞具有向鳞状细胞分化和不断增殖的能力,△Np63α通过促进关键性分化调节基因involucrin、loricrin等的表达,来调控上皮分化;另外,其通过调节PerP和整合素家族的表达,来调控细胞的黏附功能[10],以此来调控基底细胞的分化,控制鳞状上皮的转化。因此,当△Np63α表达异常时,上皮细胞的正常分化过程受阻,从而引起肿瘤发生。本研究中,从正常子宫颈鳞状上皮到子宫颈上皮内瘤变再到子宫颈鳞状细胞癌中△Np63α的表达显著降低,同时随着肿瘤细胞分化程度的降低△Np63α的表达也减少,提示我们,△Np63α的表达情况与子宫颈鳞状细胞癌的发生、发展有密切关系。另外,有研究发现[11],在上皮细胞分化过程中,△Np63α通过与P21基因启动子区域的两个结合位点结合,调控P21基因的表达,影响细胞周期,进而影响肿瘤的发生。
P21基因是一种细胞周期抑制蛋白,属于周期蛋白依赖性激酶抑制因子(CKI)家族成员之一,具有广泛抑制激酶活性的作用,其通过抑制周期蛋白依赖激酶(CDK)和周期蛋白复合物的活性,阻滞细胞周期进程使细胞周期停滞于G2期,而调控细胞周期[3-5],所以,P21在肿瘤组织中表达应该降低。然而,目前的研究发现,P21在不同肿瘤中的表达情况尚不一致,P21在外阴癌[12]、肝癌[13]中低表达,但是在副鼻窦鳞状细胞癌[14]、膀胱癌[15]、乳腺癌[16]等肿瘤中表达升高,而且与肿瘤的分化、浸润、转移有关。本实验中P21在子宫颈鳞癌中的表达显著高于子宫颈上皮内瘤变和正常宫颈组织,与文献报道一致[17],而且P21的表达情况与肿瘤的分化程度、浸润深度、以及淋巴结转移相关,提示P21的表达可能与子宫颈鳞状细胞癌的发生发展有关。另外,生存分析表明,P21表达阴性组的生存率明显高于其阳性组,这提示我们,P21的表达情况可以作为判断患者生存预后的评估指标之一。同时,如前所述,由于P21的表达受到△Np63α的调控,那么当△Np63α表达下降时,对P21的调控作用则减弱,P21的表达增加。为了探讨二者之间的关系,我们进行了相关性分析,结果表明,从正常宫颈组织到CIN再到宫颈鳞状细胞癌,随着△Np63α的表达下调,P21表达增加,二者的表达具有负相关性,同时,P21作为DPC4的下游基因,其表达情况不仅受到△Np63α的调控,还受到上游基因DPC4的调控,而TGF-β介导的P21反应和随后的生长抑制功能也均与DPC4的表达相关[18]。
DPC4作为TGF-β介导的信号转导环路中的一种转录因子,其蛋白产物Smad4具有促使各种Smad信号从细胞膜转入细胞核的作用,同时,其在TGF-β诱导的基因表达调控和生长抑制中也有重要作用[2],因此,DPC4/Smad4的失活将破坏Smad-TGF-β信号转导途径,影响细胞的增殖和凋亡[19],从而发生过度增殖和恶性转化[20]。研究发现,DPC4/Smad4在肺癌[21]、胰腺癌[22]、以及胃肠道神经内分泌肿瘤[23]等多种肿瘤中均有失表达。本研究结果显示,DPC4/Smad4在子宫颈鳞状细胞癌中的阳性表达率低于对照组,而且表达情况与肿瘤细胞的分化程度、临床分期和淋巴结转移有关,同时,DPC4/Smad4、P21之间的相关性分析显示,DPC4/ Smad4与P21有负相关关系。综上所述,我们推测,子宫颈鳞状细胞癌的发生过程中,P21基因的表达受到△Np63α与DPC4/Smad4共同调控,由于DPC4/Smad4的表达下调,导致△Np63α基因表达减弱和P21基因的表达增加,细胞周期的调控异常,引起肿瘤发生。
侵袭和转移是造成子宫颈鳞癌患者治疗失败的主要原因。目前的研究发现,P63通过与Smad结合形成复合物,抑制TGF-β诱导的肿瘤细胞转移[24-25],因此当△ Np63α和(或)DPC4/Smad4失活或表达下降时,复合物形成障碍,转移抑制作用缺失,肿瘤转移更加容易。本研究中,△Np63α和DPC4/Smad4阳性表达组的淋巴结转移率远低于△Np63α和DPC4/Smad4阴性表达组, 二者与肿瘤的淋巴结转移均显著相关(P < 0.01),同时,生存分析表明,△Np63α、DPC4/Smad4表达阳性组的生存率均明显高于其阴性组。
因此,在子宫颈鳞状细胞癌中△Np63α、DPC4/ Smad4和P21的表达情况与肿瘤的增殖、侵袭和转移密切相关,检测△Np63α、DPC4/Smad4和P21的表达情况,可作为评估子宫颈鳞状细胞癌患者转移和生存预后的指标。
| [1] |
Mangiulli M, Valletti A, Caratozzolo MF. Identification and functional characterization of two new transcriptional variants of the human p63 gene[J].
NucleicAcids Res, 2009, 37(18): 6092-104.
DOI: 10.1093/nar/gkp674. |
| [2] |
Wallden K, Nyman T, Hallberg BM. SnoN stabilizes the SMAD3/ SMAD4 protein complex[J].
Sci Rep, 2017, 7: 46370.
DOI: 10.1038/srep46370. |
| [3] |
Parveen A, Akash MS, Rehman KA. Dual role of p21 in the progression of cancer and its treatment[J].
Crit Rev Eukaryot Gene Expr, 2016, 26(1): 49-62.
DOI: 10.1615/CritRevEukaryotGeneExpr.v26.i1. |
| [4] |
Warfel NA, El-Deiry WS. p21WAF1 and tumourigenesis: 20 years after[J].
Curr Opin Oncol, 2013, 25(1): 52-8.
DOI: 10.1097/CCO.0b013e32835b639e. |
| [5] |
Dai M, Al-Odaini AA, Fils-Aimé N, et al. CyclinD1 cooperates with P21 to regulate TGFbeta-mediated breast cancer cell migration and tumor local invasion[J].
Breast Cancer Res, 2013, 15(3): R49.
|
| [6] |
Fukushima H, Koga F, Kawakami S, et al. Loss of delta Np63 alpha promotes invasion of urothelial carcinomas via N-Cadherin/Src homology and collagen/extracellular Signal-Regulated kinase pathway[J].
Cancer Res, 2009, 69(24): 9263-70.
DOI: 10.1158/0008-5472.CAN-09-1188. |
| [7] |
Chung J, Lau J, Cheng LS, et al. SATB2 augments ΔNp63α in head and neck squamous cell carcinoma[J].
EMBO Rep, 2010, 11(10): 777-83.
DOI: 10.1038/embor.2010.125. |
| [8] |
Danilov AV, Neupane D, Nagaraja AS, et al. DeltaNp63alphamediated induction of epidermal growth factor receptor promotes pancreatic cancer cell growth and chemoresistance[J].
PLoS One, 2011, 6(10): e26815.
DOI: 10.1371/journal.pone.0026815. |
| [9] |
Zhou Y, Xu Q, Ling B, et al. Reduced expression of ΔΝp63α in cervical squamous cell carcinoma[J].
Clin Invest Med, 2011, 34(3): E184-91.
DOI: 10.25011/cim.v34i3.15192. |
| [10] |
Truong AB, Khavari PA. Control of keratinocyte proliferation and differentiation by p63[J].
Cell Cycle, 2007, 6(3): 295-9.
DOI: 10.4161/cc.6.3.3753. |
| [11] |
Westfall MD, Mays DJ, Sniezek JC, et al. The delta Np63 alpha phosphoprotein binds the p21 and 14-3-3 sigma promoters in vivo and has transcriptional repressor activity that is reduced by HayWells syndrome-derived mutations[J].
Mol Cell Biol, 2003, 23(7): 2264-76.
DOI: 10.1128/MCB.23.7.2264-2276.2003. |
| [12] |
罗雪慧, 范余娟, 杨开选, 等. FHIT蛋白和p21蛋白在外阴癌和外阴尖锐湿疣中表达的研究[J].
广西医科大学学报, 2010, 27(1): 29-31.
|
| [13] |
Baddour N, Farrag E, Zeid A, et al. Decreased apoptosis in advancedstage/high-grade hepatocellular carcinoma complicating chronic hepatitis C is mediated through the downregulation of p21 ras[J].
Chin J Cancer Res, 2013, 25(3): 281-8.
|
| [14] |
Oncel S, Cosgul T, CalliA, et al. Evaluation of P53, P63, P21, P27, Ki- 67 in paranasal sinus squamous cell carcinoma and inverted papilloma[J].
Indian J Otolaryngol Head Neck Surg, 2011, 63(2): 172-7.
DOI: 10.1007/s12070-011-0252-4. |
| [15] |
Grapsa D, DokouA, Tsokanou-Kouli VA, et al. Immunohistochemical expression of p53, p63, c-myc, p21(WAF1/cip1) and p27(kiP1) proteins in urothelial bladder carcinoma: correlation with clinicopathological parameters[J].
J BUON, 2014, 19(4): 1121-4.
|
| [16] |
Wei CY, Tan QX, Zhu X, et al. Expression of CDKN1A/p21 and TGFBR2 in breast cancer and their prognostic significance[J].
Int J Clin Exp Pathol, 2015, 8(11): 14619-29.
|
| [17] |
秦赟娜, 何德明, 庄德葆, 等. 子宫颈癌中Plk1和Cyclin B1, P21WAF1的表达及其临床意义[J].
临床与实验病理学杂志, 2015, 31(4): 385-9.
|
| [18] |
Grau AM, Zhang L, Wang W, et al. Induction of p21waf1 expression and growth inhibition by transforming growth factor beta involve the tumor suppressor gene DPC4 in human pancreatic adenocarcinoma cells[J].
Cancer Res, 1997, 57(18): 3929-34.
|
| [19] |
Bai X, He T, Liu J, et al. Loureirin B inhibits fibroblast proliferation and extracellular matrix deposition in hypertrophic scar via TGF-β/ Smad pathway[J].
Exp Dermatol, 2015, 24(5): 355-60.
DOI: 10.1111/exd.12665. |
| [20] |
Ahmed S, Bradshaw AD, Gera S, et al. The TGF-β/Smad4 signaling pathway in pancreatic carcinogenesis and its clinical significance[J].
J Clin Med, 2017, 6(1): 5.
DOI: 10.3390/jcm6010005. |
| [21] |
Chen H, Wang JW, Liu LX, et al. Expression and significance of transforming growth factor-β receptor type Ⅱ and DPC4/Smad4 in non-small cell lung cancer[J].
Exp Ther Med, 2015, 9(1): 227-31.
DOI: 10.3892/etm.2014.2065. |
| [22] |
Hao J, Zhang SY, Zhou YQ, et al. MicroRNA 483-3p suppresses the expression of DPC4/Smad4 in pancreatic cancer[J].
FEBS Lett, 2011, 585(1): 207-13.
DOI: 10.1016/j.febslet.2010.11.039. |
| [23] |
Roland CL, Starker LF, Rang Y, et al. Loss of DPC4/SMAD4 expression in primary gastrointestinal neuroendocrine tumors is associated with cancer-related death after resection[J].
Surgery, 2017, 161(3): 753-9.
DOI: 10.1016/j.surg.2016.09.002. |
| [24] |
Adorno M, Cordenonsi M, Montagner M, et al. A mutant-p53/Smad complex opposes p63 to empower TGFbeta-induced metastasis[J].
Cell, 2009, 137(1): 87-98.
DOI: 10.1016/j.cell.2009.01.039. |
| [25] |
Marine JC, Berx G. Transforming growth factor-beta and mutant p53 conspire to induce metastasis by antagonizing p63: a (ternary) complex affair[J].
Breast Cancer Res, 2009, 11(4): 304.
DOI: 10.1186/bcr2337. |
 2018, Vol. 38
2018, Vol. 38

