2. 海南省人民医院麻醉教研室,海南 海口 570311;
3. 中南大学湘雅三医院神经内教研室,湖南 长沙 410013
2. Department of Anesthesiology, Hainan General Hospital, Haikou 570311, China;
3. Department of Neurology, Third Xiangya Hospital of Central South University, Changsha 410013, China
奥沙利铂(Oxa)作为第3代铂类化疗药物,广泛地用于治疗晚期转移性结直肠癌患者[1-2]。85%~95%的患者在Oxa治疗期间迅速发展为无运动功能障碍的神经性疼痛,高峰发生在用药后24~48 h[3-6],持续1周左右。三环类抗抑郁药、抗惊厥药、阿片类药物和非甾体类镇痛消炎药是目前用于治疗化疗引起的神经性疼痛的药物。然而,这些药物的有效性和安全性是有限的[7]。因此,发展新的安全有效的治疗Oxa引起的神经性疼痛的可替代药物,具有非常重要的临床意义。
右美托咪定(Dex),一种a2肾上腺素受体(a2-AR)激动剂,具有镇静、镇痛和抗交感等作用,广泛应用于围术期和危重患者[8-9]。临床上,应用Dex对缺血性疼痛、急性术后疼痛和顽固性癌性疼痛以及活体肺移植后疱疹性口炎都具有镇痛作用[10-12]。此外,在不同的动物模型中发现Dex对术后、链脲菌素诱发、弗氏完全佐剂、福尔马林和角叉菜胶诱发的炎症、急性伤害性及神经性疼痛都有镇痛消炎作用[13-14]。目前,在动物实验和临床上都没有报道Dex对Oxa引起的神经性疼痛的具有镇痛作用。因此,在本项研究中,通过建立Oxa致神经性疼痛模型,探讨Dex处理可减轻Oxa引起的神经性疼痛。
STAT3信号分子在细胞内信号转导级联反应通路中占有重要作用。一些研究在神经损伤后引起的神经源性疼痛动物模型中,发现STAT3信号分子在多种细胞中被激活[15-19]。目前,还没有研究发现STAT3信号分子与Dex对Oxa致神经性疼痛的镇痛作用存在关联。因此,本研究的目的是确定STAT3信号分子是否参与Dex对Oxa致神经性疼痛的镇痛作用。
1 材料和方法 1.1 实验动物成年雄性健康Sprague-Dawley大鼠(由湖南天勤生物技术有限公司提供,批号:43006700008149),清洁级,8周龄,体质量180~220 g,每笼饲养4~6只,12 h明暗交替,维持适当室温和湿度,自由进食水和食物。大鼠有1周时间适应环境和实验者,然后开始实验。
1.2 实验模型建立本研究应用Oxa单剂量腹腔处理诱发急性神经病理性疼痛模型。48只大鼠随机接受Oxa(6 mg/kg)或5%葡萄糖溶液(与Oxa同体积)单次腹腔注射[20-21]。在药物处理后0、1、2、3、4、5 d进行疼痛行为学测试。本实验发现大鼠在Oxa处理后的第2天机械性刺激及冷刺激引起的异常痛觉具有显著性变化。因此,我们使用了Oxa腹腔单次注射后的第2天作为一个疼痛模型来研究实验的第2部分。
1.3 药物处理Oxa(江苏恒瑞医药提供)溶于5%葡萄糖溶液,浓度为2 mg/mL,6 mg/kg,腹腔注射。Dex(江苏恒瑞医药提供)溶于生理盐水,50 µg/kg,腹腔注射[22]。阿替美唑(Ati,a2-AR阻滞剂,瀚香生物技术有限公司提供)溶于生理盐水,250 µg/kg,腹腔注射。动物在实验结束后戊巴比妥钠过量处理。
1.4 动物分组(1)第1部分,建立模型分组(n=48):①control组: 5%葡萄糖(与Oxa同体积);② Oxa组:Oxa(6 mg/kg);(2)第2部分,Dex对其模型的影响(n=80),分成4部分: ① control组:5%葡萄糖(与Oxa同体积,2 d)+与Dex相同体积的生理盐水;②model组:Oxa(6 mg/kg,2 d)+与Dex相同体积的生理盐水;③Dex组:Oxa(6 mg/kg,2 d)+Dex(50 µg/kg);④Ati组:Oxa(6 mg/kg, 2 d)+Ati(250 µg/kg,30 min)+Dex(50 µg/kg,90 min)。
1.5 行为学测试疼痛行为学测试均在上午进行。给药人员不参与行为学测试。大鼠在每次测试前有30 min适应环境和测试人员。第1部分实验分别在药物处理后第0、1、2、3、4,5天进行测试;第2部分实验分别在Dex处理后第0、30、60、90、120 min进行测试。冷热痛觉异常采用鼠尾撤退潜伏期(TWL)测定,将大鼠尾巴分别浸入4 ℃冷水或42 ℃热水中,记录尾巴在冷热水中的持续时间。设定20 s为终止时间,以避免组织损伤。每次测试间隔5 min,连续观察5次,记录平均值。机械触痛异常采用电子Von Frey疼痛测量仪(美国IITC Life Science)测量机械性缩足反射阈值(PWT)。将大鼠分别放置于金属筛网上的有机玻璃箱里,安静15 min后,以硬性Von Frey纤维垂直地刺向其双侧后肢足底中部皮肤,缓慢增加刺激压力,大鼠出现抬足、舔足、躲避等反应时,读取读数器上显示的最大值(g)。设定切断压力为80 g,避免损伤大鼠足底组织。每只大鼠双足分别重复测量5次,间隔5 min,记录平均值。
1.6 Western blot测定p-STAT3大鼠进行疼痛行为学测试后,立刻戊巴比妥钠麻醉(100 mg/kg,腹腔注射),立即取出脊髓腰膨大置于液氮中快速冻结。组织投入RIPA单去污剂蛋白裂解液于匀浆器中进行匀浆。在4 ℃离心,收集上清液。然后,蛋白质样品装上SDS-聚丙烯酰胺分离凝胶,再将蛋白质电泳转移到PVDF膜上。用封闭液(含3%脱脂牛奶的TBST溶液)室温封闭PVDF膜l h,在4 ℃加入兔抗p-STAT3(Tyr705,1:500稀释,Cell Signaling Technology)。然后,膜与辣根过氧化物酶标记的抗兔二抗孵育(1:3000, Cell Signaling Technology)1.5 h,在室温下,浸泡ECL工作液1 min化学显影并拍照。
1.7 免疫荧光检测p-STAT3动物深度麻醉后,冷生理盐水经心灌注到流出清液后,冷4%多聚甲醛灌注固定,采集脊髓腰膨大,保存在10%蔗糖4 ℃过夜脱水。脊髓组织切成5 µm切片,在含3%驴血清和0.3% Triton X-100的1×磷酸盐缓冲盐水(PBS)预孵育1 h(25 ℃)。切片在同一缓冲液中加入一次抗体兔抗p-STAT3(Tyr705;1:50稀释;Cell Signaling Technology),4 ℃孵育24 h。切片经清洗后(3×10 min,PBS 1X),加入二抗Alexa 594标记的羊抗兔IgG(1:200, Molecular Probes),室温避光孵育2 h。切片经PBS清洗后,加入DAPI(4, 6-二脒基-2-苯基吲哚,1 mg/mL,北京索莱宝科技有限公司)进行染色。染色切片用Olympus荧光显微镜观察(日本奥林巴斯)和图像是由CCD摄像机现场拍摄。
1.8 统计学处理所有资料均以均数±标准差表示,使用SPSS 22.0统计软件进行统计学分析。行为学测数据的分析采用重复测量方差分析,组内多时间点比较采用Bonferroni法,不同时间点的组间比较采用LSD法。P < 0.05认为差异有统计学意义。
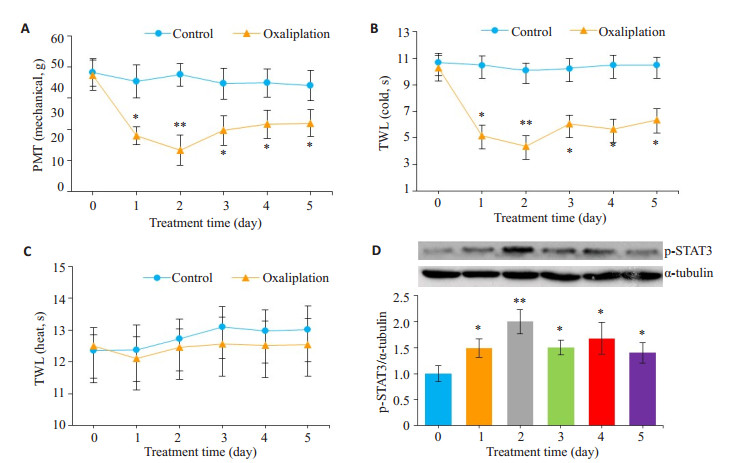
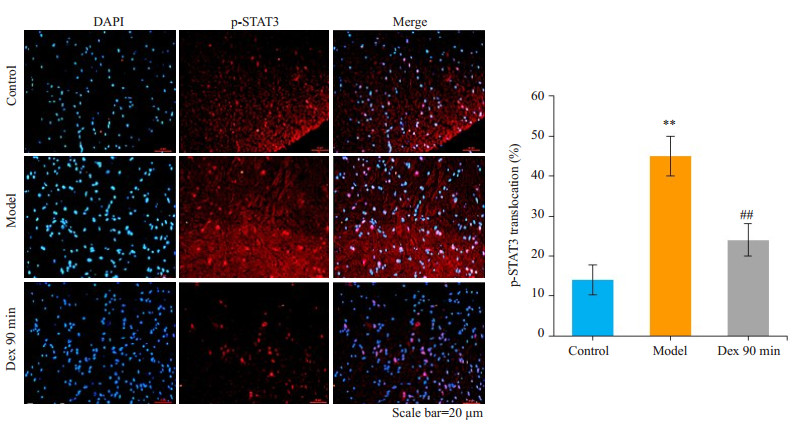
2 结果 2.1 奥沙利铂致神经疼痛模型—观察大鼠疼痛行为学及脊髓p-STAT3表达变化在奥沙利铂处理前,大鼠疼痛行为学指标在统计学上无显著性差异。与control组相比,Oxa组均在给药后第1天迅速出现痛觉异常,持续至第5天,明显缩短了大鼠的PWT(机械刺激)和TWL(冷刺激)(P < 0.05),在给药后第2天达到高峰(P < 0.01,图 1A、B);Oxa组大鼠的TWL(热刺激)无显著性变化(P>0.05,图 1C)。同时,Oxa组p-STAT3蛋白水平在第1天显著升高,持续至第5天(P < 0.05),在第2天达到高峰(P < 0.01,图 1D)。另外,免疫荧光显示Oxa组第2天p-STAT3的表达比control组显著增加(P < 0.01,图 5)。
|
图 1 奥沙利铂诱发大鼠疼痛行为学及脊髓p-STAT3的影响 Figure 1 Effect of oxaliplatin on allodynia behavior and p-STAT3 expression in the spinal cord of the rats. A: Paw withdrawal threshold (PWT) to mechanical stimulation; B: Tail withdrawal latency (TWL) in response to cold stimulation; C: Tail withdrawal latency in response to heat stimulation; D: Western blotting of spinal pSTAT3 in oxaliplatin-treated rats. *P < 0.05, **P < 0.01 vs control group. |
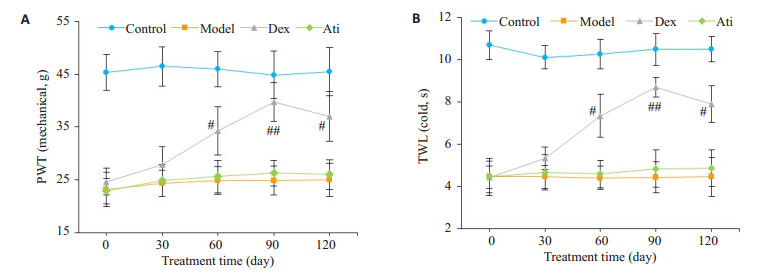
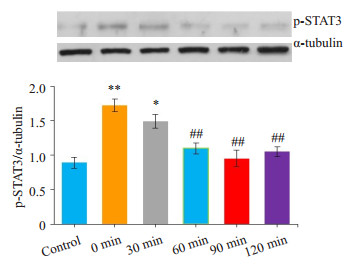
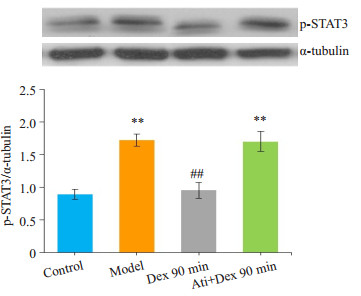
与model组相比,Dex组大鼠均在右美托咪定处理后60 min痛觉明显缓解,在90 min时达到高峰,持续至120 min,明显延长了大鼠的PWT(机械刺激)和TWL(冷刺激),差异有统计学意义(P < 0.05);30 min时无明显变化(P>0.05);Ati组无明显差异(P>0.05,图 2A、B)。相应地,与model组相比,Dex组大鼠脊髓p-STAT3在60、90、120 min时表达明显减少(P < 0.01);在30 min时无明显变化(P>0.05,图 3)。与Dex组90 min时相比,Ati组大鼠脊髓p-STAT3表达明显增加(P < 0.01);与Oxa组相比,Ati组无明显差异(P < 0.01,图 4)。同样,免疫荧光也显示右美托咪定显著地抑制p-STAT3蛋白水平的表达(P < 0.01,图 5)。
|
图 2 右美托咪定对奥沙利铂诱发大鼠疼痛行为学的影响 Figure 2 Effect of dexmedetomidine on oxaliplatin-induced allodynia behavior in rats. A: Paw withdrawal threshold (PWT) to mechanical stimulation; B: Tail withdrawal latency (TWL) in response to cold stimulation. #P < 0.05, ##P < 0.01 vs Model andAti groups. |
|
图 3 右美托咪定对大鼠脊髓p-STAT3的影响 Figure 3 Effects of dexmedetomidine on p-STAT3 expression in the spinal cord of the rats. *P < 0.05, **P < 0.01, vs control group; ##P < 0.01 vs 0 min (model) group. |
|
图 4 阿替美唑对大鼠脊髓p-STAT3的影响 Figure 4 Effects of atipamezole on p-STAT3 expression in the spinal cord of the rats. **P < 0.01, vs control group; ##P < 0.01 vs Model group. |
|
图 5 右美托咪定对大鼠脊髓p-STAT3免疫荧光结果的影响 Figure 5 Effect of dexmedetomidine on immunofluorescence of spinal cord p-STAT3 in the rats. **P < 0.01 vs control group; ##P < 0.01 vs model group. DAPI: 4, 6-diamidino-2-phenylindole. |
本研究发现腹腔注射右美托咪定可明显改善奥沙利铂诱发大鼠对机械刺激和冷刺激引起的异常疼痛,并通过抑制脊髓腰膨大STAT3蛋白的磷酸化,阻断a2-AR基本上逆转了右美托咪定的上述反应。因此,在奥沙利铂引起的神经性疼痛中,STAT3信号分子可能起重要调控作用。
本实验采用单次腹腔注射奥沙利铂诱发神经性疼痛为模型,根据一些研究来决定奥沙利铂的用药方法、剂量及途径[20, 23-27]。奥沙利铂引起的神经性疼痛是癌症治疗成功的一个主要障碍,因为它在个体和累积剂量情况下普遍存在。在本项研究中,发现单剂量奥沙利铂处理后第1~5天大鼠迅速出现对冷和机械性刺激的异常痛觉,第2天达到高峰。这与其他一些研究[20-21, 25]相符,给大鼠腹腔注射单剂量奥沙利铂,发现在奥沙利铂处理后第2天就出现明显的机械性及冷刺激引起的异常疼痛,延续至1周左右。因此,本实验选择单剂量奥沙利铂(6 mg/kg,腹腔注射)处理后的第2天作为奥沙利铂诱发神经性疼痛模型来做后面的第2部分实验。由于Oxa组大鼠没有出现热刺激引起的异常疼痛,我们没有在第2部分实验做热刺激鼠尾撤退潜伏期试验。
研究发现右美托咪定可降低大鼠机械性及冷刺激引起的异常疼痛,从12.5~50 μg/kg呈剂量依赖性,并且发现右美托咪定浓度高于100 μg/kg可引起大鼠镇静作用[22]。因此在本研究中,选用右美托咪定的浓度为50 μg/kg,可排除因右美托咪定产生的镇静作用干扰对右美托咪定镇痛作用的观察。
右美托咪定是a2-AR激动剂,在中枢神经系统和脊髓中结合到a2-AR受体,也结合大脑中的咪唑啉受体[28]。近年来,右美托咪定通过如口服、静脉注射及鞘内给药等多模式作为一种辅助方法来减少术后疼痛[29-30]。最近一项临床研究发现关节腔内注射右美托咪定对膝关节内窥镜术后有镇痛作用[10]。另一个临床研究显示在双侧第三磨牙手术中局部使用右美托咪定后有抗痛觉过敏作用[12]。一项基础研究发现右美托咪定可减轻由长春新碱诱导引发的外周神经痛[22]。然而,目前还没有研究发现右美托咪定可缓解奥沙利铂引起的神经性疼痛。因此,本研究评估了奥沙利铂诱发的大鼠神经性疼痛模型以及右美托咪定可缓解奥沙利铂引发的神经性疼痛。本实验观察到右美托咪定处理后90 min达到最大的镇痛效应,因此在免疫荧光实验中采用右美托咪定处理后90 min这个时间点观察p-STAT3的表达。有越来越多的研究显示,在各种啮齿类动物引发的慢性疼痛模型中经全身或鞘内应用右美托咪定有显著的镇痛效果[31-32]。然而,具体的信号转导机制涉及右美托咪定的镇痛作用尚不清楚。
STAT信号分子是细胞内信号转导的主要媒介,还涉及许多疼痛介质如促痛因子(IL-6、IFN-γ)和镇痛因子(IL-10)等[33-25]。损伤外周神经可激活大鼠脊髓STAT3磷酸化,引起神经病理性疼痛[6-18]。此外,脊髓IL-33/ST2可通过激活JAK2/STAT3信号通路加重神经病理性疼痛[36]。同样,在本实验中发现奥沙利铂可激活大鼠脊髓STAT3的磷酸化,在奥沙利铂处理后第1天就明显上调了p-STAT3蛋白的表达,第2天达到高峰,持续至第5天,提示奥沙利铂激活了JAK/STAT3信号通路。同时p-STAT3信号分子的表达是伴随着大鼠机械、冷刺激引发疼痛行为的加重而增加,这些表明STAT3信号分子参与了奥沙利铂诱导的神经病理性疼痛。这就说明奥沙利铂诱发的神经性疼痛与脊髓STAT3磷酸化存在相关性。在脊髓神经损伤研究中,发现JAK/ STAT3抑制剂可减少脊髓背角星形胶质细胞增殖和促进异常触觉恢复[36]。在大鼠结扎脊神经诱发的神经性疼痛中,JAK/STAT3信号通路阻滞剂处理后可明显减轻大鼠对机械刺激引起的异常疼痛[16]。本研究小组前期实验中发现采用JAK/STAT信号通路抑制剂AG490处理大鼠可减轻奥沙利铂诱导引发的异常疼痛[38]。STAT3抑制剂WP1066,可解除CCI大鼠的异常疼痛,是一种很有前途的治疗途径[39]。根据这些资料,发现JAK2/STAT3信号在损伤的外周和脊髓神经中被激活,其抑制剂处理后可减轻神经病理性疼痛。同样,在本实验中发现右美托咪定处理后同样可抑制大鼠脊髓STAT3磷酸化,p-STAT3在右美托咪定给药后60 min明显减少,在90 min时达高峰,持续至120 min。同时伴随着减轻大鼠机械、冷刺激引发的异常疼痛,这表明右美托咪定可减轻奥沙利铂诱导的神经病理性疼痛,这些影响可通过阿替美唑处理后被逆转。依此可以看出腹腔注射右美托咪定后可减轻奥沙利铂引起的神经性疼痛可能与抑制JAK/STAT3信号通路有关。
总之,这项研究揭示了右美托咪定的新作用,可减轻奥沙利铂诱导的大鼠神经病理性疼痛,说明右美托咪定在治疗神经病理性疼痛中具有一定的应用前景,其可能机制与抑制JAK/STAT3信号有关,但具体和明确的机制仍有待研究。
| [1] |
Screnci D, Mckeage MJ, Galettis P, et al. Relationships between hydrophobicity, reactivity, accumulation and peripheral nerve toxicity of a series of Platinum drugs[J].
Br J Cancer, 2000, 82(4): 966-72.
DOI: 10.1054/bjoc.1999.1026. |
| [2] |
Baker DE. Oxaliplatin: a new drug for the treatment of metastatic carcinoma of the colon or rectum[J].
Rev Gastroenterol Disord, 2003, 3(1): 31-8.
|
| [3] |
Mathé G, Kidani Y, Triana K, et al. A phase Ⅰ trial of trans-1-diaminocyclohexane oxalato-platinum (l-OHP)[J].
Biomed Pharmac, 1986, 40(10): 372-6.
|
| [4] |
Extra JM, Espie M, Calvo F, et al. phase Ⅰ study of oxaliplatin in patients with advanced cancer[J].
Chem Pharmac, 1990, 25(4): 299-303.
|
| [5] |
Ibrahim A, Hirschfeld S, Cohen MH, et al. FDA drug approval summaries: Oxaliplatin[J].
Oncologist, 2004, 9(1): 8-12.
DOI: 10.1634/theoncologist.9-1-8. |
| [6] |
Cersosimo RJ. Oxaliplatin-associated neuropathy: A review[J].
Ann Pharmac, 2005, 39(1): 128-35.
DOI: 10.1345/aph.1E319. |
| [7] |
Rd LJ, Wade CL, Zhong CM, et al. Attenuation of mechanical allodynia by clinically utilized drugs in a rat chemotherapy-induced neuropathic pain model[J].
Pain, 2004, 110(1/2): 56-63.
|
| [8] |
Paris A, Tonner PH. Dexmedetomidine in anaesthesia[J].
Curr Opin Anaesthesiol, 2005, 18(4): 412-8.
DOI: 10.1097/01.aco.0000174958.05383.d5. |
| [9] |
Gerlach AT, Murphy CV, Dasta JF. An updated focused review of dexmedetomidine in adults[J].
Ann Pharmacother, 2009, 43(12): 2064-74.
DOI: 10.1345/aph.1M310. |
| [10] |
Al-Metwalli RR, Mowafi HA, Ismail SA, et al. Effect of intraarticular dexmedetomidine on postoperative analgesia after arthroscopic knee surgery[J].
Br JAnaesth, 2008, 101(3): 395-9.
DOI: 10.1093/bja/aen184. |
| [11] |
Ohashi Y, Ohta N, Hirao O, et al. Analgesic effect of dexmedetomidine in a patient with herpetic stomatitis after living-donor lung transplantation[J].
JAnesth, 2008, 22(3): 297-9.
|
| [12] |
Cheung CW, Ng KF, Choi WS, et al. Evaluation of the analgesic efficacy of local dexmedetomidine application[J].
Clinic J Pain, 2011, 27(5): 377-82.
DOI: 10.1097/AJP.0b013e318208c8c5. |
| [13] |
Onttonen T, Pertovaara A. The mechanical antihyperalgesic effect of intrathecally administered MPV-2426, a novel alpha2-adrenoceptor agonist, in a rat model of postoperative pain[J].
Anesthesiology, 2000, 92(6): 1740-5.
DOI: 10.1097/00000542-200006000-00034. |
| [14] |
Nazarian A, Christianson CA, Hua XY, et al. Dexmedetomidine and ST-91 analgesia in the formalin model is mediated by 2A-adrenoceptors:a mechanism of action distinct from morphine[J].
British J Pharmac, 2008, 155(7): 1117-26.
|
| [15] |
Yamauchi K, Osuka K, Takayasu M, et al. Activation of JAK/STAT signalling in neurons following spinal cord injury in mice[J].
J Neurochem, 2006, 96(4): 1060-70.
DOI: 10.1111/jnc.2006.96.issue-4. |
| [16] |
Dominguez E, Rivat C, Pommier B, et al. JAK/STAT3 pathway is activated in spinal cord microglia after peripheral nerve injury and contributes to neuropathic pain development in rat[J].
J Neurochem, 2008, 107(1): 50-60.
DOI: 10.1111/jnc.2008.107.issue-1. |
| [17] |
Dominguez E, Mauborgne A, Mallet J, et al. SOCS3-mediated blockade of JAK/STAT3 signaling pathway reveals its major contribution to spinal cord neuroinflammation and mechanical allodynia after peripheral nerve injury[J].
J Neurosci, 2010, 30(16): 5754-66.
DOI: 10.1523/JNEUROSCI.5007-09.2010. |
| [18] |
Wang N, Liang HW, Zen K. Molecular mechanisms that influence the macrophage M1-M2 polarization balance[J].
Front Immunol, 2014, 5(3): 614.
|
| [19] |
Popiolek-Barczyk K, Kolosowska N, Piotrowska A, et al. Parthenolide relieves pain and promotes M2 microglia/macrophage polarization in rat model of neuropathy[J].
Neural Plast, 2015, 25(7): 1-15.
|
| [20] |
Ling B, Coudore-Civiale MA, Balayssac DA, et al. Behavioral and immunohistological assessment of painful neuropathy induced by a single oxaliplatin injection in the rat[J].
Toxicology, 2007, 234(3): 176-84.
DOI: 10.1016/j.tox.2007.02.013. |
| [21] |
Lim BS, Jinmoon H, Li DX, et al. Effect of bee venom acupuncture on Oxaliplatin-Induced cold allodynia in rats[J].
Evid Based ComplementAlternat Med, 2013(3): 369324.
|
| [22] |
Park HJ, Kim YH, Koh HJ, et al. Analgesic effects of dexmedetomidine in Vincristine-Evoked painful neuropathic rats[J].
J Korean Med Sci, 2012, 27(11): 1411-7.
DOI: 10.3346/jkms.2012.27.11.1411. |
| [23] |
Holmes J, Stanko J, Varchenko M, et al. Comparative neurotoxicity of oxaliplatin, cisplatin, and ormaplatin in a Wistar rat model[J].
Toxicol Sci, 1998, 46(2): 342-51.
|
| [24] |
Jamieson SM, Liu J, Connor B, et al. Oxaliplatin causes selective atrophy of a subpopulation of dorsal root ganglion neurons without inducing cell loss[J].
Cancer Chemother Pharmacol, 2005, 56(4): 391-9.
DOI: 10.1007/s00280-004-0953-4. |
| [25] |
Li DX, Lee Y, Kim W, et al. Analgesic effects of bee venom derived phospholipase a(2) in a mouse model of Oxaliplatin-Induced neuropathic pain[J].
Toxins (Basel), 2015, 7(7): 2422-34.
DOI: 10.3390/toxins7072422. |
| [26] |
Raymond E, Chaney SG, Taamma A, et al. Oxaliplatin: a review of preclinical and clinical studies[J].
Ann Oncol, 1998, 9(10): 1053-71.
DOI: 10.1023/A:1008213732429. |
| [27] |
Carrato A, Gallego J, Diaz-Rubio E. Oxaliplatin:results in colorectal carcinoma[J].
Crit Rev Oncol Hematol, 2002, 44(1): 29-44.
DOI: 10.1016/S1040-8428(01)00192-5. |
| [28] |
Khan ZP, Ferguson CN, Jones RM. Alpha-2 and imidazoline receptor agonists. their pharmacology and therapeutic role[J].
Anaesthesia, 1999, 54(2): 146-65.
DOI: 10.1046/j.1365-2044.1999.00659.x. |
| [29] |
Axelsson K, Gupta A. Local anaesthetic adjuvants: neuraxial versus peripheral nerve block[J].
Curr Opin Anaesthesiol, 2009, 22(5): 649-54.
DOI: 10.1097/ACO.0b013e32832ee847. |
| [30] |
Maruta T, Nemoto T, Satoh S, et al. Dexmedetomidine and clonidine inhibit the function of Na_v1.7 Independent of α_2-adrenoceptor in adrenal chromaffin cells[J].
JAnesth, 2011, 25(4): 549-57.
|
| [31] |
Asano T, Dohi S, Ohta S, et al. Antinociception by epidural and systemic alpha(2)-adrenoceptor agonists and their binding affinity in rat spinal cord and brain[J].
AnesthAnalg, 2000, 90(2): 400-7.
|
| [32] |
Xu B, Zhang WS, Yang JL, et al. Evidence for suppression of spinal glial activation by dexmedetomidine in a rat model of monoarthritis[J].
Clin Exp Pharmacol Physiol, 2010, 37(10): e158-66.
DOI: 10.1111/j.1440-1681.2010.05426.x. |
| [33] |
Heinrich PC, Behrmann I, Haan S, et al. Principles of interleukin (IL)-6-type cytokine signalling and its regulation[J].
Biochem J, 2003, 374(Pt 1): 1-20.
|
| [34] |
Dubovy P, Klusakova I, Svizenska I, et al. Satellite glial cells Express IL-6 and corresponding signal-transducing receptors in the dorsal root ganglia of rat neuropathic pain model[J].
Neuron Glia Biol, 2010, 6(1): 73-83.
DOI: 10.1017/S1740925X10000074. |
| [35] |
Vallejo R, Tilley DM, Vogel L, et al. The role of Glia and the immune system in the development and maintenance of neuropathic pain[J].
Pain Pract, 2010, 10(3): 167-84.
DOI: 10.1111/(ISSN)1533-2500. |
| [36] |
Liu S, Mi WL, Li Q, et al. Spinal IL-33/ST2 signaling contributes to neuropathic pain via neuronal CaMKⅡ-CREB and astroglial JAK2-STAT3 cascades in Mic[J].
Anesthesiology, 2015, 123(5): 1154-69.
DOI: 10.1097/ALN.0000000000000850. |
| [37] |
Tsuda M, Kohro Y, Yano T, et al. JAK-STAT3 pathway regulates spinal astrocyte proliferation and neuropathic pain maintenance in rats[J].
Brain, 2011, 134(Pt 4): 1127-39.
|
| [38] |
李双凤, 王亚平, 欧阳碧山, 等. p-STAT3在奥沙利铂致急性神经病理性疼痛中的作用[J].
中国疼痛医学杂志, 2018, 25(1): 8-13.
|
| [39] |
Xue ZJ, Shen L, Wang ZY, et al. STAT3 inhibitor WP1066 as a novel therapeutic agent for bCCI neuropathic pain rats[J].
Brain Res, 2014, 1583(8): 79-88.
|
 2018, Vol. 38
2018, Vol. 38

