肿瘤也被认为是一种离子通道病[1],细胞内外离子浓度及离子通道蛋白的表达及功能变化与肿瘤的侵袭转移、原发或继发性耐药密切相关[2-4]。钙离子通道阻滞剂(CCB)是一类能选择性地可逆性抑制钙离子泵、阻滞Ca2+流入细胞内,而调节、维持细胞内外钙离子浓度和离子流而影响细胞的生理病理功的药物[5]。现已证实,钙通道阻滞剂能逆转MDR引起的肿瘤耐药,并已成为肿瘤治疗的重要方法[6-8]。TMEM16A属于典型的CaCCs蛋白[9-14],在包括肝细胞癌、胃癌、结直肠癌、胰腺癌、头颈部鳞癌、乳腺癌、膀胱癌、前列腺癌及胃肠间质瘤等多种肿瘤中呈特异性过表达[15-19]在肿瘤细胞的增殖、定向迁移、侵袭转移中发挥重要作用,且TMEM16A的高表达与肿瘤的不良预后有关[20-21]。因而,TMEM16A被认为是肿瘤理想的潜在生物标志和治疗靶标,但目前尚不清楚传统钙离子通道阻滞剂及其引起细胞内外钙离子浓度改变是否也会影响TMEM16A的表达和活性以及肝癌细胞的增殖、迁徙和侵袭转移能力。本研究拟以肝癌为研究对象,探讨地尔硫卓对TMEM16A表达的影响及其对肝癌细胞运动、侵袭能力的作用和分子机制,以期为肝癌生物诊断和治疗寻找重要靶标。
1 材料和方法 1.1 细胞株与主要试剂MHCC97H、7402肝癌细胞株由本院生物诊疗中心惠赠。胰蛋白酶、胎牛血清、DMEM培养液、MTT细胞增殖及细胞毒性检测试剂盒购自碧云天生物技术有限公司、TMEM16A cDNA由上海尼桑生物科技有限公司合成、盐酸地尔硫卓注射液(10 mg/支)购自田边三菱制药株式会社、细胞RNA提取试剂盒、荧光定量PCR检测试剂盒购自北京康维世纪。
1.2 细胞培养MHCC97H、7402肝癌细胞株置于含10%胎牛血清、100U/mL链霉素、100 g/mL青霉素的DMEM培养液,于37 ℃、5% CO2的细胞培养箱进行培养。间隔1~2 d换培养液1次,细胞长至90%融合时,0.25%胰酶消化,以1:3传代,取对数生长期的细胞进行试验。
1.3 MTT法测定肝癌细胞的增殖选取对数生长期的MHCC97H、7402肝癌细胞,以5×103个/孔接种于96孔板,当细胞数达到1.0×105/mL时,分别按照0、25、50、100、200、400 μmol/L的终浓度加入盐酸地尔硫卓溶液,并分别培养12、24、48 h后加入MTT,作用4 h后再加入DMSO孵育30 min,在570 nm处测定吸光度(A570),每组设8个复孔。细胞生长抑制率(%)=(1-实验组吸光度(A570)/对照组吸光度(A570))×100%。
1.4 体外细胞划痕实验检测处理后肝癌细胞运动侵袭能力采用体外细胞划痕实验观察盐酸地尔硫卓对MHCC97H、7402肝癌细胞运动的影响。常规方法等量接种细胞于六孔板;培养细胞至细胞密度70~80%时,分别加入盐酸地尔硫卓溶液,使其终浓度达到0、25、50、100、200、400 μmol/L,并分别培养12、24、48 h后用200 μL无菌枪头垂直于培养孔地面划痕,每组设2个复孔。采用倒置显微镜分别于于0、12、24、48 h检测细胞生长、运动情况并拍照记录。
1.5 采用RT-PCR检测肝癌细胞中TMEM16A mRNA的表达Trizol法提取各组MHCC97H、7402肝癌细胞中总RNA,根据康维世纪公司RT-PCR试剂说明书进行反转录cDNA。以cDNA为模板进行RT-PCR反应并对结果进行分析,引物设计:TMEM16AUp:5'-AACGGGACC ATGCACGGCTT-3'和down:3'-TGTTGTGGTGGTTG CACGGC-5'。
1.6 采用免疫细胞化学检测肝癌细胞中TMEM16A蛋白表达分别取对数生长期的MHCC97H、7402细胞,接种于24孔板,细胞长至对数期时,分别加入盐酸地尔硫卓溶液,使其终浓度达到0、25、50、100、200、400 μmol/ L后,在分别培养12、24、48 h,然后用10%的福尔马林固定30 min,免疫细胞化学SP法直接在培养板内染色,DAB显色,加入PBS保存,直接在倒置显微镜下观察TMEM16A蛋白在肝癌细胞中的表达。
1.7 免疫细胞化学结果判定按照胞浆型分子免疫组化结果判读方法进行判读[22]:在低倍镜下(4 ×或10 ×)浏览培养孔,观察TMEM16A蛋白在肝癌细胞中的表达模式和阳性强度及阳性百分比(阳性细胞数或面积占同类型细胞的百比例)并进行分级:0(阴性):无着色;1+(弱阳性):≤10%的细胞呈现不同程度的细胞质着色;2+(阳性):10%~ 30%的细胞呈现强的棕褐着色的细胞质着色,或≤70%的细胞呈现弱或中等强度的细胞质着色;3+(强阳性):>30%的细胞呈现强的棕褐着色的细胞质着色或>70%的中等强度细胞质着色。
1.8 统计学分析采用SPSS18.0统计软件进行结果分析,所有数据以均数±标准差表示,组间均数比较采用单因素方差分析用LSD法进行两两比较,P < 0.05为差异有统计学意义。
2 结果 2.1 盐酸地尔硫卓对MHCC97H、7402肝癌细胞增殖的影响不同浓度盐酸地尔硫卓(0、25、50、100、200、400 μmol/L)对MHCC97H、7402肝癌细胞株的增殖均有抑制作用,且具有一定时间和浓度依赖性(表 1、2)其中100、200 μmol/L浓度的地尔硫卓作用12 h对MHCC97H肝癌细胞抑制较明显,而400 μmol/L浓度的地尔硫卓作用12 h对7402肝癌细胞抑制较明显,与对照组比较具有统计学差异(P < 0.05)。
| 表 1 盐酸地尔硫卓对人肝癌MHCC97H细胞增殖的影响 Table 1 Effect of diltiazem hydrochloride on proliferation of MHCC97H cells (n=3, Mean±SD) |
| 表 2 盐酸地尔硫卓对人肝癌7402细胞增殖的影响 Table 2 Effect of diltiazem hydrochloride on proliferation of 7402 cells (n=3, Mean±SD) |
细胞划痕实验发现地尔硫卓能抑制肝癌细胞株MHCC97H、7402细胞的运动爬行能力,但是,随着时间的延长,细胞爬行运动能力逐渐恢复,说明单次使用地尔硫卓对肝癌细胞的运动爬行能力在短时间内有抑制作用,但会随着时间的延长而消失(图 1)。

|
图 1 细胞划痕实验观察地尔硫卓对MHCC97H、7402肝癌细胞运动能力的影响 Figure 1 Effect of diltiazem on mobility of MHCC97H and 7402 cells assessed by wound healing assay (Original magnification: ×400). 1-4: Growth and migration of MHCC97H cells at 0, 12, 24 and 48 h after application of diltiazem; 5-8: Control cells at the corresponding time points; 9-12: Growth and migration of 7402 cells at 0, 12, 24 and 48 h after application of diltiazem; 13-16: The corresponding control cells. |
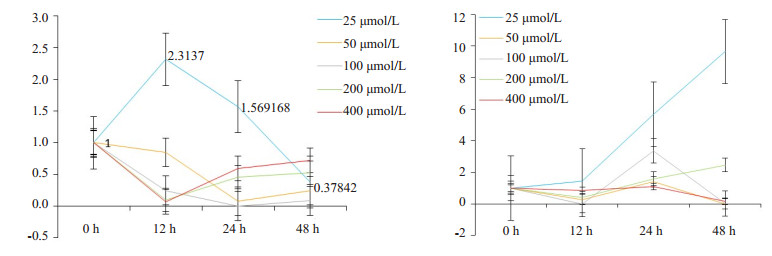
不同剂量地尔硫卓对肝癌细胞中TMEM16AmRNA表达的影响稍有不同,低剂量(25 μmol/L)地尔硫卓一过性上调MHCC97H肝癌细胞中TMEM16A mRNA表达,而提高剂量则显示出轻度下调MHCC97H肝癌细胞中TMEM16A mRNA表达的作用。虽然低剂量(25 μmol/L)地尔硫卓可上调7402肝癌细胞中TMEM16A mRNA表达,但提高地尔硫卓剂量(50~400 μmol/L)则也显示一过性轻度改变7402肝癌细胞中TMEM16A mRNA表达的作用(图 2)。
|
图 2 不同浓度地尔硫卓在不同时间对不同肝癌细胞TMEM16AmRNA相对表达(2-△△Ct)的影响 Figure 2 Effect of different concentrations of diltiazem on mRNA expression of TMEM16A in hepatocellular carcinoma cells (n=3, Mean ± SD). Left: TMEM16A mRNA expression in MHCC97H cells, which showed significant decreases in TMEM16A mRNA expression following treatment with 50 and 100 μmol/L diltiazem for 24 h (*P < 0.05, **P < 0.01 vs control). Right: TMEM16A mRNA expression in 7402 cells showing the most significant decreases in TMEM16A mRNA expression following treatment with 50 μmol/L diltiazem for 48 h (*P < 0.05, **P < 0.01 vs control). |
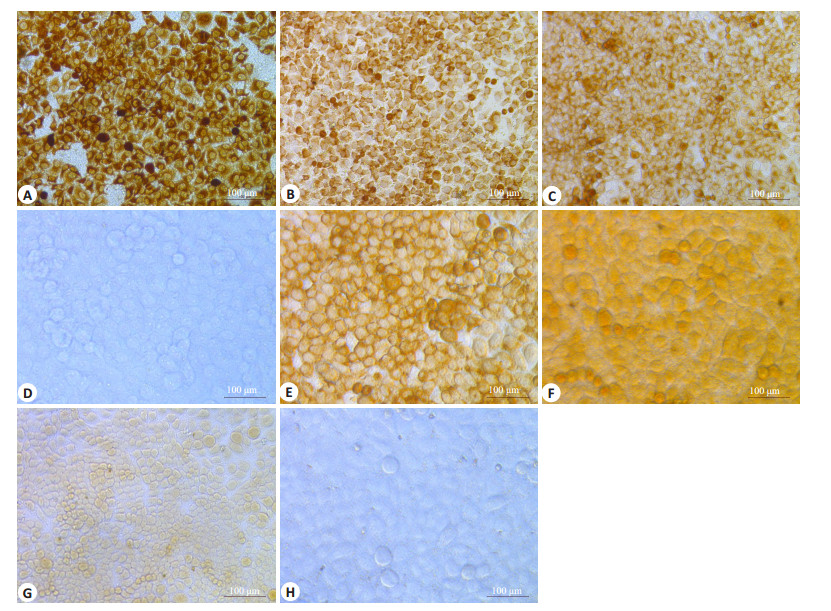
采用不同浓度地尔硫卓孵育MHCC97H、7402肝癌细胞,发现随着地尔硫卓浓度的升高和孵育时间的延长,MHCC97H肝癌细胞中TMEM16A蛋白的表达呈现一过性的降低后逐渐恢复正常表达,而在7402肝癌细胞中TMEM16A蛋白的表达则可呈现一过性上调后逐渐恢复正常表达,且其表达的变化趋势与TMEM16AmRNA表达的变化趋势基本相同(图 3)。
|
图 3 地尔硫卓对MHCC97H、7402肝癌细胞中TMEM16A蛋白表达 Figure 3 Effect of diltiazem on protein expression of TMEM16A in MHCC97H and 7402 cells (immunohistochemistry with SP method, × 400). A-C: MHCC97H cells treated with diltiazem at 25 μmol/L for 12 h, at 400 μmol/L for 24 h, and at 200 μmol/L for 48 h, respectively; D, H: Control group; E-G: 7402 cells treated with diltiazem at 50 μmol/L for 12 h, at 25 μmol/L for 24 h, and at 100 μmol/L for 48 h, respectively. |
现已发现多种TMEM16A抑制物(如,艾地苯醌、咪康唑、白花丹素、黄酮类物质等)具有潜在的抗肿瘤作用[23-24]。地尔硫卓属于CCB,具有抑制钙离子内流和抑制肿瘤生长的作用[25]。本研究发现地尔硫卓能以时间和浓度依赖性方式抑制肝癌MHCC97H、7402细胞的增殖,单次使用地尔硫卓可一过性抑制肝癌细胞的运动。且其效果可因肿瘤来源的不同而有所差异。这与Adrian[21]、Sauter等[26]发现的抑制TMEM16A表达不仅可降低小鼠移植瘤细胞的增殖和转移能力,还可显著抑制鳞癌Hep-2和SCC-25细胞的增殖的研究结果一致。同时,这一结果也得到其他学者研究结果的支持,如TMEM16A抑制因子艾地苯醌虽能强效阻断PC-3和CFPAC-1细胞高表达的TMEM16A的活性而抑制细胞增殖并诱导细胞凋亡,但对A549细胞的作用并不明显[23]。
此外,还有学者证实TMEM16A有可能是肿瘤生长的驱动因子,通过启动子的甲基化途径在肿瘤的增殖和转移的平衡中发挥作用[27]。且TMEM16A在多种肿瘤中的过表达与11q13染色体区基因的扩增有关[16],并能通过活化EGFR和CAMK信号通路促进乳腺癌的进展[21]。但其引起的肿瘤恶性转化的分子机制仍不清楚。虽然,目前尚未有资料证明地尔硫卓可直接调控TMEM16A mRNA和蛋白表达,也并未在TMEM16A中发现或确认存在已知的钙离子或钙调蛋白结合位点(如EF手结构)[24, 28],有学者推测[28]TMEM16A蛋白膜内第一个折返环的4个紧邻谷氨酸组成的与钙激活钾通道相似的“钙碗”结构有可能是钙离子结合位点的观点也未得到确认。但是,本研究发现地尔硫卓能以明显的时间、剂量依赖性特征同步调节TMEM16A mRNA和蛋白的表达水平,且不同来源的肝癌细胞呈现不同的剂量效应。这也说明地尔硫卓能通过直接阻滞钙离子通道蛋白,抑制钙离子内流,并有可能反馈性地影响TMEM16A mRNA和蛋白的表达,从而现实其对肝癌细胞增殖和迁徙运动功能的有效抑制。同时,本研究结果也提示TMEM16A蛋白中可能确实存在钙离子结合位点。当然,对于上述推论仍有待进一步研究予以证实。
总之,本研究发现单次使用地尔硫卓不仅能以时间、剂量依赖性方式一过性抑制肝癌细胞的增殖和运动,还能同步一过性下调TMEM16A mRNA和蛋白的表达而发挥肿瘤抑制作用,但其分子机制仍不清楚。同时,该研究也提示TMEM16A蛋白中可能存在钙离子结合位点。因此,继续摸索地尔硫卓的给药方式,深入研究地尔硫卓调节肝癌细胞中TMEM16A的表达、抑制肝癌细胞迁徙运动能力的分子机制仍旧具有重要的临床意义。
| [1] |
Litan A, Langhans SA. Cancer as a channelopathy: ion channels and pumps in tumor development and progression[J].
Front Cell Neurosci, 2015, 9: 86.
|
| [2] |
Monteith G R, Mcandrew D, Faddy H M, et al. Calcium and cancer: targeting Ca2+ transport[J].
Nature Reviews Cancer, 2007, 7(7): 519-30.
DOI: 10.1038/nrc2171. |
| [3] |
Saraswathy M, Gong S. Different strategies to overcome multidrug resistance in cancer[J].
BiotechnolAdv, 2013, 31(8): 1397-407.
|
| [4] |
Qu Z, Yao W, Yao R, et al. The Ca2+ activated Cl- channel, ANO1 (TMEM16A), is a double-edged sword in cell proliferation and tumorigenesis[J].
Cancer Med, 2014, 3(3): 453-46.
DOI: 10.1002/cam4.232. |
| [5] |
GraudinsA, Lee HM, Druda D. Calcium channel antagonist and betablocker overdose: antidotes and adjunct therapies[J].
Br J Clin Pharmacol, 2016, 81(3): 453-61.
DOI: 10.1111/bcp.v81.3. |
| [6] |
Cui C, Merritt R, Fu L, Pan Z. Targeting calcium signaling in cancer therapy[J].
Acta Pharm Sin B, 2017, 7(1): 3-17.
DOI: 10.1016/j.apsb.2016.11.001. |
| [7] |
Büsselberg D, Florea AM. Targeting intracellular calcium signaling ([J].
Cancers, 2017, 9(5).
|
| [8] |
Dinic J, Podolski-Renic A, Stankovic T, et al. New approaches with natural product drugs for overcoming multidrug resistance in cancer[J].
Curr Pharm Des, 2015, 21(38): 5589-604.
DOI: 10.2174/1381612821666151002113546. |
| [9] |
Kakkar A, Mathur SR, Jain D, et al. Utility of DOG1 immunomarker in fine needle aspirates of gastrointestinal stromal tumor[J].
Acta Cytol, 2015, 59(1): 61-7.
DOI: 10.1159/000370057. |
| [10] |
Pedemonte N, Galietta LJ. Structure and function of TMEM16 proteins (anoctamins)[J].
Physiol Rev, 2014, 94(2): 419-59.
DOI: 10.1152/physrev.00039.2011. |
| [11] |
Wang H, Zou L, Ma K, et al. Cell-specific mechanisms of TMEM16A Ca2+-activated chloride channel in cancer[J].
Mol Cancer, 2017, 16(1): 152.
DOI: 10.1186/s12943-017-0720-x. |
| [12] |
Hartzell HC, Yu K, Xiao QH, et al. Anoctamin/TMEM16 family members are Ca2+-activated Cl-channels[J].
J Physiol, 2009, 587(10): 2127-39.
DOI: 10.1113/jphysiol.2008.163709. |
| [13] |
Ferrera L, Caputo A, Galietta LJ. TMEM16A protein: a new identity for Ca2+-dependent Cl channels[J].
Physiology (Bethesda), 2010, 25(6): 357-63.
|
| [14] |
Huang F, Wong X, Jan LY. International union of basic and clinical pharmacology. LXXXV: calcium-activated chloride channels[J].
Pharmacol Rev, 2012, 64(1): 1-15.
DOI: 10.1124/pr.111.005009. |
| [15] |
Qu Z, Yao W, Yao R, et al. The Ca(2+) -activated Cl(-) Channel, ANO1 (TMEM16A), is a double-edged sword in cell proliferation and tumorigenesis[J].
Cancer Med, 2014, 3(3): 453-61.
DOI: 10.1002/cam4.232. |
| [16] |
Wu HZ, Guan S, Sun ML, et al. Ano1/TMEM16A overexpression is associated with good prognosis in PR-Positive or HER2-Negative breast cancer patients following tamoxifen treatment[J].
PLoS One, 2015, 10(5): e0126128.
DOI: 10.1371/journal.pone.0126128. |
| [17] |
杨军, 刘妮, 康安静, 等. TMEM16A在胃腺癌中的表达及意义[J].
南方医科大学学报, 2012, 32(6): 794-7.
|
| [18] |
杨军, 刘妮, 康安静, 等. TMEM16A在结肠癌组织中的表达及其意义[J].
世界华人消化杂志, 2012, 35: 3464-9.
|
| [19] |
杨军, 刘妮, 康安静, 等. 特异性生物标记物DOG1在胃肠间质瘤中的表达[J].
诊断病理学杂志, 2013, 20(5): 282-5.
|
| [20] |
Jacobsen KS, Zeeberg K, Sauter D, et al. The role of TMEM16A (ANO1) and TMEM16F (ANO6) in cell migration[J].
Pflugers Arch, 2013, 465(12): 1753-62.
DOI: 10.1007/s00424-013-1315-z. |
| [21] |
Britschgi A, Bill A, Brinkhaus H, et al. Calcium-activated chloride channel ANO1 promotes breast cancer progression by activating EGFR and CAMK signaling[J].
Proc Natl Acad Sci USA, 2013, 110(11): E1026-34.
DOI: 10.1073/pnas.1217072110. |
| [22] |
杨军, 康安静, 苏宝山, 等. 免疫组织化学检测结果判读进展[J].
中华临床医师杂志:电子版, 2014, 8(20): 3699-703.
|
| [23] |
Seo Y, Park J, Kim M, et al. Inhibition of ANO1/TMEM16A chloride channel by idebenone and its cytotoxicity to cancer cell lines[J].
PLoS One, 2015, 10(7): e0133656.
DOI: 10.1371/journal.pone.0133656. |
| [24] |
Zhang X, Li H, Zhang H, et al. Inhibition of TMEM16A calciumactivated chloride channels by natural flavonoids contributes to flavonoid anticancer effects[J].
Br J Pharmacol, 2017, 174(14): 2334-45.
DOI: 10.1111/bph.v174.14. |
| [25] |
Kaddour-Djebbar I, Choudhary V, Lakshmikanthan V, et al. Diltiazem enhances the apoptotic effects of proteasome inhibitors to induce prostate cancer cell death[J].
J Pharmacol Exp Ther, 2012, 341(3): 646-55.
DOI: 10.1124/jpet.111.188151. |
| [26] |
Sauter D, Novak I, Pedersen SF, et al. ANO1 (TMEM16A) in pancreatic ductal adenocarcinoma (PDAC)[J].
Pflugers Arch, 2015, 467(7): 1495-508.
DOI: 10.1007/s00424-014-1598-8. |
| [27] |
Shiwarski DJ, Shao CB. To"grow"or"go: TMEM16A expression as a switch between tumor growth and metastasis in SCCHN[J].
Clin Cancer Res, 2014, 20(17): 4673-88.
DOI: 10.1158/1078-0432.CCR-14-0363. |
| [28] |
Bao L, Kaldany C, Holmstrand EC, et al. Mapping the BKCa Channel's "Ca2+ bowl{"}: side-chains essential for Ca2+ sensing[J].
J Gen Physiol, 2004, 123(5): 475-89.
DOI: 10.1085/jgp.200409052. |
 2018, Vol. 38
2018, Vol. 38

