2. 南京制药厂有限公司新药研发中心,江苏 南京 210007;
3. 广州医科大学附属肿瘤医院肿瘤放射中心,广东 广州 510095;
4. 邵阳市中心医院药剂科,湖南 邵阳 422000
2. R&D Center, Nanjing Pharmaceutical Factory Co., Ltd., Nanjing 210007, China;
3. Department of Radiation Oncology, Affiliated Cancer Hospital of Guangzhou Medical University, Guangzhou 510282, China;
4. Department of Pharmacy, Shaoyang Central Hospital, Shaoyang 422000, China
目前,FDA批准上市的针对PD-L1的单克隆抗体有Atezolizumab [1]、Avelumab [2]及Durvalumab [3]。PD-L1抗体药物具有较好的疗效,副作用相对化疗药物较小[4]。但仍存在着免疫毒副作用,且容易因靶蛋白突变而产生耐药性[5-6]。因此,需要在更高水平如mRNA或DNA水平以靶向抑制PD-L1,降低毒副作用及耐药机率,增强抗肿瘤效应。
RNA干扰(RNAi)技术是基因功能的研究和疾病的基因治疗的重要工具[7-8]。目前关于针对PD-L1靶点的siRNA药物研究较少[9],如将针对PD-L1基因的siRNA制备成具有肿瘤靶向性三元复合物[10],纳米粒[11-12],胶束[13]等,可特异性的沉默肿瘤细胞中PD-L1基因表达,激活T淋巴的杀伤作用,抑制肿瘤细胞增殖。与抗体药物相比,siRNA药物可从mRNA水平特异性沉默PD-L1蛋白的表达,除了具有抗体药物药效外,还可避免因PD-L1蛋白突变而失效的发生,此外构建肿瘤靶向载体给药,可有效降低其他器官的免疫毒副作用[14-15]。因此,在mRNA水平抑制PD-L1蛋白的siRNA药物,可单独或联合现有抗体药物使用,具有极大的治疗肿瘤的潜力。
siRNA序列具有碱基序列特异性及双链退火温度(Tm)差异性,针对相同靶基因设计的不同siRNA序列,其沉默效率、脱靶效应及免疫原性等存在差异[16-17]。因此,设计并得到高效的siRNA序列是开发RNAi药物的基础。本研究首先通过计算机辅助设计了多条靶向PD-L1 mRNA的候选siRNA序列,然后通过RT-qPCR、流式细胞术及Western blot实验,在基因和蛋白水平筛选出能高效特异性沉默U87 MG细胞中PD-L1 mRNA表达的最佳序列。进一步应用流式细胞术及CCK-8实验验证了CD8+T细胞对经最佳siRNA序列转染后U87 MG细胞的凋亡及增殖的影响,为基于PD- L1 siRNA序列的肿瘤疗法的研究奠定了基础。
1 材料和方法 1.1 材料胎牛血清、DMEM培养基等均购自Gibco。siRNA及引物由广州锐博公司合成。Trizol试剂,转染试剂Lipofectamine 2000、opti-MEM等均购自Invitrogen。逆转录试剂盒,实时定量荧光(Real-time)PCR相关试剂购自日本TakaRa。PD-L1 Monoclonal Antibody(MIH5)-PE购自Ebioscience。Anti-human PD-L1(17952-1-AP)、辣根过氧化物酶(HRP)标记的山羊抗兔二抗,购自Proteintech。PVDF膜购自Millipore。CCK 8试剂盒购自日本同仁化学公司。细胞凋亡检测试剂盒购自广州杰特伟生物科技有限公司。CD8+T细胞分离试剂盒购自德国美天旎公司。
1.2 仪器ABI 7500实时定量PCR仪:美国Life;超净工作台(JW-CJ-1F):苏州净化设备厂;IX71型倒置显微镜:日本Olympus;Galaxy S型CO2培养箱:英国Galaxy R;5810 R型高速离心机:德国Eppendorf;FACSCalibur流式细胞仪:美国BD;Mini电泳槽:Amershem。
1.3 方法 1.3.1 设计沉默PD-L1基因的siRNA序列根据Tuschl等[18]提出的siRNA设计规则在所选基因的启动子100个碱基以后开始设计;正义链的GC含量应为30%~ 50%;正义链的第1个碱基必须为G或C;正义链的第10个碱基是U;正义链的第13个碱基不能是G;正义链的第19个碱基不能是G或C应尽量避免出现稳定的发夹型二级结构,并运用BLAST在Genbank中进行同源性分析。根据siRNA的设计原则,采用siDirect软件设计,获得针对PD-L1基因(序列号NM_001141351.1)表达的不同核苷酸序列的siRNA。运用BLAST进行同源性分析,在Genbank中进行BLAST,确定序列无误并且与其它基因不存在同源性,最终确定序列,由广州市锐博生物科技公司合成。
1.3.2 人神经胶质瘤细胞系培养人神经胶质瘤细胞系(U87 MG),购置于ATCC。U87 MG细胞贴壁生长于含10%胎牛血清的DMEM高糖培养基中,培养条件为37 ℃、5% CO2,2 d换液1次,4 d传代1次。
1.3.3 实验分组实验组:加入含siPD-L1-1~10与Lipofectamine 2000转染混合物,siRNA终浓度为100 nmol/L。阳性对照组:以专利(专利号US20170067060)中的沉默PD-L1基因的siRNA序列(siPD-L1-PC)为阳性对照。加入含siPD-L1-PC与Lipofectamine 2000转染混合物,siRNA终浓度为100 nmol/L。阴性对照组:加入与人转录组无同源性的siRNA序列(siNC),siRNA终浓度100 nmol/L。空白对照组(Control):只加入Lipofectamine 2000转染试剂。每组设3个复孔。
1.3.4 对U87 MG细胞进行siPD-L1的转染取对数生长期的细胞,接种于12孔板中,5×104/孔。待细胞贴壁后,移去完全培养基,用PBS洗2遍,每孔加入400 μL Opti-MEM。按照实验分组,每组分别将3 μL的lipofectamine 2000加入150 μL的Opti-MEM中,将7.5 μL siRNA加入150 μL的Opti-MEM中,室温下放置5 min后,混合,室温孵育15 min,配置成转染液。每组3个复孔,每孔加100 μL转染液,置于37 ℃,5% CO2孵箱中培养。培养12 h后换液,继续培养36 h后检测转染效率。
1.3.5 RT-qPCR法检测U87 MG细胞PD-L1 mRNA表达水平收集转染后的细胞样本,参照Trizol试剂盒说明书,每个样品孔中加入1 mL细胞裂解液(Trizol),充分裂解后,将细胞裂解液吸至无菌去酶的EP管中。每支EP管中加入200 μL氯仿,剧烈振荡15 s,静置10 min。4 ℃,12 000 g/min离心15 min。吸取上层的水相,转至另一EP管中。加入200 μL异丙醇,轻轻颠倒混匀,于静置放置10 min。4 ℃,2000 g/min离心15 min,可见RNA白色沉淀。弃上清,加入l mL 75%乙醇,清洗沉淀后,每支EP管中加入适当DEPC水溶解沉淀,测定RNA的浓度和纯度。
按照反转录配置反应液:5 × PrimeScript@ RT Master Mix for Real Time*1 2 μL,RNase Free dH2O 6 μL,样品2 μL。按以下条件反转录成cDNA,37 ℃ 15 min→85 ℃ 5 s→4 ℃。
用Primer primier 5软件设计PD-L1引物进行RTPCR检测。
PD-L1引物序列:正向5'-TGTACCGCTGCATGATCAG-3';
反向5'-AGTTCATGTTCAGAGGTGACTG-3';
GAPDH引物序列:正向5'-CGGAGTCAACGGATTTGGTCGTAT-3';
反向5'-AGCCTTCTCCATGGTGGTGAAGAC-3'。
按下列组成配置PCR反应液:SYBR premix Ex Tap Ⅱ(2×)(10 μL),ROX Reference Dye(50×)(0.4 μL),Primer F/R(0.8 μL, 10 μmol/L),sample cDNA(2 μL),RNase Free dH2O(6 μL)。混匀后按以下条件进行PCR反应:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s。40个循环,然后进行数据分析:各目的基因表达水平的变异用变化倍率2-△△Ct以计算来表示。
1.3.6 Western bolt法检测U87 MG细胞PD-L1蛋白表达水平把siPD- L1-NC、siPD-L1-PC、siPD- L1-3、siPD-L1-5和siPD-L1-8分别转染细胞后,提取转染各组细胞的总蛋白:转染72 h后弃去培养基,用预冷的PBS洗细胞2~3次。加入RIPA蛋白提取试剂(每个皿中加入RIPA裂解液200 μL和PMSF 20 μL),于冰上裂解30 min(不断晃动使裂解充分)。用干净的刮棒将细胞刮于培养瓶一侧,然后将细胞碎片和裂解液移至1.5 mL离心管中,整个操作在冰上进行。于4 ℃,12 000×g离心15 min,将离心后的上清液转移至0.5 mL的干净无菌离心管中,BCA法测蛋白含量。各样品组上样量相同,进行Western blotting检测:SDS-PAGE电泳分离蛋白,将凝胶上的蛋白用湿法转移到PVDF膜上,用5%牛血清白蛋白封闭PVDF膜上不含目的蛋白的结合位点,然后用anti-human PD-L1(17952-1-AP, proteintech)的抗体(一抗)处理,接着再用辣根过氧化物酶(HRP)标记的二抗与一抗结合。用ECL显影。
1.3.7 流式细胞术检测U87 MG细胞表面PD-L1的蛋白表达水平U87 MG细胞分别经lipofectamine 2000转染siNC,siPD-L1-PC、siPD-L1-1~10后,将上述各组实验样本用PBS洗涤2次,消化(1000 r/min离心5 min)收集细胞,加入100 μL PBS悬浮细胞后,加入5 μL PD-L1抗体混匀后,于4 ℃在避光条件下反应30 min。反应完全后,离心,去除抗体,用PBS洗2遍后,用200 μL PBS重悬细胞,上机检测。
1.3.8 人CD8+T细胞的提取分离(CD8磁珠阳性选择富集CD8+T细胞)80 μL PBMCs+20 μL CD8磁珠,混匀,4 ℃冰箱孵育15 min;加1~2 mL PBS(含1% FCS),1800 r/min,离心5 min,PBS(含1% FCS)重悬细胞,调整细胞密度为1×108/mL(备用);将分选柱置于磁铁上,预先用3 mL PBS(含1% FCS)冲洗分选柱(LS),保持分选柱湿润,将上述细胞悬液过柱,细胞悬液不中断,过柱后3 mL PBS(含1% FCS)洗3遍;取下分选柱,分选柱内加5 mL PBS(含1% FCS),用推头推出分选柱内液体并收集,所收集液体即为CD8+T细胞悬液。
1.3.9 流式细胞术检测CD8+T细胞对转染siPD-L1后的U87 MG细胞凋亡的影响U87 MG细胞分别经lipofectamine 2000转染siNC,siPD-L1-PC,siPD-L1-1~ 10等48 h后,每孔加入约4×104人CD8+T细胞共同孵育。24 h后,消化各组细胞,PBS清洗两遍,加入5 μL Annexin V-FITC,5 μLPI后,4 ℃,孵育15 min,上机检测。
1.3.10 CCK-8检测CD8+T细胞对转染siPD-L1后的U87 MG细胞增殖的影响U87 MG细胞分别经lipofectamine 2000转染siNC,siPD-L1-PC,siPD-L1-1~ 10等48 h后,每孔加入约4×104 CD8+T细胞共同孵育。24 h后,PBS清洗2遍,洗去T细胞,加入CCK-8试剂孵育1 h后,在450 nm波长进行上机检测。
1.4 统计学分析采用SPSS 20.0统计软件分析,数据均以均数±标准差表示,多组间比较采用单因素方差分析,检验水准为α=0.05,P < 0.05为差异有统计学意义。
2 结果 2.1 核苷酸序列采用siRNA设计法则并结合计算机辅助设计软件所设计候选的siRNA靶序列、正义链和反义链中含有的核苷酸序列(表 1)。
| 表 1 候选的siRNA靶序列、正义链和反义链中含有的核苷酸序列 Table 1 Nucleotide sequences contained in candidate siRNAtarget sequences, sense and antisense strands |
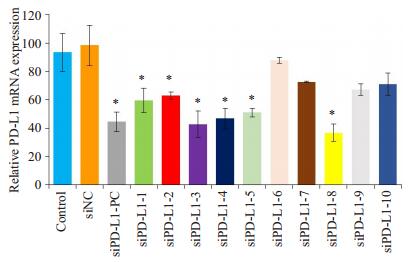
RT-qPCR验证siPD-L1-1~10在U87 MG细胞中沉默PD-L1 mRNA效率,实验结果如图 1所示,在mRNA水平,与Control组比,siPD-L1-1、siPD-L1-2 siPD-L1-3、siPD-L1-4、siPD-L1-5及siPD-L1-8均显著沉默PD-L1基因mRNA的表达(P < 0.05),其效果与siPD-L1-PC作用类似。
|
图 1 RT-qPCR检测U87 MG细胞中PD-L1的mRNA表达 Figure 1 Expression of PD-L1 mRNA levels in transfected U87 MG cells detected by RT-qPCR. *P < 0.05 vs control. |
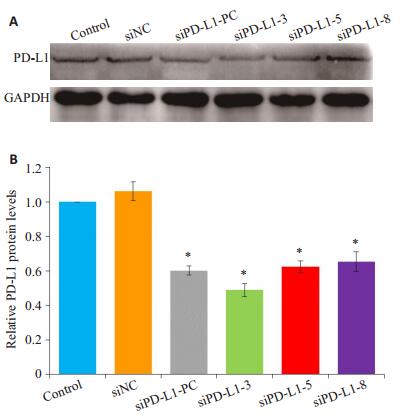
Western blot验证siPD-L1-NC、siPD-L1-PC、siPDL1-3、siPD-L1-5和siPD-L1-8在U87 MG细胞中沉默PD-L1效率,实验结果如图 2所示,在蛋白水平,与Control组比,siPD-L1-3、siPD-L1-5及siPD-L1-8均显著沉默PD-L1基因蛋白的表达(P < 0.05),其效果与siPD-L1-PC作用类似。
|
图 2 U87 MG细胞中PD-L1的蛋白表达量 Figure 2 Expression of PD- L1 protein in transfected U87 MG cells. A: Western blotting for PD-L1 expression; B: Quantitative analysis of PD-L1 protein levels. *P < 0.05 vs control. |
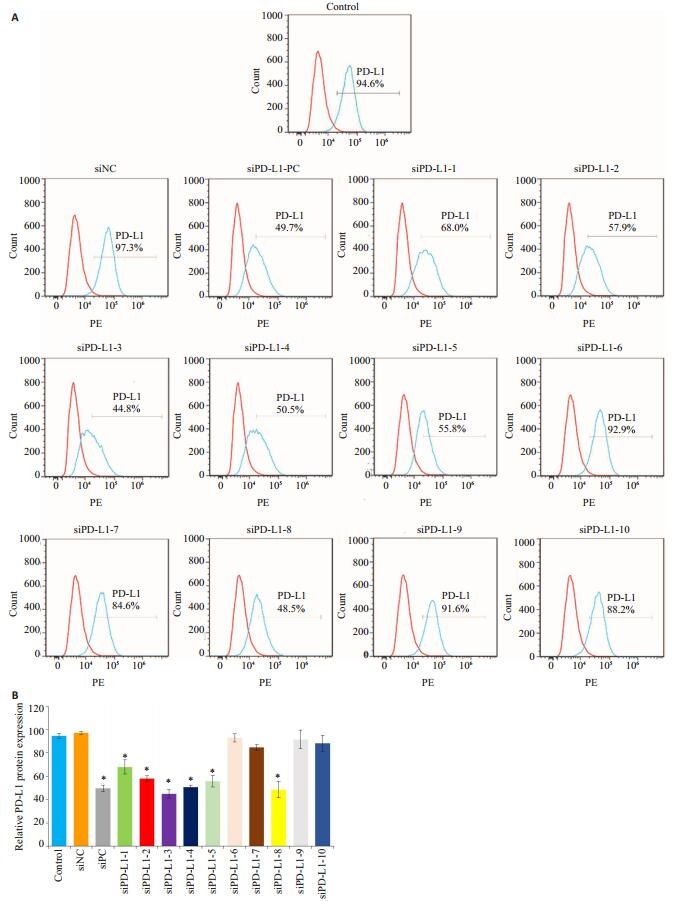
流式细胞术验证siPD-L1-1~10在U87 MG细胞中沉默PD-L1蛋白效率,结果如图 3所示,在蛋白水平,与Control组比,siPD-L1-1、siPD-L1-2 siPD-L1-3、siPDL1-4、siPD-L1-5及siPD-L1-8均显著沉默PD-L1蛋白的表达(P < 0.05),其效果与siPD-L1-PC作用类似。以siPD-L1-3、siPD-L1-5及siPD-L1-8效果较佳,并对这3条序列进行后续的细胞功能研究。其中siPD-L1-3沉默效率最高,剩余PD-L1蛋白表达量为44.8%。
|
图 3 U87 MG细胞表面PD-L1蛋白表达量 Figure 3 PD-L1 protein expression on U87 MG cell surface detected by flow cytometry (A) and quantitative analysis (B). *P < 0.05 vs control. |
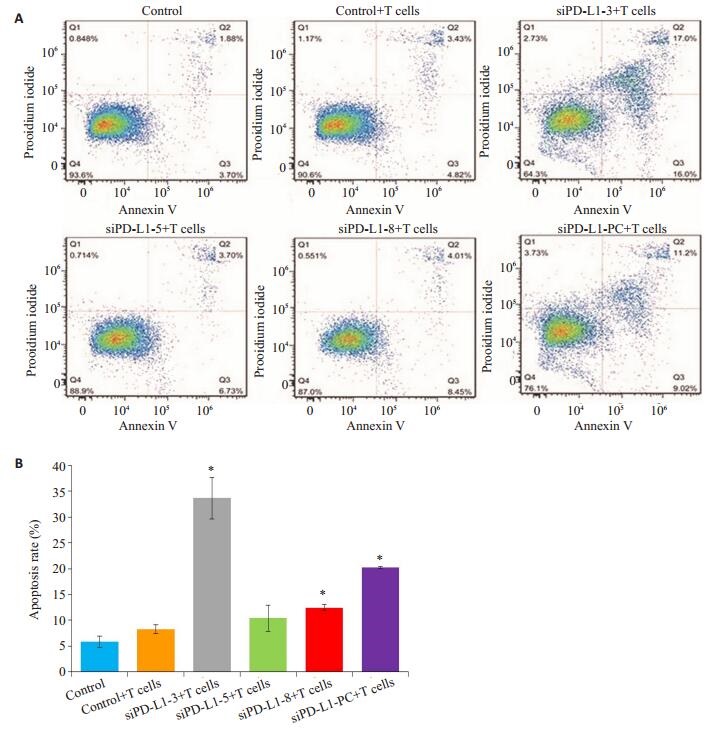
流式细胞术验证,转染相应的siPD-L1序列沉默PD-L1后,研究人CD8+T细胞对U87 MG细胞的杀伤作用。实验结果如图 4显示,与对照组相比,siPD-L1-3和siPD-L1-8均明显增强CD8+T细胞对肿瘤细胞的杀伤作用(P < 0.05),其中siPD-L1-3的作用最为显著,凋亡率为33%。
|
图 4 U87 MG细胞凋亡率 Figure 4 Apoptotic rate of transfected U87 MG cells incubated with human CD8+T lymphocytes. A: Results of flow cytometry; B: Quantitative analysis of the results. *P < 0.05 vs control. |
CCK-8实验检测转染相应的siPD-L1序列沉默PD-L1后,研究人CD8+T细胞对U87MG细胞增殖抑制作用。实验结果如图 5显示,与对照组相比,siPD-L1-3和siPD-L1-8均明显增强CD8+T细胞对肿瘤细胞增殖的抑制(P < 0.05),其中siPD-L1-3的作用最为显著,抑制率可达60%。
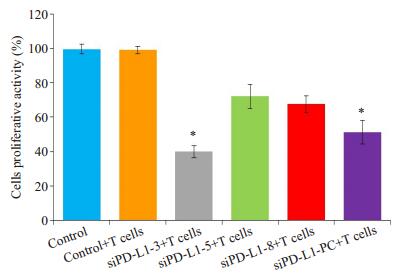
|
图 5 CCK-8检测U87 MG细胞增殖情况 Figure 5 Proliferation of transfected U87 MG cells incubated with human CD8+T lymphocytes detected by CCK-8 assay. *P < 0.05 vs control. |
研究发现,在神经胶质瘤患者体内,PD-L1的高表达能够增强肿瘤的转移及免疫逃逸能力,导致患者死亡率上升[19-20]。因此,设计小分子抑制剂、抗体或者siRNA抑制PD-1或PD-L1通路,从而利用机体T细胞直接杀灭肿瘤细胞,已成为肿瘤免疫疗法的热点[21-22]。
RNA干扰效应分子有micro RNA和siRNA等[23]。而siRNA因其效率高,且通过简单的化学合成即可获得,因而具有治疗疾病的应用前景[24-25]。目前国内外关于PD-L1及siRNA均有了较深入的研究,但是将两者结合起来研究的则甚少[26-27]。本研究利用siDirect在线设计,并通过运用BLAST在Genbank中进行同源性分析排除了与非靶基因有大于或等于15个碱基匹配的序列,双链Tm小于21.5 ℃,从而得到了10条候选siRNA序列,通过化学合成的方法获得候选siRNA分子。但由于mRNA可能存在二级结构,或者存在一些蛋白或核糖体的粘附,使得并不是所有候选序列都具有RNA干扰作用[28]。因此,需要通过实验筛选而得到最佳的siRNA序列。本实验采用阳离子脂质体法(lipofectamine 2000),通过带正电的脂质体,与核酸带负电的磷酸骨架形成复合物,也能被表面带负电荷的细胞膜吸附,通过膜的融合或细胞内吞作用导入细胞内[23]。此法因其简单方便,细胞毒性低,重复性高,可以在siRNA浓度较低的条件下转染。
本文筛选出6条高效特异性沉默PD-L1表达的siRNA序列。通过RT-qPCR、Western blot及流式细胞术实验得出,与对照组相比,siPD-L1-1、siPD-L1-2、siPD-L1-3、siPD-L1-4、siPD-L1-5及siPD-L1-8均能显著沉默PD-L1的mRNA及蛋白表达,并且可显著增强CD8+T细胞的杀伤作用,其中siPD-L1-3序列沉默活性最佳,且该序列比专利(专利号US20170067060)提供的siRNA序列(siPD-L1-PC)活性要佳。以siPD-L1-3序列转染U87 MG细胞后,使得CD8+T细胞引起肿瘤细胞的凋亡率达33%,且肿瘤细胞生长的抑制率可达60%。这可能与siPD-L1-3的GC含量适中,Tm值符合要求,且能避开mRNA二级结构及核糖体粘附区域有关。因此,本研究进一步丰富了siRNA序列的设计规则,将为设计高效沉默基因的siRNA序列提供思路。此外,本研究设计siRNA分子能够有效降低肿瘤细胞表面PD-L1蛋白的表达水平,可解除或减弱PD-L1对CD8+T细胞的抑制,从而促进T淋巴细胞对肿瘤细胞的杀伤,抑制肿瘤生长。可利用该原理,构建合适的体内给药系统,把siPD-L1序列,递送至胶质瘤细胞内,从而获得新的胶质瘤治疗方法[29-30]。综上所述,本研究设计并筛选出了一条全新的可特异性高效沉默PD-L1 mRNA的siRNA序列,该序列未见国内外文献及专利报道过,其沉默PD-L1mRNA表达的效价高于专利报道的水平,为后续开发抗肿瘤药物奠定了基础。
| [1] |
Ning YM, Suzman D, Maher VE, et al. FDA approval summary: atezolizumab for the treatment of patients with progressive advanced urothelial carcinoma after Platinum-Containing chemotherapy[J].
Oncologist, 2017, 22(6): 743-8.
DOI: 10.1634/theoncologist.2017-0087. |
| [2] |
Kim ES. Avelumab: first global approval[J].
Drugs, 2017, 77(8): 929-37.
DOI: 10.1007/s40265-017-0749-6. |
| [3] |
Syed YY. Durvalumab: first global approval[J].
Drugs, 2017, 77(12): 1369-76.
DOI: 10.1007/s40265-017-0782-5. |
| [4] |
Kythreotou A, Siddique A, Mauri FA, et al. PD-L1[J].
J Clin Pathol, 2018, 71(3): 189-94.
DOI: 10.1136/jclinpath-2017-204853. |
| [5] |
Wang XH, Bao ZQ, Zhang XJ, et al. Effectiveness and safety of PD-1/ PD-L1 inhibitors in the treatment of solid tumors: a systematic review and meta-analysis[J].
Oncotarget, 2017, 8(35): 59901-14.
|
| [6] |
Hobo W, Hutten TJ, Schaap NP. Immune checkpoint molecules in acute myeloid leukaemia: managing the double-edged sword[J].
Br J Haematol, 2018, 181(1): 38-53.
DOI: 10.1111/bjh.2018.181.issue-1. |
| [7] |
Kourtidis A, Anastasiadis PZ. Close encounters of the RNAi kind: the silencing Life of the adherens junctions[J].
Curr Opin Cell Biol, 2018, 54(4): 30-6.
|
| [8] |
Haussecker D. Current issues of RNAi therapeutics delivery and development[J].
J Control Release, 2014, 195(2): 49-54.
|
| [9] |
Swaika A, Hammond WA, Joseph RW. Current state of anti-PD-L1 and anti-PD-1 agents in cancer therapy[J].
Mol Immunol, 2015, 67(2 PtA): 4-17.
|
| [10] |
Kwak G, Kirn D, Nam GH, et al. Programmed cell death protein ligand-1 silencing with Polyethylenimine-Dermatan sulfate complex for dual inhibition of melanoma growth[J].
ACS Nano, 2017, 11(10): 10135-46.
DOI: 10.1021/acsnano.7b04717. |
| [11] |
Luo X, Peng X, Hou JY, et al. Folic acid- functionalized polyethylenimine superparamagnetic iron oxide nanoparticles as theranostic agents for magnetic resonance imaging and PD-L1 siRNA delivery for gastric cancer[J].
Int J Nanomedicine, 2017, 12(1): 5331-43.
|
| [12] |
Teo PY, Yang C, Whilding LM, et al. Ovarian Cancer immunotherapy using PD-L1 siRNA targeted delivery from folic Acid-Functionalized polyethylenimine: strategies to enhance T cell killing[J].
Adv Healthc Mater, 2015, 4(8): 1180-9.
DOI: 10.1002/adhm.v4.8. |
| [13] |
Wang D, Wang T, Liu J, et al. Acid-Activatable versatile micelleplexes for PD-L1 Blockade-Enhanced cancer photodynamic immunotherapy[J].
Nano Lett, 2016, 16(9): 5503-13.
DOI: 10.1021/acs.nanolett.6b01994. |
| [14] |
Wittrup A, Lieberman J. Knocking down disease: a progress report on siRNAtherapeutics[J].
Nat Rev Genet, 2015, 16(9): 543-52.
DOI: 10.1038/nrg3978. |
| [15] |
Ozcan G, Ozpolat B, Coleman RL, et al. Preclinical and clinical development of siRNA-based therapeutics[J].
Adv Drug Deliv Rev, 2015, 87(7): 108-19.
|
| [16] |
Ui-Tei K, Naito Y, Nishi K, et al. Thermodynamic stability and Watson-Crick base pairing in the seed duplex are major determinants of the efficiency of the siRNA-based off-target effect[J].
Nucleic Acids Res, 2008, 36(22): 7100-9.
DOI: 10.1093/nar/gkn902. |
| [17] |
Ui-Tei K, Naito Y, Takahashi F, et al. Guidelines for the selection of highly effective siRNA sequences for mammalian and chick RNA interference[J].
NucleicAcids Res, 2004, 32(3): 936-48.
DOI: 10.1093/nar/gkh247. |
| [18] |
Reynolds A, Leake D, Boese Q, et al. Rational siRNA design for RNA interference[J].
Nat Biotechnol, 2004, 22(3): 326-30.
DOI: 10.1038/nbt936. |
| [19] |
Sun C, Mezzadra R, Schumacher TN. Regulation and function of the PD-L1 checkpoint[J].
Immunity, 2018, 48(3): 434-52.
DOI: 10.1016/j.immuni.2018.03.014. |
| [20] |
Goodman A, Patel SP, Kurzrock R. PD-1-PD-L1 immune-checkpoint blockade in B-cell lymphomas[J].
Nat Rev Clin Oncol, 2017, 14(4): 203-20.
DOI: 10.1038/nrclinonc.2016.168. |
| [21] |
Gravelle P, Burroni B, Pericart S, et al. Mechanisms of PD-1/PD-L1 expression and prognostic relevance in non- Hodgkin lymphoma: a summary of immunohistochemical studies[J].
Oncotarget, 2017, 8(27): 44960-75.
|
| [22] |
Chen J, Jiang CC, Jin L, et al. Regulation of PD-L1: a novel role of pro-survival signalling in cancer[J].
Ann Oncol, 2016, 27(3): 409-16.
DOI: 10.1093/annonc/mdv615. |
| [23] |
Dowdy SF. Overcoming cellular barriers for RNA therapeutics[J].
Nat Biotechnol, 2017, 35(3): 222-9.
DOI: 10.1038/nbt.3802. |
| [24] |
Chiu YL, Rana TM. siRNA function in RNAi: A chemical modification analysis[J].
RNA, 2003, 9(9): 1034-48.
DOI: 10.1261/rna.5103703. |
| [25] |
Selvam C, Mutisya D, Prakash S, et al. Therapeutic potential of chemically modified siRNA: Recent trends[J].
Chem Biol Drug Des, 2017, 90(5): 665-78.
DOI: 10.1111/cbdd.2017.90.issue-5. |
| [26] |
Lee SH, Kang YY, Jang HE, et al. Current preclinical small interfering RNA (siRNA)-based conjugate systems for RNA therapeutics[J].
Adv Drug Deliv Rev, 2016, 104(8): 78-92.
|
| [27] |
Ohaegbulam KC, Assal A, Lazar-Molnar E, et al. Human Cancer immunotherapy with antibodies to the PD-1 and PD-L1 pathway[J].
Trends Mol Med, 2015, 21(1): 24-33.
DOI: 10.1016/j.molmed.2014.10.009. |
| [28] |
Saldi T, Cortazar MA, Sheridan RM, et al. Coupling of RNA polymerase Ⅱ transcription elongation with Pre-mRNA splicing[J].
J Mol Biol, 2016, 428(12, SI): 2623-35.
DOI: 10.1016/j.jmb.2016.04.017. |
| [29] |
Martinez T, Wright N, Lopez-Fraga M, et al. Silencing human genetic diseases with oligonucleotide-based therapies[J].
Hum Genet, 2013, 132(5): 481-93.
DOI: 10.1007/s00439-013-1288-1. |
| [30] |
Preusser M, Berghoff AS, Wick W, et al. Clinical neuropathology mini-review 6-2015: PD-L1: emerging biomarker in glioblastoma?[J].
Clin Neuropathol, 2015, 34(6): 313-21.
|
 2018, Vol. 38
2018, Vol. 38

