乳腺癌是危害女性健康的恶性肿瘤之一,往往成为致死的主要病因。在乳腺癌的治疗中,除了手术、放射和内分泌治疗以外,还有非常重要的化学药物辅助治疗[1]。阿霉素是治疗乳腺癌的经典药物,但是心脏毒性等不良反应均限制了它在临床的应用,因此寻找增强阿霉素抗肿瘤活性,并降低不良反应的方法迫在眉睫[2]。
缝隙连接(GJ)是细胞与细胞之间物质交换的重要通道,由连接蛋白(Cx)组成[3]。研究表明在肿瘤的产生和发展中,Cx的表达通常会下降或缺失,而通过增加细胞Cx的表达可以依赖或不依赖细胞GJ从而抑制肿瘤细胞增殖,促进其凋亡[4]。也有研究表明,Cx可能会促进晚期肿瘤的外渗和转移[5]。在乳腺上皮细胞中以Cx43、Cx26等表达水平较高,本课题组前期研究也证明,在肿瘤细胞中,对GJ的调控可以影响化疗药物的抗肿瘤作用,且Cx43表达水平与肿瘤的恶性程度有一定的相关性[6]。然而,目前尚无文献报道在雌激素受体阳性(ER+)的乳腺癌细胞和雌激素受体阴性(ER-)的细胞中比较Cx43蛋白的表达和GJ功能,并通过对GJ功能的调控观察阿霉素对两种不同性质乳腺癌细胞毒性的影响。因此,本研究将首先比较ER(+)的MCF-7细胞和ER(-)的MDA-MB-231细胞中Cx43蛋白的表达及GJ功能。然后分别采用药理学和分子生物学两种方法调控MCF-7细胞的GJ功能,观察对阿霉素抗乳腺癌作用的影响。本实验将从增强细胞GJ功能和抑制GJ功能两个角度分别探讨对阿霉素毒性的影响,并进一步通过沉默Cx43基因,观察对GJ功能及阿霉素抗肿瘤作用的影响。以期为ER(+)的乳腺癌细胞临床治疗提供新靶点,扩大阿霉素的临床应用。
1 材料和方法 1.1 材料细胞株MCF-7、MDA-MB-231细胞购自上海细胞库,由蚌埠医学院药理实验室冻存。阿霉素、维甲酸、油酸酰胺、18- alpha -甘草次酸、胰酶、MTT、二甲基亚砜均购于美国Sigma;DMEM高糖培养基、胎牛血清、荧光染料calcein-AM购于美国Gibco。阳离子脂质体转染试剂LipofectamineTM2000、Opti-MEM培养基、ECL发光试剂盒购于Invitrogen;Cx43单克隆抗体为美国Sigma产品,羊抗鼠β-actin单克隆抗体、羊抗鼠IgG抗体均购自Bio-Rad。其他试剂均是国产分析纯级。
1.2 方法 1.2.1 细胞培养ER(+)乳腺癌MCF-7细胞培养于MEM培养基,ER(-)乳腺癌MDA-MB-231细胞培养于DMEM高糖培养基,分别含有10%(V/V)胎牛血清、0.01 mg/mL人胰岛素、100 U/mL青霉素,100 mg/L链霉素,放置于37 ℃、含5% CO2的细胞培养箱中培养。传代时采用0.25%胰蛋白酶溶液,1周传代2~3次,传代比例约为1: 3。
1.2.2 MTT检测GJ功能的调控对阿霉素抗肿瘤作用的影响将细胞按5×104 /mL的密度接种于96孔板,每组设5个复孔。细胞经GJ功能药物预处理(RA:24 h,oleamide:1 h,18-α-GA:1 h)后,再用阿霉素刺激24 h,检测细胞存活率。另设阴性对照组(不加药物)和空白对照组(不加细胞,只加培养基)。终止培养前4 h,每孔加MTT 15 μL(5 g/L)37 ℃下孵育,检测前弃上清,加入二甲基亚砜(DMSO)150 μL /孔,37 ℃下孵育30 min,微量振荡器震摇8 min,酶标仪测定每孔在A490nm处的吸光度值,实验重复4次。
1.2.3 Western blotting检测细胞中Cx43总蛋白的表达收集MCF-7和MDA-MB-231细胞,冰上裂解30 min,提取总蛋白,BCA蛋白定量法测各组蛋白浓度,用细胞裂解液配平各组蛋白浓度,与2×上样缓冲液1:1混合,100 ℃下煮沸5 min使蛋白变性。经SDS-PAGE电泳(10%分离胶)分离后电转至PVDF膜上。脱脂牛奶室温下封闭2 h;Cx43一抗采用Western blotting一抗稀释液按1: 5000的比例稀释,4 ℃下孵育过夜;摇床上用TPBS洗10 min×3次;羊抗鼠lgG二抗用脱脂牛奶按1:4000稀释,室温下孵育2 h;TPBS洗10 min×3次;ECL试剂盒避光下显影曝光。Bio-Rad凝胶成像系统采集图像。以β-actin为内参对照。
1.2.4 细胞免疫荧光法观察细胞膜Cx43蛋白表达以5×104 /mL的密度将MCF-7和MDA-MB-231细胞接种于六孔板中盖玻片上,培养箱中培养2 d,吸去培养基,PBS洗5 min×2次;4%多聚甲醛-0.1% Triton溶液室温下固定细胞10 min,PBS洗10 min×2次;1% BSA封片2 h;Cx43一抗用一抗稀释液按1:500的比例稀释,4 ℃孵育过夜(勿摇晃),PBS洗10 min×3次;二抗用TPBS按1:200稀释,放置37 ℃下湿盒中孵育2 h,PBS洗10 min×3次;碳酸甘油缓冲液封片,倒置荧光显微镜观察、拍照。
1.2.5 细胞接种荧光示踪法测定MCF-7细胞间GJ功能将两株细胞以10×104 /mL的密度接种于十二孔板内,药物处理后,将荧光指示剂calcine-AM与其中一孔细胞共同孵育,calcine-AM可以通过GJ通道进入细胞浆内。该细胞称为“供体细胞”。然后将“供体细胞”接种到已生长融合(有条件形成GJ)的细胞中,培养4 h。待供体细胞贴壁,并与相邻细胞形成稳定的GJ后,小分子的calcine-AM(发绿色荧光)可以通过GJ进入相邻的细胞。实验结果采用倒置荧光显微镜观察,以一个“供体细胞”周围含有绿色荧光的细胞数量多少作为GJ功能指标[7]。
1.2.6 siRNA序列的设计与合成针对人源Cx43基因小分子干扰RNA片段由上海吉玛公司设计合成。Cx43siRNA和阴性对照siRNA序列分别为:Cx43siRNA:(正义链):5'-GGAAGCACCAUCUCUA ACUTT-3',(反义链):5'-AGUUAGAGAUGGUGCUU CCTT-3';Negative control:(正义链):5'-GGCCUUG AAUAUCAUUGAATT-3',(反义链):5'-UUCAAUGA UAUUCAAGGCCTT-3'。SiRNA序列作BLAST比对,以保证和其他基因没有同源性,siRNA由上海吉玛制药技术有限公司合成。
1.2.7 统计学分析实验结果使用SPSS 11.0软件进行分析。资料以均数±标准差表示,两组之间计量资料比较采用t检验,统计图表采用Sigma Plot 12.0绘制,P < 0.05为差异有统计学意义。
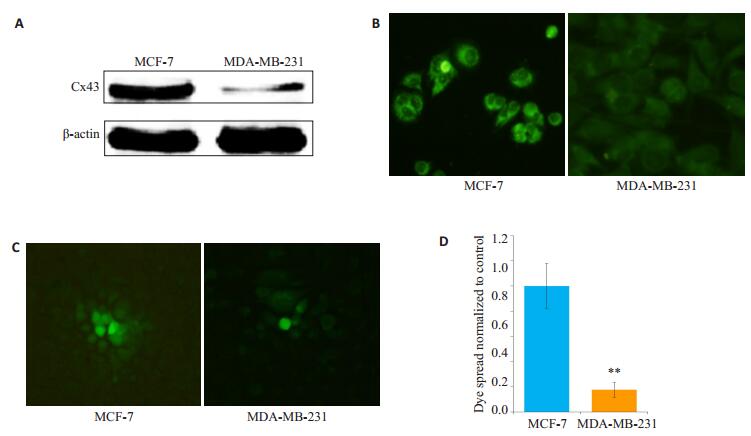
2 结果 2.1 MCF-7和MDA-MB-231细胞中Cx43蛋白的表达及细胞GJ功能Western blotting结果表明,MCF-7细胞中Cx43的总蛋白表达水平显著高于MDA-MB-231细胞(图 1A);细胞免疫荧光结果显示,ER(+)的乳腺癌MCF-7细胞胞膜Cx43绿色荧光比ER(-)乳腺癌细胞MDA-MB-231更强,在MDA-MB-231细胞膜上只见到极少数的绿色荧光斑(图 1B);MCF-7细胞的GJ功能显著高于MDAMB-231细胞(图 1C、D)。
|
图 1 MCF-7和MDA-MB-231细胞Cx43蛋白表达水平及GJ功能 Figure 1 Expression of Cx43 and function of gap junction in MCF-7 and MDA-MB-231 cells. A: Total Cx43 protein detected by Western blotting; B: Expression of Cx43 on the cell membrane (Original magnification: × 400); C: Function of gap junction assessed by parachute dye-coupling assay (×400); D: Bar chart of the results of the parachute assay. **P < 0.01 vs MCF-7 cells. |
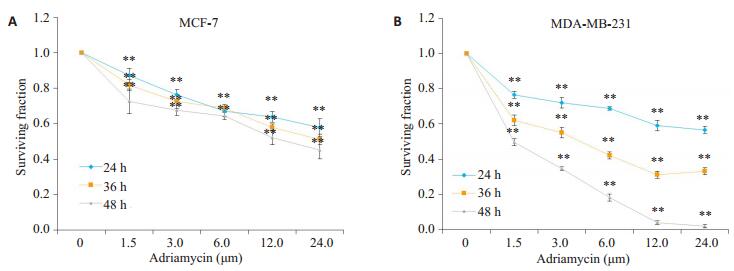
选用0~24.0 μmol/L的阿霉素作用于MCF-7和MDA-MB-231细胞24 h后,MTT结果显示:随着药物浓度的提高,两珠细胞的存活率明显下降。24.0 μmol/L阿霉素作用于MCF-7细胞24、36、48 h后,细胞存活率分别为56.35%、51.36%、44.89%。阿霉素作用于MDAMB-231细胞24、48、72 h后,细胞存活率分别为69.25%、42.43%、97.96%(图 2)。
|
图 2 阿霉素对MCF-7和MDA-MB-231细胞24、36、48 h存活率的影响 Figure 2 Surviving fraction of MCF-7 and MDA-MB-231 cells treated with adriamycin for 24, 36, and 48 h (MTT assay, n=4). A: Surviving fraction of MCF-7 cells treated with 0 to 24.0 μmol/L adriamycin. **P < 0.01 vs 0 μmol/L adriamycin group; B: Surviving fraction of MDA-MB-231 cells treated with 0 to 24.0 μmol/L adriamycin. **P < 0.01 vs 0 μmol/L adriamycin group. |
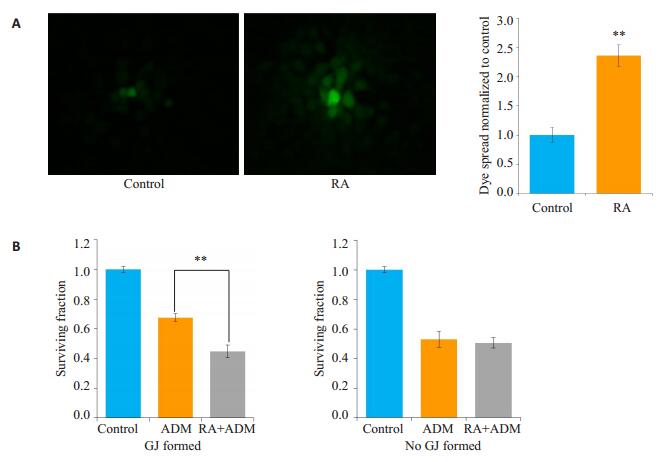
在MCF-7细胞中,用10.0 μmol/L的RA(此浓度RA对细胞无毒性)预处理24 h,细胞接种荧光示踪法结果显示,与对照组相比,RA预处理后的细胞荧光传递增强了112.86%(图 3A)。图 3B结果显示,高密度接种细胞时(细胞生长融合,有GJ形成),6.0 μmol/L的阿霉素作用于细胞24 h的细胞存活率为0.64±0.03,而10.0 μmol/L的RA预处理24 h,再用阿霉素刺激细胞24 h,MCF-7细胞存活率为0.43±0.04,低于阿霉素单用组,差异有统计学意义(P < 0.01)。而在低密度接种的细胞(细胞生长未融合,无GJ形成),用RA预处理组的细胞存活率(0.56±0.03)与阿霉素单用组(0.52±0.04)相比,差异无统计学意义(P>0.05)。
|
图 3 维甲酸在MCF-7细胞中增强阿霉素的细胞毒性 Figure 3 Retinoic acid increased the cytotoxicity of adriamycin (ADM) in MCF-7 cells (n=4, Mean±SD). A: Fluorescence images (×400) showing dye coupling in parachute assay and quantitative analysis. **P < 0.01 vs control group; B: Retinoic acid increased the antitumor activity of cisplatin in A549/CDDP cells with high- or low-density GJ. **P < 0.01 vs ADM group. |
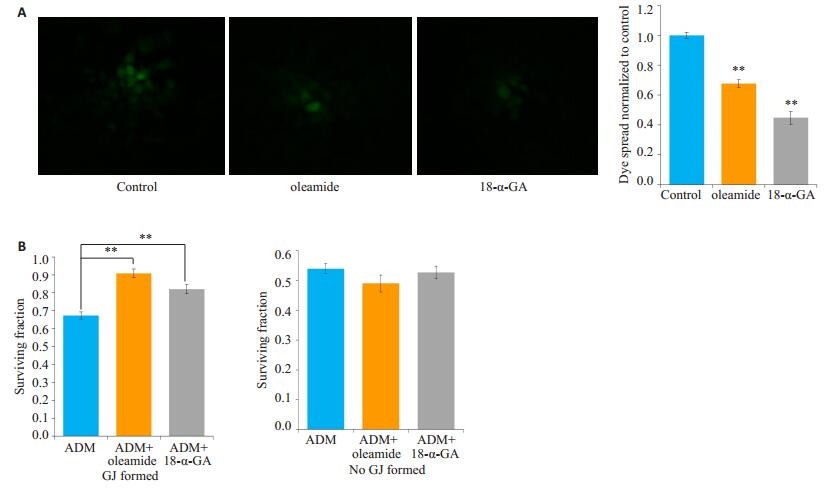
选用oleamide和18-α-GA两种GJ功能抑制剂预处理细胞,细胞接种荧光示踪法结果显示:25.0 μmol/L oleamide和10.0 μmol/L 18-α-GA分别预处理MCF-7细胞1 h,细胞荧光传递分别降低了70.24%和33.62%(图 4A)。接着采用高低密度接种法,观察25.0 μmol/L oleamide和10.0 μmol/L 18-α-GA预处理后对阿霉素细胞毒性的影响。在高密度接种细胞时(细胞生长融合,有GJ形成),6.0 μmol/L的阿霉素作用于细胞24 h的细胞存活率为0.69±0.03,而25.0 μmol/L的oleamide和10.0 μmol/L18-α-GA分别预处理细胞1 h,再用6.0 μmol/L的阿霉素刺激细胞24 h,MCF-7细胞存活率分别为0.86 ±0.04、0.83±0.07,均显著高于阿霉素单用组(P < 0.01,图 4B)。而在低密度接种的细胞(细胞生长未融合,无GJ形成),用oleamide和18-α-GA预处理组的细胞存活率分别为0.50±0.03、0.53±0.06与阿霉素单用组(0.54± 0.04)相比,差异无统计学意义(P>0.05)。
|
图 4 油酸酰胺和18-α-甘草次酸在MCF-7细胞中降低阿霉素的细胞毒性 Figure 4 Oleamide and 18-α-GA decreased the cytotoxicity of adriamycin (ADM) in MCF-7 cells (n=4, Mean± SD). A: Fluorescence images of parachute dye-coupling assay (× 400). **P < 0.01 vs control group; B: Oleamide and 18-α-GA decreased the antitumor activity of cisplatin in A549/CDDP cells with high-or low-density GJ. **P < 0.01. |
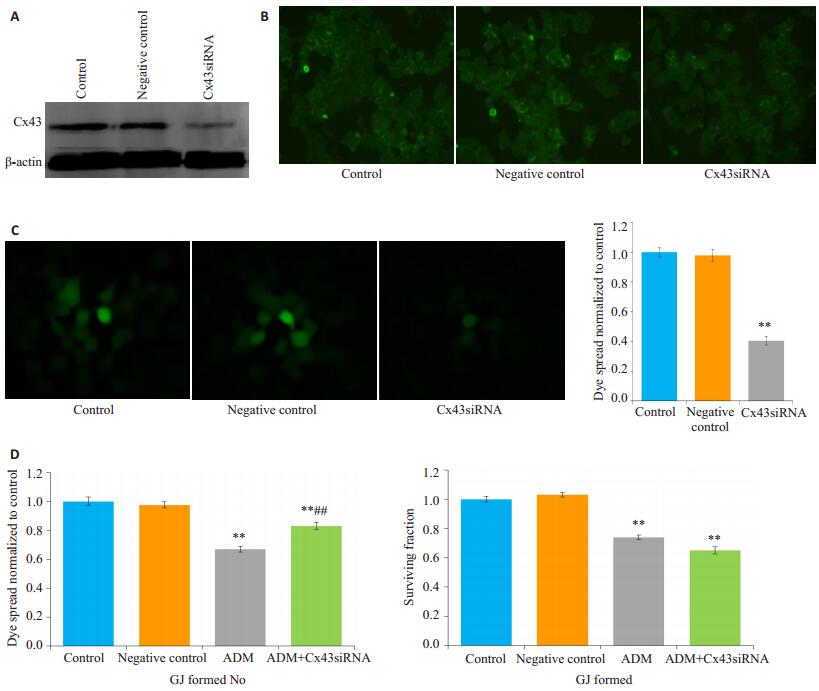
Western blot结果显示,将Cx43siRNA转染入MCF-7细胞后,Cx43蛋白表达显著降低。细胞免疫荧光法结果显示,转染了siRNA后,MCF-7细胞膜的Cx43蛋白表达显著降低(图 5A、B)。在高密度接种的细胞(细胞生长融合,有GJ形成),单用阿霉素组细胞的存活率为68.85±0.03,siRNA沉默Cx43后,使MCF-7细胞GJ功能减弱,与单用阿霉素组相比,细胞存活率增加84.23±0.05(P < 0.01)。阴性对照组细胞存活率为98.02±0.02,与单用阿霉素组比较差异无统计学意义(P>0.05)。在低密度接种的细胞(生长未融合,无GJ形成),与单用阿霉素相比,Cx43siRNA对阿霉素的细胞存活率无明显影响(P>0.05,图 5C、D)。
|
图 5 Cx43siRNA在MCF-7细胞中降低阿霉素的抗肿瘤作用 Figure 5 Cx43 siRNA decreased the cytotoxicity of adriamycin (ADM) in MCF-7 cells (n=4, Mean±SD). A: Expression level of Cx43 detected by Western blotting; B: Immunofluorescence assay of expression of Cx43 on the membrane; C: Fluorescence images of parachute dye-coupling assay (×400). **P < 0.01 vs control group; D: Cx43siRNA decreased the antitumor activity of adriamycin in A549/CDDP cells with high-or low-density GJ. **P < 0.01 vs the control group. ##P < 0.01 vs the ADM group. |
目前对细胞缝隙连接调控的方式主要有工具药物和基因沉默/过表达[8],药物诱导主要是通过文献查阅的比较公认的工具药物,如RA [9]、维生素A、黄芩素[7]等,增强细胞GJ功能,从而加强细胞间的物质交流,课题组前期研究证明黄芩素可以通过增加细胞Cx43蛋白的表达从而增强睾丸间质细胞TM4的GJ功能;而目的基因转染也是常用的恢复和上调肿瘤细胞GJ功能的方法。黄酮类药物黄连素在肺腺癌A549细胞中可以通过增加Cx43蛋白的表达从而增强顺铂的抗肿瘤作用。这表明,化疗药物的抗肿瘤作用可以通过调控细胞GJ功能来实现。
乳腺癌的发病率在所有女性恶性肿瘤中占首位,阿霉素是乳腺癌治疗的经典药物,但心脏毒性等不良反应比较严重,且长期使用以后,乳腺癌对其敏感性下降均在很大程度上影响了乳腺癌的治疗[10]。因此,找到增强阿霉素抗肿瘤作用的方法对于临床乳腺癌的治疗至关重要。雌激素受体是影响乳腺癌患者主要的预后因素之一,目前对乳腺癌的分型常用指标为:ER和孕激素受体(PR)等。通常ER(+)的乳腺癌恶性程度较低,预后较好[11-12]。在ER(+)的原发性乳腺癌中,Cx43mRNA的表达可以与肿瘤的抑制相关,而对ER(-)的乳腺癌却起到相反的保护作用[13]。Cx43对肿瘤生长的潜在控制可能有助于ER(+)乳腺肿瘤更好地分化和患者生存质量的提高[14]。在ER(-)乳腺癌中,其他途径比Cx43的表达更占主导地位,如Wnt-1和/或Ras-Raf-MAPK活化,它们负责分化出较差的表型、导致更差的预后[15]。本研究结果显示,在细胞水平中,ER(+)的乳腺癌中Cx43表达水平显著高于ER(-)的乳腺癌。但在ER(+)的乳腺癌中,从调控GJ功能及Cx蛋白的角度来治疗乳腺癌的研究尚缺乏,因此,本实验开展了一系列的实验。
正常乳腺组织表达Cx26、Cx32和Cx43等连接蛋白,其中Cx43是乳腺组织中含量较丰富的蛋白,且被广泛研究[4, 6]。本实验结果表明,在ER(+)的MCF-7乳腺癌细胞中Cx43蛋白的表达水平高于ER(-)的MDAMB-231细胞,且由Cx43形成GJ的功能也显著增强,MDA-MB-231细胞中几乎不表达Cx43。这表明,Cx43在乳腺癌细胞中的表达可能与ER的表达水平相关。于是后续研究将集中在ER(+)的MCF-7细胞中,通过调控细胞GJ功能观察对阿霉素抗肿瘤作用的影响。
肿瘤细胞中的Cx往往会缺失,而恢复Cx的表达可以增加肿瘤细胞的死亡[4, 16]。在间皮瘤细胞中,Cx43表达增多可以增强顺铂的细胞毒性[17],这表明,细胞中Cx43的表达对化疗药物敏感性密切相关。但是该过程是否与GJ的形成有关呢,我们不得而知,因此本实验采用了高低密度接种细胞的方法。GJ形成需要细胞与细胞之间相互接触,接触越紧密,形成的GJ越多,调控GJ后效果就越显著。
单独用药可以治疗鳞状细胞癌和黑色素瘤等肿瘤[18-19]。课题组前期研究表明,RA在不影响细胞增殖的情况下可以增强细胞GJ功能,从而影响化疗药物的细胞毒性[6]。本实验同样采用对MCF-7细胞无毒性的10.0 μmol/L的RA预处理24 h,结果表明RA可以增强细胞GJ功能,并增加阿霉素的抗乳腺癌作用。
Oleamide的作用机制仍不明确,可能是通过抑制Ca2+通过GJ进入细胞,从而抑制细胞的死亡[20]。研究表明其衍生物MI-22等可以通过下调细胞Cx26的表达,从而抑制GJIC,阻碍细胞的侵袭转移[21]。在转染了Cx32/Cx26的宫颈癌细胞Hela中,经多西环素的诱导后,加入GJ抑制剂18-α-GA,能显著降低顺铂和奥沙利铂的细胞敏感性[22]。但是对于oleamide和18-α-GA能否影响乳腺癌MCF-7细胞中由Cx43形成的GJ功能不得而知。本研究证明oleamide和18-α-GA可以显著抑制MCF-7细胞GJ功能,从而降低阿霉素对MCF-7的毒性。药物可以通过改变Cx的结构、数量及分布,或直接调控GJ功能调控细胞GJ功能[4, 23]。Oleamide和18-α-GA主要是通过改变细胞GJ的“门控”功能,即通透性而产生的。
为了排除药物可能通过其他途径影响细胞GJ功能[24],本实验选择采用siRNA从基因水平特异性地沉默Cx43。结果表明,SiRNA干扰后的MCF-7细胞中Cx43总蛋白和细胞膜蛋白表达均显著降低,细胞间GJ功能和阿霉素的毒性也均显著降低。这进一步证实Cx43在乳腺癌的发生发展中,扮演着抑癌基因的角色[25]。微小RNA(microRNA)对Cx43的调控也逐渐成为热门的研究靶点[25-29],大鼠大脑缺血后处理可以通过下调miRNA-1影响Cx43蛋白的重新分布[30]。
综上所述,本文首先发现了ER(+)的乳腺癌细胞中Cx43总蛋白、细胞膜蛋白的表达水平均高于ER(-)细胞,且ER(+)细胞中由Cx43形成的GJ功能显著强于ER(-)细胞。其次,在ER(+)细胞MCF-7中通过调控GJ功能,观察了对阿霉素抗肿瘤作用的影响。本研究可为阿霉素的临床扩大应用、ER(+)乳腺癌的临床治疗提供新靶点。
| [1] |
Shah R, Singh J, Singh D, et al. Sulfatase inhibitors for recidivist breast cancer treatment: a chemical review[J].
Eur J Med Chem, 2016, 114(8): 170-90.
|
| [2] |
Augusto C, Pietro M, Cinzia M, et al. Peripheral neuropathy due to paclitaxel: study of the temporal relationships between the therapeutic schedule and the clinical quantitative score (QST) and comparison with neurophysiological findings[J].
J Neurooncol, 2008, 86(1): 89-99.
DOI: 10.1007/s11060-007-9438-8. |
| [3] |
Skerrett IM, Williams JB. A structural and functional comparison of gap junction channels composed of connexins and innexins[J].
Dev Neurobiol, 2017, 77(5): 522-47.
DOI: 10.1002/dneu.v77.5. |
| [4] |
Raza A, Ghoshal A, Chockalingam S, et al. Connexin-43 enhances tumor suppressing activity of artesunate via gap junction-dependent as well as independent pathways in human breast cancer cells[J].
Sci Rep, 2017, 7(1): 7580-92.
DOI: 10.1038/s41598-017-08058-y. |
| [5] |
Saito-Katsuragi M, Asada H, Niizeki H, et al. Role for connexin 26 in metastasis of human malignant melanoma: communication between melanoma and endothelial cells via connexin 26[J].
Cancer, 2007, 110(5): 1162-72.
DOI: 10.1002/(ISSN)1097-0142. |
| [6] |
Jiang G, Dong S, Yu M, et al. Influence of gap junction intercellular communication composed of connexin 43 on the antineoplastic effect of adriamycin in breast cancer cells[J].
Oncol Lett, 2017, 13(2): 857-66.
DOI: 10.3892/ol.2016.5471. |
| [7] |
蒋国君, 董淑英, 纪洁, 等. 黄芩素对小鼠睾丸支持细胞TM4缝隙连接功能的影响[J].
中华男科学杂志, 2015, 21(8): 687-91.
|
| [8] |
Yang Y, Qin SK, Wu Q, et al. Connexin-dependent gap junction enhancement is involved in the synergistic effect of sorafenib and alltrans retinoic acid on HCC growth inhibition[J].
Oncol Rep, 2014, 31(2): 540-50.
DOI: 10.3892/or.2013.2894. |
| [9] |
Wu D, Li B, Liu H, et al. In vitro inhibited effect of gap junction composed of Cx43 in the invasion and metastasis of testicular cancer resistancedtocisplatin[J].
BiomedPharmacother, 2018, 98(7): 826-33.
|
| [10] |
Tong X, Han X, Yu B, et al. Role of gap junction intercellular communication in testicular leydig cell apoptosis induced by oxaliplatin via the mitochondrial pathway[J].
Oncol Rep, 2015, 33(1): 207-14.
DOI: 10.3892/or.2014.3571. |
| [11] |
Wu J, Taylor RN, Sidell N. Retinoic acid regulates gap junction intercellular communication in human endometrial stromal cells through modulation of the phosphorylation status of connexin 43[J].
J Cell Physiol, 2013, 228(4): 903-10.
DOI: 10.1002/jcp.24241. |
| [12] |
Hawley ST, Li Y, An LC, et al. Improving breast cancer surgical treatment decision making: the iCanDecide Randomized Clinical Trial[J].
J Clin Oncol, 2018, 36(7): 659-66.
DOI: 10.1200/JCO.2017.74.8442. |
| [13] |
Xu J, Sun T, Guo X, et al. Estrogen receptor-α promoter methylation is a biomarker for outcome prediction of cisplatin resistance in triplenegative breast cancer[J].
Oncol Lett, 2018, 15(3): 2855-62.
|
| [14] |
Sakai H, Tsurutani J, Iwasa T, et al. HER2 genomic amplification in circulating tumor DNA and estrogen receptor positivity predict primary resistance to trastuzumab emtansine (T-DM1) in patients with HER2-positive metastatic breast cancer[J].
Breast Cancer, 2018, 26(3): 35.
|
| [15] |
Teleki I, Szasz AM, Maros ME, et al. Correlations of differentially expressed gap junction connexins Cx26, Cx30, Cx32, Cx43 and Cx46 with breast cancer progression and prognosis[J].
PLoS One, 2014, 9(11): e112541.
DOI: 10.1371/journal.pone.0112541. |
| [16] |
Carey LA, Perou CM, Livasy CA, et al. Race, breast Cancer subtypes, and survival in the carolina breast cancer study[J].
JAMA, 2006, 295(21): 2492-502.
DOI: 10.1001/jama.295.21.2492. |
| [17] |
Oyamada M, Oyamada Y, Takamatsu T. Regulation of connexin expression[J].
Biochim BiophysActa, 2005, 1719(1-2): 6-23.
DOI: 10.1016/j.bbamem.2005.11.002. |
| [18] |
Stewart MK, Bechberger JF, Welch I, et al. Cx26 knockout predisposes the mammary gland to primary mammary tumors in a DMBAinduced mouse model of breast cancer[J].
Oncotarget, 2015, 6(35): 37185-99.
|
| [19] |
Uzu M, Sato H, Yamada R, et al. Effect of enhanced expression of connexin 43 on sunitinib-induced cytotoxicity in mesothelioma cells[J].
J Pharmacol Sci, 2015, 128(1): 17-26.
|
| [20] |
Li N, Lu Y, Li D, et al. All-trans retinoic acid suppresses the angiopoietin-Tie2 pathway and inhibits angiogenesis and metastasis in esophageal squamous cell carcinoma[J].
PLoS One, 2017, 12(4): e0174555-70.
DOI: 10.1371/journal.pone.0174555. |
| [21] |
Yin W, Song Y, Liu Q, et al. Topical treatment of all-trans retinoic acid inhibits murine melanoma partly by promoting CD8+ T-cell immunity[J].
Immunology, 2017, 152(2): 287-97.
DOI: 10.1111/imm.12768. |
| [22] |
Yamamoto S, Takehara M, Ushimaru M. Inhibitory action of linoleamide and oleamide toward sarco/endoplasmic reticulum Ca(2 +)- ATPase[J].
Biochim BiophysActa, 2017, 1861(1 PtA): 3399-405.
|
| [23] |
Nojima H, Ohba Y, Kita Y. Oleamide derivatives are prototypical anti-metastasis drugs that act by inhibiting connexin 26[J].
Curr Drug Saf, 2007, 2(3): 204-11.
DOI: 10.2174/157488607781668837. |
| [24] |
童旭辉, 董淑英, 蒋国君, 等. 缝隙连接蛋白Cx26/Cx32对依托泊苷抗肿瘤作用的影响[J].
南方医科大学学报, 2012, 32(3): 329-32.
|
| [25] |
Kitazawa M, Hida S, Fujii C, et al. ASC induces apoptosis via activation of caspase-9 by enhancing gap Junction-Mediated intercellular communication[J].
PLoS One, 2017, 12(1): e0169340-54.
DOI: 10.1371/journal.pone.0169340. |
| [26] |
Lai Y, Fan L, Zhao Y, et al. Cx32 suppresses extrinsic apoptosis in human cervical Cancer cells via the NF-κB signalling pathway[J].
Int J Oncol, 2017, 51(4): 1159-68.
DOI: 10.3892/ijo.2017.4106. |
| [27] |
Busby M, Hallett MT, Plante I. The complex subtype-dependent role of connexin 43 (GJA1) in breast cancer[J].
Int J Mol Sci, 2018, 19(3): 75.
|
| [28] |
Yang G, Peng X, Wu Y, et al. Involvement of connexin 43 phosphorylation and gap junctional communication between smooth muscle cells in vasopressin-induced ROCK-dependent vasoconstriction after hemorrhagic shock[J].
Am J Physiol Cell Physiol, 2017, 313(4): C362-70.
DOI: 10.1152/ajpcell.00258.2016. |
| [29] |
Viczenczova C, Kura B, Egan Benova T, et al. Irradiation-induced cardiac connexin-43 and miR-21 responses are hampered by treatment with atorvastatin and aspirin[J].
Int J Mol Sci, 2018, 19(4): 1128-38.
DOI: 10.3390/ijms19041128. |
| [30] |
Bian B, Yu XF, Wang GQ, et al. Role of miRNA-1 in regulating connexin 43 in ischemia-reperfusion heart injury: a rat model[J].
Cardiovasc Pathol, 2017, 27(5): 37-42.
|
 2018, Vol. 38
2018, Vol. 38

