2. 暨南大学 口腔医学院修复学教研室,广东 广州 510632;
3. 华侨医院口腔科,广东 广州 510630
2. Department of Prosthodontics, College of Stomatology, Jinan University, Guangzhou 510632, China;
3. Department of Stomatology, First Affiliated Hospital of Jinan University, Guangzhou 510630, China
钙离子是细胞凋亡信号中关键的第二信使,而线粒体凋亡途径是细胞凋亡发生的核心[1]。研究显示,线粒体“钙超载”是细胞损伤甚至凋亡的关键事件[2-3]。钙/钙调素依赖性蛋白激酶Ⅱ(CaMKⅡ),是一种多功能的丝氨酸/苏氨酸蛋白激酶,它作为Ca2+信号的重要传感器,调节细胞的多种生物学功能,其功能异常可引起骨骼肌细胞内钙稳态失衡进而引起骨骼肌功能障碍[4]。有研究证实,CaMKⅡ可磷酸化线粒体Ca2+传送体,并提高线粒体摄Ca2+率[5]。
咬合早接触是临床常见的咬合异常类型,早期可引起患者咬合不适,久之可导致牙周创伤、咀嚼肌功能障碍及颌面部疼痛等一系列临床症状。以往研究显示,过负荷运动可致骨骼肌线粒体钙超载,致使骨骼肌疲劳损伤的发生[6]。而关于咬合早接触是否通过引发咀嚼肌组织线粒体“钙超载”,进而导致咀嚼肌功能障碍,仍缺乏实验研究证实。为此,本实验通过建立咬合早接触大鼠模型,检测咬合早接触作用下大鼠咬肌组织中线粒体Ca2+浓度、细胞外Na+浓度及p-CaMKⅡ(Thr286)/CaMKⅡ表达水平的变化,阐明咬合异常与咬肌线粒体“钙超载”的相关性,探明CaMKⅡ对线粒体“钙超载”的调节作用。
1 材料和方法 1.1 实验动物选择和分组选取由暨南大学实验动物中心提供的8周龄SD雄性大鼠30只,体质量200~250 g,许可证号:SYXK(粤) 2012-0117。所有大鼠口腔内检查牙列完整,咬合关系基本正常,适应性饲养一周后进行实验。将SD大鼠按照随机数字表法分为6组,分别为咬合早接触3 d组、7 d组、14 d组、21 d组、去除干扰后3 d组及正常对照组,每组各5只。
1.2 方法 1.2.1 建立动物模型实验组大鼠经3%戊巴比妥钠腹腔注射麻醉后,呈仰卧位固定于手术板上,拉开上下颌,用37%磷酸酸蚀剂酸蚀右上颌第一磨牙咬合面60 s,清洁吹干,粘接剂涂布咬合面,光固化15 s,涂布流体树脂,放置直径0.6 mm钢丝段,光固化40 s,完成粘接。对照组大鼠不造咬合高点,其余操作同实验组。
1.2.2 样本制取各组大鼠经3%戊巴比妥钠腹腔注射麻醉后固定于手术板上,心尖灌注预冷的生理盐水直至完全置换血液,咬肌区备皮,分离取出咬肌组织。切取双侧咬肌中部组织块,生理盐水冲洗后滤纸吸干,置入中性福尔马林固定液中固定约30 min;称取双侧咬肌各100 mg置于冰上保存,用于线粒体钙离子浓度测定;称取双侧咬肌组织各80 mg,用9倍生理盐水研磨,将研磨液离心10 min,取上清液,用于测定钠离子浓度;另取双侧咬肌组织各40 mg,剪碎并置于组织研磨机中研磨10 min,离心20 min,取上清,用于Western blot的检测。
1.2.3 咬肌组织切片和染色取福尔马林固定液固定后的咬肌组织块修整,经洗涤、脱水、透明及浸蜡后,进行石蜡包埋及切片。石蜡切片经双蒸水温润2 min,甩干,苏木素滴染9 min,纯水冲洗1 min,5%冰醋酸分化5 s,流动自来水冲洗10 min,滴入伊红复染1 min,纯水冲洗干净,依次浸入70%、80%、90%、95%、100%乙醇各2 min,浸入二甲苯Ⅰ、二甲苯Ⅱ各2 min,中性树脂封片。
1.2.4 咬肌组织线粒体Ca2+浓度检测取保存于冰上的新鲜咬肌组织,用组织线粒体分离试剂盒(碧云天生物技术研究所)分离提取咬肌线粒体。用钙离子荧光探针Fura-2 AM(美国Biotium试剂公司)负载线粒体样本,再用荧光分光光度计记录钙离子荧光信号在发射波长510 nm,激发波长340 nm和380 nm时的荧光强度值。线粒体内钙浓度的计算公式如下:[Ca2+]=kd×[(R-Rmin)/ (Rmax-R)]×(F0/Fs) [7]。记录测量值,并依次带入公式计算各组线粒体钙离子浓度。
1.2.5 咬肌组织细胞外Na+离子浓度检测取用于测定钠离子浓度的上清液,用钠离子测定试剂盒配置标准液和样品液,752-P紫外可见分光光度计在波长630 nm下测定样品和标准液的A值。计算公式如下:样本浓度(mmol/L)=(样本A/标准品A)×标准品浓度。记录测量值,并带入公式计算各组样品钠离子浓度。
1.2.6 咬肌组织CaMKⅡ磷酸化水平检测取出测Western blotingt用的上清液,用BCA蛋白浓度测定试剂盒进行蛋白浓度定量后,加入上样缓冲液,沸水浴5 min,-20 ℃冰箱保存。清洗组装玻璃板,配胶灌胶,上样,SDS-PAGE电泳,至溴酚蓝到达分离胶底部停止电泳。切取相应部分凝胶进行转膜,转膜完成后将其置于室温下用5% BSA封闭1 h,TBST脱色摇床洗涤。加入抗p-CaMKⅡ(Thr286)单克隆抗体(1:500稀释)、抗CaMKⅡ单克隆抗体(1:500稀释),4 ℃孵育过夜,弃一抗,TBST脱色摇床洗涤。加入鼠抗兔二抗,1:5000稀释,室温下孵育1 h,TBST脱色摇床洗涤。加入超敏ECL化学发光液,反应约2 min后在凝胶成像系统显影,拍照记录结果,并用Image J软件对条带灰度值进行定量分析。
1.3 统计方法采用SPSS13.0软件进行统计学分析,数据用均数±标准差表示,对各实验组及同期对照组双侧均数进行单因素方差分析,各实验组同侧组间用SNK检验(Student-Newman-Keuls test),同组左右两侧用配对样本t检验,以P < 0.05为差异有统计学意义。
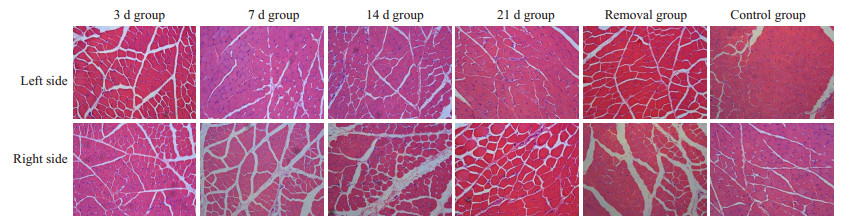
2 结果 2.1 咬合早接触大鼠咬肌组织形态学变化HE染色显示,对照组大鼠咬肌肌纤维横切面呈圆形或多边形,胞浆呈红染,胞核呈蓝色并为于肌细胞周边,细胞排列整齐,肌束间隙小,间隙间见少量结缔组织。与对照组比较,建模3 d组咬合干扰侧咬肌HE切片即呈现出细胞排列轻度紊乱,肌纤维间隙增宽并可见结缔组织间少量白细胞浸润,建模7 d组、14 d组HE切片显示炎症反应加重,建模21 d组及去除干扰后3 d组咬肌HE切片可见炎性细胞浸润减少,组织炎症反应减轻;各实验组非干扰侧咬肌亦可见同样改变,但细胞间结缔组织白细胞浸润程度较咬合干扰侧轻,其余各组均未观察到明显的炎症反应及细胞退行性变(图 1)。
|
图 1 各组大鼠咬肌肌纤维HE染色 Figure 1 HE staining of the masseter muscle fiber of the rats at different time points after occlusal interference (Original magnification: ×100). |
根据荧光分光光度计测出的各实验组线粒体Ca2+荧光强度值,带入公式[7]后计算得出各实验组线粒体Ca2+浓度,与同期对照组对比,建模3 d组、7 d组、14 d组咬合干扰侧线粒体Ca2+浓度持续显著升高,21 d组达峰值(P < 0.05),去除咬合干扰后3 d组线粒体Ca2+浓度显著下降并低于正常对照组(P < 0.05);实验组非咬合干扰侧线粒体Ca2+浓度变化趋势同干扰侧但略低于干扰侧(P < 0.05,表 1)。
| 表 1 各组大鼠咬肌线粒体Ca2+浓度 Table 1 Mitochondrial Ca2+ concentration in the masseter muscle of the rats at different time points after occlusal interference (Mean±SD, n=5) |
根据分光光度计测得的A值带入公式计算,实验组咬合干扰侧咬肌细胞外Na+浓度在建模3 d组、7 d组、14 d组及21 d组呈持续升高趋势(P < 0.05),去除咬合干扰后3 d组细胞外Na+浓度显著降低(P < 0.05),实验组非干扰侧变化趋势同干扰侧但略低于干扰侧(P < 0.05,表 2)。
| 表 2 各组大鼠咬肌细胞外Na+浓度 Table 2 Extracellular Na+ concentration in the masseter muscle of the rats at different time points after occlusal interference (Mean±SD, n=5) |
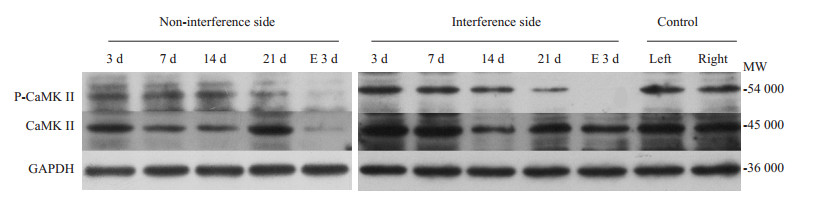
根据灰度值分析,实验组咬合干扰侧咬肌p-CaMK Ⅱ(Thr286)/CaMKⅡ的表达在建模3 d组、7 d组及14 d组显著持续升高,14 d组达峰值(P < 0.05),建模21 d组表达水平显著下降(P < 0.05),去除咬合干扰后3 d组表达水平持续降低(P < 0.05),非咬合干扰侧咬肌p-CaMK Ⅱ(Thr286)/CaMKⅡ表达水平变化趋势同咬合干扰侧但略低于干扰侧(P < 0.05,图 2、表 3)。
|
图 2 Western blot检测p-CaMKⅡ(Thr286)、CaMKⅡ蛋白表达情况 Figure 2 Protein expression of p-CaMK Ⅱ (Thr287) and CaMK Ⅱ detected by Western blotting. |
| 表 3 各组p-CaMKⅡ(Thr286)/CaMKⅡ相对表达量 Table 3 Relative expression of p-CaMK Ⅱ (Thr287)/CaMK Ⅱ in the masseter muscle of the rats at different time points after occlusal interference (Mean±SD, n=5) |
诸多研究表明[8-9],咬合干扰对牙体牙髓、牙周组织、咀嚼肌甚至颞下颌关节都存在一定程度的不良影响。研究发现,咬合早接触干扰与咀嚼肌痛性敏感之间存在着刺激-反应关系,且在去除干扰6 d后咀嚼肌的机械痛觉敏感现象仍然存在[10]。Li等[11]探索了咬合干扰与咀嚼肌系统疼痛的相关性,在受试者右侧下颌第一磨牙上制备0.5 mm高嵌体形成咬合早接触干扰,通过受试者自行视觉模拟量表(VAS)评分,在6 d记录期可获得口颌面部疼痛反应,同时检测干扰前后及去除干扰后双侧咬肌和颞肌前份表面肌电图发现,咀嚼时双侧颞肌前份肌电图不对称性增加。本研究为了解咬合早接触干扰对大鼠咬肌结构与功能的影响,在整个实验周期中观察各组大鼠行为学改变,发现自建模初期实验组大鼠出现搔抓面颊部、拂面、嘴鼻部胡须颤动频繁等反应;建模中后期,实验组大鼠活动度、进食量及精神状态与正常对照组对比明显较差。这与近年来关于咬合干扰与咀嚼肌疼痛的研究结果相符,证实咬合干扰与咀嚼肌疼痛的发生密切相关,且中枢敏化机制涉及咬合干扰诱导的机械性痛觉敏化[12]。在咀嚼肌功能障碍患者中肌肉疼痛是最常见的主述,疼痛呈弥漫性,常为渐进式起病,可从一种疲劳感到更为剧烈、严重的疼痛而变化不等,令人精疲力竭并很难与特定的疾病或其他伴发的症状关联起来,给患者的工作生活带来严重的负面影响。
咬合干扰还涉及咀嚼肌组织学的改变。已有研究表明,单侧升高咬合后4周,大鼠肌纤维间炎性细胞浸润、肌细胞可见中央核等病理表现,并且大鼠咬肌肌纤维横截面积普遍大于对照组[13]。本实验发现,与对照组比较,建模3 d组咬合干扰侧咬肌HE切片即呈现出细胞排列轻度紊乱,肌纤维间隙增宽并可见结缔组织间少量白细胞浸润,建模7 d组、14 d组HE切片显示炎症反应加重,建模21 d组及去除干扰后3 d组咬肌HE切片可见炎性细胞浸润减少,组织炎症反应减轻;各实验组非干扰侧咬肌亦可见同样改变,但细胞间结缔组织白细胞浸润程度较咬合干扰侧轻,其余各组均未观察到明显的炎症反应及细胞退行性变。说明咬合干扰在一定程度上可诱发咬肌组织的炎症反应,且不同方法所建立的咬合紊乱动物模型,在进行各种不同组织学染色后,观察到的组织学改变并不完全相同。这可能与咬合紊乱的具体类型、实验干预时间以及造模的具体方法不同有关。
3.2 咬合干扰致咬肌线粒体Ca2+与细胞外Na+浓度变化及其调节机制骨骼肌疲劳与损伤的发展过程中常常伴随着钙离子浓度的变化,线粒体“钙超载”可通过影响线粒体ATP生成致使线粒体能量代谢障碍,进而引起肌疲劳损伤;亦可通过激活氧自由基生成造成肌纤维膜系统氧化损伤加重、肌纤维结构破坏最终引起肌功能障碍;还可通过激活线粒体渗透性转换孔(mPTP)开放,启动凋亡程序引起肌细胞凋亡影响肌功能[14-15]。已有研究证实[16-17],在咬合异常动物实验中,咬肌细胞内和线粒体内钙离子浓度升高。本实验中实验组大鼠咬肌线粒体钙离子浓度亦表现出持续升高的趋势,去除咬合干扰后3 d线粒体钙离子浓度显著下降。表明咬合干扰引发大鼠咬肌线粒体Ca2+浓度升高致“钙超载”,提示与咬肌疲劳损伤有关。
调节线粒体钙离子浓度变化包括两种存在于膜性结构上的转运体[18]:线粒体钙离子单向转运体(MCU)和线粒体钠-钙交换体(NCX)。其中,线粒体钠-钙交换体NCX是分布于线粒体膜上的阳离子转运蛋白,具有两种转运Na+、Ca2+的模式:介导Na+内流、Ca2+外排的前向模式和作用相反的反向模式[19]。有研究表明NCX参与骨骼肌信号传导且肌肉剧烈收缩运动时其表达水平升高[20],在缺血、缺氧等病理条件下由反向模式主导,介导Ca2+内流使线粒体“钙超载”并激活氧化应激反应,造成细胞损伤和凋亡[21]。细胞外Na+可动态调节NCX的活性,NCX对钠钙离子的调节具有Na+依赖性[19]。本实验发现实验组咬合干扰侧咬肌细胞外Na+浓度在建模后呈持续升高趋势,去除咬合干扰后3 d组细胞外Na+浓度显著降低,其变化趋势与线粒体钙浓度变化呈现显著相关性。推测,在咬合干扰过程中线粒体膜上的钠-钙离子转运体NCX参与并启动反向转运模式调节钠钙离子的转运,介导线粒体Ca2+内流与Na+外排,引发“钙超载-膜结构破坏-钙内流加重”的恶性循环过程,从而加重肌细胞损伤,最终导致咀嚼肌功能障碍。
3.3 CaMKⅡ调节线粒体钙离子浓度变化的相关机制钙/钙调素依赖性蛋白激酶Ⅱ(CaMKⅡ)是一种多功能的丝氨酸/苏氨酸蛋白激酶,有研究表明[22],CaMK Ⅱ是线粒体Ca2+摄入和细胞凋亡的关键因子,线粒体靶向CaMKⅡ抑制剂能预防和减少由“钙超载”引发的心肌细胞凋亡和心衰的发生。本实验通过建立咬合早接触干扰大鼠动物模型,发现建模后咬合干扰侧大鼠咬肌内p-CaMKⅡ(Thr286)的相对表达量,除建模21 d组及去除干扰后3 d组外,均较正常水平上调。干扰侧咬肌p-CaMKⅡ(Thr286)/CaMKⅡ的表达在建模后亦显著持续升高且均高于对照组水平。可解释为在咬合干扰的咀嚼模式下,CaMKⅡ磷酸化水平升高,其可能参与线粒体Ca2+浓度升高的调节。同时,本实验还发现:pCaMKⅡ(Thr286)表达量的变化及其磷酸化水平(pCaMKⅡ(Thr286)/CaMKⅡ),较单纯的CaMKⅡ表达量的变化情况更显著地与咬合干扰的存在相关联。这与近年来多数学者的研究结果相符,Rose等[23]学者对运动后肌肉进行活检的研究显示,骨骼肌细胞CaMKⅡ在安静时并不具备功能活性,而在细胞钙离子浓度增加时其表达变得活跃,运动5 min和40 min时CaMKⅡ-δ/γ (Thr286)的活性分别是运动前的(67 ± 12)%和(52 ± 14)%,表明运动能激活人骨骼肌细胞CaMKⅡ;并且运动时CaMKⅡ发生的自磷酸化比静止状态下高出50%~ 70%,提示其磷酸化状态是提高该蛋白激酶自主活性的主要模式。
关于CaMKⅡ调节线粒体钙浓度的机制,有研究表明[24]:CaMKⅡ可磷酸化线粒体钙单向转运体(MCU),调控线粒体钙浓度变化。当胞质Ca2+浓度较低未达阈值时,线粒体钙摄入蛋白1(MICU1)不能结合Ca2+从而抑制了线粒体钙单向转运体MCU的摄钙作用;随着胞质Ca2+浓度升高达阈值,线粒体钙摄入蛋白1MICU1结合Ca2+,激活MCU的摄钙作用,且敲出MICU1基因后,线粒体摄钙能力明显下降,可见线粒体钙摄入蛋白1MICU1是钙离子的重要感受蛋白[25]。
本实验值得强调的是,咬合干扰21 d组大鼠咬肌CaMKⅡ磷酸化水平呈下降趋势,而21 d组大鼠咬肌线粒体钙离子浓度仍然呈现较高表达水平,推测可能与肌疲劳、肌肉蛋白整体水平下降、肌肉弹性降低相关,抑或是咬合干扰致大鼠线粒体钙浓度变化的调节存在其他的协同调节通路,且至少一条通路受到“钙超载”的负反馈调节抑制。有研究证实[26],分别阻断钙调神经磷酸酶(CaN)和Ca2+/钙调素依赖性蛋白激酶(CaMK)信号通路,均能观察到骨骼肌肌纤维类型由快缩型向慢缩型的转变,然而只有当两条通路协同作用时,才能使肌纤维类型发生最大程度的转化。对于咬合干扰致咀嚼肌线粒体“钙超载”影响肌功能的更深层次机制,尚需进一步探究。
| [1] |
Cully TR, Launikonis BS. Leaky ryanodine receptors delay the activation of store overload-induced Ca2+ release, a mechanism underlying malignant hyperthermia-like events in dystrophic muscle[J].
Am J Physiol Cell Physiol, 2016, 310(8): C673-80.
DOI: 10.1152/ajpcell.00366.2015. |
| [2] |
Zhao X, Yamazaki D, Park KH, et al. Ca2+overload and sarcoplasmic reticulum instability in tric-a null skeletal muscle[J].
J Biol Chem, 2010, 285(48): 37370-6.
DOI: 10.1074/jbc.M110.170084. |
| [3] |
丁璇, 夏晨蕾, 贺苗, 等. 钙调神经磷酸酶-T细胞核因子信号通路在应力诱导成肌细胞凋亡中的作用[J].
华西口腔医学杂志, 2015, 33(5): 456-61.
DOI: 10.7518/hxkq.2015.05.003. |
| [4] |
Eilers W, Jaspers RT, de Haan A, et al. CaMKⅡ content affects contractile, but not mitochondrial, characteristics in regenerating skeletal muscle[J].
BMC physiol, 2014, 14: 7.
DOI: 10.1186/s12899-014-0007-z. |
| [5] |
Gonano LA, Petroff MV. Subcellular mechanisms underlying Digitalis-Induced arrhythmias: role of Calcium/CalmodulinDependent kinase Ⅱ (CaMKⅡ) in the transition from an inotropic to an arrhythmogenic effect[J].
Heart Lung Circ, 2014, 23(12): 1118-24.
DOI: 10.1016/j.hlc.2014.07.074. |
| [6] |
Macintosh BR, Holash RJ, Renaud JM. Skeletal muscle fatigue - regulation of excitation-contraction coupling to avoid metabolic catastrophe[J].
J Cell Sci, 2012, 125(9): 2105-14.
DOI: 10.1242/jcs.093674. |
| [7] |
Grynkiewicz G, Poenie M, Tsien RY. A new Generation of Ca2+ indicators with greatly improved fluorescence properties[J].
J Biol Chem, 1985, 260(6): 3440-50.
|
| [8] |
万浩元, 孙惠强, 商思霞, 等. 大鼠咬合创伤早期压槽骨基因差异表达的初步探讨[J].
华西口腔医学杂志, 2012, 30(2): 183-6.
|
| [9] |
Cimic S, Zaja M, Kraljevic S, et al. Influence of occlusal interference on the mandibular condylar position[J].
Acta Stomatol Croat, 2016, 50(2): 116-21.
DOI: 10.15644/asc. |
| [10] |
Cao Y, Xie QF, Li K, et al. Experimental occlusal interference induces long-term masticatory muscle hyperalgesia in rats[J].
Pain, 2009, 144(3): 287-93.
DOI: 10.1016/j.pain.2009.04.029. |
| [11] |
Li J, Jiang T, Feng H, et al. The electromyographic activity of masseter and anterior temporalis during orofacial symptoms induced by experimental occlusal highspot[J].
J Oral Rehabil, 2008, 35(2): 79-87.
|
| [12] |
朱美玲, 刘洪臣, 郝作琦, 等. 咬合创伤大鼠三叉神经节PN3及NaN mRNA的表达[J].
中华口腔医学杂志, 2004, 39(5): 421-4.
|
| [13] |
Nishide N, Baba S, Hori N, et al. Histological study of rat masseter muscle following experimental occlusal alteration[J].
J Oral Rehabil, 2001, 28(3): 294-8.
|
| [14] |
Logan CV, Szabadkai G, Sharpe JA, et al. Loss-of-function mutations in MICU1 cause a brain and muscle disorder linked to primary alterations in mitochondrial calcium signaling[J].
Nat Genet, 2014, 46(2): 188-93.
DOI: 10.1038/ng.2851. |
| [15] |
Fu ML, Shi WH, Li ZL, et al. Activation of mPTP-dependent mitochondrial apoptosis pathway by a novel Pan HDAC inhibitor resminostat in hepatocellular carcinoma cells[J].
Biochem Biophys Res Commun, 2016, 477(4): 527-33.
DOI: 10.1016/j.bbrc.2016.04.147. |
| [16] |
孙淑贞, 汲平, 来庆国, 等. 咬合创伤致兔咬肌线粒体钙离子和二、三磷酸腺苷含量的改变[J].
华西口腔医学杂志, 2004, 22(4): 313-6.
|
| [17] |
王子娴, 徐龙博, 祁冬, 等. 偏侧咀嚼致咀嚼肌功能紊乱发病机制的研究[J].
华西口腔医学杂志, 2011, 29(1): 96-9.
|
| [18] |
Williams GS, Boyman L, Chikando AC, et al. Mitochondrial calcium uptake[J].
Proc Natl Acad Sci USA, 2013, 110(26): 10479-86.
DOI: 10.1073/pnas.1300410110. |
| [19] |
Palty R, Hershfinkel M, Sekler I. Molecular identity and functional properties of the mitochondrial Na+/Ca2+ exchanger[J].
J Biol Chem, 2012, 287(38): 31650-7.
DOI: 10.1074/jbc.R112.355867. |
| [20] |
Tu J, Lu L, Cai W, et al. cAMP/protein kinase a activates cystic fibrosis transmembrane conductance regulator for ATP release from rat skeletal muscle during low pH or contractions[J].
PLoS One, 2012, 7(11): e50157.
DOI: 10.1371/journal.pone.0050157. |
| [21] |
Roome CJ, Power EM, Empson RM. Transient reversal of the Sodium/Calcium exchanger boosts presynaptic calcium and synaptic transmission at a cerebellar synapse[J].
J Neurophysiol, 2013, 109(6): 1669-80.
DOI: 10.1152/jn.00854.2012. |
| [22] |
Fischer TH, Herting J, Tirilomis T, et al. Ca2+/calmodulin-dependent protein kinase Ⅱ and protein kinase A differentially regulate sarcoplasmic reticulum Ca2+ leak in human cardiac pathology[J].
Circulation, 2013, 128(9): 970-81.
DOI: 10.1161/CIRCULATIONAHA.113.001746. |
| [23] |
Rose AJ, Hargreaves M. Exercise increases Ca2 +-calmodulindependent protein kinase Ⅱ activity in human skeletal muscle[J].
J Physiol, 2003, 553(1): 303-9.
DOI: 10.1113/jphysiol.2003.054171. |
| [24] |
Fieni F, Johnson DE, Hudmon A, et al. Mitochondrial Ca2+ uniporter and CaMKⅡ in heart[J].
Nature, 2014, 513(7519): E1-2.
DOI: 10.1038/nature13626. |
| [25] |
Reane DV, Vallese F, Checchetto VA, et al. A MICU1 splice variant confers high sensitivity to the mitochondrial Ca2+ uptake machinery of skeletal muscle[J].
Mol Cell, 2016, 64(4): 760-73.
DOI: 10.1016/j.molcel.2016.10.001. |
| [26] |
Mu XD, Brown LD, Liu YW, et al. Roles of the calcineurin and CaMK signaling pathways in fast-to-slow fiber type transformation of cultured adult mouse skeletal muscle fibers[J].
Physiol Genomics, 2007, 30(3): 300-12.
DOI: 10.1152/physiolgenomics.00286.2006. |
 2018, Vol. 38
2018, Vol. 38

