慢加急性肝衰竭(ACLF)是慢性肝病基础发生急性肝损伤驱动的全身多器官功能障碍。其特点是病情急骤且预后较差,短期病死率高达50%~90%[1-4]。我国ACLF的主要病因是乙型肝炎病毒感染。目前除了肝移植术,尚缺乏特效的干预手段。因为肝源短缺、费用昂贵等因素,大部分ACLF患者不能接受肝移植术,但经过积极的内科治疗后,仍有30%~50%的患者能够恢复[5-6]。由于东西方对于ACLF的定义不同,国外更多关注肝硬化基础ACLF患者的病情转归。研究表明,发生ACLF会严重影响肝硬化患者的长期预后,3年累计死亡率达62%[7]。而关于非肝硬化基础的ACLF存活者预后的研究较少,得到的初步研究结论需进一步验证[8]。慢性肝病患者可出现乏力、腹痛、食欲下降、焦虑等问题,急性打击事件的发生是否会给ACLF存活者的生存质量带来严重影响,尚未见报道。本研究旨在观察ACLF存活者长期预后情况,关注非肝硬化基础ACLF患者的肝脏转归,并首次对ACLF存活患者的健康生存质量进行评价。
1 资料和方法 1.1 病例选择及诊断标准南方医科大学南方医院2011年11月~2016年10月住院的出院诊断“肝衰竭”的患者共895例,入组标准:慢性乙型肝炎基础上[9],符合2014亚太肝病学会ACLF诊断共识[10];经我科综合内科治疗后病情好转出院且存活时间长于90 d。排除标准:年龄>70岁或 < 18岁;其他病因的肝脏疾病;合并肿瘤或其他显著影响患者生存的严重疾病。最终入组患者223例,分析患者临床资料,进行随访,终止随访时间为2017年11月。
对于存活1年以上,并于2017年7月至11月回访的HBV-ACLF患者进行生存质量SF-36量表填写,共回访64人。对照组为同一时期期门诊就诊的“慢性乙型肝炎”患者及“乙肝肝硬化”患者共70例,入组标准:分别符合慢性乙型肝炎防治指南(2015年版)[9]和肝硬化诊断依据[11];口服核苷类似物药物治疗。排除拒绝问卷填写者9例,最终入组慢乙肝患者31例(CHB组)和乙肝肝硬化患者30例(CIR组)。正常参照采用李秀宁等所调查2249名城乡生存质量资料[12]。
慢性乙型肝炎诊断参照慢性乙型肝炎防治指南(2015年版)[9]。
慢加急性肝衰竭诊断标准[10]:既往已知或者未知的慢性肝病/肝硬化的基础上,出现以黄疸(血清TBil≥ 5 mg/dL或85 μmol/L)和凝血功能障碍(INR≥1.5或PTA≤40%)为主要表现的急性肝功能损伤,在4周内并发腹水或/和肝性脑病
肝硬化诊断依据[11]:1、肝脏活检证实;2、有失代偿事件发生或静脉曲张的临床证据;3、肝结节形成等影像学检查支持。肝细胞癌(HCC)诊断参照文献[13]。
1.2 方法HBV-ACLF患者随访方式:(1)电话随访共97例患者,出院后每3个月电话随访1次,出院1年后每半年电话随访1次,了解患者病情状况和生存情况。(2)门诊随访126例患者,对复诊患者行血常规、血生化、HBVDNA病毒定量、腹部B型超声、肝脏弹性扫描等检查。
观察指标:(1)人口学资料;(2)患者在院期间实验室指标及影像学检查;(3)出院后生存情况;(4)肝硬化发生、肝硬化失代偿和HCC等肝病事件的发生;(5)生存质量评分。
量表填写:本次调研在2017年7月至11月进行,在患者返院随访时进行调查,并在取得患者同意后填写,由调查者用统一指导语指导患者自行填写,不理解题意者给与解释,但不予提示性诱导。填写完成后现场回收,并检查填写的完整性。最终发放问卷125份,有效回收125份,有效回收率100%。其中回收HBV-ACLF患者64份,乙肝肝硬化患者30例和慢乙肝患者31例。
生存质量判定标准:利用SF-36量表评估患者生存质量[14]。包括生理功能(PF)、生理职能(RP)、机体疼痛(BP)、健康总体自评(GH)、活力(VT)、社会功能(SF)、情感职能(RE)和精神健康(MH)8个维度,最后将得分转化为标准分值0~100,分值越高代表其生命质量越高。
1.3 统计学方法采用SPSS 22.0统计软件进行数据处理。计量资料采用均数±标准差表示,比较采用z检验和U检验;计量资料与常模的比较采用t检验;计数资料采用百分率(%)表示,比较采用卡方检验。生存率及肝硬化发生率的估计采用Kaplan-Meier法,组间生存曲线比较采用Log-rank检验;通过Cox回归模型进行筛选新发肝硬化的危险因素,单因素分析P < 0.1的变量纳入多因素分析,采用前进法构建模型;P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料共223例乙肝相关ACLF患者纳入研究,按入院时是否合并肝硬化分为乙型肝炎组(CHB-ACLF,n=130)和乙肝肝硬化组(CIR-ACLF,n=93)。两组患者在性别、入院合并腹水及肝性脑病比例、实验室检查白细胞、中性粒细胞百分比、肌酐、INR水平等差异无统计学意义(P>0.05);在年龄、脾厚、MELD-Na评分、实验室指标血小板、谷丙转氨酶、总胆红素、白蛋白等因素的差异有统计学意义(P < 0.05,表 1)。
| 表 1 两组患者临床资料基线比较 Table 1 Comparison of clinical characteristics between CHB- ACLF group and CIR- ACLF group (Mean±SD or number of cases) |
223例患者在2012年1月~2017年11月的随访过程中,9例行肝移植,失访36例。运用Kaplan-Meier生存分析比较两组间生存情况,CHB-ACLF组第12个月、24个月、50个月的累计生存率分别为97%、95.7%和93.9%,而CIR-ACLF组为91%、86%和74%,两组比较差异有统计学意义(P=0.007,图 1)。在返院复查ACLF的存活患者中(n=126),CIR-ACLF组新发失代偿事件24/48(50%),其中腹水发生24例,食管-胃底静脉出血1例,原发性肝癌发生3例,死亡1例;CHB-ACLF组新发失代偿事件22/78(28.2%),其中腹水发生21例,食管-胃底静脉出血2例,死亡1例(表 2)。
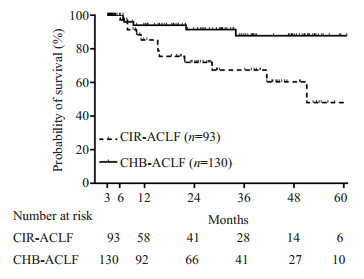
|
图 1 两组患者的长期生存分析 Figure 1 Survival analysis of ACLF patients with and without cirrhosis. |
| 表 2 门诊随访126名患者临床不良事件发生率 Table 2 Incident of liver-related clinical adverse events in 126 follow-up outpatients[n(%)] |
共有78例CHB-ACLF长期存活者有回院随访记录,中位随访时间为34个月,12个月、24个月、36个月肝硬化累计进展率分别为37.9%、58.4%和68.7%(图 2)。将患者入院时的年龄、脾厚、实验室指标及28 d内疾病严重程度(肝性脑病的发生、血小板最低值、总胆红素最高值、肌酐最高值及INR最高值)等纳入Cox回归模型,分析进展至肝硬化的危险因素。结果发现,患者基线Na水平、28 d内肌酐及INR的最高值是影响其出院后发展至肝硬化的独立危险因素,HR值分别是0.84,1.015,2.032(表 3)。
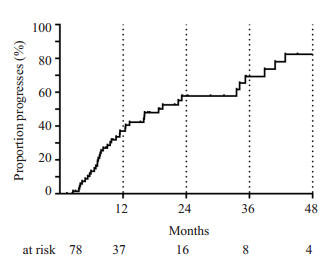
|
图 2 CHB-ACLF存活者新发肝硬化比例 Figure 2 Cirrhosis progression rates in chronic hepatitis B related ACLF survivors. |
| 表 3 CHB-ACLF存活者肝硬化进展的危险因素Cox回归分析 Table 3 Cox regression analysis of factors associated with progression of cirrhosis in CHB-ACLF survivors |
共有125例患者完成SF-36量表,其中CHB-ACLF组24例,CHB组31例;CIR-ACLF组40例,CIR组30例。对照组在性别、年龄上与ACLF组无统计学差异。ACLF患者与常模相比,除“心理健康”维度得分低于正常人群外(P < 0.001,图 3A),其余各维度差异无统计学意义。ACLF患者与慢乙肝、肝硬化患者相比,CHBACLF组在“一般健康”维度的得分高CHB组,而CIRACLF组在“躯体疼痛”和“一般健康”2个维度中的得分高于CIR组(P < 0.05,图 3B-C),其余维度两组间均无统计学差异。
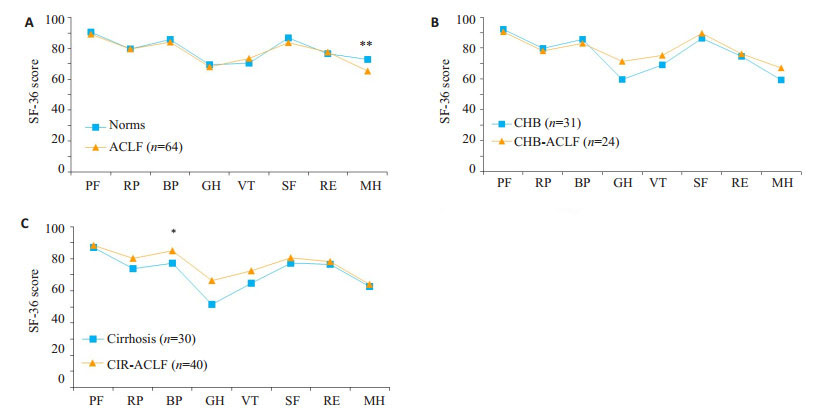
|
图 3 ACLF组与正常人群及对照组生存质量比较 Figure 3 Comparison of quality of life score in ACLF groups with norms and control groups. A: Comparison between ACLF group and norms; B: Comparison between CHB ACLF group and CHB group; C: Comparison between CIR ACLF group and CIR group. BP: Bodily pain; GH: General health; MH: Mental health; PF: Physical functioning; RE: Role limitation due to emotional problems; RP: Role limitation due to physical problems; SF: Social functioning; VT: Vitality; *P < 0.05: **P < 0.01. |
HBV相关慢加急性肝衰竭是在乙型肝炎或肝硬化基础上短期内发生急性肝功能失代偿的临床综合征,常伴有肝外器官受累。ACLF的特点是短期病死率高,欧洲肝脏-慢性肝衰竭研究协会CANONIC研究显示,ACLF1、2、3级患者90 d及180 d的死亡率分别为42%和47%,74%和79%,95%和96%[15],因此目前已有大量关于ACLF短期预后的研究,并建立了许多不同的预后模型[16-18]。然而,与终末期肝病不同,经过抗病毒药物及器官支持等治疗,部分ACLF患者可以恢复[19-22],但对于这部分存活患者长期预后的报道则较少。Bruno等研究显示在符合APASL-ACLF标准的肝硬化患者1年、2年、3年的累计死亡率分别是28%, 53%和62%[7]。关于非肝硬化基础ACLF存活者的长期预后如何,目前国内仅有一篇相关报道[8]。以上的研究均忽视了ACLF存活者生存质量情况。本研究拟分析ACLF存活者的长期预后,重点关注慢乙肝基础ACLF患者恢复后的肝脏转归,并利用SF-36量表评价ACLF存活者的生存质量。
本研究回顾性分析223名ACLF存活大于90 d患者的长期预后情况,发现慢乙肝ACLF患者的长期存活率高于肝硬化基础上的ACLF患者(P=0.007);且失代偿事件的发生率低于肝硬化组(P=0.014)。与已有研究结果一致[8],起病前肝病基础不同可影响ACLF患者长期预后,慢乙肝基础ACLF患者的长期预后情况好于肝硬化ACLF患者。可能是肝硬化者肝储备功能降低,肝细胞再生能力受损[23],肝脏修复所需时间更长[24]。因此,对于ACLF恢复患者仍要密切随访,不可忽视后续的进一步治疗。
肝硬化的形成一般是循序渐进的缓慢过程,慢乙肝基础的肝硬化年发生率为2%~7%[4, 25-26]。本研究发现慢乙肝患者经历急性打击事件后,即使在积极地保肝、抗病毒治疗,出院1年后约38%的患者发生肝硬化,3年发生率更高达70%,提示病情仍在进展,肝硬化发生率增加。ACLF患者的短期结局取决于肝脏储备能力和疾病的严重程度[10],但器官衰竭的严重程度是否仍然影响患者的长期预后尚不清楚[27]。Cox回归分析显示,患者基线Na水平、28 d内肌酐及INR的最高值是乙型肝炎ACLF存活者进展至肝硬化的独立危险因素,HR值分别是0.84,1.015,2.032。而28 d内肝性脑病的发生、总胆红素、肌酐、INR的最高值可表示各器官损伤的严重程度[19, 28]。肝脏及肝外器官的损害程度对乙型肝炎基础的ACLF患者恢复后肝硬化的发生影响显著,可能与肝脏大块坏死,修复能力下降有关。
生存质量是评价临床治疗效果的一重要指标[29],也为后续治疗提供重要依据[30, 31]。慢性肝病患者的生存质量普遍下降,尤其是肝硬化患者更甚[31]。ACLF长期存活患者经历了肝衰竭的急性打击,其恢复后生存质量如何尚未有文献报道。本研究运用SF-36量表,对ACLF恢复患者进行健康、心理、社会、主观满意度的评价。结果显示,ACLF存活者在SF-36问卷中,反应心理健康维度的得分低于正常人群,而其他维度与常模相比差异无统计学意义,提示ACLF存活者经历肝脏甚至多器官功能衰竭后,经过治疗好转出院,虽然能维持正常工作和日常活动,但仍存在一定的心理压力,应重视ACLF存活者的心理变化,给予患者适当的鼓励和支持。ACLF患者与门诊就诊的慢乙肝及肝硬化患者相比,生存质量评分无显著差异,甚至在某些方面表现更优(如,一般健康、躯体疼痛),说明ACLF存活者生活质量不亚于慢乙肝及肝硬化患者。在随访过程中发现,ACLF患者出院后高度重视他们的健康变化,其生活方式较前明显改善,并且依从性也明显提高,可部分解释其问卷评分更高。
本研究为单中心回顾性研究,存在一定的局限性;失访率较高,部分病人在随访过程中脱失,无法查究其结局;由于本次调研在2017年7月至11月进行,部分ACLF存活患者未完成问卷填写,比较已完成SF-36量表的ACLF患者与未完成患者的入院基线资料及预后,差异无统计学意义,但问卷调查分析的样本量较少,仍需进一步扩大样本量进行验证。
总之,乙型肝炎疾病基础不同可导致ACLF患者长期预后有所差别。严重的急性打击事件可增加CHBACLF患者肝硬化的发生率,可能与肝衰竭时各器官的损害程度有关。ACLF患者好转出院后,其生活、社会能力无显著降低,但存在一定的心理压力,需予以重视。
| [1] |
Jalan R, Gines P, Olson JC, et al. Acute-on chronic liver failure[J].
J Hepatol, 2012, 57(6): 1336-48.
DOI: 10.1016/j.jhep.2012.06.026. |
| [2] |
Sun QF, Ding JG, Xu DZ, et al. Prediction of the prognosis of patients with acute-on-chronic hepatitis B liver failure using the model for end-stage liver disease scoring system and a novel logistic regression model[J].
J Viral Hepat, 2009, 16(7): 464-70.
DOI: 10.1111/jvh.2009.16.issue-7. |
| [3] |
Katoonizadeh A, Laleman W, Verslype C, et al. Early features of acute-on-chronic alcoholic liver failure:a prospective cohort study[J].
Gut, 2010, 59(11): 1561-9.
DOI: 10.1136/gut.2009.189639. |
| [4] |
Wlodzimirow KA, Eslami S, Abu-Hanna A, et al. A systematic review on prognostic indicators of acute on chronic liver failure and their predictive value for mortality[J].
Liver Int, 2013, 33(1): 40-52.
DOI: 10.1111/liv.2012.33.issue-1. |
| [5] |
Chen JJ, Huang JR, Yang Q, et al. Plasma exchange-centered artificial liver support system in hepatitis B virus-related acute-onchronic liver failure:a nationwide prospective multicenter study in China[J].
Hepatobiliary Pancreat Dis Int, 2016, 15(3): 275-81.
DOI: 10.1016/S1499-3872(16)60084-X. |
| [6] |
Shi Y, Yang Y, Hu Y, et al. Acute-on-chronic liver failure precipitated by hepatic injury is distinct from that precipitated by extrahepatic insults[J].
Hepatology, 2015, 62(1): 232-42.
DOI: 10.1002/hep.27795. |
| [7] |
臧红, 肖珑, 刘婉姝, 等. 乙型肝炎病毒相关慢加急性肝衰竭恢复患者的长期预后[J].
中华实验和临床病毒学杂志, 2017, 31(2): 137-41.
|
| [8] |
王贵强, 王福生, 成军, 等. 慢性乙型肝炎防治指南(2015年版)[J].
中国肝脏病杂志:电子版, 2015, 3(1): 1-18.
|
| [9] |
Sarin SK, Kedarisetty CK, Abbas Z, et al. Acute-on-chronic liver failure:consensus recommendations of the Asian Pacific Association for the Study of the Liver (APASL) 2014[J].
Hepatol Int, 2014, 8(4): 453-71.
DOI: 10.1007/s12072-014-9580-2. |
| [10] |
Bajaj JS, O'leary JG, Reddy KR, et al. Second infections independently increase mortality in hospitalized patients with cirrhosis:the North American consortium for the study of end-stage liver disease (NACSELD) experience[J].
Hepatology, 2012, 56(6): 2328-35.
DOI: 10.1002/hep.25947. |
| [11] |
李宁秀, 刘朝杰, 李俊, 等. 四川省城乡居民SF-36评价参考值[J].
华西医科大学学报, 2001, 32(1): 43-7.
|
| [12] |
叶胜龙, 秦叔逵, 吴孟超, 等. 原发性肝癌规范化诊治的专家共识[J].
肿瘤, 2009, 29(4): 295-304.
|
| [13] |
Ware JE, Sherbourne CD. The MOS 36-item short-form health survey (SF-36).Ⅰ.Conceptual framework and item selection[J].
Med Care, 1992, 30(6): 473-83.
DOI: 10.1097/00005650-199206000-00002. |
| [14] |
Gustot T, Fernandez J, Garcia E, et al. Clinical course of acute-onchronic liver failure syndrome and effects on prognosis[J].
Hepatology, 2015, 62(1): 243-52.
DOI: 10.1002/hep.27849. |
| [15] |
Lee M, Lee JH, Oh S, et al. CLIF-SOFA scoring system accurately predicts short-term mortality in acutely decompensated patients with alcoholic cirrhosis:a retrospective analysis[J].
Liver Int, 2015, 35(1): 46-57.
DOI: 10.1111/liv.12683. |
| [16] |
Gao F, Sun L, Ye X, et al. Development and validation of a prognostic model for acute-on-chronic hepatitis B liver failure[J].
Eur J Gastroenterol Hepatol, 2017, 29(6): 669-78.
DOI: 10.1097/MEG.0000000000000854. |
| [17] |
Li H, Chen LY, Zhang NN, et al. Characteristics, diagnosis and prognosis of Acute-on-Chronic liver failure in cirrhosis associated to hepatitis B[J].
Sci Rep, 2016, 6: 25487.
DOI: 10.1038/srep25487. |
| [18] |
Moreau R, Jalan R, Gines P, et al. Acute-on-chronic liver failure is a distinct syndrome that develops in patients with acute decompensation of cirrhosis[J].
Gastroenterology, 2013, 144(7): 1426-1437.e1-9.
DOI: 10.1053/j.gastro.2013.02.042. |
| [19] |
Shen Y, Wang XL, Wang B, et al. Survival benefits with artificial liver support system for Acute-on-Chronic liver failure:a time Series-Based Meta-Analysis[J].
Medicine (Baltimore), 2016, 95(3): e2506.
DOI: 10.1097/MD.0000000000002506. |
| [20] |
Qin G, Shao JG, Wang B, et al. Artificial liver support system improves short- and long-term outcomes of patients with HBVassociated acute-on-chronic liver failure:a single-center experience[J].
Medicine (Baltimore), 2014, 93(28): e338.
DOI: 10.1097/MD.0000000000000338. |
| [21] |
Li X, Gao F, Liu H, et al. Lamivudine improves short-term outcome in hepatitis B virus-related acute-on-chronic liver failure patients with a high model for end-stage liver disease score[J].
Eur J Gastroenterol Hepatol, 2017, 29(1): 1-9.
DOI: 10.1097/MEG.0000000000000750. |
| [22] |
Fausto N. Liver regeneration and repair:Hepatocytes, progenitor cells, and stem cells[J].
Hepatology, 2004, 39(6): 1477-87.
DOI: 10.1002/(ISSN)1527-3350. |
| [23] |
Shi Y, Zheng MH, Yang Y, et al. Increased delayed mortality in patients with acute-on-chronic liver failure who have prior decompensation[J].
J Gastroenterol Hepatol, 2015, 30(4): 712-8.
DOI: 10.1111/jgh.12787. |
| [24] |
Iloeje UH, Yang HI, Su J, et al. Predicting cirrhosis risk based on the level of circulating hepatitis B viral load[J].
Gastroenterology, 2006, 130(3): 678-86.
DOI: 10.1053/j.gastro.2005.11.016. |
| [25] |
Huo T, Wu JC, Hwang SJ, et al. Factors predictive of liver cirrhosis in patients with chronic hepatitis B:a multivariate analysis in a longitudinal study[J].
Eur J Gastroenterol Hepatol, 2000, 12(6): 687-93.
DOI: 10.1097/00042737-200012060-00019. |
| [26] |
Seo Y, Yano Y. Short- and long-term outcome of interferon therapy for chronic hepatitis B infection[J].
World J Gastroenterol, 2014, 20(37): 13284-92.
DOI: 10.3748/wjg.v20.i37.13284. |
| [27] |
Wehler M, Kokoska J, Reulbach U, et al. Short-term prognosis in critically ill patients with cirrhosis assessed by prognostic scoring systems[J].
Hepatology, 2001, 34(2): 255-61.
DOI: 10.1053/jhep.2001.26522. |
| [28] |
Heyland DK, Hopman W, Coo H, et al. Long-term health-related quality of Life in survivors of sepsis.Short Form 36:a valid and reliable measure of health-related quality of Life[J].
Crit Care Med, 2000, 28(11): 3599-605.
DOI: 10.1097/00003246-200011000-00006. |
| [29] |
Dan AA, Kallman JB, Srivastava R, et al. Impact of chronic liver disease and cirrhosis on health utilities using SF-6D and the health utility index[J].
Liver Transpl, 2008, 14(3): 321-6.
DOI: 10.1002/(ISSN)1527-6473. |
| [30] |
Lam ET, Lam CL, Lai CL, et al. Psychometrics of the chronic liver disease questionnaire for Southern Chinese patients with chronic hepatitis B virus infection[J].
World J Gastroenterol, 2009, 15(26): 3288-97.
DOI: 10.3748/wjg.15.3288. |
| [31] |
Janani K, Varghese J, Jain M, et al. HRQOL using SF36 (generic specific) in liver cirrhosis[J].
Indian J Gastroenterol, 2017, 36(4): 313-7.
DOI: 10.1007/s12664-017-0773-1. |
 2018, Vol. 38
2018, Vol. 38

