随着世界人口数量及人类平均寿命的不断增长,骨缺损修复在临床上的应用越来越广泛,但目前临床上应用的自体骨移植会产生二次损伤以及容易畸形等并发症,而异体骨移植又存在供应源紧缺及免疫原性等障碍。所以为解决这个难题,通过“支架材料”、“生物活性因子”、“种子细胞”作为3基本要素的骨组织工程在近年来得到快速发展[1-3]。
目前在骨组织工程中研究中运用最广泛的支架材料主要有磷酸钙骨修复替代材料(CPC)[4]、聚己内酯(PCL)[5]等。其中CPC最早是由Brown和Chow在1987年发明的,目前凭借其良好的生物相容性、骨传导性、可注射性、自凝能力以及可替代性,已被越来越广泛地在临床作为骨替代物使用[6-7]。但是由于CPC仍然具有脆性大、溶解性差以及降解速度慢等缺点,使得它在临床应用上未能更进一步[8]。而有研究发现,来自蟹壳提取物的壳聚糖(CN),在骨组织工程中被广泛作为一种结构性固化剂使用,可以在增加支架机械强度的同时,在生物体内能有效降解且不存在免疫原性[9]。此外,在骨组织工程的应用中的生物活性因子有很多种,目前最主要有骨形态发生蛋白-2(BMP-2)[10-12]、血小板衍生生长因子(PDGF)[13]、转化生长因子(TGF)[14]、血管内皮生长因子(VEGF)[14]及胰岛素样生长因子(IGF)[15-16]等,但腺苷(AD)至今尚未广泛被使用。而腺苷已被证明可参与调节多种哺乳动物组织中生理活动的核苷,有研究表明,腺苷相关通路可以促进干细胞的成骨分化及骨组织形成[17]。相比其他生物活性因子,腺苷具有制作成本低及无免疫原性等一系列优势,因此腺苷可在骨组织工程中被认为是一种非常有研究价值的活性因子[18]。在种子细胞方面,目前的研究更倾向于通过生物活性因子引导自体干细胞至缺损部位产生自身修复功能,而不是选择一般具有免疫原性的外源性细胞[19]。
然而,目前尚未有研究观察或探究磷酸钙/壳聚糖/小分子腺苷复合材料的骨修复效果。因此,本研究主要在观察磷酸钙/壳聚糖/小分子腺苷复合材料的骨缺损修复效果的基础上,分析其效果产生的原因,为骨缺损再生修复的相关研究提供相应的实验数据。
1 材料和方法 1.1 材料制作分别制作4组实验所需的支架材料。根据前期的相关研究,制备CPC粉末由磷酸四钙[TTCP:Ca4(PO4) 2O]和无水磷酸氢钙(DCPA:CaHPO4)以1: 3摩尔比混合物组成[20]。不同组的支架制作方法如下:(1)CPC对照组:把无菌CPC粉末与蒸馏水以质量比为2: 1的比例混合制作成CPC糊剂,再将此CPC糊剂放入内直径为8 mm,高度为1 mm的模具中,然后放入37 ℃的培养箱中24 h烤干,待成形后取出材料;(2)CPC/CN组:先在蒸馏水中加入壳聚糖苹果酸盐(Vanson, Redmond, WA)并使得壳聚糖质量分数为10%(壳聚糖质量/壳聚糖+蒸馏水质量=10%),再把无菌CPC粉末与壳聚糖溶液以质量比为2: 1的比例混合制作成CPC糊剂,再将此CPC糊剂放入内直径为8 mm,高度为1 mm的模具中,然后放入37 ℃的培养箱中24 h烤干,待成形后取出材料;(3)CPC/CN/AD组:首先把300 μg小分子腺苷(Sigma-Aldrich,目录号:A4036)溶于水中制成腺苷溶液,再往溶液里面加入壳聚糖苹果酸盐并使得壳聚糖质量分数为10%(壳聚糖质量/壳聚糖+腺苷溶液质量=10%),再把无菌CPC粉末与壳聚糖腺苷溶液以质量比为2: 1的比例混合制作成CPC糊剂,再将此CPC糊剂放入一个内直径为8 mm,高度为1 mm的模具中,然后放入37 ℃的培养箱中24 h烤干,待成形后取出材料,将复合材料浸泡在培养液中,通过检测培养液中腺苷的浓度来监测材料中腺苷释放量;(4)CPC/AD组:先在蒸馏水中加入壳聚糖苹果酸盐(Vanson,Redmond,WA)并使得壳聚糖质量分数为10%(壳聚糖质量/壳聚糖+蒸馏水质量=10%),再把无菌CPC粉末与壳聚糖溶液以质量比为2: 1的比例混合制作成CPC糊剂,再将此CPC糊剂放入内直径为8 mm,高度为1 mm的模具中,然后放入37 ℃的培养箱中24 h烤干,待成形后取出材料并用上文描述方法监测材料中腺苷释放量。
1.2 实验动物选用健康的SPF级8周龄的雄性Sprague-Dawley大鼠,共18只,体质量320~400 g,由南方医科大学南方医院实验动物中心提供(合格证号:NO44002100004402),随机分为3组。
1.3 实验分组植入材料分为3组:单纯使用蒸馏水作为成形剂的8 mm直径的磷酸钙骨修复替代材料(CPC)支架材料;使用10%壳聚糖溶液作为成形剂的CPC支架材料;用10%壳聚糖液体作为成形剂并每个含有300 μg小分子腺苷的CPC支架材料。各组重复6次。
1.4 动物造模3%戊巴比妥钠以50 mg/kg剂量腹腔注射麻醉大鼠后,常规消毒、铺单,沿颅骨正中线切开皮肤,逐层分离皮肤、软组织、骨膜,清晰暴露顶骨最平坦部位,经大鼠颅骨矢状缝定位测量,以骨科微型动力系统于顶骨制作直径为8.0 mm的全层圆形颅骨缺损,注意避免损伤硬脑膜,随机植入3组不同的实验材料,逐层缝合骨膜、软组织、皮肤。术后麻醉未醒前独笼观察,待麻醉清醒后重新合笼饲养,每日观察动物活动、饮食、精神状态、切口状况等,观察时间12周。
1.5 X线检测术后12周再次3%戊巴比妥腹腔麻醉大鼠,麻醉成功后送南方医科大学南方医院影像科行颅骨正侧位摄片(Siemens, Aristos MX2, 73 KV/16 mAs/500 ms),观察骨折生长情况。
1.6 CT检测X光检测完毕后,送南方医科大学南方医院影像科CT室分别对每只大鼠头部进行CT扫描(Somatom Definition, Siemens Healthcare, Erlangen, Germany)、三维重建及观察分析。
1.7 组织形态学分析CT扫描结束后,处死大鼠,取下颅骨标本。所有标本用10%中性缓冲福尔马林溶液固定72 h,EDTA溶液脱钙,期间用大头针轻戳标本,至针头可轻松刺入标本中提示脱钙完成,脱钙时间约4~6周,脱钙完成后60%乙醇4 h→70%乙醇4 h→80%乙醇4 h→正丁醇8 h脱水,脱水完成后常规石蜡包埋,包埋完成后以5 μm厚度连续切片,所得切片行苏木素-伊红染色(HE染色),观察各组材料与组织相容性、成骨及成血管情况,利用Image-Pro Plus 6.0软件计算各组代表性切片组织新生骨面积百分数(NewBone Area NBA%)、新生血管密度(New Vessel Density, NVD),分析各组复合材料骨缺损修复效果。
新生骨面积百分数(NBA%)=新生骨面积/缺损总面积×100%。
新生血管密度(NVD)=新生血管数/缺损面积。
1.8 统计学分析应用IBMSPSS 20.0统计软件分析,结果中的统计数据用均数±标准差表示,各组实验结果量化后的相关数据采用单因素方差分析进行检验,如果差异有统计学意义进一步做两两比较,若方差齐用LSD检验,方差不齐则使用Dunnett T3检验。当P < 0.05时认为差异具有统计学意义。
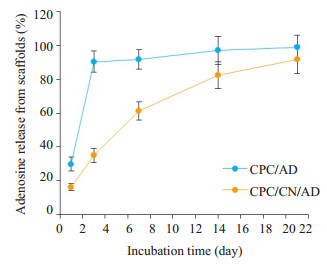
2 结果 2.1 腺苷累计释放量通过磷酸钙骨支架复合壳聚糖和小分子腺苷组成的新型支架生物材料以及无壳聚糖组,在酸碱度7和温度为37 ℃下的腺苷的释放能力如图 1所示。在孵育期间,通过将壳聚糖加入到CPC中,腺苷在培养基中可得到持续往外扩散的作用。构建的CPC/CN/AD组支架材料,在第1天的突释效应[释放出约占总腺苷量的(16.25±2.07)%]之后,腺苷的释放率显著降低。此支架在之后的时间里,每两天持续释放约10%的腺苷量,并最后累积释放率在第21天达到(91.77±8.35)%。因此可以认为,此新型支架中的腺苷总是缓慢释放的,并可持续在在整个细胞成骨诱导培养周期内。而相比之下,无壳聚糖组由于腺苷缓释过快,3 d后支架内已经释放腺苷含量达所含低分子腺苷的(90.52±6.33)%,可以认为3 d后此组支架中所含腺苷已经基本释放殆尽。所以,磷酸钙骨支架复合小分子腺苷的支架明显不具有缓释功能,因此在接下来的体内实验中这组支架没有实验意义。
|
图 1 腺苷累积释放曲线 Figure 1 Dissolution curve of adenosine release. |
实验共纳入SD大鼠18只,术后恢复情况均良好,术后1周伤口完全恢复,无伤口裂开、填充材料移位等并发症。
2.3 X射线观察结果3组大鼠颅骨顶部骨缺损变小,骨折线模糊,边缘骨密度增高,从肉眼观察下可见CPC/CN/AD组新生骨面积百分比明显大于CPC/CN组和CPC对照组(图 2)。

|
图 2 SD大鼠颅骨X线头位片影像 Figure 2 X-ray of the SD rat skull. A: CPC control group at 12 weeks after surgery; B: CPC/CN group at 12 weeks after surgery; C: CPC/CN/AD group at 12 weeks after surgery; D: Before surgery. The arrows indicate the cranial defects. |
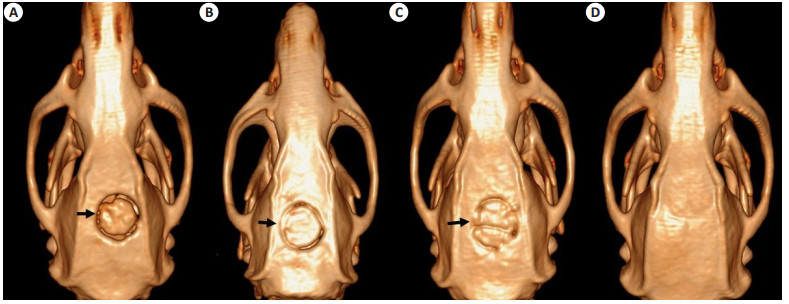
CPC/CN组和CPC对照组新生骨仅位于缺损边缘,且新生骨与支架材料之间仍有明显缝隙,CPC/CN/AD组新生骨量明显更多,新生骨基本与支架材料边缘完全融合(图 3)。
|
图 3 SD大鼠颅骨CT三维重建图 Figure 3 3D reconstruction of large cranial defects. A: CPC control group at 12 weeks after surgery; B: CPC/CN group at 12 weeks after surgery; C: CPC/CN/AD group at 12 weeks after surgery; D: Before surgery. The arrows indicate the cranial defects. |
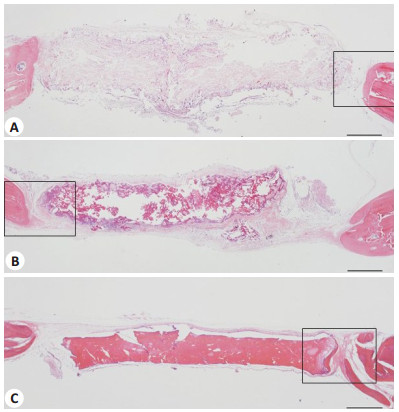
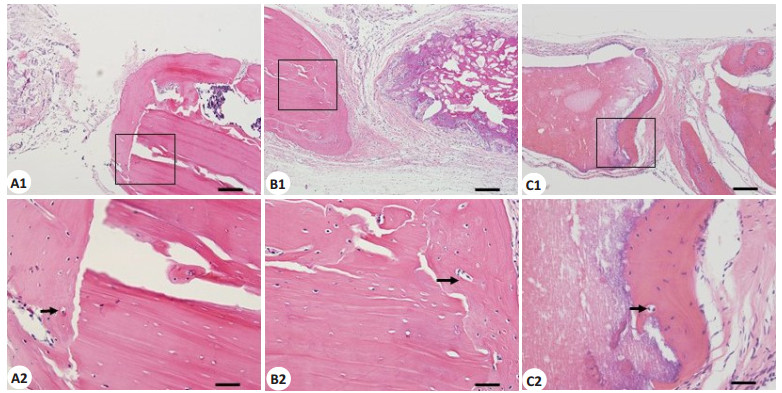
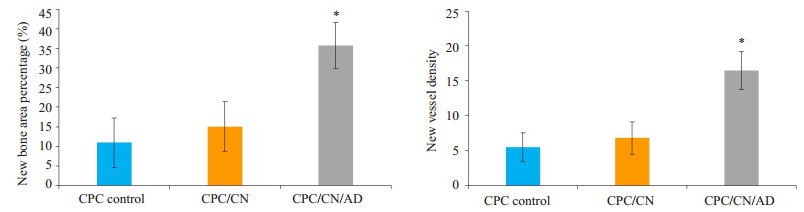
低倍显微镜下苏木精-伊红(HE)染色能观察到所有CPC支架在12周时均有不同程度的吸收,且可见被染成深红色的新生骨形成(图 4);高倍显微镜下可见3组缺损边缘处可见染色均一的新生骨组织,含有大量的成骨细胞与骨基质(图 5)。从图 5可以看出,CPC/CN/ AD组的新生骨量多于其它两组。在CPC/CN/AD组中,新生骨不仅仅出现在缺损边缘,支架的边缘明显可见新生骨与支架紧密相接,而另外两组新生骨主要集中在缺损边缘,支架边缘基本无新生骨或者仅有少量新生骨。新生骨中均可见新生毛细血管。通过使用IPP 6.0软件进行定量分析新生骨量及新生血管数,可见CPC/ CN/AD组中新生骨面积百分比(35.4±5.8)%是CPC对照组(11.0±6.3)%的3.4倍(P < 0.05),CPC/CN/AD组中的新生血管数(16.50±2.7)/mm2明显多于CPC对照组的(5.50±2.1)/mm2(P < 0.05),但CPC/CN组的新生骨面积百分比(15.0±6.3)%及新生血管数(6.83±2.3)/mm2与CPC对照组差异无统计学意义(P > 0.05,图 6)。
|
图 4 镜下所见病理HE染色切片图像 Figure 4 HE staining of the tissues from the defects. A: CPC control group; B: CPC/CN group; C: CPC/CN/AD group. (Scale bar=1.0 mm). Pictures in the black boxes would be enlarged. |
|
图 5 镜下所见病理HE染色切片图像 Figure 5 HE staining of the tissues from the defects. A1/A2: CPC control group; B1/B2: CPC/CN group; C1/C2: CPC/CN/AD group. (A1/B1/C1: Scale bar=200 μm, A2/B2/C2: Scale bar=50 μm). The arrows indicate the new vessels. Pictures in the black boxes would be enlarged. |
|
图 6 HE染色切片骨缺损部位新生骨面积百分数定量和新生血管定量分析 Figure 6 Quantitative assessment of new bone area percentage and new vessel density. *P < 0.05 vs CPC control group. |
CPC凭借自身的可注射性、可塑形性、良好的生物活性以及生物硬组织替代能力,在骨科和口腔科等科室均有着非常广阔的临床应用前景[21]。早在1991年,CPC就被FDA批准用于骨科、整形外科以及口腔科的组织修复中。但CPC本身相对较差的强度性能及生物脆性严重影响了它在临床上的进一步应用,使得CPC目前只能应用在非承重骨组织部位[22-25]。
为了解决这个缺陷,我们尝试通过在传统的CPC材料中加入固化剂及其它生物活性材料,来提高其机械强度的同时保留CPC原有的优点,同时加入生物活性因子也可增加缺损部位骨组织再生修复的能力,达到更好的治疗效果。有文献指出,基于壳聚糖的支架对各种细胞类型均没有细胞毒性,且可以为生物材料提供良好的强度[26]。同时壳聚糖可对破骨细胞的功能有一定程度的抑制作用,可以减少成骨的吸收[27]。另外,也有大量研究证明腺苷相关通路可以促进干细胞的成骨分化及骨组织形成[28-30]。但是至今尚未有直接的实验证据来观察磷酸钙/壳聚糖/小分子腺苷复合材料的骨缺损修复效果。因此,在此研究中,我们把每300 μg小分子腺苷与10%壳聚糖溶液混合,再加入CPC粉末,混合后蒸发除去混合物中的水分,最后制作成直径为8 mm、高度为1 mm的扁圆柱体支架。通过这样我们实现了两个目标:将CPC+壳聚糖+腺苷结合在一起可以增强该支架的机械特性;通过生物因子增强CPC支架上的细胞以维持生存能力和进行成骨分化和矿化以增强骨再生的能力。本实验首次观察了磷酸钙/壳聚糖/小分子腺苷复合材料对Sprague Dawley大鼠颅骨极限缺损模型的修复作用。
通过本次实验,可以发现使用10%壳聚糖作为成形剂的CPC支架相比单纯使用蒸馏水作为成形剂的CPC支架,在促进成骨分化上以及促进骨组织形成上前者虽然比后者稍好,但是经过统计分析后两者无显著差别,而在加了小分子腺苷后,缺损的修复效果有了显著的提高,而且新生骨生长的部位不仅仅局限于骨缺损边缘,还在支架边缘形成了明显的新生骨。因此,根据此次实验结果我们可以知道,小分子腺苷是刺激骨组织形成及骨缺损的重要因素之一,而10%壳聚糖仅仅作为提高支架机械特性的溶剂,在12周的时间过程中对骨修复无明显促进作用。但是,由于本次实验在有限的实验动物数量、有限的修复时间上以及动物物种上存在着局限性,有可能在更大样本的实验动物中或者更长的修复时间中或者其他哺乳动物中有可能会得到显著的结果。
此外,在本次动物体内实验之前,我们也设计了一组CPC复合小分子腺苷而不含壳聚糖的支架。经过进一步实验发现,此支架由于失去了壳聚糖的缓释作用,导致支架内腺苷释放过快,短期腺苷局部浓度迅速升高,这会对细胞的生长产生明显抑制及毒性作用。另外,在3 d以后,支架内低分子腺苷基本耗尽,此时本组支架相当于单纯的CPC支架。通过支架的腺苷累计释放量结果可证明CPC复合小分子腺苷而不含壳聚糖的支架在无法达到持续释放腺苷刺激机体细胞修复的目的,因此,本次体内实验无CPC复合小分子腺苷而不含壳聚糖的支架。
综上所述,本次实验所构建的磷酸钙骨修复替代材料支架复合壳聚糖和小分子腺苷在SD大鼠颅骨极限缺损的骨修复上表现出了很好的生物相容性和促进骨组织再生的能力,修复效果明显较目前临床上常用的单纯CPC支架要更好。因此磷酸钙骨修复替代材料支架复合壳聚糖和小分子腺苷很有希望成为一种新型的骨修复材料,并在临床上得到广泛应用。但是,我们的研究也存在不少局限性。除了上文所提出的有限的实验动物数量、有限的修复时间及实验动物种类单一之外,在控制体内的小分子腺苷从CPC支架中释放到周围组织的准确定量是十分困难的,目前我们实验只能尽量控制其缓释,但缓释的量尚未进一步探究。因此,对于我们下一步的研究方向,将会更进一步深入探究小分子腺苷在此支架中发挥最优作用的浓度,同时也会在细胞以及在分子水平上研究小分子腺苷的成骨刺激的作用机制,使得小分子腺苷的相关功能得到进一步的了解。
| [1] |
Langer R, Vacanti JP. Tissue engineering[J].
Science, 1993, 260(5110): 920-6.
|
| [2] |
Petite H, Viateau V, Bensaïd W, et al. Tissue-engineered bone regeneration[J].
Nat Biotechnol, 2000, 18(9): 959-63.
DOI: 10.1038/79449. |
| [3] |
Salgado AJ, Coutinho OP, Reis RL. Bone tissue engineering: state of the art and future trends[J].
Macromol Biosci, 2004, 4(8): 743-65.
|
| [4] |
Lode A, Heiss C, Knapp G, et al. Strontium-modified premixed Calcium phosphate cements for the therapy of osteoporotic bone defects[J].
Acta Biomater, 2018, 65(9): 475-85.
|
| [5] |
Ródenas-Rochina J, Ribelles JL, Lebourg M. Comparative study of PCL-HAp and PCL-bioglass composite scaffolds for bone tissue engineering[J].
J Mater Sci Mater Med, 2013, 24(5): 1293-308.
|
| [6] |
Chow BA. A new calcium phosphate[C]. Watersetting Cement, 1987: 352-79.
|
| [7] |
Frankenburg EP, Goldstein SA, Bauer TW, et al. Biomechanical and histological evaluation of a calcium phosphate cement[J].
J Bone Joint Surg Am, 1998, 80(8): 1112-24.
DOI: 10.2106/00004623-199808000-00004. |
| [8] |
Ambard AJ, Mueninghoff L. Calcium phosphate cement: review of mechanical and biological properties[J].
J Prosthodont, 2006, 15(5): 321-8.
DOI: 10.1111/jopr.2006.15.issue-5. |
| [9] |
Xu HH, Quinn JB, Takagi S, et al. Synergistic reinforcement of in situ hardening calcium phosphate composite scaffold for bone tissue engineering[J].
Biomaterials, 2004, 25(6): 1029-37.
DOI: 10.1016/S0142-9612(03)00608-2. |
| [10] |
Zhao L, Tang M, Weir MD, et al. Osteogenic media and rhBMP-2- induced differentiation of umbilical cord mesenchymal stem cells encapsulated in alginate microbeads and integrated in an injectable calcium phosphate-chitosan fibrous scaffold[J].
Tissue Eng Part A, 2011, 17(7/8): 969-79.
|
| [11] |
Weir MD, Xu HH. Osteoblastic induction on Calcium phosphate cement-chitosan constructs for bone tissue engineering[J].
J Biomed Mater Res A, 2010, 94(1): 223-33.
|
| [12] |
Ramazzotti G, Bavelloni A, Blalock W, et al. BMP-2 induced expression of PLCβ1 that is a positive regulator of osteoblast differentiation[J].
J Cell Physiol, 2016, 231(3): 623-9.
|
| [13] |
Abreu FA, Ferreira CL, Silva GA, et al. Effect of PDGF-BB, IGF-Ⅰ growth factors and their combination carried by liposomes in tooth socket healing[J].
Braz Dent J, 2013, 24(4): 299-307.
DOI: 10.1590/0103-6440201302238. |
| [14] |
Möller-Siegert J, Parmentier J, Laquerrière P, et al. Physicochemical regulation of TGF and VEGF delivery from mesoporous calcium phosphate bone substitutes[J].
Nanomedicine (Lond), 2017, 12(15): 1835-50.
|
| [15] |
Discher DE, Mooney DJ, Zandstra PW. Growth factors, matrices, and forces combine and control stem cells[J].
Science, 2009, 324(5935): 1673-7.
DOI: 10.1126/science.1171643. |
| [16] |
Poudel SB, Bhattarai G, Kook SH, et al. Recombinant human IGF- 1 produced by transgenic plant cell suspension culture enhances new bone formation in calvarial defects[J].
Growth Horm IGF Res, 2017, 36(6): 1-10.
|
| [17] |
Mediero A, Cronstein BN. Adenosine and bone metabolism[J].
Trends Endocrinol Metab, 2013, 24(6): 290-300.
DOI: 10.1016/j.tem.2013.02.001. |
| [18] |
Kang H, Shih YR, Nakasaki M, et al. Small molecule-driven direct conversion of human pluripotent stem cells into functional osteoblasts[J].
Sci Adv, 2016, 2(8): e1600691.
DOI: 10.1126/sciadv.1600691. |
| [19] |
Lee CH, Cook JL, Mendelson A, et al. Regeneration of the articular surface of the rabbit synovial joint by cell homing: a proof of concept study[J].
Lancet, 2010, 376(9739): 440-8.
DOI: 10.1016/S0140-6736(10)60668-X. |
| [20] |
Weir MD, Xu HH, Simon CG. Strong Calcium phosphate cement-chitosan-mesh construct containing cell-encapsulating hydrogel beads for bone tissue engineering[J].
J Biomed Mater Res A, 2006, 77(3): 487-96.
|
| [21] |
Samavedi S, Whittington AR, Goldstein AS. Calcium phosphate ceramics in bone tissue engineering: a review of properties and their influence on cell behavior[J].
Acta Biomater, 2013, 9(9): 8037-45.
DOI: 10.1016/j.actbio.2013.06.014. |
| [22] |
Costantino PD, Friedman CD, Jones K, et al. Experimental hydroxyapatite cement cranioplasty[J].
Plast Reconstr Surg, 1992, 90(2): 174-85.
|
| [23] |
Bohner M, Gbureck U, Barralet JE. Technological issues for the development of more efficient calcium phosphate bone cements: a critical assessment[J].
Biomaterials, 2005, 26(33): 6423-9.
DOI: 10.1016/j.biomaterials.2005.03.049. |
| [24] |
Chow LC. Next Generation calcium phosphate-based biomaterials[J].
Dent Mater J, 2009, 28(1): 1-10.
|
| [25] |
Ginebra MP, Espanol M, Montufar EB, et al. New processing approaches in calcium phosphate cements and their applications in regenerative medicine[J].
Acta Biomater, 2010, 6(8): 2863-73.
|
| [26] |
Younes RM. Chitosan preparation from marine sources, structure, properties and applications[J].
Mar Drugs, 2015, 13(3): 1133-74.
DOI: 10.3390/md13031133. |
| [27] |
Rochet N, Balaguer T, Boukhechba F, et al. Differentiation and activity of human preosteoclasts on chitosan enriched calcium phosphate cement[J].
Biomaterials, 2009, 30(26): 4260-7.
|
| [28] |
Mediero A, Wilder T, Perez-Aso M, et al. Direct or indirect stimulation of adenosine A2A receptors enhances bone regeneration as well as bone morphogenetic protein-2[J].
FASEB J, 2015, 29(4): 1577-90.
|
| [29] |
Bradaschia-Correa V, Josephson AM, Egol AJ, et al. Ecto-5'- nucleotidase (CD73) regulates bone formation and remodeling during intramembranous bone repair in aging mice[J].
Tissue Cell, 2017, 49(5): 545-51.
|
| [30] |
Mediero A, Wilder T, Reddy VS, et al. Ticagrelor regulates osteoblast and osteoclast function and promotes bone formation in vivo via an adenosine-dependent mechanism[J].
FASEB J, 2016, 30(11): 3887-900.
DOI: 10.1096/fj.201600616R. |
 2018, Vol. 38
2018, Vol. 38

